Диэтилалюминий хлорид
| |
| Имена | |
|---|---|
| Название ИЮПАК
хлордиэтилалюман
| |
| Другие имена
хлордиэтилалюминий
| |
| Идентификаторы | |
3D model ( JSmol )
|
|
| 4123259 | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.002.253 |
| Номер ЕС |
|
ПабХим CID
|
|
| номер РТЭКС |
|
| НЕКОТОРЫЙ | |
| Число | 3394 |
Панель управления CompTox ( EPA )
|
|
| Характеристики | |
| С 8 Н 20 Аl 2 Cl 2 | |
| Молярная масса | 241.11 g·mol −1 |
| Появление | Бесцветная жидкость [1] |
| Плотность | 0,96 г/см 3 [1] |
| Температура плавления | -74 ° C (-101 ° F; 199 К) [1] |
| Точка кипения | От 125 до 126 ° C (от 257 до 259 ° F; от 398 до 399 К) при 50 мм рт. ст. |
| Реагирует [1] | |
| Давление пара | 3 мм рт.ст. (при 60 °C) |
| Опасности | |
| СГС Маркировка : | |
 
| |
| Опасность | |
| Х225 , Х250 , Х260 , Х261 , Х314 | |
| P210 , P222 , P223 , P231+P232 , P233 , P240 , P241 , P242 , P243 , P260 , P264 , P280 , P301+P330+P331 , P302+ P334 , P303+P361+P353 , 4+П340 , П305+П351+ P338 , P310 , P321 , P335+P334 , P363 , P370+P378 , P402+P404 , P403+P235 , P405 , P422 , P501 | |
| NFPA 704 (огненный алмаз) | |
| точка возгорания | −18 ° C (0 ° F; 255 К) |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |
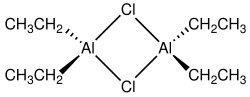
Хлорид диэтилалюминия , сокращенно ДЭАК, представляет собой алюминийорганическое соединение . Хотя его часто называют химической формулой (C 2 H 5 ) 2 AlCl, он существует в виде димера [(C 2 H 5 ) 2 AlCl] 2. Он является предшественником катализаторов Циглера-Натта, используемых для производства полиолефинов . Это соединение также является кислотой Льюиса , полезной в органическом синтезе . Соединение представляет собой бесцветное воскообразное твердое вещество, но обычно с ним обращаются в виде раствора в углеводородных растворителях. Он очень реактивен, даже пирофорен . [2]
Структура и связь
[ редактировать ]Соединения брутто-формулы AlR 2 Cl (R = алкил , арил ) обычно существуют в виде димеров с формулой (R 2 Al) 2 (μ-Cl) 2 . Мостиковые лиганды (обозначенные буквой «μ-») представляют собой галогениды, а не органические заместители. Алюминий имеет тетраэдрическую геометрию. Каждый центр Al(III) следует правилу октетов . [3] [4] Напротив, триэтилалюминий и триметилалюминий имеют мостиковые алкильные группы, и эти соединения нарушают правило октетов.
Производство
[ редактировать ]Хлорид диэтилалюминия можно получить из сесквихлорида этилалюминия (C 2 H 5 ) 3 Al 2 Cl 3 восстановлением натрием: [5]
- 2 (C 2 H 5 ) 3 Al 2 Cl 3 + 3 Na → 3 (C 2 H 5 ) 2 AlCl + Al + 3 NaCl
Его также получают реакцией триэтилалюминия с соляной кислотой:
- (C 2 H 5 ) 3 Al + HCl → (C 2 H 5 ) 2 AlCl + C 2 H 6
Также можно использовать реакции репропорционирования:
- 2 (C 2 H 5 ) 3 Al + AlCl 3 → 3 (C 2 H 5 ) 2 AlCl
- (C 2 H 5 ) 3 Al 2 Cl 3 + (C 2 H 5 ) 3 Al → 3 (C 2 H 5 ) 2 AlCl
Использование
[ редактировать ]Хлорид диэтилалюминия и другие алюминийорганические соединения используются в сочетании с соединениями переходных металлов в качестве катализаторов Циглера-Натта для полимеризации различных алкенов. [6]
Как кислота Льюиса, хлорид диэтилалюминия также находит применение в органическом синтезе. Например, его используют для катализа реакций Дильса-Альдера и еновых реакций . Альтернативно, он может реагировать как нуклеофил или поглотитель протонов. [2]
Безопасность
[ редактировать ]Хлорид диэтилалюминия не только горюч, но и пирофорен.
Ссылки
[ редактировать ]- Ху, YJ; Цзян, Х.Л.; Ван, Х.Х., «Получение высокоразветвленного полиэтилена с использованием катализатора аценафтендииминхлорид никеля/диэтилалюминийхлорида». Китайский журнал науки о полимерах , 2006, 24 (5), 483–488.
- Яо, Ю.М.; Ци, ГЗ; Шен, К.; Ху, JY; Лин, Ю. Х., «Реакционная способность и структурная характеристика арилоксида двухвалентного самария с хлоридом диэтилалюминия». Китайский научный бюллетень 2003, 48 (20), 2164–2167.
- ^ Jump up to: а б с д Джон Рамбл (18 июня 2018 г.). Справочник CRC по химии и физике (99-е изд.). ЦРК Пресс. стр. 4–40. ISBN 978-1138561632 .
- ^ Jump up to: а б Снайдер, Барри Б. (2001). «Диэтилалюминийхлорид». Энциклопедия реагентов для органического синтеза . дои : 10.1002/047084289X.rd165 . ISBN 0-471-93623-5 .
- ^ Брендхауген, Кристен; Хааланд, Арне ; Новак, Дэвид П.; Оствальд, Терье; Бьёрсет, Альф ; Пауэлл, Д.Л. (1974). «Молекулярная структура димера хлорида диметилалюминия, [(CH3)2AlCl] 2 , переопределенная методом газовой электронографии» . Acta Chemica Scandinavica . 28а : 45–47. doi : 10.3891/acta.chem.scand.28a-0045 .
- ^ МакМахон, К. Ниам; Фрэнсис, Джули А.; Бэррон, Эндрю Р. (1997). «Молекулярная структура [(t Bu ) 2 Al(μ-Cl)]2». Журнал химической кристаллографии . 27 (3): 191–194. дои : 10.1007/BF02575988 . S2CID 195242291 .
- ^ Краузе, Майкл Дж.; Орланди, Фрэнк; Саураж, Альфред Т.; Зитц, Джозеф Р. (2000), «Органические соединения алюминия», Энциклопедия промышленной химии Ульмана , Вайнхайм, Германия: Wiley-VCH Verlag GmbH & Co. KGaA, стр. 592–593, doi : 10.1002/14356007.a01_543 , ISBN 978-3-527-30673-2
- ^ Фиш, АГ (2000). «Катализаторы Циглера-Натта». Энциклопедия химической технологии Кирка-Отмера . Уайли. стр. 1–22. дои : 10.1002/0471238961.2609050703050303.a01.pub2 . ISBN 978-0-471-48494-3 . S2CID 213111515 .
Внешние ссылки
[ редактировать ] СМИ, связанные с хлоридом диэтилалюминия, на Викискладе?
СМИ, связанные с хлоридом диэтилалюминия, на Викискладе?
