Координатная ковалентная связь
В координационной химии координационная связь ковалентная [1] также известный как дательная связь , [2] диполярная связь , [1] или координировать связь [3] Это своего рода двухцентровая двухэлектронная ковалентная связь , в которой два электрона происходят от одного и того же атома . Соединение металлов ионов с лигандами предполагает именно такое взаимодействие. [4] Этот тип взаимодействия занимает центральное место в кислотно-основной теории Льюиса .
Координационные связи обычно встречаются в координационных соединениях . [5]
Примеры
[ редактировать ]
Координатная ковалентная связь распространена повсеместно. [6] Во всех аквакомплексах металлов [M(H 2 O) n ] м + , связь между водой и катионом металла описывается как координатная ковалентная связь. металл-лигандные взаимодействия в большинстве металлоорганических соединений и большинстве координационных соединений Аналогично описываются .
Термин «диполярная связь» используется в органической химии для таких соединений, как оксиды аминов , электронная структура которых может быть описана в терминах основного амина, отдающего два электрона атому кислорода.
- Р
3 Н → О
Стрелка → указывает, что оба электрона связи происходят от аминного фрагмента . В стандартной ковалентной связи каждый атом отдает один электрон. Следовательно, альтернативное описание состоит в том, что амин отдает один электрон атому кислорода, который затем используется вместе с оставшимся неспаренным электроном на атоме азота для образования стандартной ковалентной связи. Процесс передачи электрона от азота к кислороду создает формальные заряды , поэтому электронную структуру можно также изобразить как
- Р
3 Н +
ТО −
Эта электронная структура имеет электрический диполь , отсюда и название полярной связи. В действительности атомы несут частичные заряды ; более электроотрицательный атом из двух, участвующих в связи, обычно несет частичный отрицательный заряд. Единственным исключением из этого правила является окись углерода . В этом случае атом углерода несет частичный отрицательный заряд, хотя он менее электроотрицательен, чем кислород.
Примером дативной ковалентной связи является взаимодействие между молекулой аммиака , основанием Льюиса с неподеленной парой электронов на атоме азота, и трифторидом бора , кислотой Льюиса , поскольку атом бора имеет октет неполный электроны. При образовании аддукта атом бора приобретает октетную конфигурацию.
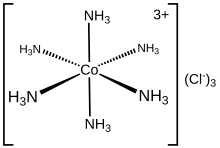
Электронную структуру координационного комплекса можно описать набором лигандов , каждый из которых отдает пару электронов металлическому центру. Например, в хлориде гексамминкобальта(III) каждый аммиачный лиганд отдает свою неподеленную пару электронов иону кобальта(III). В этом случае образующиеся связи называются координатными. В методе классификации ковалентных связей (CBC) лиганды, которые образуют координационные ковалентные связи с центральным атомом, классифицируются как L-тип, а те, которые образуют нормальные ковалентные связи, классифицируются как X-тип.
Сравнение с другими режимами обмена электронами
[ редактировать ]Во всех случаях связь, будь то дативная или «нормальная» с общим электроном, является ковалентной связью. В обычном использовании префикс диполярный, дательный или координатный просто служит для указания происхождения электронов, используемых при создании связи. Например, F 3 B ← O(C 2 H 5 ) 2 (« (диэтил)эфират трифторида бора ») получают из BF 3 и : O(C 2 H 5 ) 2 , в отличие от радикальной разновидности [•BF 3 ] – и [•O(C 2 H 5 ) 2 ] + . Дательная связь также удобна с точки зрения обозначений, поскольку позволяет избежать формальных обвинений: мы можем писать D : + []A ⇌ D → A, а не D. + –А – (здесь : и [] обозначают неподеленную пару и пустую орбиталь донора электронной пары D и акцептора A соответственно). Это обозначение иногда используется даже тогда, когда рассматриваемая кислотно-основная реакция Льюиса является лишь условной (например, сульфоксид R 2 S → O редко, если вообще когда-либо, образуется путем реакции сульфида R 2 S с атомарным кислородом O). Таким образом, большинство химиков не делают никаких заявлений относительно свойств связи при выборе одного обозначения вместо другого (формальные заряды вместо стрелочной связи).
Однако в целом верно, что связи, изображенные таким образом, являются полярно-ковалентными, иногда сильно, и некоторые авторы утверждают, что существуют реальные различия в свойствах дативной связи и связи с общим электроном, и предполагают, что показывать дативную связь более важно. уместно в конкретных ситуациях. Еще в 1989 году Хааланд охарактеризовал дативные облигации как облигации, которые (i) являются слабыми и длинными; (ii) при образовании связи происходит лишь небольшая степень переноса заряда; и (iii) предпочтительный способ диссоциации которого в газовой фазе (или инертном растворителе с низким ε) является гетеролитическим, а не гомолитическим. [7] В качестве классического примера приведен аммиачно-борановый аддукт (H 3 N → BH 3 ): связь слабая, с энергией диссоциации 31 ккал/моль (ср. 90 ккал/моль для этана), и длинная, при 166 пм (ср. 153 пм для этана), а молекула обладает дипольным моментом 5,2 Д, что означает передачу всего 0,2 э. – от азота к бору. По оценкам, гетеролитическая диссоциация H 3 N → BH 3 требует 27 ккал/моль, что подтверждает, что гетеролиз с образованием аммиака и борана более выгоден, чем гомолиз с образованием катион-радикала и анион-радикала. Однако, помимо четких примеров, существуют серьезные споры относительно того, когда квалифицируется конкретное соединение и, следовательно, об общей распространенности дативной связи (по отношению к предпочтительному определению автора). Химики-вычислители предложили количественные критерии, позволяющие различать два «типа» связей. [8] [9] [10]
Некоторые неочевидные примеры, когда дативная связь считается важной, включают субоксид углерода (O≡C → C 0 ← C≡O), тетрааминоаллены (описанные с использованием дательного языка связей как «карбодикарбены»; (R 2 N) 2 C → C 0 ← C(NR 2 ) 2 Рамиреса ), карбодифосфоран (Ph 3 P → C 0 ← PPh 3 ) и катион бис(трифенилфосфин)иминия (Ph 3 P → N + ← PPh 3 ), все из которых демонстрируют значительно изогнутую равновесную геометрию, хотя и с неглубоким барьером для изгиба. Простое применение обычных правил рисования структур Льюиса путем максимизации связей (с использованием связей с общим электроном) и минимизации формальных зарядов могло бы предсказать гетерокумуленовые структуры и, следовательно, линейную геометрию для каждого из этих соединений. Таким образом, утверждается, что эти молекулы лучше моделировать как координационные комплексы : C : (углерод(0) или карбон ) или : N : + (катион мононитрогена) с CO, PPh 3 или N- гетероциклическими карбенами в качестве лигандов, неподеленные пары на центральном атоме отвечают за изогнутую геометрию. Однако полезность этой точки зрения оспаривается. [9] [10]
Ссылки
[ редактировать ]- ^ Jump up to: а б ИЮПАК , Сборник химической терминологии , 2-е изд. («Золотая книга») (1997). Исправленная онлайн-версия: (2006–) « Диполярная связь ». дои : 10.1351/goldbook.D01752
- ^ ИЮПАК , Сборник химической терминологии , 2-е изд. («Золотая книга») (1997). Исправленная онлайн-версия: (2006–) « дательная связь ». дои : 10.1351/goldbook.D01523
- ^ ИЮПАК , Сборник химической терминологии , 2-е изд. («Золотая книга») (1997). Интернет-исправленная версия: (2006–) « Координатная связь ». два : 10.1351/goldbook.C01329
- ^ Арияратна, Исуру (март 2021 г.). Первые принципиальные исследования основных и возбужденных электронных состояний: химическая связь в молекулах основной группы, молекулярные системы с диффузными электронами и активация воды с использованием монооксидов переходных металлов .
- ^ Харе, Э.; Холтен-Андерсен, Н.; Бюлер, MJ (2021). «Координационные связи переходных металлов для биоинспирированных макромолекул с настраиваемыми механическими свойствами». Nat Rev Mater . 6 : 421–436. дои : 10.1038/s41578-020-00270-z .
- ^ Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . ISBN 978-0-08-037941-8 .
- ^ Хааланд, Арне (1989). «Ковалентные и дативные связи с металлами основной группы, полезное различие». Angewandte Chemie International Edition на английском языке . 28 (8): 992–1007. дои : 10.1002/anie.198909921 . ISSN 0570-0833 .
- ^ Химмель, Даниэль; Кроссинг, Инго; Шнепф, Андреас (07 января 2014 г.). «Дативные связи в соединениях главной группы: аргумент в пользу меньшего количества стрел!». Angewandte Chemie, международное издание . 53 (2): 370–374. дои : 10.1002/anie.201300461 . ПМИД 24243854 .
- ^ Jump up to: а б Френкинг, Гернот (10 июня 2014 г.). «Дативные связи в соединениях главной группы: аргумент в пользу большего количества стрел!». Angewandte Chemie, международное издание . 53 (24): 6040–6046. дои : 10.1002/anie.201311022 . ПМИД 24849466 .
- ^ Jump up to: а б Шмидбаур, Хуберт; Шир, Аннет (2 января 2013 г.). «Координационная химия углерода: лоскутное семейство, включающее (Ph 3 P) 2 C, (Ph 3 P) C (C 2 H 4 ) и (C 2 H 4 ) 2 C». Angewandte Chemie, международное издание . 52 (1): 176–186. дои : 10.1002/anie.201205294 . ПМИД 23203500 .