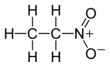
Нитроэтан
| |||
 | |||
| Имена | |||
|---|---|---|---|
| Предпочтительное название ИЮПАК Нитроэтан | |||
| Идентификаторы | |||
3D model ( JSmol ) | |||
| ЧЭБИ | |||
| ЧЕМБЛ | |||
| ХимическийПаук | |||
| Информационная карта ECHA | 100.001.081 | ||
| КЕГГ | |||
ПабХим CID | |||
| номер РТЭКС |
| ||
| НЕКОТОРЫЙ | |||
| Число | И 2842 | ||
Панель управления CompTox ( EPA ) | |||
| Характеристики | |||
| С 2 Н 5 Н О 2 | |||
| Молярная масса | 75.067 g·mol −1 | ||
| Появление | Бесцветная жидкость | ||
| Плотность | 1,054 г/см 3 | ||
| Температура плавления | -51 ° C (-60 ° F; 222 К) | ||
| Точка кипения | 114 ° С (237 ° F; 387 К) | ||
| Мало растворим (4,6 г/100 мл при 20 °C) | |||
| Давление пара | 21 мм рт.ст. (25 °С) [1] | ||
| Кислотность ( pKa ) | 16.7 [2] [3] | ||
| -35.4·10 −6 см 3 /моль | |||
| Вязкость | 0,677 мПа·с при 20 °C | ||
| Опасности | |||
| Безопасность и гигиена труда (OHS/OSH): | |||
Основные опасности | Легковоспламеняющийся, вредный | ||
| СГС Маркировка : | |||
   | |||
| Опасность | |||
| Х226 , Х302 , Х315 , Х331 , Х341 , Х412 | |||
| P210 , P261 , P301 , P304 , P312 , P330 , P340 , P370 , P378 , P403+P233 | |||
| NFPA 704 (огненный алмаз) | |||
| точка возгорания | 28 ° C (82 ° F; 301 К) | ||
| Взрывоопасные пределы | 3.4%-? [1] | ||
| Летальная доза или концентрация (LD, LC): | |||
ЛК 50 ( средняя концентрация ) | 5000 частей на миллион (кролик, 2 часа) [4] | ||
LC Lo ( самый низкий из опубликованных ) | 6250 частей на миллион (мышь, 2 часа) [4] | ||
| NIOSH (пределы воздействия на здоровье в США): | |||
МЕХ (Допускается) | СВВ 100 частей на миллион (310 мг/м 3 ) [1] | ||
РЕЛ (рекомендуется) | СВВ 100 частей на миллион (310 мг/м 3 ) [1] | ||
IDLH (Непосредственная опасность) | 1000 частей на миллион [1] | ||
| Паспорт безопасности (SDS) | Паспорт безопасности на сайте fishersci.com | ||
| Родственные соединения | |||
Родственные нитросоединения | 2-нитропропан Нитрометан | ||
Родственные соединения | Этилнитрит Этилнитрат | ||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |||
Нитроэтан – органическое соединение , имеющее химическую формулу C 2 H 5 NO 2 . Во многом похожий на нитрометан , нитроэтан представляет собой маслянистую жидкость при стандартной температуре и давлении. Чистый нитроэтан бесцветен и имеет фруктовый запах.
Подготовка
[ редактировать ]Нитроэтан получают в промышленных масштабах обработкой пропана при азотной кислотой температуре 350–450 °С. В результате этой экзотермической реакции образуются четыре промышленно значимых нитроалкана: нитрометан , нитроэтан, 1-нитропропан и 2-нитропропан . В реакции участвуют свободные радикалы, такие как CH 3 CH 2 CH 2 O. . , которые возникают в результате гомолиза соответствующего нитритного эфира . Эти алкокси-радикалы подвержены реакциям фрагментации С—С, что объясняет образование смеси продуктов. [5]
Альтернативно, нитроэтан может быть получен реакцией Виктора Мейера галоидэтанов, таких как хлорэтан , бромэтан или йодэтан, с нитритом серебра в диэтиловом эфире или ТГФ . В модификации Корнблюма этой реакции используется нитрит натрия в растворителе диметилсульфоксид или диметилформамид . [6]
Использование
[ редактировать ]В результате конденсации, такой как реакция Генри , нитроэтан превращается в несколько соединений, представляющих коммерческий интерес. Конденсация с 3,4-диметоксибензальдегидом дает предшественник антигипертензивного препарата метилдопы ; конденсация с незамещенным бензальдегидом дает фенил-2-нитропропен , предшественник наркотиков амфетамина. Нитроэтан конденсируется с двумя эквивалентами формальдегида с образованием после гидрирования 2-амино-2-метил-1,3-пропандиола, который, в свою очередь, конденсируется с олеиновой кислотой с образованием оксазолина, который протонируется с образованием катионного поверхностно-активного вещества . [5]
Как и некоторые другие нитрованные органические соединения, нитроэтан также используется в качестве топливной добавки и предшественника ракетного топлива .
Нитроэтан является полезным растворителем для таких полимеров, как полистирол , и особенно полезен для растворения цианоакрилатных клеев. В косметических целях его использовали в качестве компонента средств для снятия искусственных ногтей и спреев для герметика для потолочных потолков.
Нитроэтан ранее успешно использовался в качестве химического сырья (ингредиента-прекурсора) в лабораториях для синтеза множества веществ и потребительских товаров. Например, лекарство Первитин (метамфетамин) широко использовалось в 19 и 20 веках и было особенно популярно во время Второй мировой войны в войсках обеих сторон для повышения настроения, подавления аппетита и сна, а также повышения концентрации внимания и бдительности). Нитроалканы были одним из многих ингредиентов, используемых в синтезе многих фенэтиламинов , включая такие лекарства, как первитин и рацемическое соединение бензедрин. [7] (амфетамин), используемый как аноректическое средство при ожирении. [8]
Токсичность
[ редактировать ]Предполагается, что нитроэтан вызывает генетические повреждения и вреден для нервной системы . Типичное значение TLV/TWA составляет 100 частей на миллион. Типичный STEL составляет 150 частей на миллион. Контакт с кожей вызывает дерматит у человека . В исследованиях на животных наблюдалось, что воздействие нитроэтана вызывало слезотечение , одышку , хрипы в легких, отеки , повреждение печени и почек, а также наркоз. [9] Дети отравились в результате случайного проглатывания средства для снятия искусственных ногтей. [10]
50 LD для крыс составляет 1100 мг/кг. Сообщается, что [11]
Ссылки
[ редактировать ]- ^ Jump up to: а б с д и Карманный справочник NIOSH по химическим опасностям. «#0453» . Национальный институт охраны труда и здоровья (NIOSH).
- ^ Райх, Ганс. «Таблица Bordwell pKa: «Нитроалканы» » . Химический факультет Университета Висконсина . Проверено 17 января 2016 г.
- ^ Мэтьюз, Уолтер; и др. (1975). «Равновесные кислотности угольных кислот. VI. Установление абсолютной шкалы кислотностей в растворе диметилсульфоксида». Журнал Американского химического общества . 97 (24): 7006. doi : 10.1021/ja00857a010 .
- ^ Jump up to: а б «Нитроэтан» . Непосредственно опасные для жизни и здоровья концентрации (IDLH) . Национальный институт охраны труда и здоровья (NIOSH).
- ^ Jump up to: а б Шелдон Б. Маркофски «Алифатические нитросоединения» в Энциклопедии промышленной химии Ульмана , Wiley-VCH, Вайнхайм, 2002. два : 10.1002/14356007.a17_401 .
- ^ Агравал, Джай (2007). Органическая химия взрывчатых веществ . Чичестер, Англия: Джон Уайли и сыновья. стр. 7–10. ISBN 9780470029671 .
- ^ «Краткий обзор национальной оценки лекарств за 2016 год» (PDF) . Администрация по лекарствам . Ноябрь 2016.
- ^ «Краткий обзор национальной оценки лекарств за 2016 год» (PDF) . Администрация по лекарствам . Ноябрь 2016.
- ^ «Информация о химических пробах нитроэтана». Получено 9 февраля 2007 г. с веб-сайта Управления по охране труда США.
- ^ Хорнфельдт CS, Рабе WH (1994). «Отравление нитроэтаном средством для снятия искусственных ногтей». Дж. Токсикол. Клин. Токсикол . 32 (3): 321–4. дои : 10.3109/15563659409017967 . ПМИД 8007041 .
- ^ Паспорт безопасности нитроэтана (пересмотрен 3 октября 2005 г.), как сообщает Fisher Scientific.