Брахитерапия
| Брахитерапия | |
|---|---|
 Стрелка указывает на шарики для брахитерапии, используемые для лечения рака простаты. | |
| Другие имена | внутренняя лучевая терапия, лучевая терапия с закрытыми источниками, кюритерапия, эндокуритерапия |
| МКБ-10-ПКС | Д ?1 |
| МКБ-9-СМ | 92.27 |
| МеШ | D001918 |
Брахитерапия — это форма лучевой терапии , при которой герметичный источник излучения размещается внутри или рядом с областью, требующей лечения. Брахи — по-гречески сокращенно . Брахитерапия обычно используется в качестве эффективного лечения рака шейки матки , простаты , молочной железы , пищевода и кожи , а также может использоваться для лечения опухолей во многих других участках тела. [1] Результаты лечения показали, что показатели излечения рака с помощью брахитерапии либо сопоставимы с хирургическим вмешательством и дистанционной лучевой терапией (ДЛТ), либо улучшаются при использовании в сочетании с этими методами. [2] [3] [4] Брахитерапию можно использовать отдельно или в сочетании с другими методами лечения, такими как хирургическое вмешательство, лучевая терапия и химиотерапия .
Brachytherapy contrasts with unsealed source radiotherapy, in which a therapeutic radionuclide (radioisotope) is injected into the body to chemically localize to the tissue requiring destruction. It also contrasts to External Beam Radiation Therapy (EBRT), in which high-energy x-rays (or occasionally gamma-rays from a radioisotope like cobalt-60) are directed at the tumour from outside the body. Brachytherapy instead involves the precise placement of short-range radiation-sources (radioisotopes, iodine-125 or caesium-131 for instance) directly at the site of the cancerous tumour. These are enclosed in a protective capsule or wire, which allows the ionizing radiation to escape to treat and kill surrounding tissue but prevents the charge of radioisotope from moving or dissolving in body fluids. The capsule may be removed later, or (with some radioisotopes) it may be allowed to remain in place.[1]: Ch. 1 [5]
A feature of brachytherapy is that the irradiation affects only a very localized area around the radiation sources. Exposure to radiation of healthy tissues farther away from the sources is therefore reduced. In addition, if the patient moves or if there is any movement of the tumour within the body during treatment, the radiation sources retain their correct position in relation to the tumour. These characteristics of brachytherapy provide advantages over EBRT – the tumour can be treated with very high doses of localised radiation whilst reducing the probability of unnecessary damage to surrounding healthy tissues.[1]: Ch. 1 [5]
A course of brachytherapy can be completed in less time than other radiotherapy techniques. This can help reduce the chance for surviving cancer-cells to divide and grow in the intervals between each radiotherapy dose.[5] Patients typically have to make fewer visits to the radiotherapy clinic compared with EBRT, and may receive the treatment as outpatients. This makes treatment accessible and convenient for many patients.[6][7] These features of brachytherapy mean that most patients are able to tolerate the brachytherapy procedure very well.
The global market for brachytherapy reached US$680 million in 2013, of which the high-dose rate (HDR) and LDR segments accounted for 70%. Microspheres and electronic brachytherapy comprised the remaining 30%.[8] One analysis predicts that the brachytherapy market may reach over US$2.4 billion in 2030, growing by 8% annually, mainly driven by the microspheres market as well as electronic brachytherapy, which is gaining significant interest worldwide as a user-friendly technology.[9]
Medical uses
[edit]
Brachytherapy is commonly used to treat cancers of the cervix, prostate, breast, and skin.[1]
Brachytherapy can also be used in the treatment of tumours of the brain, eye, head and neck region (lip, floor of mouth, tongue, nasopharynx and oropharynx),[10] respiratory tract (trachea and bronchi), digestive tract (oesophagus, gall bladder, bile-ducts, rectum, anus),[11] urinary tract (bladder, urethra, penis), female reproductive tract (uterus, vagina, vulva), and soft tissues.[1]
As the radiation sources can be precisely positioned at the tumour treatment site, brachytherapy enables a high dose of radiation to be applied to a small area. Furthermore, because the radiation sources are placed in or next to the target tumour, the sources maintain their position in relation to the tumour when the patient moves or if there is any movement of the tumour within the body. Therefore, the radiation sources remain accurately targeted. This enables clinicians to achieve a high level of dose conformity – i.e. ensuring the whole of the tumour receives an optimal level of radiation. It also reduces the risk of damage to healthy tissue, organs or structures around the tumour,[12] thus enhancing the chance of cure and preservation of organ function.
The use of HDR brachytherapy enables overall treatment times to be reduced compared with EBRT.[13][14]Patients receiving brachytherapy generally have to make fewer visits for radiotherapy compared with EBRT, and overall radiotherapy treatment plans can be completed in less time.[15]Many brachytherapy procedures are performed on an outpatient basis. This convenience may be particularly relevant for patients who have to work, older patients, or patients who live some distance from treatment centres, to ensure that they have access to radiotherapy treatment and adhere to treatment plans. Shorter treatment times and outpatient procedures can also help improve the efficiency of radiotherapy clinics.[16][17]
Brachytherapy can be used with the aim of curing the cancer in cases of small or locally advanced tumours, provided the cancer has not metastasized (spread to other parts of the body). In appropriately selected cases, brachytherapy for primary tumours often represents a comparable approach to surgery, achieving the same probability of cure and with similar side effects.[18][19]However, in locally advanced tumours, surgery may not routinely provide the best chance of cure and is often not technically feasible to perform. In these cases radiotherapy, including brachytherapy, offers the only chance of cure.[20][21]In more advanced disease stages, brachytherapy can be used as palliative treatment for symptom relief from pain and bleeding.
In cases where the tumour is not easily accessible or is too large to ensure an optimal distribution of irradiation to the treatment area, brachytherapy can be combined with other treatments, such as EBRT and/or surgery.[1]: Ch. 1 Combination therapy of brachytherapy exclusively with chemotherapy is rare.[22]
Cervical cancer
[edit]Brachytherapy is commonly used in the treatment of early or locally confined cervical cancer and is a standard of care in many countries.[1]: Ch. 14 [23][24][25][26]Cervical cancer can be treated with either LDR, PDR or HDR brachytherapy.[25][27][28]Used in combination with EBRT, brachytherapy can provide better outcomes than EBRT alone.[2]The precision of brachytherapy enables a high dose of targeted radiation to be delivered to the cervix, while minimising radiation exposure to adjacent tissues and organs.[24][25][29][30]
The chances of staying free of disease (disease-free survival) and of staying alive (overall survival) are similar for LDR, PDR and HDR treatments.[21][31]However, a key advantage of HDR treatment is that each dose can be delivered on an outpatient basis with a short administration time[2] providing greater convenience for many patients.
Research shows locally advanced carcinoma of the cervix must be treated with a combination of external beam radiotherapy (EBRT) and intracavity brachytherapy (ICBT).[32]
Prostate cancer
[edit]Brachytherapy to treat prostate cancer can be given either as permanent LDR seed implantation or as temporary HDR brachytherapy.[1]: Ch. 20 [33][34]
Permanent seed implantation is suitable for patients with a localised tumour and good prognosis[33][35][36][37] and has been shown to be a highly effective treatment to prevent the cancer from returning.[35][38] The survival rate is similar to that found with EBRT or surgery (radical prostatectomy), but with fewer side effects such as impotence and incontinence.[39] The procedure can be completed quickly and patients are usually able to go home on the same day of treatment and return to normal activities after one to two days.[6]Permanent seed implantation is often a less invasive treatment option compared to the surgical removal of the prostate.[6]
Temporary HDR brachytherapy is a newer approach to treating prostate cancer, but is currently less common than seed implantation. It is predominantly used to provide an extra dose in addition to EBRT (known as "boost" therapy) as it offers an alternative method to deliver a high dose of radiation therapy that conforms to the shape of the tumour within the prostate, while sparing radiation exposure to surrounding tissues.[4][34][36][40][41][42]HDR brachytherapy as a boost for prostate cancer also means that the EBRT course can be shorter than when EBRT is used alone.[20][40][41][42]
Breast cancer
[edit]Лучевая терапия является стандартом лечения женщин, перенесших лампэктомию или мастэктомию , и является неотъемлемым компонентом органосохраняющей терапии. [1]: Ch. 18 [43]Brachytherapy can be used after surgery, before chemotherapy or palliatively in the case of advanced disease.[44] Brachytherapy to treat breast cancer is usually performed with HDR temporary brachytherapy. Post surgery, breast brachytherapy can be used as a "boost" following whole breast irradiation (WBI) using EBRT.[43][45]В последнее время для доставки APBI (ускоренного частичного облучения молочной железы) используется только брахитерапия, включающая доставку радиации только в непосредственную область, окружающую исходную опухоль. [43] [45] [46]
Основное преимущество брахитерапии молочной железы по сравнению с облучением всей молочной железы заключается в том, что высокая доза радиации может быть точно применена к опухоли, сохраняя при этом облучение здоровых тканей молочной железы и подлежащих структур, таких как ребра и легкие. [44] APBI обычно можно выполнить в течение недели. [46] Вариант брахитерапии может быть особенно важен для обеспечения того, чтобы работающие женщины, пожилые люди или женщины, не имеющие легкого доступа к лечебному центру, могли получить пользу от органосохраняющей терапии из-за короткого курса лечения по сравнению с WBI (который часто требует большего количества посещений). в течение 1–2 месяцев). [7]
Существует пять методов, которые можно использовать для проведения брахитерапии молочной железы: интерстициальная брахитерапия молочной железы, внутриполостная брахитерапия молочной железы, интраоперационная лучевая терапия, постоянная имплантация семян молочной железы и неинвазивная брахитерапия молочной железы с использованием маммографии для локализации цели и источника HDR.
Интерстициальная брахитерапия молочной железы
[ редактировать ]Интерстициальная брахитерапия молочной железы предполагает временное размещение нескольких гибких пластиковых катетеров в ткани молочной железы. Они тщательно расположены, чтобы обеспечить оптимальное нацеливание излучения на область лечения, сохраняя при этом окружающие ткани молочной железы. [7] Катетеры подключаются к постлоадеру , который доставляет запланированную дозу радиации в область лечения. Интерстициальную брахитерапию молочной железы можно использовать в качестве «стимуляции» после ДЛТ или в качестве APBI. [45]
Интраоперационная лучевая терапия
[ редактировать ]Интраоперационная лучевая терапия (ИОЛТ) обеспечивает облучение одновременно с операцией по удалению опухоли (лампэктомией). [47] Аппликатор помещается в полость, оставшуюся после удаления опухоли, и мобильное электронное устройство генерирует излучение (рентгеновское излучение). [47] или электроны [48] ) и доставляет его через аппликатор. Излучение подается сразу, а аппликатор удаляется перед закрытием разреза.
Внутриполостная брахитерапия молочной железы
[ редактировать ]Внутриполостная брахитерапия молочной железы (также известная как «баллонная брахитерапия») предполагает введение единственного катетера в полость молочной железы, оставшуюся после удаления опухоли (лампэктомия). [7] Катетер может быть установлен во время лампэктомии или после операции. [7] Затем через катетер в полость надувают баллон. Затем катетер подсоединяется к постлоадеру , который доставляет дозу радиации через катетер в баллон. В настоящее время внутриполостная брахитерапия молочной железы рутинно используется только при APBI. [49]
Существуют также устройства, сочетающие в себе особенности интерстициальной и внутриполостной брахитерапии молочной железы (например, SAVI). В этих устройствах используется несколько катетеров, но они вводятся через единственную точку входа в грудь. Исследования показывают, что использование нескольких катетеров позволяет врачам более точно нацеливать радиацию. [50] [51]
Постоянная имплантация семян в грудь
[ редактировать ]При постоянной имплантации семян в грудь (PBSI) множество радиоактивных «семен» (маленьких гранул) имплантируется в грудь в область, окружающую место опухоли, аналогично брахитерапии простаты с постоянными семенами. [52] Семена имплантируются за одну 1–2-часовую процедуру и подвергаются облучению в течение следующих месяцев по мере распада радиоактивного материала внутри них. Риск облучения имплантатов другими людьми (например, партнером/супругом) был изучен и признан безопасным. [52]
Опухоли головного мозга
[ редактировать ]Хирургически направленная лучевая терапия (STaRT), известная как GammaTile Therapy, представляет собой тип имплантата для брахитерапии, специально разработанный для использования внутри мозга. GammaTile одобрен FDA для лечения недавно диагностированных, операбельных злокачественных внутричерепных новообразований (например, опухолей головного мозга) и операбельных рецидивирующих внутричерепных новообразований, включая менингиомы, метастазы, глиомы высокой степени злокачественности и глиобластомы . [53]
В клиническом исследовании GammaTile Therapy улучшила местный контроль опухоли по сравнению с предыдущими методами лечения того же места без повышенного риска побочных эффектов. [54] [55]
Рак пищевода
[ редактировать ]Для лучевого лечения рака пищевода брахитерапия является одним из вариантов эффективного лечения и включает радикальную лучевую терапию (буст). [56] [57] или паллиативное лечение. [58] [59] Окончательная лучевая терапия (буст) позволяет точно подобрать дозу, а для облегчения дисфагии можно назначить паллиативное лечение. Аппликаторы большого диаметра или катетер баллонного типа используются с постлоадером для расширения пищевода и облегчения доставки дозы радиации к опухоли с сохранением близлежащих нормальных тканей. [60] [61]
Было показано, что брахитерапия после ДЛТ или хирургического вмешательства улучшает выживаемость и частоту местных рецидивов, чем ДЛТ или хирургическое вмешательство только у пациентов с раком пищевода. [62] [58]
Рак кожи
[ редактировать ]HDR-брахитерапия немеланоматозного рака кожи , такого как базально-клеточная карцинома и плоскоклеточный рак , представляет собой альтернативный вариант лечения хирургическому вмешательству. Это особенно актуально при раке носа, ушей, век или губ, когда хирургическое вмешательство может привести к обезображиванию или потребовать обширной реконструкции. [1] : Ч. 28 Для обеспечения тесного контакта между источником(ами) излучения и кожей можно использовать различные аппликаторы, которые соответствуют кривизне кожи и помогают обеспечить точную доставку оптимальной дозы облучения. [1] : Ч. 28
Другим типом брахитерапии, который имеет те же преимущества, что и HDR, является рений-SCT ( терапия рака кожи ). Он использует бета-излучение рения - 188 для лечения базальноклеточного или плоскоклеточного рака . источник излучения заключен в компаунд, который наносится на тонкую защитную пленку непосредственно над поражением. Таким образом, источник излучения можно применять в сложных местах и минимизировать облучение здоровых тканей. [63]
Брахитерапия рака кожи обеспечивает хорошие косметические результаты и клиническую эффективность; исследования с периодом наблюдения до пяти лет показали, что брахитерапия высокоэффективна с точки зрения местного контроля и сравнима с ДЛТ. [64] [65] [66] Время лечения обычно короткое, что обеспечивает удобство для пациентов. [67] Было высказано предположение, что брахитерапия может стать стандартом лечения рака кожи в ближайшем будущем. [67]
Кровеносные сосуды
[ редактировать ]Брахитерапию можно использовать при лечении коронарного рестеноза стента , при котором катетер помещается внутрь кровеносных сосудов, через которые вводятся и удаляются источники. [68] Было обнаружено, что при лечении рестеноза In-стента (ISR) стенты с лекарственным покрытием (DES) превосходят интракоронарную брахитерапию (ICBT).Тем не менее, сохраняется интерес к сосудистой брахитерапии при стойком рестенозе неудачных стентов и венозных трансплантатов.Терапия также исследовалась на предмет использования при лечении стеноза периферических сосудов. [69] и рассматривается для лечения фибрилляции предсердий . [70]
Побочные эффекты
[ редактировать ]Вероятность и характер потенциальных острых, подострых или долгосрочных побочных эффектов, связанных с брахитерапией, зависят от местоположения опухоли, подлежащей лечению, и типа используемой брахитерапии.
Острый
[ редактировать ]Острые побочные эффекты, связанные с брахитерапией, включают локализованные синяки, отеки, кровотечения, выделения или дискомфорт в области имплантации. Обычно они проходят в течение нескольких дней после завершения лечения. [71] Пациенты также могут чувствовать усталость в течение короткого периода после лечения. [71] [72]
Лечение брахитерапией рака шейки матки или простаты может вызвать острые и преходящие симптомы мочеиспускания, такие как задержка мочи, недержание мочи или болезненное мочеиспускание (дизурия). [39] [73] [74] Также могут возникнуть преходящее увеличение частоты дефекации, диарея, запор или незначительное ректальное кровотечение. [39] [73] [74] Острые и подострые побочные эффекты обычно проходят в течение нескольких дней или нескольких недель. В случае постоянной (семенной) брахитерапии рака простаты существует небольшая вероятность того, что некоторые семена могут мигрировать из области лечения в мочевой пузырь или уретру и выйти с мочой.
Брахитерапия рака кожи может привести к отслаиванию внешних слоев кожи (десквамации) вокруг области лечения в течение нескольких недель после терапии, которая обычно заживает через 5–8 недель. [1] : Ч. 28 Если рак расположен на губе, в результате брахитерапии может возникнуть изъязвление, которое обычно проходит через 4–6 недель. [75]
Большинство острых побочных эффектов, связанных с брахитерапией, можно лечить с помощью лекарств или путем изменения диеты, и они обычно исчезают со временем (обычно в течение нескольких недель) после завершения лечения. Острые побочные эффекты HDR-брахитерапии во многом аналогичны ДЛТ. [72]
Долгосрочный
[ редактировать ]У небольшого числа людей брахитерапия может вызывать долгосрочные побочные эффекты из-за повреждения или разрушения соседних тканей или органов. Долгосрочные побочные эффекты обычно носят легкий или умеренный характер. Например, проблемы с мочеиспусканием и пищеварением могут сохраняться в результате брахитерапии рака шейки матки или простаты и могут потребовать постоянного лечения. [39] [73] [74]
Брахитерапия рака простаты может вызвать эректильную дисфункцию примерно у 15–30% пациентов. [1] : Ч. 20 [76] Однако риск эректильной дисфункции связан с возрастом (мужчины старшего возраста подвергаются большему риску, чем мужчины молодого возраста), а также с уровнем эректильной функции до начала брахитерапии. У пациентов, испытывающих эректильную дисфункцию, в большинстве случаев можно успешно лечить такие препараты, как Виагра . [1] : Ч. 20 Важно отметить, что риск развития эректильной дисфункции после брахитерапии меньше, чем после радикальной простатэктомии . [18] [73]
Брахитерапия при раке молочной железы или кожи может привести к образованию рубцовой ткани вокруг области лечения. В случае брахитерапии молочной железы может возникнуть жировой некроз в результате попадания жирных кислот в ткани молочной железы. Это может привести к тому, что ткань молочной железы станет опухшей и болезненной. Жировой некроз является доброкачественным состоянием и обычно возникает через 4–12 месяцев после лечения и поражает около 2% пациентов. [77] [78]
Безопасность вокруг других
[ редактировать ]Пациенты часто спрашивают, нужно ли им соблюдать особые меры безопасности в присутствии семьи и друзей после прохождения брахитерапии. Если применяется временная брахитерапия, после лечения в организме не остается радиоактивных источников. Таким образом, нет никакого радиационного риска для друзей или семьи, если они находятся в непосредственной близости от них. [79]
Если используется постоянная брахитерапия, после лечения в организме остаются малые дозы радиоактивных источников (семена) – уровни радиации очень низкие и со временем уменьшаются. Кроме того, облучение воздействует только на ткани в пределах нескольких миллиметров от радиоактивных источников (т.е. от опухоли, подлежащей лечению). В качестве меры предосторожности некоторым людям, получающим постоянную брахитерапию, можно посоветовать не держать на руках маленьких детей и не находиться слишком близко к беременным женщинам в течение короткого времени после лечения. Онкологи-радиологи или медсестры могут дать пациентам конкретные инструкции и посоветовать, как долго им следует соблюдать осторожность. [79]
Типы
[ редактировать ]Различные типы брахитерапии можно определить в зависимости от (1) размещения источников радиации в целевой области лечения, (2) скорости или «интенсивности» дозы облучения, доставленной в опухоль, и (3) продолжительности действия дозы. доставка .
Размещение источника
[ редактировать ]Двумя основными видами брахитерапевтического лечения с точки зрения размещения радиоактивного источника являются интерстициальный и контактный.
В случае интерстициальной брахитерапии источники помещаются непосредственно в целевую ткань пораженного участка, например простаты или молочной железы. [1] : Ч. 1
Контактная брахитерапия предполагает размещение источника излучения в пространстве рядом с целевой тканью. [1] : Ч. 1 Это пространство может представлять собой полость тела (внутриполостная брахитерапия), например шейку матки , матку или влагалище ; просвет тела (внутрипросветная брахитерапия), такой как трахея или пищевод ; или наружно (поверхностная брахитерапия), например через кожу . [1] : Ч. 1 Источник радиации также может быть помещен в кровеносные сосуды (внутрисосудистая брахитерапия) для лечения коронарного рестеноза стента . [80]
Мощность дозы
[ редактировать ]Мощность дозы брахитерапии относится к уровню или «интенсивности», с которой излучение доставляется в окружающую среду, и выражается в греях в час (Гр/ч).
Брахитерапия с низкой мощностью дозы (LDR) предполагает имплантацию источников радиации, излучающих излучение со скоростью до 2 Гр·ч. −1 . [81] LDR-брахитерапия обычно используется при раке полости рта. [10] ротоглотка , [10] саркомы [1] : Ч. 27 и рак простаты [1] : Ч. 20 [82]
Брахитерапия средней мощности дозы (MDR) характеризуется средней скоростью доставки дозы, варьирующейся от 2 Гр·ч. −1 до 12 Гр·ч −1 . [81]
Брахитерапия с высокой мощностью дозы (HDR) – это когда скорость доставки дозы превышает 12 Гр·ч. −1 . [81] Наиболее часто HDR-брахитерапия применяется при опухолях шейки матки , пищевода , легких , молочной железы и простаты . [1] Большинство процедур HDR проводятся амбулаторно, но это зависит от места лечения. [12]
Брахитерапия с импульсной дозой (PDR) включает короткие импульсы излучения, обычно один раз в час, для имитации общей скорости и эффективности лечения LDR. Типичными участками опухоли, подвергаемыми PDR-брахитерапии, являются гинекологические области. [1] : Ч. 14 и рак головы и шеи. [10]

Расчет дозы радиации от радиоактивных семян имеет решающее значение при планировании и проведении лечения брахитерапией. Большинство современных расчетов выполняются с использованием формализма, опубликованного Американской ассоциацией физиков в медицине . [83] Для геометрии на рисунке 1 этот формализм использует пять параметров.
- Сила источника : сколько радиации излучает семя, выражается как сила воздушной кермы и обозначается .
- Мощность дозы источника : какую дозу семена доставят в контрольную точку за определенный период времени, обозначаемый .
- Коэффициент геометрии : как форма семени повлияет на дозу в точках, удаленных от контрольной точки, обозначаемой .
- Функция анизотропии : насколько большое количество излучения будет остановлено перед выходом из затравки, обозначается .
- Функция радиальной дозы : как излучение будет взаимодействовать с материалом, окружающим семя, обозначаемым .
Уравнение, связывающее эти параметры:
Продолжительность доставки дозы
[ редактировать ]Размещение источников радиации в целевой зоне может быть временным или постоянным.
Временная брахитерапия предполагает размещение источников радиации на определенный период времени (обычно несколько минут или часов) перед их отменой. [1] : Ч. 1 Конкретная продолжительность лечения будет зависеть от множества различных факторов, включая требуемую скорость введения дозы, а также тип, размер и расположение рака. При брахитерапии LDR и PDR источник обычно остается на месте до 24 часов, прежде чем его удаляют, тогда как при брахитерапии HDR это время обычно составляет несколько минут. [84]
Постоянная брахитерапия, также известная как имплантация семян, включает в себя размещение небольших радиоактивных семян или гранул LDR (размером с рисовое зернышко) в опухоль или место лечения и оставление их там навсегда для постепенного распада. В течение недель или месяцев уровень радиации, испускаемой источниками, снизится почти до нуля. Неактивные семена остаются в месте обработки без длительного эффекта. [76] Постоянная брахитерапия чаще всего используется при лечении рака простаты . [82]
Процедура
[ редактировать ]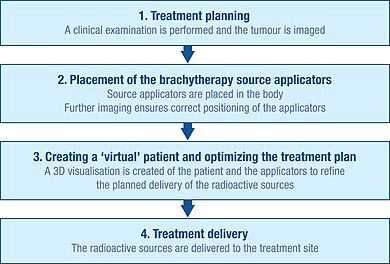
Первоначальное планирование
[ редактировать ]Чтобы точно спланировать процедуру брахитерапии, проводится тщательное клиническое обследование, чтобы понять характеристики опухоли. Кроме того, для визуализации формы и размера опухоли и ее связи с окружающими тканями и органами можно использовать ряд методов визуализации. К ним относятся рентгеновская рентгенография, ультразвук, компьютерная аксиальная томография (КТ или CAT) и магнитно-резонансная томография (МРТ). [1] : Ч. 5 Данные из многих из этих источников можно использовать для создания 3D-визуализации опухоли и окружающих тканей. [1] : Ч. 5
Используя эту информацию, можно разработать план оптимального распределения источников радиации. Это включает в себя рассмотрение того, как следует размещать и располагать носители источников (аппликаторы), которые используются для доставки излучения к месту лечения. [1] : Ч. 5 Аппликаторы нерадиоактивны и обычно представляют собой иглы или пластиковые катетеры. Конкретный тип используемого аппликатора будет зависеть от типа рака, подлежащего лечению, и характеристик целевой опухоли. [1] : Ч. 5
Такое первоначальное планирование помогает избежать «холодных точек» (слишком малого облучения) и «горячих точек» (слишком сильного облучения) во время лечения, поскольку они могут соответственно привести к неудаче лечения и побочным эффектам. [29]
Вставка
[ редактировать ]Прежде чем радиоактивные источники можно будет доставить к месту опухоли, аппликаторы необходимо вставить и правильно расположить в соответствии с первоначальным планированием.
Методы визуализации, такие как рентген, рентгеноскопия и ультразвук, обычно используются, чтобы помочь правильно расположить аппликаторы и уточнить план лечения. [1] : Ч. 5 Также можно использовать компьютерную томографию и МРТ. [1] : Ч. 5 После введения аппликаторов их фиксируют на коже с помощью швов или клейкой ленты, чтобы предотвратить их перемещение. Как только будет подтверждено, что аппликаторы находятся в правильном положении, можно выполнить дальнейшую визуализацию для детального планирования лечения. [1] : Ч. 5
Создание виртуального пациента
[ редактировать ]
Изображения пациента с аппликаторами на месте импортируются в программное обеспечение для планирования лечения, и пациента помещают в специальную экранированную комнату для лечения. Программное обеспечение для планирования лечения позволяет преобразовать несколько 2D-изображений места лечения в 3D-«виртуального пациента», внутри которого можно определить положение аппликаторов. [1] : Ч. 5 Пространственные взаимоотношения между аппликаторами, местом лечения и окружающими здоровыми тканями внутри этого «виртуального пациента» являются копией взаимоотношений реального пациента.
Оптимизация плана облучения
[ редактировать ]
Чтобы определить оптимальное пространственное и временное распределение источников излучения внутри аппликаторов имплантированной ткани или полости, программное обеспечение для планирования лечения позволяет размещать виртуальные источники излучения внутри виртуального пациента. Программное обеспечение показывает графическое представление распределения облучения. Это служит руководством для команды брахитерапевтов, позволяющим уточнить распределение источников и разработать план лечения, оптимально адаптированный к анатомии каждого пациента, прежде чем начнется фактическое облучение. [85] Этот подход иногда называют «дозационным рисованием».
Доставка лечения
[ редактировать ]Источники радиации, используемые для брахитерапии, всегда заключены в нерадиоактивную капсулу. Источники можно доставлять вручную, но чаще всего они доставляются с помощью метода, известного как «последующая загрузка».
Ручное проведение брахитерапии ограничено несколькими применениями LDR из-за риска радиационного воздействия на клинический персонал. [84]
Напротив, постнагрузка предполагает точное позиционирование нерадиоактивных аппликаторов в месте лечения, которые впоследствии загружаются источниками радиации. При ручной загрузке источник доставляется в аппликатор оператором.
Системы удаленной постнагрузки обеспечивают защиту медицинских работников от радиационного воздействия путем помещения источника радиации в экранированный сейф. Как только аппликаторы правильно расположены на пациенте, их подключают к аппарату «дозагрузки» (содержащему радиоактивные источники) через ряд соединительных направляющих трубок. План лечения передается в постлоадер, который затем контролирует доставку источников по направляющим трубкам в заранее заданные позиции внутри аппликатора. Этот процесс начинается только после того, как персонал выводится из процедурного кабинета. Источники остаются на месте в течение заранее заданного периода времени, опять же в соответствии с планом лечения, после чего по трубкам возвращаются в постлоадер.
По завершении доставки радиоактивных источников аппликаторы осторожно удаляют с тела. Пациенты обычно быстро восстанавливаются после процедуры брахитерапии, что позволяет часто проводить ее амбулаторно. [12]
В период с 2003 по 2012 год в общественных больницах США количество госпитализаций с брахитерапией (внутренней лучевой терапией) снизилось в среднем на 24,4 процента среди взрослых в возрасте 45–64 лет и среднегодовое снижение на 27,3 процента среди взрослых в возрасте 65–84 лет. . Брахитерапия была операционной процедурой с наибольшим изменением частоты пребывания в больнице, оплачиваемой Medicare и частной страховкой. [86]
Источники радиации
[ редактировать ]Обычно используемые источники излучения (радионуклиды) для брахитерапии включают: [87]
| Радионуклид | Режим затухания | Период полураспада | Энергия |
|---|---|---|---|
| Цезий-131 ( 131 С) | е | 9,7 дней | 30,4 кэВ (среднее) |
| Цезий-137 ( 137 С) | б − , с | 30,17 лет | 0,512, 0,662 МэВ γ-лучи |
| Кобальт-60 ( 60 Ко) | б − , с | 5,26 лет | 1,17, 1,33 МэВ γ-лучи |
| Иридий-192 ( 192 И) | б − , е, в | 73,8 дней | 0,38 МэВ (среднее) |
| Йод-125 ( 125 Я) | е | 59,6 дней | 27,4, 31,4 и 35,5 кэВ |
| Палладий-103 ( 103 Пд) | е | 17,0 дней | 21 кэВ (среднее) |
| Рутений-106 ( 106 ру) | б − | 1,02 года | 3,54 МэВ |
| Радий-226 ( 226 день) | а | 1599 лет |
История
[ редактировать ]Брахитерапия берет свое начало в 1901 году (вскоре после открытия Анри Беккерелем радиоактивности в 1896 году), когда Пьер Кюри предположил Анри-Александру Данлосу , что радиоактивный источник можно вводить в опухоль. [88] [89] Было обнаружено, что радиация заставила опухоль уменьшиться. [89] Независимо Александр Грэм Белл также предложил использовать радиацию таким образом. [89] В начале двадцатого века методы применения брахитерапии были впервые применены в институте Кюри в Париже Данлосом и в Мемориальной больнице Святого Луки в Нью-Йорке Робертом Аббе . [1] : Ч. 1 [89]
Работая вместе с семьей Кюри в их лаборатории исследования радия в Парижском университете, американский физик Уильям Дуэйн усовершенствовал метод извлечения газообразного радона-222 из растворов сульфата радия . Растворы, содержащие 1 грамм радия, «доили», чтобы создать «семена» радона примерно по 20 милликюри каждый. Эти «семена» были распространены по всему Парижу для использования в ранней форме брахитерапии, называемой эндокуритерапией. Дуэйн усовершенствовал эту технику «доения» во время своего пребывания в Париже и назвал это устройство «радиевой коровой». [90]
Дуэйн вернулся в Соединенные Штаты в 1913 году и работал одновременно в качестве доцента физики в Гарварде и научного сотрудника по физике Гарвардской комиссии по раку. [91] Комиссия по раку была основана в 1901 году и наняла Дуэйна для исследования использования эманаций радия в лечении рака. [92] В 1915 году он построил первую в Бостоне «радиевую корову», и тысячи пациентов получили лечение радоном-222, вырабатываемым из нее. [93]
Интерстициальная радиевая терапия была широко распространена в 1930-х годах. [1] : Ч. 1 Золотые семена, наполненные радоном, использовались еще в 1942 году. [94] по крайней мере до 1958 года. [95] Золотые оболочки были выбраны Джино Файллой примерно в 1920 году для защиты бета-лучей при прохождении гамма-лучей . [96] Кобальтовые иглы также некоторое время использовались после Второй мировой войны. [1] : Ч. 1 Радон и кобальт были заменены радиоактивными танталом и золотом, прежде чем иридий занял видное место. [1] : Ч. 1 Впервые использованный в 1958 году, иридий сегодня является наиболее часто используемым искусственным источником для брахитерапии. [1] : Ч. 1
После первоначального интереса к брахитерапии в Европе и США, ее использование сократилось в середине двадцатого века из-за проблемы радиационного облучения операторов в результате ручного применения радиоактивных источников. [89] [97] Однако разработка систем дистанционной догрузки , позволяющих доставлять радиацию из экранированного сейфа, и использование новых радиоактивных источников в 1950-х и 1960-х годах снизили риск ненужного радиационного воздействия на оператора и пациентов. [88] Это, в сочетании с недавними достижениями в области трехмерных методов визуализации, компьютеризированных систем планирования лечения и оборудования для доставки, сделало сегодня брахитерапию безопасным и эффективным методом лечения многих типов рака. [1] : Ч. 1
Слово «брахитерапия» происходит от греческого слова βραχύς , brachys , что означает «короткое расстояние» или «короткий».
Экологическая опасность
[ редактировать ]Из-за небольшого размера источников для брахитерапии и слабого контроля в первые десятилетия существует риск того, что некоторые из них утекут в окружающую среду и станут бесхозными источниками . В 2011 году на детской площадке в Праге была обнаружена радиевая игла, излучающая мощность 500 мкЗв/ч на расстоянии одного метра. [98] [99] [100]
См. также
[ редактировать ]- Дистанционная лучевая терапия
- Брахитерапия простаты
- Таргетная интраоперационная лучевая терапия
- Лучевая терапия с открытым источником
- Ядерная медицина
- Интраоперационная лучевая терапия
- Контактная рентгеновская брахитерапия (также называемая «электронной брахитерапией»)
Ссылки
[ редактировать ]- ^ Перейти обратно: а б с д и ж г час я дж к л м н тот п д р с т в v В х и С аа аб и объявление но из в ах есть также Гербаулет А., Поттер Р., Мазерон Дж.Дж., Меертенс Х., Лимберген Э.В., ред. (2002). Справочник GEC ESTRO по брахитерапии . Левен, Бельгия: Европейское общество терапевтической радиологии и онкологии. OCLC 52988578 .
- ^ Перейти обратно: а б с Вишванатан А.Н. и др. (2007). «Гинекологическая брахитерапия». В Девлине П. (ред.). Брахитерапия: применение и методы . Филадельфия: LWW.
- ^ Кишан А., Кук Р., Циезки Дж. и др. (2018). «Радикальная простатэктомия, внешняя лучевая терапия или внешняя лучевая терапия с усилением брахитерапии, прогрессированием заболевания и смертностью у пациентов с раком простаты 9–10 баллов по шкале Глисона» . ДЖАМА . 319 (9): 896–905. дои : 10.1001/jama.2018.0587 . ПМЦ 5885899 . ПМИД 29509865 .
- ^ Перейти обратно: а б Питерс Б.Р., Де Бэк Д.З., Конинг CC, Звиндерман А.Х. (2009). «Сравнение трех методов лучевой терапии по биохимическому контролю и общей выживаемости при лечении рака простаты: систематический обзор». Лучевая терапия и онкология . 93 (2): 168–173. дои : 10.1016/j.radonc.2009.08.033 . ПМИД 19748692 .
- ^ Перейти обратно: а б с Стюарт А.Дж. и др. (2007). «Радиобиологические концепции брахитерапии». В Девлине П. (ред.). Брахитерапия. Приложения и методы . Филадельфия: LWW.
- ^ Перейти обратно: а б с Группа BMJ (июнь 2009 г.). «Рак простаты: внутренняя лучевая терапия (брахитерапия)» . Guardian.co.uk. Архивировано из оригинала 4 апреля 2009 года . Проверено 25 сентября 2009 г.
- ^ Перейти обратно: а б с д и Келли Дж.Р. и др. (2007). «Брахитерапия груди». В Девлине П. (ред.). Брахитерапия. Приложения и методы . Филадельфия: LWW.
- ^ CSIntell. «Восстановление рынка брахитерапии достигнет 2,4 миллиарда долларов США» .
В 2013 году мировой рынок брахитерапии достиг 680 миллионов долларов США, из которых на сегменты высокой мощности дозы (HDR) и LDR приходилось 70%. Оставшиеся 30% принадлежали микросферам и электронной брахитерапии.
- ^ CSIntell. «Восстановление рынка брахитерапии достигнет 2,4 миллиарда долларов США» .
Ожидается, что к 2030 году рынок брахитерапии достигнет более 2,4 миллиарда долларов США и будет расти на 8% ежегодно, в основном за счет рынка микросфер, а также электронной брахитерапии, которая вызывает значительный интерес во всем мире как удобная для пользователя технология.
- ^ Перейти обратно: а б с д Мазерон Дж.Дж., Ардиет Ж.М., Хайе-Медер С., Ковач Г.Р., Левендаг П., Пайфферт Д., Поло А., Ровироса А., Стрнад В. (2009). «Рекомендации GEC-ESTRO по брахитерапии плоскоклеточного рака головы и шеи». Лучевая терапия и онкология . 91 (2): 150–156. дои : 10.1016/j.radonc.2009.01.005 . ПМИД 19329209 .
- ^ Дворжак, Яндик П., Меличар Б., Джон Б., Мерганцова Дж., Зул З., Вацек З., Петера Дж. (2002). «Внутрипросветная высокодозная брахитерапия в лечении рака желчных протоков и желчного пузыря». Гепато-гастроэнтерология . 49 (46): 916–917. ПМИД 12143240 .
- ^ Перейти обратно: а б с Наг С. (2004). «Высокомощная брахитерапия: ее клиническое применение и рекомендации по лечению». Технологии исследования и лечения рака . 3 (3): 269–87. дои : 10.1177/153303460400300305 . ПМИД 15161320 . S2CID 36764232 .
- ^ Джозеф К.Дж., Алви Р., Скарсгард Д., Тонита Дж., Первез Н., Смолл С., Тай П. (2008). «Анализ качества жизни, связанного со здоровьем (HRQoL), пациентов с клинически локализованным раком простаты через год после лечения только дистанционной лучевой терапией (ДЛТ) в сравнении с ДЛТ и брахитерапией с высокой мощностью дозы (HDRBT)» . Радиационная онкология . 3:20 . дои : 10.1186/1748-717X-3-20 . ПМЦ 2494997 . ПМИД 18627617 .
- ^ Холмбо, Конкато Дж (2000). «Решения о лечении локализованного рака простаты: спрашиваем мужчин, что важно» . Журнал общей внутренней медицины . 15 (10): 694–701. дои : 10.1046/j.1525-1497.2000.90842.x . ПМЦ 1495597 . ПМИД 11089712 .
- ^ Хоскин П., Койл С., ред. (2005). Лучевая терапия на практике: брахитерапия . Нью-Йорк: Издательство Оксфордского университета. ISBN 978-0-19-852940-8 .
- ^ Гедеа Ф, Вентура М, Мазерон Дж, Торресилья Дж, Бильбао П, Боррас Дж (2008). «Способы лечения брахитерапии в Европе: возможности и ресурсы брахитерапии в европейском регионе». Брахитерапия . 7 (3): 223–230. дои : 10.1016/j.brachy.2008.03.001 . ПМИД 18579448 .
- ^ Куанг Т.С. и др. (2007). «Технологическая эволюция в лечении рака простаты» . Онкология . 21 .
- ^ Перейти обратно: а б Гедеа Ф, Феррер М, Пера Х, Агило Ф, Боладерас А, Суарес ХФ, Кунильера О, Феррер Ф, Пардо Ю, Мартинес Э, Вентура М (2009). «Качество жизни через два года после радикальной простатэктомии, брахитерапии простаты или дистанционной лучевой терапии при клинически локализованном раке простаты: опыт Каталонского института онкологии / больницы Беллвитге». Клиническая и трансляционная онкология . 11 (7): 470–478. дои : 10.1007/s12094-009-0387-x . ПМИД 19574206 . S2CID 22946298 .
- ^ Литвин М.С., Гор Дж.Л., Кван Л., Брандейс Дж.М., Ли С.П., Уизерс Х.Р., Райтер Р.Э. (2007). «Качество жизни после операции, внешнего лучевого облучения или брахитерапии при раке простаты на ранней стадии». Рак . 109 (11): 2239–2247. дои : 10.1002/cncr.22676 . ПМИД 17455209 . S2CID 25926233 .
- ^ Перейти обратно: а б Пистис Ф, Гедеа Ф, Пера Х, Гутьеррес К, Вентура М, Поло А, Мартинес Э, Боладерас А, Феррер Ф, Габриэле П, Линарес Л (2009). «Внешняя лучевая терапия плюс высокодозная брахитерапия для лечения местно-распространенного рака простаты: первоначальный опыт Каталонского института онкологии». Брахитерапия . 9 (1): 15–22. дои : 10.1016/j.brachy.2009.05.001 . ПМИД 19734106 .
- ^ Перейти обратно: а б Лерсангуансинчай П., Лертбутсаянукул С., Шотерсук К., Хорпрасерт С., Роджпорнпрадит П., Чоттетанапрасит Т., Шрисутеп А., Сурияпи С., Джампангерн С., Тресукосол Д., Чарунсантикул С. (2004). «Рандомизированное исследование фазы III, сравнивающее брахитерапию LDR и HDR в лечении рака шейки матки». Международный журнал радиационной онкологии, биологии, физики . 59 (5): 1424–1431. дои : 10.1016/j.ijrobp.2004.01.034 . ПМИД 15275728 .
- ^ Роддигер С.Дж. и др. (2006). «Неоадъювантная интерстициальная высокодозная брахитерапия (HDR) в сочетании с системной химиотерапией у пациентов с раком молочной железы» . Стралентер Онкол . 182 (1): 22–9. дои : 10.1007/s00066-006-1454-7 . ПМИД 16404517 . S2CID 23210347 .
- ^ Гаффни Д., Дюбуа А., Нараян К., Рид Н., Тойта Т., Пигната С., Блейк П., Портеланс Л., Садойзе А., Поттер Р., Коломбо А., Рэндалл М., Мирза М.Р., Тримбл Э.Л. (2007). «Практика лучевой терапии при раке шейки матки среди групп-членов Интергруппы по гинекологическому раку (GCIG)». Международный журнал радиационной онкологии, биологии, физики . 68 (2): 485–490. дои : 10.1016/j.ijrobp.2006.12.013 . ПМИД 17336465 .
- ^ Перейти обратно: а б Национальный институт здравоохранения и клинического мастерства (март 2006 г.). «Высокомощная брахитерапия рака шейки матки» . ХОРОШИЙ . Проверено 25 сентября 2009 г.
- ^ Перейти обратно: а б с Вишванатан А.Н. и др. «Целевая группа по брахитерапии рака шейки матки Американского общества брахитерапии» (PDF) . Американское общество брахитерапии . Проверено 25 сентября 2009 г.
- ^ Вишванатан А.Н., Эриксон Б.А. (2009). «Трехмерная визуализация в гинекологической брахитерапии: исследование Американского общества брахитерапии». Международный журнал радиационной онкологии, биологии, физики . 76 (1): 104–109. дои : 10.1016/j.ijrobp.2009.01.043 . ПМИД 19619956 .
- ^ Хайе-Медер С., Шаргари С., Рей А., Дюма И., Морис П., Магне Н. (2009). «Параметры DVH и исходы для пациентов с раком шейки матки на ранней стадии, получавших предоперационную брахитерапию с низкой мощностью дозы на основе МРТ с последующим хирургическим вмешательством». Лучевая терапия и онкология . 93 (2): 316–321. дои : 10.1016/j.radonc.2009.05.004 . ПМИД 19586673 .
- ^ Ким Д.Х., Ван-Чезебро А., Вайнберг В., Пулио Дж., Чен Л.М., Спейт Дж., Литтелл Р., Сюй И.С. (2009). «Высокомощная брахитерапия с использованием обратного планирования с имитацией отжига при локорегионально распространенном раке шейки матки: клинический отчет с двухлетним наблюдением». Международный журнал радиационной онкологии, биологии, физики . 75 (5): 1329–1334. дои : 10.1016/j.ijrobp.2009.01.002 . ПМИД 19409728 .
- ^ Перейти обратно: а б Поттер Р., Кириситс С., Фидарова Е., Димопулос Дж., Бергер Д., Тандеруп К., Линдегаард Дж. (2008). «Современное состояние и будущее высокоточной адаптивной брахитерапии под визуальным контролем при раке шейки матки» . Акта Онкологика . 47 (7): 1325–1336. дои : 10.1080/02841860802282794 . ПМИД 18661430 .
- ^ Поттер Р., Хайе-Медер С., Ван Лимберген Е.В., Барильот И., Де Брабандер М.Д., Димопулос Дж., Дюма И., Эриксон Б., Ланг С., Нуленс А., Петроу П., Раунд Дж., Кириситс С., Гек Эстро Уоркинг Г (2006) . «Рекомендации гинекологической (гинекологической) рабочей группы GEC ESTRO (II): Концепции и термины в планировании лечения на основе трехмерных изображений при брахитерапии рака шейки матки - параметры объема трехмерной дозы и аспекты анатомии на основе трехмерных изображений, радиационной физики, радиобиологии». Лучевая терапия и онкология . 78 (1): 67–77. дои : 10.1016/j.radonc.2005.11.014 . ПМИД 16403584 .
- ^ Хареяма М., Саката К.И., Оучи А., Нагакура Х., Шидо М., Сомея М., Който К. (2002). «Высоко-дозовая и низкодозовая внутриполостная терапия рака шейки матки» . Рак . 94 (1): 117–124. дои : 10.1002/cncr.10207 . ПМИД 11815967 .
- ^ Лю Р., Ван X, Тянь Дж. Х., Ян К., Ван Дж., Цзян Л., Хао XY (09.10.2014). «Внутриполостная брахитерапия с высокой мощностью дозы и низкой мощностью дозы при местно-распространенном раке шейки матки» . Кокрейновская база данных систематических обзоров . 2022 (10): CD007563. дои : 10.1002/14651858.cd007563.pub3 . ISSN 1465-1858 . ПМЦ 8734152 . ПМИД 25300170 .
- ^ Перейти обратно: а б Меррик Г.С. и др. «Рабочая группа по низкой мощности простаты Американского общества брахитерапии» (PDF) . Американское общество брахитерапии . Проверено 25 сентября 2009 г.
- ^ Перейти обратно: а б Сюй И.С. и др. «Группа по лечению простаты с высокой мощностью дозы Американского общества брахитерапии» (PDF) . Американское общество брахитерапии . Проверено 25 сентября 2009 г.
- ^ Перейти обратно: а б Баттерманн Дж., Бун Т., Моерланд М. (2004). «Результаты постоянной брахитерапии простаты, 13-летний опыт работы в одном учреждении». Лучевая терапия и онкология . 71 (1): 23–28. дои : 10.1016/j.radonc.2004.01.020 . ПМИД 15066292 .
- ^ Перейти обратно: а б Эш Д. и др. (2005). «Рак простаты». В Хоскин П., Койл С. (ред.). Радиотерапия на практике: брахитерапия . Нью-Йорк: Издательство Оксфордского университета.
- ^ Моррис В.Дж., Киз М., Пальма Д., Маккензи М., Спейдингер И., Агранович А., Пиклз Т., Лю М., Кван В., Ву Дж., Лапуант В., Бертле Э., Пай Х., Харрисон Р., Ква В., Буччи Дж., Рац В. , Вудс Р. (2009). «Оценка дозиметрических параметров и реакции заболевания после трансперинеальной брахитерапии с применением 125 йода при раке предстательной железы низкого и среднего риска». Международный журнал радиационной онкологии, биологии, физики . 73 (5): 1432–1438. дои : 10.1016/j.ijrobp.2008.07.042 . ПМИД 19036530 .
- ^ Пиклз Т., Киз М., Моррис У.Дж. (2009). «Брахитерапия или конформная внешняя лучевая терапия рака простаты: анализ подобранной пары в одном учреждении». Международный журнал радиационной онкологии, биологии, физики . 76 (1): 43–49. дои : 10.1016/j.ijrobp.2009.01.081 . ПМИД 19570619 .
- ^ Перейти обратно: а б с д Фрэнк С., Пистерс Л., Дэвис Дж., Ли А., Бассетт Р., Кубан Д. (2007). «Оценка качества жизни после радикальной простатэктомии, высоких доз внешней лучевой терапии и брахитерапии, имплантации йода в качестве монотерапии локализованного рака простаты». Журнал урологии . 177 (6): 2151–2156. дои : 10.1016/j.juro.2007.01.134 . ПМИД 17509305 .
- ^ Перейти обратно: а б Галалае Р., Мартинес А., Мате Т., Митчелл С., Эдмундсон Г., Нюрнберг Н., Юлау С., Густафсон Г., Гриббл М., Ковач Г. (2004). «Долгосрочный результат по факторам риска с использованием конформной высокодозной брахитерапии (HDR-BT) с неоадъювантной андрогенной супрессией или без нее при локализованном раке простаты». Международный журнал радиационной онкологии, биологии, физики . 58 (4): 1048–1055. дои : 10.1016/j.ijrobp.2003.08.003 . ПМИД 15001244 .
- ^ Перейти обратно: а б Хоскин П.Дж., Мотохаши К., Боунс П., Брайант Л., Остлер П. (2007). «Высокомощная брахитерапия в сочетании с дистанционной лучевой терапией в радикальном лечении рака простаты: первые результаты рандомизированного исследования третьей фазы». Лучевая терапия и онкология . 84 (2): 114–120. дои : 10.1016/j.radonc.2007.04.011 . ПМИД 17531335 .
- ^ Перейти обратно: а б Писанский Т.М., Голд Д.Г., Фурутани К.М., Макдональд ОК, Макларен Р.Х., Миндерс Л.А., Уилсон Т.М., Хебл Дж.Р., Чу Р. (2008). «Высокодозная брахитерапия в радикальном лечении больных локализованным раком предстательной железы» . Труды клиники Мэйо . 83 (12): 1364–1372. дои : 10.4065/83.12.1364 . ПМИД 19046556 .
- ^ Перейти обратно: а б с Кейш и др. (февраль 2007 г.). «Целевая группа по брахитерапии груди Американского общества брахитерапии» (PDF) . Американское общество брахитерапии . Проверено 25 сентября 2009 г.
- ^ Перейти обратно: а б Хоскин П. и др. (2005). «Брахитерапия груди». В Хоскин П., Койл С. (ред.). Лучевая терапия на практике: брахитерапия . Нью-Йорк: Издательство Оксфордского университета. ISBN 978-0-19-852940-8 .
- ^ Перейти обратно: а б с Полгар С, майор Т (2009). «Современное состояние и перспективы брахитерапии рака молочной железы». Международный журнал клинической онкологии . 14 (1): 7–24. дои : 10.1007/s10147-008-0867-y . ПМИД 19225919 . S2CID 20971836 .
- ^ Перейти обратно: а б Нельсон Дж.К., Бейтш П.Д., Вичини Ф.А., Квайт К.А., Гарсия Д., Снайдер Х.К., Гиттлман М.А., Заннис В.Дж., Уитворт П.В., Файн Р.Э., Келехер А.Дж., Куерер Х.М. (2009). «Четырёхлетние клинические новости исследования брахитерапии MammoSite, проведенного Американским обществом грудных хирургов». Американский журнал хирургии . 198 (1): 83–91. дои : 10.1016/j.amjsurg.2008.09.016 . ПМИД 19268900 .
- ^ Перейти обратно: а б Вайдья Дж.С. (2009). «APBI с фотонами 50 кВ: целевая интраоперационная лучевая терапия (TARGIT)». Ускоренное частичное облучение молочной железы . Шпрингер, Берлин, Гейдельберг. стр. 327–344. дои : 10.1007/978-3-540-88006-6_19 . ISBN 9783540880059 .
- ^ Ореккья Р., Ивальди ГБ, Леонарди МК (2009). «Интраоперационная техника APBI с электронами». Ускоренное частичное облучение молочной железы . Шпрингер, Берлин, Гейдельберг. стр. 345–366. дои : 10.1007/978-3-540-88006-6_20 . ISBN 9783540880059 .
- ^ Шах А.П., Штраус Дж.Б., Кирк М.К., Чен С.С., Диклер А. (2010). «Дозиметрический анализ, сравнивающий электронный луч с аппликатором для брахитерапии MammoSite для увеличения неповрежденной груди». Физика Медика . 26 (2): 80–87. дои : 10.1016/j.ejmp.2009.08.004 . ПМИД 19836283 .
- ^ Скандербег Д., Яшар С., Уайт Дж., Райс Р., Павлицкий Т. (2010). «Оценка трех методов APBI в соответствии с рекомендациями NSABP B-39» . Журнал прикладной клинической медицинской физики . 11 (1): 274–280. дои : 10.1120/jacmp.v11i1.3021 . ПМЦ 5719777 . ПМИД 20160680 .
- ^ Яшар С., Блэр С., Уоллес А., Скандербег Д. (2009). «Начальный клинический опыт использования аппликатора для брахитерапии с регулируемым объемом имплантата для ускоренного частичного облучения груди». Брахитерапия . 8 (4): 367–372. дои : 10.1016/j.brachy.2009.03.190 . ПМИД 19744892 .
- ^ Перейти обратно: а б Пиньоль Дж. П., Келлер Б. М. (2009). «Постоянные имплантаты грудных семян». Ускоренное частичное облучение молочной железы . Шпрингер, Берлин, Гейдельберг. стр. 263–276. дои : 10.1007/978-3-540-88006-6_15 . ISBN 9783540880059 .
- ^ К1 «ГаммаТайл» — Isoray Medical Inc. — 510(k) Предварительное уведомление . FDA. 23 января 2020 г. Подведение итогов
- ^ «Ежегодное научное собрание AANS 2019 в Сан-Диего» . Архивировано из оригинала 21 декабря 2019 г. Проверено 15 апреля 2020 г.
- ^ Брахман Д., Юсеф Э., Дардис С., Смит К., Пиннадуваге Д., Накаджи П. (2019). «Хирургическая таргетная лучевая терапия: профиль безопасности брахитерапии с коллагеновыми плитками при 79 рецидивирующих, ранее облученных внутричерепных новообразованиях в проспективном клиническом исследовании» . Брахитерапия . 18 (3): С35–С36. дои : 10.1016/j.brachy.2019.04.076 . S2CID 196511749 .
- ^ Фолкерт М.Р., Коэн Г.Н., Ву А.Дж., Гердес Х., Шаттнер М.А., Марковиц А.Дж., Людвиг Э., Илсон Д.Х., Бэйнс М.С. (сентябрь 2013 г.). «Эндолюминальная высокодозная брахитерапия при ранней стадии и рецидивном раке пищевода у неоперабельных пациентов». Брахитерапия . 12 (5): 463–470. дои : 10.1016/j.brachy.2012.12.001 . ISSN 1538-4721 . ПМИД 23434221 .
- ^ Хишикава Ю., Курису К., Танигучи М., Камиконья Н., Миура Т. (октябрь 1991 г.). «Высокодозная внутрипросветная брахитерапия (HDRIBT) при раке пищевода». Международный журнал радиационной онкологии, биологии, физики . 21 (5): 1133–1135. дои : 10.1016/0360-3016(91)90267-8 . ПМИД 1938510 .
- ^ Перейти обратно: а б Фуччио Л., Мандолези Д., Фариоли А., Хасан С., Фраццони Л., Гвидо А., де Бортоли Н., Силла С., Пьерантони С. (март 2017 г.). «Брахитерапия для паллиативного лечения дисфагии, вызванной раком пищевода: систематический обзор и метаанализ проспективных исследований». Лучевая терапия и онкология . 122 (3): 332–339. дои : 10.1016/j.radonc.2016.12.034 . ПМИД 28104297 .
- ^ Хомс М.Ю., Стейерберг Э.В., Эйкенбум В.М., Тиланус Х.В., Сталперс Л.Дж., Бартельсман Дж.Ф., ван Ланшот Дж.Дж., Вейрдеман Х.К., Малдер С.Дж. (октябрь 2004 г.). «Однодозовая брахитерапия по сравнению с установкой металлического стента для паллиативного лечения дисфагии, вызванной раком пищевода: многоцентровое рандомизированное исследование». Ланцет . 364 (9444): 1497–1504. дои : 10.1016/S0140-6736(04)17272-3 . ПМИД 15500894 . S2CID 29529166 .
- ^ Ноносита Т., Сасаки Т., Хирата Х., То Ю., Шиояма Ю., Накамура К., Хонда Х. (26 октября 2007 г.). «Высокодозная брахитерапия для ранее облученных пациентов с рецидивирующим раком пищевода». Радиационная медицина . 25 (8): 373–377. дои : 10.1007/s11604-007-0152-4 . ISSN 0288-2043 . ПМИД 17952540 . S2CID 7294379 .
- ^ Акаги Ю, Хирокава Ю, Кагемото М, Мацуура К, Ито А, Фудзита К, Кендзё М, Кириу Х, Ито К (февраль 1999 г.). «Оптимальное фракционирование для высокодозной эндоэзофагеальной брахитерапии после внешнего облучения рака пищевода на ранней стадии». Международный журнал радиационной онкологии, биологии, физики . 43 (3): 525–530. дои : 10.1016/S0360-3016(98)00433-7 . ПМИД 10078632 .
- ^ Сай Х, Мицумори М, Араки Н, Мизоваки Т, Нагата Ю, Нисимура Ю, Хираока М (август 2005 г.). «Отдаленные результаты окончательной лучевой терапии рака пищевода I стадии». Международный журнал радиационной онкологии, биологии, физики . 62 (5): 1339–1344. дои : 10.1016/j.ijrobp.2004.12.042 . ISSN 0360-3016 . ПМИД 16029790 .
- ^ Чиприани С., Десантис М., Дальхофф Г., Браун С.Д., Вендлер Т., Ольмеда М., Питш Г., Эберляйн Б. (22 июля 2020 г.). «Персонализированная лучевая терапия НМСК с помощью терапии рака кожи рением-188: долгосрочное ретроспективное исследование» . Журнал дерматологического лечения . 33 (2): 969–975. дои : 10.1080/09546634.2020.1793890 . ISSN 0954-6634 . PMID 32648530 .
- ^ Гикс, Финестрес Ф., Телло Дж., Пальма С., Мартинес А., Гикс Дж., Гикс Р. (2000). «Лечение рака кожи лица высокодозной брахитерапией и изготовлением индивидуальных поверхностных форм». Международный журнал радиационной онкологии, биологии, физики . 47 (1): 95–102. дои : 10.1016/S0360-3016(99)00547-7 . ПМИД 10758310 .
- ^ Седда А.Ф., Росси Дж., Чиприани С., Карроццо А.М., Донати П. (2008). «Дерматологическая высокодозная брахитерапия для лечения базально- и плоскоклеточного рака» (PDF) . Клиническая и экспериментальная дерматология . 33 (6): 745–749. дои : 10.1111/j.1365-2230.2008.02852.x . hdl : 2108/59410 . ПМИД 18681873 . S2CID 26912830 .
- ^ Рио Э., Барде Э., Феррон С., Певрель П., Супиот С., Кэмпион Л., Бовиллен Де Монтрей С., Маэ М., Дрено Б. (2005). «Интерстициальная брахитерапия периорифициальных карцином кожи лица: ретроспективное исследование 97 случаев». Международный журнал радиационной онкологии, биологии, физики . 63 (3): 753–757. дои : 10.1016/j.ijrobp.2005.03.027 . ПМИД 15927410 .
- ^ Перейти обратно: а б Мусмахер Дж. и др. (2006). «Высокодозная брахитерапия с поверхностными аппликаторами: лечение немеланоматозного рака кожи». Журнал клинической онкологии . 24 (18_дополнение): 15543. doi : 10.1200/jco.2006.24.18_suppl.15543 .
- ^ Члены А/, Альбертссон С., Авилес П., Камичи Ф.Ф., Коломбо П.Г., Хамм А., Йоргенсен С., Марко Э., Нордрехауг Дж., Рузилло В., Урбан П., Стоун Г.В., Вейнс В., Рабочая группа по чрескожным коронарным вмешательствам Европейского общества. кардиологии (2005). «Руководство по чрескожным коронарным вмешательствам: Рабочая группа по чрескожным коронарным вмешательствам Европейского общества кардиологов» . Европейский кардиологический журнал . 26 (8): 804–847. дои : 10.1093/eurheartj/ehi138 . ПМИД 15769784 .
- ^ Сидави, Вайсвассер Дж., Ваксман Р. (2002). «Периферическая сосудистая брахитерапия» . Журнал сосудистой хирургии . 35 (5): 1041–1047. дои : 10.1067/mva.2002.123751 . ПМИД 12021726 .
- ^ Перес-Кастельяно Н., Вильякастин Х., Арагонсильо П., Фантидис П., Сабате М., Гарсия-Торрент М.Дж., Прието С., Коррал Х.М., Морено Х., Фернандес-Ортис А., Вано Э., Макайя С. (2006). «Патологические эффекты бета-излучения легочной вены на модели свиньи». Журнал сердечно-сосудистой электрофизиологии . 17 (6): 662–669. дои : 10.1111/j.1540-8167.2006.00462.x . ПМИД 16836719 . S2CID 22161263 .
- ^ Перейти обратно: а б Поддержка рака Macmillan. «Брахитерапия» . Архивировано из оригинала 3 октября 2009 года . Проверено 25 сентября 2009 г.
- ^ Перейти обратно: а б Филер (1997). «Побочные эффекты и качество жизни у пациентов, получающих высокодозную брахитерапию». Форум медицинских сестер онкологии . 24 (3): 545–553. ПМИД 9127366 .
- ^ Перейти обратно: а б с д Дуст, Миллер Э., Дюшен Г., Китченер М., Веллер Д. (2004). «Систематический обзор брахитерапии. Является ли это эффективным и безопасным методом лечения локализованного рака простаты?». Австралийский семейный врач . 33 (7): 525–529. ПМИД 15301172 .
- ^ Перейти обратно: а б с Магне Н., Манси Н.С., Шажон Э., Дювиллард П., Потье П., Кастань Д., Ломме К., Морис П., Хайе-Медер С (2009). «Схемы ухода и результаты лечения пожилых пациентов с раком шейки матки: особое внимание брахитерапии». Лучевая терапия и онкология . 91 (2): 197–201. дои : 10.1016/j.radonc.2008.08.011 . ПМИД 18954913 .
- ^ Казино AR и др. (2006). «Брахитерапия при раке губы». Медицина Орал . 11 : E223–9.
- ^ Перейти обратно: а б Мул Р.Н., Хоскин П.Дж. (2009). «Безоперационное лечение локализованного рака простаты». Хирургическая онкология . 18 (3): 255–267. дои : 10.1016/j.suronc.2009.03.006 . ПМИД 19442516 .
- ^ Вичини Ф., Бейч П.Д., Квайт К.А., Келехер А.Дж., Гарсия Д., Снайдер-младший ХК, Гиттлман М.А., Заннис В.Дж., Куерер Х.М., Лайден М. (2008). «Трехлетний анализ эффективности лечения, косметического эффекта и токсичности, проведенный Американским обществом грудных хирургов по исследованию брахитерапии груди MammoSite у пациентов, получавших ускоренное частичное облучение молочной железы (APBI)» . Рак . 112 (4): 758–766. дои : 10.1002/cncr.23227 . ПМИД 18181095 .
- ^ Кафедра онкологии человека, Школа медицины и общественного здравоохранения Университета Висконсина. «Брахитерапия груди» . Проверено 25 сентября 2009 г. [ мертвая ссылка ]
- ^ Перейти обратно: а б «Виды лечения: Брахитерапия» . Ответы RT . Американское общество радиационной онкологии . Проверено 24 июля 2017 г. [ мертвая ссылка ]
- ^ Зиап Х., Трипуранени П. (2007). «Сосудистая брахитерапия». В Девлине П. (ред.). Брахитерапия. Приложения и методы . Филадельфия: LWW.
- ^ Перейти обратно: а б с Томассен Б.Р. и др. (2005). Брахитерапия Физика . Издательство медицинской физики.
- ^ Перейти обратно: а б Кукуракис Г. и др. (2009). «Брахитерапия рака простаты: систематический обзор». Адв Урол . 26 (1): 63–8. дои : 10.1177/000456328902600109 . ПМИД 2735748 . S2CID 32151003 .
- ^ Нэт Р., Андерсон Л.Л., Лакстон Г., Уивер К.А., Уильямсон Дж.Ф., Мейгуни А.С. (1995). «Дозиметрия интерстициальных источников брахитерапии: Рекомендации рабочей группы № 43 Комитета по лучевой терапии AAPM». Медицинская физика . 22 (2): 209–234. Бибкод : 1995MedPh..22..209N . дои : 10.1118/1.597458 . ПМИД 7565352 .
- ^ Перейти обратно: а б Флинн А. и др. (2005). «Изотопы и системы доставки для брахитерапии». В Хоскин П., Койл С. (ред.). Лучевая терапия на практике: брахитерапия . Нью-Йорк: Издательство Оксфордского университета.
- ^ Трнкова П., Поттер Р., Балтас Д., Карабис А., Фидарова Е., Димопулос Дж., Георг Д., Кириситс К. (2009). «Новая технология обратного планирования для брахитерапии рака шейки матки под визуальным контролем: описание и оценка в клинических условиях» (PDF) . Лучевая терапия и онкология . 93 (2): 331–340. дои : 10.1016/j.radonc.2009.10.004 . ПМИД 19846230 . Архивировано из оригинала (PDF) 17 октября 2015 г. Проверено 11 марта 2010 г.
- ^ Фингар К.Р., Стокс С., Вайс А.Дж., Штайнер К.А. (декабрь 2014 г.). «Наиболее частые операционные процедуры, выполняемые в больницах США, 2003–2012 гг.» . Статистическая справка HCUP (186). Роквилл, Мэриленд: Агентство медицинских исследований и качества.
- ^ Алекс Рейндерс. Источники фотонов для броцитерапии. стр. 185–194 в журнале «Лучевая терапия и брахитерапия», ред. Ив Лемуан, Алессандра Канер. Наука НАТО ради мира и безопасности. Серия B: Физика и биофизика. Springer Science & Business Media, 2009 г. ISBN 9789048130955 стр. 191
- ^ Перейти обратно: а б Гупта ВК. (1995). «Брахитерапия – прошлое, настоящее и будущее» . Журнал медицинской физики . 20 (2): 31–38. дои : 10.4103/0971-6203.50045 .
- ^ Перейти обратно: а б с д и Наг С. «Краткая история брахитерапии» . Архивировано из оригинала 22 декабря 2017 года . Проверено 25 сентября 2009 г.
- ^ Курси Б.М. (2017). «150 лет со дня рождения Марии Кюри» . Прикладное излучение и изотопы . 130 . Национальный институт стандартов и технологий: 280–284. дои : 10.1016/j.apradiso.2017.10.028 . ПМИД 29079418 .
- ^ Бриджмен П. «Биографические мемуары Уильяма Дуэйна 1872–1935» (PDF) . www.nasonline.org . Национальная академия наук . Проверено 16 июня 2021 г.
- ^ Вебстер Э.В. (1993). «Истоки медицинской физики в США: Уильям Дуэйн, доктор философии, 1913–1920» (PDF) . Медицинская физика . 20 (6): 1607–1610. Бибкод : 1993MedPh..20.1607W . дои : 10.1118/1.597159 . ПМИД 8309432 . Архивировано из оригинала (PDF) 13 июня 2021 года . Проверено 16 июня 2021 г.
- ^ Брюсер М. (ноябрь 1993 г.). «Уильям Дуэйн и радиевая корова: американский вклад в наступающий атомный век» . Медицинская физика . 20 (6): 1601–1605. Бибкод : 1993MedPh..20.1601B . дои : 10.1118/1.596947 . ПМИД 8309431 . Проверено 15 июня 2021 г.
- ^ Гольдштейн Н. (1975). «Имплантаты семян радона. Остаточная радиоактивность через 33 года». Архив дерматологии . 111 (6): 757–759. doi : 10.1001/archderm.1975.01630180085013 . ПМИД 1137421 .
- ^ Уинстон П. (июнь 1958 г.). «Рак трахеи, лечение имплантацией семян радона». Журнал ларингологии и отологии . 72 (6): 496–499. дои : 10.1017/S0022215100054232 . ПМИД 13564019 . S2CID 36790323 .
- ^ Ассоциированные университеты Ок-Риджа. «Семена (ок. 1940-е – 1960-е годы)» . ОРАУ Музей радиации и радиоактивности . Проверено 12 октября 2021 г.
- ^ Ароновиц Дж. (2008). «Золотой век» брахитерапии простаты: поучительная история». Брахитерапия . 7 (1): 55–59. дои : 10.1016/j.brachy.2007.12.004 . ПМИД 18299114 .
- ^ « Радиоактивный» цилиндр найден под землей в парке на Подоли . iDNES.cz . 29 сентября 2011 года . Проверено 12 ноября 2012 г.
- ^ Мотл Л. «Почему небольшой цилиндр, закопанный в Праге, излучает 500 мкЗв/ч?» . Проверено 12 ноября 2012 г.
- ^ Фалви С. (29 сентября 2011 г.). «Благодаря наручным часам прохожий наткнулся на радиоактивную детскую площадку» . Радио Прага . Проверено 21 ноября 2012 г.





