Оксокарбений
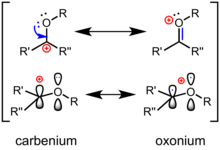
Ион оксокарбения ) представляет собой химическую разновидность , (или ион оксакарбения характеризующуюся центральным sp 2 -гибридизованный углерод, заместитель кислорода и общий положительный заряд, который делокализован между центральными атомами углерода и кислорода. [ 1 ] Ион оксокарбения представлен двумя предельными резонансными структурами: одна в виде карбениевого иона с положительным зарядом на углероде, а другая в виде оксониевой разновидности с формальным зарядом на кислороде. Будучи резонансным гибридом, истинная структура находится между ними. По сравнению с нейтральными карбонильными соединениями, такими как кетоны или сложные эфиры, ионная форма карбения вносит больший вклад в структуру. Они являются обычными реактивными промежуточными продуктами гидролиза гликозидных связей и широко используемой стратегией химического гликозилирования . С тех пор эти ионы были предложены в качестве реакционноспособных промежуточных продуктов в широком спектре химических превращений и использовались в полном синтезе нескольких природных продуктов. Кроме того, они часто участвуют в механизмах ферментативно-катализируемого биосинтеза и гидролиза углеводов в природе. Антоцианы – это природные флавилиевые красители, которые представляют собой стабилизированные соединения оксокарбения. Антоцианы отвечают за окраску широкого спектра распространенных цветов, таких как анютины глазки и съедобные растения, такие как баклажаны и черника .
Распределение электронов и реакционная способность
[ редактировать ]Лучшая структура Льюиса для иона оксокарбения содержит двойную связь кислород-углерод , при этом атом кислорода присоединен к дополнительной группе и, следовательно, принимает формальный положительный заряд. На языке канонических структур (или «резонанса») поляризация π-связи описывается вторичной карбокатионной резонансной формой с формальным положительным зарядом на углероде (см. выше). С точки зрения теории пограничных молекулярных орбиталей , самая нижняя незанятая молекулярная орбиталь (LUMO) иона оксокарбения представляет собой π*-орбиталь, имеющую большую долю на атоме углерода; чем более электроотрицательный кислород вносит меньший вклад в LUMO. Следовательно, в случае нуклеофильной атаки углерод является электрофильным центром . По сравнению с кетоном поляризация иона оксокарбения усилена: они больше напоминают «настоящий» карбокатион и более реакционноспособны по отношению к нуклеофилам. В органических реакциях кетоны обычно активируются путем координации кислоты Льюиса или кислоты Бренстеда. к кислороду с образованием иона оксокарбения в качестве промежуточного продукта.
Численно типичный частичный заряд (полученный на основе вычислений Хартри-Фока) для карбонильного углерода кетона R 2 C=O (например, ацетона) составляет δ+ = 0,51. При присоединении кислого водорода к атому кислорода с образованием [R 2 C=OH] + парциальный заряд увеличивается до δ+ = 0,61. Для сравнения, азотистые аналоги кетонов и ионов оксокарбения, иминов (R 2 C=NR) и иминиевых ионов ([R 2 C=NRH] + ), соответственно, имеют частичные заряды δ+ = 0,33 и δ+ = 0,54 соответственно. Таким образом, порядок частичного положительного заряда карбонильного углерода следующий: имин < кетон < иминий < оксокарбений.

Это также порядок электрофильности для веществ, содержащих связи C = X (X = O, NR). Этот порядок является синтетически значимым и объясняет, например, почему восстановительное аминирование часто лучше всего проводить при pH от 5 до 6 с использованием цианоборогидрида натрия (Na + [Н 3 В(CN)] − ) или триацетоксиборгидрид натрия (Na + [HB(OAc) 3 ] − ) в качестве реагента. Имея электроноакцепторную группу, цианоборгидрид натрия и триацетоксиборгидрид натрия являются более плохими восстановителями, чем боргидрид натрия, и их прямая реакция с кетонами обычно является медленным и неэффективным процессом. Однако ион иминия (но не сам имин), образующийся in situ во время реакции восстановительного аминирования, является более сильным электрофилом, чем исходный кетон, и будет реагировать с источником гидрида с синтетически полезной скоростью. Важно отметить, что реакция проводится в умеренно кислых условиях, которые в значительной степени протонируют промежуточный имин имин, образуя ион иминия, но при этом недостаточно сильно кислые, чтобы протонировать кетон, который мог бы образовать еще более электрофильный ион оксокарбения. Таким образом, условия реакции и реагент обеспечивают селективное образование амина в результате восстановления иминия, а не прямого восстановления карбонильной группы (или ее протонированной формы) с образованием спирта.
Формирование
[ редактировать ]Образование ионов оксокарбения может происходить по нескольким различным путям. Чаще всего кислород кетона связывается с кислотой Льюиса , которая активирует кетон, делая его более эффективным электрофилом. Кислота Льюиса может представлять собой широкий спектр молекул: от простого атома водорода до комплексов металлов. Оставшаяся часть этой статьи будет посвящена ионам алкилоксокарбения, однако в них атом, добавленный к кислороду, представляет собой углерод. Одним из способов образования такого рода ионов является удаление группы уходящей . В химии углеводов эта уходящая группа часто представляет собой простой или сложный эфир . Альтернативой элиминированию является прямое депротонирование молекулы с образованием иона, однако это может быть сложно и для достижения этого потребуются сильные основания.

Приложения к синтезу
[ редактировать ]5-членные кольца
[ редактировать ]
Стереохимию , участвующую в реакциях пятичленных колец, можно предсказать с помощью модели переходного состояния оболочки. Нуклеофилы предпочитают присоединение «изнутри» оболочки или сверху рисунка справа. «Внутреннее» добавление дает результат в шахматном порядке , а не в затменную конформацию , возникающую в результате «внешнего» добавления. [ 2 ]

6-членные кольца
[ редактировать ]
Модель переходного состояния шестичленного оксокарбениевого кольца была предложена ранее в 1992 году Вудсом и др. [ 3 ] Общая стратегия определения стереохимии нуклеофильного присоединения к шестичленному кольцу аналогична процедуре, что и в случае пятичленного кольца. При этом анализе делается предположение, что кольцо находится в той же конформации, что и циклогексен , с тремя атомами углерода и кислородом в плоскости, а два других атома углерода вытянуты из плоскости, один вверху, другой внизу (см. рисунок справа). На основании заместителей, присутствующих в кольце, определяется конформация с наименьшей энергией с учетом стерических и стереоэлектронных эффектов (см. раздел ниже, где обсуждаются стереоэлектронные эффекты в оксокарбениевых кольцах). Как только эта конформация установлена, можно рассматривать нуклеофильное присоединение. Присоединение будет происходить через переходное состояние кресла с низкой энергией, а не через относительно высокоэнергетическую твист-лодку. Пример такого типа реакции можно увидеть ниже. В этом примере также показано, как стереоэлектронный эффект, оказываемый электроотрицательным заместителем, переворачивает конформацию с самой низкой энергией и приводит к противоположной селективности. [ 4 ]

Стереоэлектронные эффекты
[ редактировать ]В алкеновом кольце, не содержащем атома кислорода, любой крупный заместитель предпочитает находиться в экваториальном положении, чтобы минимизировать стерические эффекты . В кольцах, содержащих ионы оксокарбения, было обнаружено, что электроотрицательные заместители предпочитают аксиальные или псевдоаксиальные положения. Когда электроотрицательный атом находится в аксиальном положении, его электронная плотность может передаваться через пространство положительно заряженному атому кислорода в кольце. [ 5 ] Это электронное взаимодействие стабилизирует аксиальную конформацию. Гидроксильные группы, простые эфиры и галогены являются примерами заместителей, демонстрирующих это явление. Стереоэлектронные эффекты необходимо учитывать при определении конформации с наименьшей энергией при анализе нуклеофильного присоединения к иону оксокарбения. [ 4 ] [ 6 ]

Циклодополнения
[ редактировать ]В органическом синтезе ионы винилоксокарбения (структура справа) могут использоваться в широком спектре реакций циклоприсоединения . Их обычно используют в качестве диенофилов в реакции Дильса-Альдера . К диенофилу часто добавляют электроноакцепторный кетон для увеличения скорости реакции. [ 7 ] и эти кетоны часто превращаются в ионы винилоксокарбения во время реакции. [ 8 ] Неясно, обязательно ли образуется ион оксокарбения, но Рауш и его коллеги продемонстрировали промежуточное соединение оксокарбения в циклизации, показанной ниже. В этой реакции наблюдались два продукта, которые могли образоваться только в том случае, если оксокарбениевое кольцо присутствует в качестве промежуточного продукта. [ 9 ] Сообщалось также о [4+3], [2+2], [3+2] и [5+2] циклоприсоединения с оксокарбениевыми интермедиатами. [ 8 ]

Альдольная реакция
[ редактировать ]Хиральные ионы оксокарбения использовались для получения высокодиастереоселективного и энантиоселективного ацетатного альдола. реакции присоединения. [ 10 ] Ион оксокарбения используется в качестве электрофила в реакции. Когда метильная группа увеличивается в размерах, диастереоселективность увеличивается.

Примеры из полного синтеза
[ редактировать ]Ионы оксокарбения неоднократно использовались в полном синтезе. Синтезирована основная субъединица (+)-клавозолида с восстановлением шестичленного оксокарбениевого кольца. Все крупные заместители находились в экваториальном положении, и превращение, как и предполагалось, проходило через переходное состояние кресла. [ 11 ]

Второй пример можно увидеть на ключевой стадии синтеза (-)-неопельтолида, в которой используется восстановление шестичленного оксокарбениевого кольца для диастереоселективного присоединения гидрида. [ 12 ]

Приложения к биологии
[ редактировать ]В биологических системах ионы оксокарбения чаще всего наблюдаются в реакциях углеводов . Поскольку сахара присутствуют в структуре нуклеиновых кислот , рибоза сахар присутствует в РНК , а дезоксирибоза присутствует в структуре ДНК , их химический состав играет важную роль в широком спектре клеточных функций нуклеиновых кислот. Помимо своих функций в нуклеотидах, сахара также используются для структурных компонентов организмов, в качестве молекул хранения энергии, сигнальных молекул клеток, модификации белков и играют ключевую роль в иммунной системе , оплодотворении , предотвращении патогенеза , свертывании крови и развитии . [ 13 ] Обилие химического состава сахаров в биологических процессах приводит к тому, что многие механизмы реакций протекают через ионы оксокарбения. В этом разделе описаны несколько важных биологических реакций, в которых используются ионы оксокарбения.
Биосинтез нуклеотидов
[ редактировать ]Нуклеотиды могут подвергаться внутримолекулярной циклизации, катализируемой ферментами, с образованием нескольких важных биологических молекул. Эти циклизации обычно протекают через промежуточное соединение оксокарбения. Пример этой реакции можно увидеть в циклизации АДФ-рибозы , которая является важной молекулой для внутриклеточной передачи сигналов кальция . [ 14 ]
Гликозидазы
[ редактировать ]Гликозидаза — это фермент , который катализирует разрыв гликозидной связи с образованием двух меньших сахаров. Этот процесс имеет важное значение для использования запасенной энергии, такой как гликоген , у животных, а также для расщепления целлюлозы организмами, питающимися растениями. Обычно остатки аспарагиновой или глутаминовой кислоты в активном центре фермента катализируют гидролиз гликозидной связи. Механизм действия этих ферментов включает промежуточный ион оксокарбения, общий пример которого показан ниже. [ 15 ]

См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ ИЮПАК , Сборник химической терминологии , 2-е изд. («Золотая книга») (1997). Исправленная онлайн-версия: (2006–) « Ион карбения ». doi : 10.1351/goldbook.C00812
- ^ Ларсен, Швейцария; Риджуэй, Британская Колумбия; Шоу, Джей Ти; Верпель, К.А. (1999), «Стереоэлектронная модель для объяснения высокостереоселективных реакций нуклеофилов с пятичленными ионами оксокарбения», Журнал Американского химического общества , 121 (51): 12208–12209, doi : 10.1021/ja993349z
- ^ Вудс, Р.Дж.; Эндрюс, CW; Боуэн, Дж.П. (1992), «Молекулярно-механические исследования свойств ионов оксокарбения. 2. Применение к гидролизу гликозидов», Журнал Американского химического общества , 114 (3): 859–864, doi : 10.1021/ja00029a008.
- ^ Перейти обратно: а б Ромеро, JAC; Табакко, ЮАР; Верпель, К.А. (1999), «Стереохимическое обращение реакций нуклеофильного замещения в зависимости от заместителя: реакции ионов оксокарбения с шестичленным кольцом, замещенных гетероатомом, через псевдоаксиальные конформеры», Журнал Американского химического общества , 122 : 168–169, doi : 10.1021/ja993366o
- ^ Милькович, М. И.; Йигли, Д.; Делонгшам, П.; Дори, Ю.Л. (1997), «Экспериментальные и теоретические доказательства пространственной электростатической стабилизации зарождающегося иона оксокарбения аксиально-ориентированным электроотрицательным заместителем во время ацетолиза гликопиранозида», Журнал органической химии , 62 (22): 7597–7604, doi : 10.1021/jo970677d
- ^ Хансен, Томас; Лебедель, Людивин; Реммерсваль, Воутер А.; ван дер Ворм, Стефан; Вандер, Деннис, Пенсильвания; Сомерс, Марк; Оверклефт, Герман С.; Филиппов Дмитрий В.; Дезире, Жером; Мингот, Агнес; Блерио, Ив (18 апреля 2019 г.). «Определение SN1-стороны реакций гликозилирования: стереоселективность гликопиранозильных катионов» . Центральная научная служба ACS . 5 (5): 781–788. дои : 10.1021/accentsci.9b00042 . ISSN 2374-7943 . ПМЦ 6535769 .
- ^ Воллхардт; Шор (2009). Органическая химия . Нью-Йорк, штат Нью-Йорк: WH Freeman and Co.
- ^ Перейти обратно: а б Хармата, М.; Рашатасахон, П. (2003), «Реакции циклоприсоединения винилоксокарбениевых ионов», Tetrahedron , 59 (14): 2371–2395, doi : 10.1016/s0040-4020(03)00253-9
- ^ Руш, М.; Гиллис, П.; Эссенфельд, А. (1984), «Внутримолекулярные реакции Дильса-Альдера, катализируемые плавиковой кислотой», Journal of Organic Chemistry , 49 (24): 4674–4682, doi : 10.1021/jo00198a018
- ^ Канвар, С.; Трехан, С. (2005), «Ацетат-альдольные реакции хиральных ионов оксокарбения», Tetrahedron Letters , 46 (8): 1329–1332, doi : 10.1016/j.tetlet.2004.12.116
- ^ Каррик, доктор юридических наук; Дженнингс, член парламента (2009), «Эффективный формальный синтез (-)-клавосолида а с «несогласованным» стереоселективным восстановлением оксокарбения», Organic Letters , 11 (3): 769–772, doi : 10.1021/ol8028302
- ^ Мартинес-Солорио, Д.; Дженнингс, член парламента (2010), «Формальный синтез (-)-неопелтолида с высокостереоселективной последовательностью образования/восстановления оксокарбения», Журнал органической химии , 75 (12): 4095–4104, doi : 10.1021/jo100443h
- ^ Матон, Антея; Джин Хопкинс; Чарльз Уильям Маклафлин; Сьюзан Джонсон; Марианна Куон Уорнер; Дэвид ЛаХарт; Джилл Д. Райт (1993). Биология человека и здоровье . Энглвуд Клиффс, Нью-Джерси, США: Прентис Холл. стр. 52–59 . ISBN 0-13-981176-1 .
- ^ Мюллер-Штеффнер, HM; Огюстен, А.; Шубер, Ф. (1996), «Механизм циклизации пиридиновых нуклеотидов с помощью НАД+ гликогидролазы бычьей селезенки», Journal of Biological Chemistry , 271 (39): 23967–23972, doi : 10.1074/jbc.271.39.23967 , PMID 8798630
- ^ Зехель, Д.Л.; Уизерс, С.Г. (2000). «Механизмы гликозидазы: анатомия точно настроенного катализатора». Отчеты о химических исследованиях . 33 (1): 11–18. дои : 10.1021/ar970172 . ISSN 0001-4842 . ПМИД 10639071 .