Волчанка
В этой статье есть несколько проблем. Пожалуйста, помогите улучшить его или обсудите эти проблемы на странице обсуждения . ( Узнайте, как и когда удалять эти шаблонные сообщения )
|
| Волчанка | |
|---|---|
| Другие имена | Системная красная волчанка (СКВ) |
 | |
| Young woman with the distinctive butterfly rash that many individuals with lupus experience | |
| Pronunciation | |
| Specialty | Rheumatology |
| Symptoms | Painful and swollen joints, fever, chest pain, hair loss, mouth ulcers, swollen lymph nodes, feeling tired, red rash[1] |
| Usual onset | 15–45 years of age[1][2] |
| Duration | Long term[1] |
| Causes | Unclear[1] |
| Diagnostic method | Based on symptoms and blood tests[1] |
| Medication | NSAIDs, corticosteroids, immunosuppressants, hydroxychloroquine, methotrexate[1] |
| Prognosis | 15 year survival ~80%[3] |
| Frequency | 2–7 per 10,000[2] |
Волчанка , технически известная как системная красная волчанка ( СКВ ), представляет собой аутоиммунное заболевание организма , при котором иммунная система ошибочно атакует здоровые ткани во многих частях тела. [1] Симптомы у разных людей различаются и могут быть от легких до тяжелых. [1] Общие симптомы включают болезненные и опухшие суставы , лихорадку , боль в груди , выпадение волос , язвы во рту , увеличение лимфатических узлов , чувство усталости и красную сыпь , которая чаще всего возникает на лице. [1] Часто бывают периоды заболевания, называемые обострениями , и периоды ремиссии , во время которых симптомов мало. [1]
The cause of SLE is not clear.[1] It is thought to involve a combination of genetics and environmental factors.[4] Among identical twins, if one is affected there is a 24% chance the other one will also develop the disease.[1] Female sex hormones, sunlight, smoking, vitamin D deficiency, and certain infections are also believed to increase a person's risk.[4] The mechanism involves an immune response by autoantibodies against a person's own tissues.[1] These are most commonly anti-nuclear antibodies and they result in inflammation.[1] Diagnosis can be difficult and is based on a combination of symptoms and laboratory tests.[1] There are a number of other kinds of lupus erythematosus including discoid lupus erythematosus, neonatal lupus, and subacute cutaneous lupus erythematosus.[1]
There is no cure for SLE,[1] but there are experimental and symptomatic treatments.[5] Treatments may include NSAIDs, corticosteroids, immunosuppressants, hydroxychloroquine, and methotrexate.[1] Although corticosteroids are rapidly effective, long-term use results in side effects.[6] Alternative medicine has not been shown to affect the disease.[1] Men have higher mortality.[7] SLE significantly increases the risk of cardiovascular disease, with this being the most common cause of death.[4] While women with lupus have higher risk pregnancies, most are successful.[1]
Rate of SLE varies between countries from 20 to 70 per 100,000.[2] Women of childbearing age are affected about nine times more often than men.[4] While it most commonly begins between the ages of 15 and 45, a wide range of ages can be affected.[1][2] Those of African, Caribbean, and Chinese descent are at higher risk than those of European descent.[4][2] Rates of disease in the developing world are unclear.[8] Lupus is Latin for 'wolf': the disease was so-named in the 13th century as the rash was thought to appear like a wolf's bite.[9]
Signs and symptoms

SLE is one of several diseases known as "the great imitator" because it often mimics or is mistaken for other illnesses.[11] SLE is a classical item in differential diagnosis,[12] because SLE symptoms vary widely and come and go unpredictably. Diagnosis can thus be elusive, with some people having unexplained symptoms of SLE for years before a definitive diagnosis is reached.[13]
Common initial and chronic complaints include fever, malaise, joint pains, muscle pains, and fatigue. Because these symptoms are so often seen in association with other diseases, these signs and symptoms are not part of the diagnostic criteria for SLE. When occurring in conjunction with other signs and symptoms, however, they are considered suggestive.[14]
While SLE can occur in both males and females, it is found far more often in women, and the symptoms associated with each sex are different.[7] Females tend to have a greater number of relapses, a low white blood cell count, more arthritis, Raynaud syndrome, and psychiatric symptoms. Males tend to have more seizures, kidney disease, serositis (inflammation of tissues lining the lungs and heart), skin problems, and peripheral neuropathy.[15]
Skin


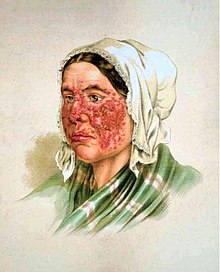
As many as 70% of people with lupus have some skin symptoms. The three main categories of lesions are chronic cutaneous (discoid) lupus, subacute cutaneous lupus, and acute cutaneous lupus. People with discoid lupus may exhibit thick, red scaly patches on the skin. Similarly, subacute cutaneous lupus manifests as red, scaly patches of skin but with distinct edges. Acute cutaneous lupus manifests as a rash. Some have the classic malar rash (commonly known as the butterfly rash) associated with the disease.[16] This rash occurs in 30–60% of people with SLE.[17]
Hair loss, mouth and nasal ulcers, and lesions on the skin are other possible manifestations.[18]
Muscles and bones
The most commonly sought medical attention is for joint pain, with the small joints of the hand and wrist usually affected, although all joints are at risk. More than 90 percent of those affected will experience joint or muscle pain at some time during the course of their illness.[19] Unlike rheumatoid arthritis, lupus arthritis is less disabling and usually does not cause severe destruction of the joints. Fewer than ten percent of people with lupus arthritis will develop deformities of the hands and feet.[19] People with SLE are at particular risk of developing osteoarticular tuberculosis.[20]
A possible association between rheumatoid arthritis and SLE has been suggested,[21] and SLE may be associated with an increased risk of bone fractures in relatively young women.[22]
Blood
Anemia is common in children with SLE[23] and develops in about 50% of cases.[24] Low platelet count (thrombocytopenia) and low white blood cell count (leukopenia) may be due to the disease or a side effect of pharmacological treatment. People with SLE may have an association with antiphospholipid antibody syndrome[25] (a thrombotic disorder), wherein autoantibodies to phospholipids are present in their serum. Abnormalities associated with antiphospholipid antibody syndrome include a paradoxical prolonged partial thromboplastin time (which usually occurs in hemorrhagic disorders) and a positive test for antiphospholipid antibodies; the combination of such findings have earned the term "lupus anticoagulant-positive". Another autoantibody finding in SLE is the anti-cardiolipin antibody, which can cause a false positive test for syphilis.[citation needed]
Heart
SLE may cause pericarditis (inflammation of the outer lining surrounding the heart), myocarditis (inflammation of the heart muscle), or endocarditis (inflammation of the inner lining of the heart). The endocarditis of SLE is non-infectious, and is also called Libman–Sacks endocarditis. It involves either the mitral valve or the tricuspid valve. Atherosclerosis also occurs more often and advances more rapidly than in the general population.[26][27]
Steroids are sometimes prescribed as an anti-inflammatory treatment for lupus; however, they can increase one's risk for heart disease, high cholesterol, and atherosclerosis.[28]
Lungs
SLE can cause pleuritic pain as well as inflammation of the pleurae known as pleurisy, which can rarely give rise to shrinking lung syndrome involving a reduced lung volume.[29][30] Other associated lung conditions include pneumonitis, chronic diffuse interstitial lung disease, pulmonary hypertension, pulmonary emboli, and pulmonary hemorrhage.[citation needed]
Kidneys
Painless passage of blood or protein in the urine may often be the only presenting sign of kidney involvement. Acute or chronic renal impairment may develop with lupus nephritis, leading to acute or end-stage kidney failure. Because of early recognition and management of SLE with immunosuppressive drugs or corticosteroids,[31] end-stage renal failure occurs in less than 5%[32][33] of cases; except in the black population, where the risk is many times higher.
The histological hallmark of SLE is membranous glomerulonephritis with "wire loop" abnormalities.[34] This finding is due to immune complex deposition along the glomerular basement membrane, leading to a typical granular appearance in immunofluorescence testing.
Neuropsychiatric
Neuropsychiatric syndromes can result when SLE affects the central or peripheral nervous system. The American College of Rheumatology defines 19 neuropsychiatric syndromes in systemic lupus erythematosus.[35] The diagnosis of neuropsychiatric syndromes concurrent with SLE (now termed as NPSLE),[36] is one of the most difficult challenges in medicine, because it can involve so many different patterns of symptoms, some of which may be mistaken for signs of infectious disease or stroke.[37]
A common neurological disorder people with SLE have is headache,[38] although the existence of a specific lupus headache and the optimal approach to headache in SLE cases remains controversial.[39]Other common neuropsychiatric manifestations of SLE include cognitive disorder, mood disorder, cerebrovascular disease,[38] seizures, polyneuropathy,[38] anxiety disorder, psychosis, depression, and in some extreme cases, personality disorders.[40] Steroid psychosis can also occur as a result of treating the disease.[36] It can rarely present with intracranial hypertension syndrome, characterized by an elevated intracranial pressure, papilledema, and headache with occasional abducens nerve paresis, absence of a space-occupying lesion or ventricular enlargement, and normal cerebrospinal fluid chemical and hematological constituents.[41]
More rare manifestations are acute confusional state, Guillain–Barré syndrome, aseptic meningitis, autonomic disorder, demyelinating syndrome, mononeuropathy (which might manifest as mononeuritis multiplex), movement disorder (more specifically, chorea), myasthenia gravis, myelopathy, cranial neuropathy and plexopathy.[citation needed]
Neurological disorders contribute to a significant percentage of morbidity and mortality in people with lupus.[42] As a result, the neural side of lupus is being studied in hopes of reducing morbidity and mortality rates.[35] One aspect of this disease is severe damage to the epithelial cells of the blood–brain barrier. In certain regions, depression affects up to 60% of women with SLE.[43]
Eyes
Up to one-third of patients report that their eyes are affected. The most common diseases are dry eye syndrome and secondary Sjögren's syndrome, but episcleritis, scleritis, retinopathy (more often affecting both eyes than one), ischemic optic neuropathy, retinal detachment, and secondary angle-closure glaucoma may occur. In addition, the medications used to treat SLE can cause eye disease: long-term glucocorticoid use can cause cataracts and secondary open-angle glaucoma, and long-term hydroxychloroquine treatment can cause vortex keratopathy and maculopathy.[44]
Reproductive
While most pregnancies have positive outcomes, there is a greater risk of adverse events occurring during pregnancy.[45] SLE causes an increased rate of fetal death in utero and spontaneous abortion (miscarriage). The overall live-birth rate in people with SLE has been estimated to be 72%.[46] Pregnancy outcome appears to be worse in people with SLE whose disease flares up during pregnancy.[47]
Neonatal lupus is the occurrence of SLE symptoms in an infant born from a mother with SLE, most commonly presenting with a rash resembling discoid lupus erythematosus, and sometimes with systemic abnormalities such as heart block or enlargement of the liver and spleen.[48] Neonatal lupus is usually benign and self-limited.[48]
Medications for treatment of SLE can carry severe risks for female and male reproduction. Cyclophosphamide (also known as Cytoxan), can lead to infertility by causing premature ovarian insufficiency (POI), the loss of normal function of one's ovaries prior to age forty.[49] Methotrexate can cause termination or deformity in fetuses and is a common abortifacient, and for men taking a high dose and planning to father, a discontinuation period of 6 months is recommended before insemination.[50]
Systemic
Fatigue in SLE is probably multifactorial and has been related to not only disease activity or complications such as anemia or hypothyroidism, but also to pain, depression, poor sleep quality, poor physical fitness and lack of social support.[51][52]
Causes
SLE is presumably caused by a genetic susceptibility coupled with an environmental trigger that results in defects in the immune system. One of the factors associated with SLE is vitamin D deficiency.[53]
Genetics
SLE does run in families, but no single causal gene has been identified. Instead, multiple genes appear to influence a person's chance of developing lupus when triggered by environmental factors. HLA class I, class II, and class III genes are associated with SLE, but only classes I and II contribute independently to increased risk of SLE.[54] Other genes that contain risk variants for SLE are IRF5, PTPN22, STAT4,[55] CDKN1A,[56] ITGAM, BLK,[55] OX40L and BANK1.[57]
Some of the susceptibility genes may be population specific.[55] Genetic studies of the rates of disease in families supports the genetic basis of this disease with a heritability of >66%.[58] Identical (monozygotic) twins were found to share susceptibility to the disease at >35% rate compared to fraternal (dizygotic) twins and other full siblings who only showed a 2–5% concordance in shared inheritance.[58]
Since SLE is associated with many genetic regions, it is likely an oligogenic trait, meaning that there are several genes that control susceptibility to the disease.[59]
SLE is regarded as a prototype disease due to the significant overlap in its symptoms with other autoimmune diseases.[60]
Drug reactions
Drug-induced lupus erythematosus is a (generally) reversible condition that usually occurs in people being treated for a long-term illness. Drug-induced lupus mimics SLE. However, symptoms of drug-induced lupus generally disappear once the medication that triggered the episode is stopped. More than 38 medications can cause this condition, the most common of which are procainamide, isoniazid, hydralazine, quinidine, and phenytoin.[61][12]
Non-systemic forms of lupus
Discoid (cutaneous) lupus is limited to skin symptoms and is diagnosed by biopsy of rash on the face, neck, scalp or arms. Approximately 5% of people with DLE progress to SLE.[62]
Pathophysiology
SLE is triggered by environmental factors that are unknown. In SLE, the body's immune system produces antibodies against self-protein, particularly against proteins in the cell nucleus. These antibody attacks are the immediate cause of SLE.[12][63][64]
SLE is a chronic inflammatory disease believed to be a type III hypersensitivity response with potential type II involvement.[65] Reticulate and stellate acral pigmentation should be considered a possible manifestation of SLE and high titers of anti-cardiolipin antibodies, or a consequence of therapy.[66]
People with SLE have intense polyclonal B-cell activation, with a population shift towards immature B cells. Memory B cells with increased CD27+/IgD—are less susceptible to immunosuppression. CD27-/IgD- memory B cells are associated with increased disease activity and renal lupus. T cells, which regulate B-cell responses and infiltrate target tissues, have defects in signaling, adhesion, co-stimulation, gene transcription, and alternative splicing. The cytokines B-lymphocyte stimulator (BLyS), also known as B-cell activating factor (BAFF), interleukin 6, interleukin 17, interleukin 18, type I interferons, and tumor necrosis factor α (TNFα) are involved in the inflammatory process and are potential therapeutic targets.[4][67][68]
SLE is associated with low C3 levels in the complement system.[69]
Cell death signaling
- Apoptosis is increased in monocytes and keratinocytes
- Expression of Fas by B cells and T cells is increased
- There are correlations between the apoptotic rates of lymphocytes and disease activity.
- Necrosis is increased in T lymphocytes.
Tingible body macrophages (TBMs) – large phagocytic cells in the germinal centers of secondary lymph nodes – express CD68 protein. These cells normally engulf B cells that have undergone apoptosis after somatic hypermutation. In some people with SLE, significantly fewer TBMs can be found, and these cells rarely contain material from apoptotic B cells. Also, uningested apoptotic nuclei can be found outside of TBMs. This material may present a threat to the tolerization of B cells and T cells. Dendritic cells in the germinal center may endocytose such antigenic material and present it to T cells, activating them. Also, apoptotic chromatin and nuclei may attach to the surfaces of follicular dendritic cells and make this material available for activating other B cells that may have randomly acquired self-protein specificity through somatic hypermutation.[70] Necrosis, a pro-inflammatory form of cell death, is increased in T lymphocytes, due to mitochondrial dysfunction, oxidative stress, and depletion of ATP.[71]
Clearance deficiency

Impaired clearance of dying cells is a potential pathway for the development of this systemic autoimmune disease. This includes deficient phagocytic activity, impaired lysosomal degradation, and scant serum components in addition to increased apoptosis.[citation needed]
SLE is associated with defects in apoptotic clearance, and the damaging effects caused by apoptotic debris. Early apoptotic cells express "eat-me" signals, of cell-surface proteins such as phosphatidylserine, that prompt immune cells to engulf them. Apoptotic cells also express find-me signals to attract macrophages and dendritic cells. When apoptotic material is not removed correctly by phagocytes, they are captured instead by antigen-presenting cells, which leads to the development of antinuclear antibodies.[4]
Monocytes isolated from whole blood of people with SLE show reduced expression of CD44 surface molecules involved in the uptake of apoptotic cells. Most of the monocytes and tingible body macrophages (TBMs), which are found in the germinal centres of lymph nodes, even show a definitely different morphology; they are smaller or scarce and die earlier. Serum components like complement factors, CRP, and some glycoproteins are, furthermore, decisively important for an efficiently operating phagocytosis. With SLE, these components are often missing, diminished, or inefficient.[citation needed]
Macrophages during SLE fail to mature their lysosomes and as a result have impaired degradation of internalized apoptotic debris, which results in chronic activation of Toll-like receptors and permeabilization of the phagolysosomal membrane, allowing activation of cytosolic sensors. In addition, intact apoptotic debris recycles back to the cell membrane and accumulate on the surface of the cell.[72][73]
Recent research has found an association between certain people with lupus (especially those with lupus nephritis) and an impairment in degrading neutrophil extracellular traps (NETs). These were due to DNAse1 inhibiting factors, or NET protecting factors in people's serum, rather than abnormalities in the DNAse1 itself.[74] DNAse1 mutations in lupus have so far only been found in some Japanese cohorts.[75]
The clearance of early apoptotic cells is an important function in multicellular organisms. It leads to a progression of the apoptosis process and finally to secondary necrosis of the cells if this ability is disturbed. Necrotic cells release nuclear fragments as potential autoantigens, as well as internal danger signals, inducing maturation of dendritic cells (DCs) since they have lost their membranes' integrity. Increased appearance of apoptotic cells also stimulates inefficient clearance. That leads to the maturation of DCs and also to the presentation of intracellular antigens of late apoptotic or secondary necrotic cells, via MHC molecules.[76]
Autoimmunity possibly results from the extended exposure to nuclear and intracellular autoantigens derived from late apoptotic and secondary necrotic cells. B and T cell tolerance for apoptotic cells is abrogated, and the lymphocytes get activated by these autoantigens; inflammation and the production of autoantibodies by plasma cells is initiated. A clearance deficiency in the skin for apoptotic cells has also been observed in people with cutaneous lupus erythematosus (CLE).[76]
Germinal centers

In healthy conditions, apoptotic lymphocytes are removed in germinal centers (GC) by specialized phagocytes, the tingible body macrophages (TBM), which is why no free apoptotic and potential autoantigenic material can be seen. In some people with SLE, a buildup of apoptotic debris can be observed in GC because of an ineffective clearance of apoptotic cells. Close to TBM, follicular dendritic cells (FDC) are localised in GC, which attach antigen material to their surface and, in contrast to bone marrow-derived DC, neither take it up nor present it via MHC molecules.
Autoreactive B cells can accidentally emerge during somatic hypermutation and migrate into the germinal center light zone. Autoreactive B cells, maturated coincidentally, normally do not receive survival signals by antigen planted on follicular dendritic cells and perish by apoptosis. In the case of clearance deficiency, apoptotic nuclear debris accumulates in the light zone of GC and gets attached to FDC.
This serves as a germinal centre survival signal for autoreactive B-cells. After migration into the mantle zone, autoreactive B cells require further survival signals from autoreactive helper T cells, which promote the maturation of autoantibody-producing plasma cells and B memory cells. In the presence of autoreactive T cells, a chronic autoimmune disease may be the consequence.
Anti-nRNP autoimmunity
Anti-nRNP autoantibodies to nRNP A and nRNP C initially targeted restricted, proline-rich motifs. Antibody binding subsequently spread to other epitopes. The similarity and cross-reactivity between the initial targets of nRNP and Sm autoantibodies identifies a likely commonality in cause and a focal point for intermolecular epitope spreading.[77]
Others
Elevated expression of HMGB1 was found in the sera of people and mice with systemic lupus erythematosus, high mobility group box 1 (HMGB1) is a nuclear protein participating in chromatin architecture and transcriptional regulation. Recently, there is increasing evidence HMGB1 contributes to the pathogenesis of chronic inflammatory and autoimmune diseases due to its inflammatory and immune stimulating properties.[78]
Diagnosis


Laboratory tests
Antinuclear antibody (ANA) testing and anti-extractable nuclear antigen (anti-ENA) form the mainstay of serologic testing for SLE. ANA testing for lupus is highly sensitive, with the vast majority of individuals with Lupus testing positive; but the test is not specific, as a positive result may or may not be indicative of Lupus.[79]
Several techniques are used to detect ANAs. The most widely used is indirect immunofluorescence (IF). The pattern of fluorescence suggests the type of antibody present in the people's serum. Direct immunofluorescence can detect deposits of immunoglobulins and complement proteins in people's skin. When skin not exposed to the sun is tested, a positive direct IF (the so-called lupus band test) is evidence of systemic lupus erythematosus.[80]
ANA screening yields positive results in many connective tissue disorders and other autoimmune diseases, and may occur in normal individuals. Subtypes of antinuclear antibodies include anti-Smith and anti-double stranded DNA (anti-dsDNA) antibodies (which are linked to SLE) and anti-histone antibodies (which are linked to drug-induced lupus). Anti-dsDNA antibodies are highly specific for SLE; they are present in 70% of cases, whereas they appear in only 0.5% of people without SLE.[12]
Laboratory tests can also help distinguish between closely related connective tissue diseases. A multianalyte panel (MAP) of autoantibodies, including ANA, anti-dsDNA, and anti-Smith in combination with the measurement of cell-bound complement activation products (CB-CAPs) with an integrated algorithm has demonstrated 80% diagnostic sensitivity and 86% specificity in differentiating diagnosed SLE from other autoimmune connective tissue diseases.[81] The MAP approach has been further studied in over 40,000 patients tested with either the MAP or traditional ANA testing strategy (tANA), demonstrating patients who test MAP positive are at up to 6-fold increased odds of receiving a new SLE diagnosis and up to 3-fold increased odds of starting a new SLE medication regimen as compared to patients testing positive with the tANA approach.[82]
The anti-dsDNA antibody titers also tend to reflect disease activity, although not in all cases.[12] Other ANA that may occur in people with SLE are anti-U1 RNP (which also appears in systemic sclerosis and mixed connective tissue disease), SS-A (or anti-Ro) and SS-B (or anti-La; both of which are more common in Sjögren's syndrome). SS-A and SS-B confer a specific risk for heart conduction block in neonatal lupus.[83]
Other tests routinely performed in suspected SLE are complement system levels (low levels suggest consumption by the immune system), electrolytes and kidney function (disturbed if the kidney is involved), liver enzymes, and complete blood count.[citation needed]
The lupus erythematosus (LE) cell test was commonly used for diagnosis, but it is no longer used because the LE cells are only found in 50–75% of SLE cases and they are also found in some people with rheumatoid arthritis, scleroderma, and drug sensitivities. Because of this, the LE cell test is now performed only rarely and is mostly of historical significance.[84]
Diagnostic criteria
Some physicians make a diagnosis based on the American College of Rheumatology (ACR) classification criteria. However, these criteria were primarily established for use in scientific research, including selection for randomized controlled trials, which require higher confidence levels. As a result, many people with SLE may not meet the full ACR criteria.[citation needed]
Criteria
The American College of Rheumatology (ACR) established eleven criteria in 1982,[85] which were revised in 1997[86] as a classificatory instrument to operationalise the definition of SLE in clinical trials. They were not intended to be used to diagnose individuals and do not do well in that capacity. For the purpose of identifying people for clinical studies, a person has SLE if any 4 out of 11 symptoms are present simultaneously or serially on two separate occasions.
- Malar rash (rash on cheeks); sensitivity = 57%; specificity = 96%.[87]
- Discoid rash (red, scaly patches on skin that cause scarring); sensitivity = 18%; specificity = 99%.[87]
- Serositis: Pleurisy (inflammation of the membrane around the lungs) or pericarditis (inflammation of the membrane around the heart); sensitivity = 56%; specificity = 86% (pleural is more sensitive; cardiac is more specific).[87]
- Oral ulcers (includes oral or nasopharyngeal ulcers); sensitivity = 27%; specificity = 96%.[87]
- Arthritis: nonerosive arthritis of two or more peripheral joints, with tenderness, swelling, or effusion; sensitivity = 86%; specificity = 37%.[87]
- Photosensitivity (exposure to ultraviolet light causes rash, or other symptoms of SLE flareups); sensitivity = 43%; specificity = 96%.[87]
- Blood—hematologic disorder—hemolytic anemia (low red blood cell count), leukopenia (white blood cell count<4000/μL), lymphopenia (<1500/μL), or low platelet count (<100000/μL) in the absence of offending drug; sensitivity = 59%; specificity = 89%.[87] Hypocomplementemia is also seen, due to either consumption of C3[88] and C4 by immune complex-induced inflammation or to congenitally complement deficiency, which may predispose to SLE.
- Renal disorder: More than 0.5 g per day protein in urine or cellular casts seen in urine under a microscope; sensitivity = 51%; specificity = 94%.[87]
- Antinuclear antibody test positive; sensitivity = 99%; specificity = 49%.[87]
- Immunologic disorder: Positive anti-Smith, anti-ds DNA, antiphospholipid antibody, or false positive serological test for syphilis; sensitivity = 85%; specificity = 93%.[87] Presence of anti-ss DNA in 70% of cases (though also positive with rheumatic disease and healthy persons).[89]
- Neurologic disorder: Seizures or psychosis; sensitivity = 20%; specificity = 98%.[87]
Other than the ACR criteria, people with lupus may also have:[90]
- Fever (over 100 °F/ 37.7 °C)
- Extreme fatigue
- Hair loss
- Fingers turning white or blue when cold (Raynaud syndrome)
Criteria for individual diagnosis
Some people, especially those with antiphospholipid syndrome, may have SLE without four of the above criteria, and also SLE may present with features other than those listed in the criteria.[91][92][93]
Recursive partitioning has been used to identify more parsimonious criteria.[87] This analysis presented two diagnostic classification trees:
- Simplest classification tree: SLE is diagnosed if a person has an immunologic disorder (anti-DNA antibody, anti-Smith antibody, false positive syphilis test, or LE cells) or malar rash. It has sensitivity = 92% and specificity = 92%.
- Full classification tree: Uses six criteria. It has sensitivity = 97% and specificity = 95%.
Other alternative criteria have been suggested, e.g. the St. Thomas' Hospital "alternative" criteria in 1998.[94]
Treatment
There is no cure for Lupus. The treatment of SLE involves preventing flares and reducing their severity and duration when they occur.[citation needed]
Treatment can include corticosteroids and anti-malarial drugs. Certain types of lupus nephritis such as diffuse proliferative glomerulonephritis require intermittent cytotoxic drugs. These drugs include cyclophosphamide and mycophenolate. Cyclophosphamide increases the risk of developing infections, pancreas problems, high blood sugar, and high blood pressure.[95]
Hydroxychloroquine was approved by the FDA for lupus in 1955.[96] Some drugs approved for other diseases are used for SLE 'off-label'. In November 2010, an FDA advisory panel recommended approving belimumab (Benlysta) as a treatment for the pain and flare-ups common in lupus. The drug was approved by the FDA in March 2011.[97][98]
In terms of healthcare utilization and costs, one study found that "patients from the US with SLE, especially individuals with moderate or severe disease, utilize significant healthcare resources and incur high medical costs."[99]
Medications
Due to the variety of symptoms and organ system involvement with SLE, its severity in an individual must be assessed to successfully treat SLE. Mild or remittent disease may, sometimes, be safely left untreated. If required, nonsteroidal anti-inflammatory drugs and antimalarials may be used. Medications such as prednisone, mycophenolic acid and tacrolimus have been used in the past.[citation needed]
Disease-modifying antirheumatic drugs
Disease-modifying antirheumatic drugs (DMARDs) are used preventively to reduce the incidence of flares, the progress of the disease, and the need for steroid use; when flares occur, they are treated with corticosteroids. DMARDs commonly in use are antimalarials such as hydroxychloroquine and immunosuppressants (e.g. methotrexate and azathioprine). Hydroxychloroquine is an FDA-approved antimalarial used for constitutional, cutaneous, and articular manifestations. Hydroxychloroquine has relatively few side effects, and there is evidence that it improves survival among people who have SLE.[96]Cyclophosphamide is used for severe glomerulonephritis or other organ-damaging complications. Mycophenolic acid is also used for the treatment of lupus nephritis, but it is not FDA-approved for this indication, and FDA is investigating reports that it may be associated with birth defects when used by pregnant women.[100] A study involving more than 1,000 people with lupus found that people have a similar risk of serious infection with azathioprine and mycophenolic acid as with newer biological therapies (rituximab and belimumab).[101][102]
Immunosuppressive drugs
In more severe cases, medications that modulate the immune system (primarily corticosteroids and immunosuppressants) are used to control the disease and prevent recurrence of symptoms (known as flares). Depending on the dosage, people who require steroids may develop Cushing's syndrome, symptoms of which may include obesity, puffy round face, diabetes mellitus, increased appetite, difficulty sleeping, and osteoporosis. These may subside if and when the large initial dosage is reduced, but long-term use of even low doses can cause elevated blood pressure and cataracts.[citation needed]
Numerous new immunosuppressive drugs are being actively tested for SLE. Rather than broadly suppressing the immune system, as corticosteroids do, they target the responses of specific types of immune cells. Some of these drugs are already FDA-approved for treatment of rheumatoid arthritis, however due to high-toxicity, their use remains limited.[96][103]
Analgesia
Since a large percentage of people with SLE have varying amounts of chronic pain, stronger prescription analgesics (painkillers) may be used if over-the-counter drugs (mainly nonsteroidal anti-inflammatory drugs) do not provide effective relief. Potent NSAIDs such as indomethacin and diclofenac are relatively contraindicated for people with SLE because they increase the risk of kidney failure and heart failure.[96]
Pain is typically treated with opioids, varying in potency based on the severity of symptoms. When opioids are used for prolonged periods, drug tolerance, chemical dependency, and addiction may occur. Opiate addiction is not typically a concern since the condition is not likely to ever completely disappear. Thus, lifelong treatment with opioids is fairly common for chronic pain symptoms, accompanied by periodic titration that is typical of any long-term opioid regimen.[citation needed]
Intravenous immunoglobulins (IVIGs)
Внутривенные иммуноглобулины можно использовать для борьбы с СКВ с поражением органов или васкулитом . Считается, что они снижают выработку антител или способствуют выведению иммунных комплексов из организма, хотя механизм их действия недостаточно изучен. [104] В отличие от иммунодепрессантов и кортикостероидов , ВВИГ не подавляют иммунную систему снижается . риск серьезных инфекций , поэтому при использовании этих препаратов [105]
Изменения образа жизни
Избегание солнечного света при СКВ имеет решающее значение, поскольку известно, что ультрафиолетовое излучение усугубляет кожные проявления заболевания. [106] Также важно избегать действий, вызывающих усталость, поскольку люди с СКВ легко утомляются, и это может быть изнурительным. Эти две проблемы могут привести к тому, что люди будут оставаться дома в течение длительного периода времени. Было доказано, что физические упражнения помогают снизить утомляемость у взрослых с СКВ. [106] Лекарственные средства, не связанные с СКВ, следует назначать только в том случае, если известно, что они не усугубляют заболевание. Профессиональное воздействие кремнезема , пестицидов и ртути также может усугубить заболевание. [67] Рекомендации по научно обоснованным нефармакологическим вмешательствам в лечении СКВ были разработаны международной целевой группой врачей и пациентов с СКВ. [106]
Трансплантация почки
Трансплантация почек является методом выбора при терминальной стадии заболевания почек , которая является одним из осложнений волчаночного нефрита , но рецидив полного заболевания встречается у 30% людей. [107]
Антифосфолипидный синдром
Примерно у 20% людей с СКВ наблюдаются клинически значимые уровни антифосфолипидных антител, которые связаны с антифосфолипидным синдромом . [108] Антифосфолипидный синдром также связан с появлением симптомов нервной волчанки в головном мозге. При этой форме заболевания причина сильно отличается от волчанки: в кровеносных сосудах образуются тромбы (сгустки крови или «липкая кровь»), которые оказываются смертельными, если попадают в кровоток. [91] Если тромбозы мигрируют в мозг, они потенциально могут вызвать инсульт , блокируя кровоснабжение мозга.
Если у людей подозревается это расстройство, для раннего выявления обычно требуется сканирование мозга. Эти сканирования могут показать локализованные области мозга, где кровоснабжение недостаточно. План лечения этих людей требует антикоагулянтной терапии. низкие дозы аспирина Часто с этой целью назначают антикоагулянты, такие как варфарин . , хотя в случаях тромбоза используются [109]
Ведение беременности
Хотя большинство детей, рожденных от матерей, больных СКВ, здоровы, беременные матери с СКВ должны оставаться под медицинским наблюдением до родов. Неонатальная волчанка встречается редко, но выявление матерей с самым высоким риском осложнений позволяет своевременно начать лечение до или после рождения. Кроме того, СКВ может обостриться во время беременности, а правильное лечение позволяет дольше сохранить здоровье матери. Беременным женщинам, имеющим антитела против Ro (SSA) или против La (SSB), часто проводят эхокардиограмму на 16-й и 30-й неделе беременности, чтобы контролировать здоровье сердца и окружающих сосудов. [110]
Женщинам с СКВ регулярно рекомендуются контрацепция и другие надежные формы предотвращения беременности, поскольку было обнаружено, что беременность во время активного заболевания вредна. волчаночный нефрит . Наиболее частым проявлением был [ нужна ссылка ]
Прогноз
Лекарства от СКВ не существует, но существует множество методов лечения этого заболевания. [1]
В 1950-е годы большинство людей с диагнозом СКВ жили менее пяти лет. Сегодня более 90% из них выживают более десяти лет, и многие живут относительно бессимптомно. 80–90% могут рассчитывать на нормальную продолжительность жизни. [111] Однако уровень смертности выше по сравнению с людьми без СКВ. [112]
Прогноз обычно хуже для мужчин и детей, чем для женщин; однако, если симптомы присутствуют после 60 лет, заболевание имеет тенденцию протекать более доброкачественно. Ранняя смертность в течение пяти лет обусловлена органной недостаточностью или тяжелыми инфекциями, которые можно изменить с помощью ранней диагностики и лечения. Риск смертности на поздних стадиях увеличивается в пять раз по сравнению с нормальной популяцией, что можно объяснить сердечно-сосудистыми заболеваниями, вызванными ускоренным атеросклерозом, основной причиной смерти людей с СКВ. [96] Чтобы снизить вероятность сердечно-сосудистых проблем, следует предотвращать или активно лечить высокое кровяное давление и высокий уровень холестерина. Стероиды следует использовать в минимальной дозе в течение как можно более короткого периода времени, а другие препараты, которые могут уменьшить симптомы, следует использовать, когда это возможно. [96]
Эпидемиология
Глобальные показатели СКВ составляют примерно 20–70 на 100 000 человек. У женщин этот показатель наиболее высок в возрасте от 45 до 64 лет. Самый низкий общий показатель наблюдается в Исландии и Японии. Самые высокие показатели наблюдаются в США и Франции. Однако нет достаточных доказательств, чтобы сделать вывод, почему СКВ менее распространена в некоторых странах по сравнению с другими; это может быть изменчивость окружающей среды в этих странах. Например, в разных странах уровень солнечного света разный, а воздействие УФ-лучей влияет на дерматологические симптомы СКВ. [2]
Некоторые исследования предполагают, что существует генетическая связь между расой и волчанкой, которая влияет на распространенность заболевания. Если это правда, то расовый состав стран влияет на заболевание и приведет к изменению заболеваемости в стране по мере изменения расового состава. Чтобы понять, правда ли это, необходимо изучить страны с в значительной степени однородным и расово стабильным населением, чтобы лучше понять заболеваемость. [2] Уровень заболеваемости в развивающихся странах неясен. [8]
Уровень заболеваемости СКВ варьируется в зависимости от страны, этнической принадлежности и пола и меняется со временем. [109] В Соединенных Штатах, по одной из оценок, уровень СКВ составляет 53 на 100 000 человек; [109] по другой оценке, общая численность пострадавшего населения составляет от 322 000 до более 1 миллиона (от 98 до более 305 на 100 000). [113] В Северной Европе этот показатель составляет около 40 на 100 000 человек. [12] СКВ встречается чаще и с большей тяжестью среди лиц неевропейского происхождения. [113] Было обнаружено, что этот показатель достигает 159 на 100 000 среди лиц афро-карибского происхождения. [109] Системная красная волчанка, дебютирующая в детском возрасте, обычно проявляется в возрасте от 3 до 15 лет и в четыре раза чаще встречается у девочек. [114]
Хотя возникновение и сохранение СКВ может свидетельствовать о различиях между полами, социально-экономический статус также играет важную роль. Было показано, что женщины с СКВ и с более низким социально-экономическим статусом имеют более высокие показатели депрессии, более высокий индекс массы тела и более ограниченный доступ к медицинской помощи, чем женщины с более высоким социально-экономическим статусом, страдающие этим заболеванием. Люди с СКВ имели более высокие оценки тревоги и депрессии, если они имели более низкий социально-экономический статус. [115]
Раса
Есть утверждения, что раса влияет на заболеваемость СКВ. Однако обзор исследований 2010 года, связывающих расу и СКВ, выявил несколько источников систематических и методологических ошибок, указывающих на то, что связь между расой и СКВ может быть ложной. [116] Например, исследования показывают, что социальная поддержка является модулирующим фактором, который защищает от повреждений, связанных с СКВ, и поддерживает физиологическую функциональность. [116] Не проводились исследования, чтобы определить, получают ли люди разного расового происхождения разные уровни социальной поддержки. [116] Если разница и есть, она может выступать в качестве мешающей переменной в исследованиях, связывающих расу и СКВ.
Еще одно предостережение, на которое следует обратить внимание при изучении исследований СКВ, заключается в том, что о симптомах часто сообщают сами люди. Этот процесс приводит к дополнительным источникам методологических ошибок. Исследования показали, что на данные, сообщаемые самим пациентом, влияет не только опыт пациента с заболеванием: социальная поддержка, уровень беспомощности и ненормальное поведение, связанное с заболеванием, также влияют на самооценку. Кроме того, прогрессированию заболевания могут способствовать и другие факторы, такие как степень социальной поддержки, которую получает человек, социально-экономический статус, медицинская страховка и доступ к медицинской помощи. [116] [117]
Расовые различия в прогрессировании волчанки не были обнаружены в исследованиях, контролировавших социально-экономический статус [СЭС] участников. [116] [118] Исследования, в которых контролировали СЭС участников, показали, что у небелых людей болезнь начинается более резко по сравнению с белыми людьми, и что их болезнь прогрессирует быстрее. Цветные пациенты часто сообщают о более гематологических, серозных, неврологических и почечных симптомах. Однако тяжесть симптомов и смертность одинаковы у белых и небелых пациентов. Исследования, которые сообщают о различных темпах прогрессирования заболевания на поздней стадии СКВ, скорее всего, отражают различия в социально-экономическом статусе и соответствующем доступе к медицинской помощи. [116] Люди, получающие медицинскую помощь, часто получают меньший ущерб, связанный с болезнями, и с меньшей вероятностью оказываются за чертой бедности. [118] Дополнительные исследования показали, что образование, семейное положение, род занятий и доход создают социальный контекст, влияющий на прогрессирование заболевания. [116]
Секс
СКВ, как и многие аутоиммунные заболевания, поражает женщин чаще, чем мужчин, примерно в соотношении 9 к 1. [7] [109]
Гормональные механизмы могут объяснить повышенную заболеваемость СКВ у женщин. Возникновение СКВ можно объяснить повышенным гидроксилированием эстрогена у и аномально сниженным уровнем андрогенов женщин. Кроме того, было показано, что различия в передаче сигналов GnRH способствуют развитию СКВ. Хотя женщины более склонны к рецидивам, чем мужчины, интенсивность этих рецидивов одинакова для обоих полов. [15]
Помимо гормональных механизмов, развитию СКВ могут способствовать специфические генетические влияния, обнаруженные на Х-хромосоме. Х-хромосома несет иммунологические гены, такие как CD40L , которые могут мутировать или просто избегать подавления за счет инактивации Х-хромосомы и способствовать возникновению СКВ. [119] [120] Исследование показало связь между синдромом Клайнфельтера и СКВ. Мужчины XXY с СКВ имеют аномальную транслокацию X-Y, приводящую к частичному трипликации области гена PAR1 . [121] Исследования также показали, что XIST , который кодирует длинную некодирующую РНК , которая покрывает неактивный член пары Х-хромосом у женщин как часть рибонуклеопротеинового комплекса, является источником аутоиммунитета. [122]
Изменение уровня заболеваемости
Уровень СКВ в США увеличился с 1,0 в 1955 г. до 7,6 в 1974 г. Неизвестно, связано ли это увеличение с улучшением диагностики или с увеличением частоты заболевания. [109]
История
Историю СЛЭ можно разделить на три периода: классический, неоклассический и современный. В каждый период исследования и документация способствовали пониманию и диагностике СКВ, что привело к ее классификации как аутоиммунного заболевания в 1851 году, а также к различным вариантам диагностики и лечения, доступным теперь людям с СКВ. Достижения медицинской науки в диагностике и лечении СКВ значительно улучшили продолжительность жизни человека с диагнозом СКВ. [124]
Этимология
Существует несколько объяснений термина «красная волчанка». Lupus означает в переводе с латыни «волк». [125] [9] а в средневековой латыни также использовалось для обозначения кожного заболевания. [126] а слово «эритематоз» происходит от древнегреческого слова ἐρύθημα , означающего «покраснение кожи». Все объяснения связаны с красноватой сыпью на скулах в форме бабочки, которая классически проявляется при этом заболевании на носу и щеках. Причина, по которой термин «волчанка» использовался для описания этого заболевания, возникла в середине 19 века. Многие заболевания, вызывавшие изъязвление или некроз, получили термин «волчанка», поскольку рана напоминала укус волка. Это похоже на название волчанки обыкновенной или хронического туберкулеза лица, при котором поражения рваные и перфорированные и, как говорят, напоминают укус волка. [127]
Классический период
Классический период начался, когда болезнь была впервые обнаружена в средние века. Термин «волчанка» приписывается итальянскому врачу XII века Рогериусу Фругару , который использовал его для описания изъязвляющихся язв на ногах людей. [128] Официального лечения этой болезни не существовало, а ресурсы врачей, способные помочь людям, были ограничены. [129]
Неоклассический период
было зарегистрировано кожное заболевание, которое сейчас известно как дискоидная волчанка Неоклассический период начался в 1851 году, когда французским врачом Пьером Казенавом . Казенав назвал это заболевание волчанкой и добавил слово «эритематоз», чтобы отличить это заболевание от других заболеваний, поражающих кожу, за исключением инфекционных. [130] Казенав наблюдал болезнь у нескольких человек и сделал очень подробные записи, чтобы помочь другим в ее диагностике. Он был одним из первых, кто задокументировал, что волчанка поражает взрослых от подросткового возраста до тридцати с небольшим лет и что сыпь на лице является ее наиболее отличительной чертой. [131]
Исследования и документирование заболевания продолжались в неоклассический период работами Фердинанда фон Хебры и его зятя Морица Капоши . Они задокументировали физические последствия волчанки, а также некоторые предположения о возможности того, что болезнь вызывает внутреннюю травму. Фон Хебра заметил, что симптомы волчанки могут длиться много лет и что болезнь может перейти в «спячку» после многих лет агрессивной активности, а затем снова появиться с симптомами, имеющими ту же общую картину. Эти наблюдения побудили Гебру в 1872 году назвать волчанку хронической болезнью. [132]
Капоши заметил, что волчанка принимает две формы: поражения кожи (теперь известные как дискоидная волчанка) и более острую форму, которая поражает не только кожу, но также вызывает лихорадку, артрит и другие системные заболевания у людей. [133] Последний также представлял собой сыпь, ограниченную лицом, появляющуюся на щеках и на переносице; он назвал это « сыпью бабочки ». Капоши также заметил, что пациенты, у которых появилась сыпь в форме бабочки, часто страдали другим заболеванием, таким как туберкулез, анемия или хлориз, которые часто приводили к смерти. [131] Капоши был одним из первых людей, осознавших то, что сейчас называется системной красной волчанкой, в своих документах о ремиттирующей и рецидивирующей природе заболевания и взаимосвязи кожных и системных проявлений во время активности заболевания. [134]
Исследования волчанки в XIX веке продолжились работой сэра Уильяма Ослера , который в 1895 году опубликовал первую из трех своих статей о внутренних осложнениях многоформной экссудативной эритемы . Не у всех пациентов, описанных в его статье, была СКВ, но работа Ослера расширила знания о системных заболеваниях и задокументировала обширные и критические висцеральные осложнения при некоторых заболеваниях, включая волчанку. [131] Отметив, что у многих людей с волчанкой имеется заболевание, поражающее не только кожу, но и многие другие органы тела, Ослер добавил слово «системный» к термину «красная волчанка», чтобы отличить этот тип заболевания от дискоидной красной волчанки. [135]
Во второй статье Ослера отмечалось, что рецидивы являются особенностью заболевания и что приступы могут длиться месяцами или даже годами. Дальнейшее изучение заболевания привело к появлению третьей статьи, опубликованной в 1903 году, в которой документировались такие недуги, как артрит, пневмония, неспособность формировать связные идеи, бред и поражение центральной нервной системы, которые поражают пациентов с диагнозом СКВ. [131]
Современный период
Современный период, начавшийся в 1920 году, ознаменовался крупными достижениями в исследованиях причин и лечения дискоидной и системной волчанки. Исследования, проведенные в 1920-х и 1930-х годах, привели к первым подробным патологическим описаниям волчанки и продемонстрировали, как болезнь влияет на почки, сердце и легочную ткань. [136] Прорыв был сделан в 1948 году с открытием LE-клетки (клетки красной волчанки — неправильное название, поскольку она встречается и при других заболеваниях). Обнаруженные группой исследователей из клиники Майо , они обнаружили, что лейкоциты содержат ядро другой клетки, которая давит на собственное ядро лейкоцитов. [137]
Отметив, что вторгающееся ядро было покрыто антителом, которое позволяло ему поглощаться фагоцитирующей или мусорной клеткой, они назвали антитело, которое заставляет одну клетку поглощать другую, фактором LE, и в результате двухядерной клетки образуется LE-клетка. [138] Было установлено, что LE-клетка была частью реакции антиядерных антител (ANA); организм вырабатывает антитела против собственных тканей. Это открытие привело к одному из первых окончательных тестов на волчанку, поскольку LE-клетки обнаруживаются примерно у 60% всех людей с диагнозом волчанка. [139] Сегодня тест на LE-клетки редко проводится в качестве окончательного теста на волчанку, поскольку LE-клетки не всегда встречаются у людей с СКВ и могут встречаться у людей с другими аутоиммунными заболеваниями. Их наличие может помочь установить диагноз, но уже не указывает на окончательный диагноз СКВ.
Открытие LE-клетки привело к дальнейшим исследованиям, которые привели к более точным тестам на волчанку. Основываясь на знаниях о том, что у больных СКВ имеются аутоантитела, которые прикрепляются к ядрам нормальных клеток, заставляя иммунную систему посылать лейкоциты для борьбы с этими «захватчиками», был разработан тест для поиска анти-антител. ядерное антитело (ANA), а не конкретно клетка LE. Этот ANA-тест было легче выполнить, и он привел не только к окончательному диагнозу волчанки, но и многих других связанных с ним заболеваний. Это открытие привело к пониманию того, что сейчас известно как аутоиммунные заболевания. [140]
Чтобы гарантировать, что у человека волчанка, а не другое аутоиммунное заболевание, Американский колледж ревматологии (ACR) разработал список клинических и иммунологических критериев, которые в любой комбинации указывают на СКВ. Критерии включают симптомы, которые человек может идентифицировать (например, боль), а также вещи, которые врач может обнаружить при физическом осмотре и результатах лабораторных исследований. Список был первоначально составлен в 1971 году, первоначально пересмотрен в 1982 году, а затем переработан и улучшен в 2009 году. [141]
Историки медицины предположили, что люди с порфирией (заболеванием, которое имеет много общих симптомов с СКВ) породили фольклорные истории о вампирах и оборотнях из-за фоточувствительности, рубцевания, роста волос и порфириновых коричневато-красных пятен на зубах при тяжелых рецессивных формах порфирии ( или комбинации заболевания, известные как двойная, гомозиготная или сложная гетерозиготная порфирия). [142]
Полезное лекарство от этого заболевания было впервые найдено в 1894 году, когда впервые было объявлено о хинине как об эффективном лечении. Четыре года спустя было отмечено, что использование салицилатов в сочетании с хинином дает еще большую пользу. Это был лучший доступный метод лечения до середины двадцатого века, когда Хенч обнаружил эффективность кортикостероидов в лечении СКВ. [142]
Исследовать
В исследовании под названием BLISS-76 тестировался препарат белимумаб , полностью человеческое моноклональное антитело против BAFF (или анти-BLyS). [98] BAFF стимулирует и продлевает жизнь В-лимфоцитов , которые вырабатывают антитела против чужеродных и собственных белков . [143] Он был одобрен FDA в марте 2011 года. [97] По состоянию на 2019 год генно-инженерные иммунные клетки также изучаются на животных моделях заболевания. [144]
В сентябре 2022 года исследователи из Университета Эрланген-Нюрнберг опубликовали многообещающие результаты использования генетически измененных иммунных клеток для лечения тяжелобольных пациентов. Четыре женщины и один мужчина получили переливание CAR Т-клеток, модифицированных для атаки на их В-клетки , устраняя аберрантные клетки. Терапия привела к ремиссии заболевания у всех пяти пациентов, которые не принимали лекарства от волчанки в течение нескольких месяцев после окончания лечения. [145] [146]
Известные случаи
- Шеннон Бокс , футболист олимпийской сборной США. [147]
- Ник Кэннон , американский телеведущий, актер, рэпер и комик [148]
- Нажмите «Загрузить» , чтобы сохранить Pumpuang Duangjan - Thai Luk Thung Singer mp3 youtube com [149]
- Селена Гомес , певица, актриса, продюсер и бизнесвумен [150]
- Салли Хокинс , актриса [151]
- Фланнери О'Коннор , писательница южной готики и автор рассказов. [152]
- Майкл Джексон , американский певец, автор песен, танцор и филантроп. [153]
- Сил , британский певец [154]
См. также
Ссылки
- ^ Перейти обратно: а б с д и ж г час я дж к л м н тот п д р с т в v «Раздаточный материал по здоровью: системная красная волчанка» . www.niams.nih.gov . Февраль 2015. Архивировано из оригинала 17 июня 2016 года . Проверено 12 июня 2016 г.
- ^ Перейти обратно: а б с д и ж г Данченко Н., Сатиа Дж.А., Энтони М.С. (2006). «Эпидемиология системной красной волчанки: сравнение мирового бремени болезней». Волчанка . 15 (5): 308–318. дои : 10.1191/0961203306lu2305xx . ПМИД 16761508 . S2CID 6465663 .
- ^ Интенсивный обзор внутренних болезней клиники Кливленда (5-е изд.). Липпинкотт Уильямс и Уилкинс. 2012. с. 969. ИСБН 978-1-4511-5330-9 . Проверено 13 июня 2016 г.
- ^ Перейти обратно: а б с д и ж г Лисневская Л., Мерфи Г., Изенберг Д. (ноябрь 2014 г.). «Системная красная волчанка». Ланцет . 384 (9957): 1878–1888. CiteSeerX 10.1.1.1008.5428 . дои : 10.1016/s0140-6736(14)60128-8 . ПМИД 24881804 . S2CID 28905456 .
- ^ «После иммунотерапии у пяти пациентов с волчанкой наступила длительная ремиссия» . Новый Атлас . 15 сентября 2022 г. Проверено 17 сентября 2022 г.
- ^ Дэвис Л.С., Реймолд А.М. (апрель 2017 г.). «Исследования и терапия: традиционные и новые методы лечения системной красной волчанки» . Ревматология . 56 (дополнение_1): i100–i113. дои : 10.1093/ревматология/kew417 . ПМК 5850311 . ПМИД 28375452 .
- ^ Перейти обратно: а б с Мерфи Дж., Айзенберг Д. (декабрь 2013 г.). «Влияние пола на клиническую картину системной красной волчанки» . Ревматология . 52 (12): 2108–2115. дои : 10.1093/ревматология/ket160 . ПМИД 23641038 .
- ^ Перейти обратно: а б Тиффин Н., Адеймо А., Окпечи I (январь 2013 г.). «Разнообразный набор генетических факторов способствует патогенезу системной красной волчанки» . Сиротский журнал редких заболеваний . 8 :2. дои : 10.1186/1750-1172-8-2 . ПМЦ 3551738 . ПМИД 23289717 .
- ^ Перейти обратно: а б Чабнер Д.Э. (2013). Язык медицины . Elsevier Науки о здоровье. п. 610. ИСБН 978-1-4557-2846-6 .
- ^ Шил-младший, ЧМ (30 января 2009 г.). Штёпплер MC (ред.). «Системная волчанка (продолжение)» . МедицинаНет . Архивировано из оригинала 20 декабря 2009 г.
- ^ «Люпус, «Великий подражатель» » . Университетское здравоохранение. Архивировано из оригинала 15 января 2009 года . Проверено 3 февраля 2009 г.
- ^ Перейти обратно: а б с д и ж Рахман А., Изенберг Д.А. (февраль 2008 г.). «Системная красная волчанка». Медицинский журнал Новой Англии . 358 (9): 929–939. CiteSeerX 10.1.1.1008.5428 . дои : 10.1056/NEJMra071297 . ПМИД 18305268 .
- ^ «Факты и статистика о волчанке | Американский фонд волчанки» . www.lupus.org . Проверено 2 ноября 2023 г.
- ^ «Волчанка: Симптомы — MayoClinic.com» . Архивировано из оригинала 14 июля 2008 г. Проверено 14 июля 2008 г.
- ^ Перейти обратно: а б Якуб Васеф С.З. (август 2004 г.). «Гендерные различия при системной красной волчанке». Гендерная медицина . 1 (1): 12–17. дои : 10.1016/S1550-8579(04)80006-8 . ПМИД 16115579 .
- ^ Теббе Б., Орфанос CE (1997). «Эпидемиология и социально-экономические последствия кожных заболеваний при красной волчанке». Волчанка . 6 (2): 96–104. дои : 10.1177/096120339700600204 . ПМИД 9061657 . S2CID 25969434 .
- ^ Харрис Дж.П., Вейсман М.Х., ред. (2007). Проявления системного заболевания головы и шеи . Нью-Йорк: Информа Здравоохранение. п. 6. ISBN 978-1-4200-1756-4 .
- ^ Гладман Д. (10 сентября 2015 г.). «Обзор клинических проявлений системной красной волчанки у взрослых» . До настоящего времени . Архивировано из оригинала 19 апреля 2017 года . Проверено 18 апреля 2017 г. .
- ^ Перейти обратно: а б Боль в суставах и мышцах. Архивировано 9 ноября 2007 г. в Wayback Machine Lupus Foundation. Американском фонде
- ^ Ходкинсон Б., Мусенге Э., Тикли М. (май 2009 г.). «Костно-суставной туберкулез у больных системной красной волчанкой» . КДЖМ . 102 (5): 321–328. дои : 10.1093/qjmed/hcp015 . ПМИД 19246552 .
- ^ Хемминки К., Ли Х, Сундквист Дж., Сундквист К. (март 2009 г.). «Семейные ассоциации ревматоидного артрита с аутоиммунными заболеваниями и связанными с ними состояниями» . Артрит и ревматизм . 60 (3): 661–668. дои : 10.1002/арт.24328 . ПМИД 19248111 .
- ^ Мендоса-Пинто С., Гарсиа-Карраско М., Сандовал-Крус Х., Муньос-Гуарнерос М., Эскарсега Р.О., Хименес-Эрнандес М. и др. (май 2009 г.). «Факторы риска переломов позвонков у женщин с системной красной волчанкой». Клиническая ревматология . 28 (5): 579–585. дои : 10.1007/s10067-009-1105-3 . ПМИД 19224131 . S2CID 29786198 .
- ^ Лам С.К., Куах Т.С. (1990). «Анемия при системной красной волчанке». Журнал Сингапурского педиатрического общества . 32 (3–4): 132–136. ПМИД 2133750 .
- ^ Джаннули С., Вулгарелис М., Зиакас П.Д., Циуфас А.Г. (февраль 2006 г.). «Анемия при системной красной волчанке: от патофизиологии к клинической оценке» . Анналы ревматических болезней . 65 (2): 144–148. дои : 10.1136/ard.2005.041673 . ПМК 1798007 . ПМИД 16079164 .
- ^ Сюто Т., Симидзу А., Такеучи Ю., Танака С., Хасегава М., Нагай Ю. и др. (июль 2009 г.). «Связь антител к антифосфатидилсерину/протромбину с нервно-психической системной красной волчанкой». Клиническая ревматология . 28 (7): 841–845. дои : 10.1007/s10067-009-1123-1 . ПМИД 19224124 . S2CID 26215523 .
- ^ Хан Б.Х. (декабрь 2003 г.). «Системная красная волчанка и ускоренный атеросклероз». Медицинский журнал Новой Англии . 349 (25): 2379–2380. дои : 10.1056/NEJMp038168 . ПМИД 14681501 .
- ^ Фриери М., Stampfl H (январь 2016 г.). «Системная красная волчанка и атеросклероз: обзор литературы». Обзоры аутоиммунитета . 15 (1): 16–21. дои : 10.1016/j.autrev.2015.08.007 . ПМИД 26299985 .
- ^ «Лечение волчанки стероидами» . Центр волчанки Джонса Хопкинса . Проверено 1 декабря 2021 г.
- ^ Хендерсон Л.А., Лоринг Ш., Гилл Р.Р., Ляо К.П., Ишизавар Р., Ким С. и др. (март 2013 г.). «Синдром сморщивания легких как проявление плеврита: новая модель, основанная на физиологических исследованиях легких» . Журнал ревматологии . 40 (3): 273–281. дои : 10.3899/jrheum.121048 . ПМК 4112073 . ПМИД 23378468 .
- ^ Кальдераро, округ Колумбия, Феррейра, Джорджия (май 2012 г.). «Проявление и прогноз синдрома сокращения легких при системной красной волчанке: сообщение о четырех случаях». Международная ревматология . 32 (5): 1391–1396. дои : 10.1007/s00296-011-1863-5 . ПМИД 21431288 . S2CID 1955534 .
- ^ Сингх Дж.А., Хоссейн А., Котб А., Оливейра А., Мудано А.С., Гроссман Дж. и др. (октябрь 2016 г.). «Лечение волчаночного нефрита: систематический обзор и сетевой метаанализ» . Журнал ревматологии . 43 (10): 1801–1815. дои : 10.3899/jrheum.160041 . ПМИД 27585688 . S2CID 19621372 .
- ^ Сомерс Э.К., Мардер В., Каньоли П., Льюис Э.Э., ДеГуайр П., Гордон С. и др. (февраль 2014 г.). «Популяционная заболеваемость и распространенность системной красной волчанки: Мичиганская программа эпидемиологии и надзора за волчанкой» . Артрит и ревматология . 66 (2): 369–378. дои : 10.1002/арт.38238 . hdl : 2027.42/102724 . ПМК 4198147 . ПМИД 24504809 .
- ^ Уорд ММ (ноябрь 2000 г.). «Изменения заболеваемости терминальной стадией почечной недостаточности вследствие волчаночного нефрита, 1982-1995 гг.» . Архив внутренней медицины . 160 (20): 3136–3140. дои : 10.1001/archinte.160.20.3136 . ПМИД 11074743 .
- ^ «Изображения общей патологии для иммунопатологии» . Архивировано из оригинала 10 мая 2007 г. Проверено 24 июля 2007 г.
- ^ Перейти обратно: а б «Номенклатура и определения случаев нейропсихиатрических синдромов волчанки Американского колледжа ревматологии» . Артрит и ревматизм . 42 (4): 599–608. Апрель 1999 г. doi : 10.1002/1529-0131(199904)42:4<599::AID-ANR2>3.0.CO;2-F . ПМИД 10211873 .
- ^ Перейти обратно: а б Касама Т., Маеока А., Огуро Н. (2016). «Клинические особенности нервно-психических синдромов при системной красной волчанке и других заболеваниях соединительной ткани» . Клиническая медицина. Артрит и заболевания опорно-двигательного аппарата . 9 : 1–8. дои : 10.4137/CMAMD.S37477 . ПМК 4718090 . ПМИД 26819561 .
- ^ Нойвельт CM, Young RG (2 апреля 2009 г.). «Управление психоневрологической волчанкой: 10 лучших клинических жемчужин» . Журнал скелетно-мышечной медицины . 26 (4). Архивировано из оригинала 27 апреля 2009 года.
- ^ Перейти обратно: а б с Гончаренко К., Будзяновска А., Останек Л. (2008). «Неврологические синдромы при системной красной волчанке и их связь с антифосфолипидным синдромом» . Неврология и Нейрохирургия Польска . 42 (6): 513–517. ПМИД 19235104 . Архивировано из оригинала 07 января 2020 г. Проверено 7 марта 2009 г.
- ^ Омдал Р. (2002). «Некоторые противоречия нейропсихиатрической системной красной волчанки». Скандинавский журнал ревматологии . 31 (4): 192–197. дои : 10.1080/030097402320318369 . ПМИД 12369649 . S2CID 1057841 .
- ^ «Волчаночный сайт (СКВ)» . Архивировано из оригинала 29 марта 2010 г. Проверено 6 ноября 2009 г.
- ^ Сюэ З, Ван Х, Лю Ф, Ху С, Чжу С, Чжан С и др. (февраль 2009 г.). «Синдром внутричерепной гипертензии при системной красной волчанке: клинический анализ и обзор литературы». Журнал Хуачжунского университета науки и технологий, медицинских наук . 29 (1): 107–111. дои : 10.1007/s11596-009-0123-3 . ПМИД 19224175 . S2CID 195682502 .
- ^ Вест СГ (сентябрь 1996 г.). «Волчанка и центральная нервная система». Современное мнение в ревматологии . 8 (5): 408–414. дои : 10.1097/00002281-199609000-00004 . ПМИД 8941443 .
- ^ Закери З., Шакиба М., Наруи Б., Младкова Н., Гасеми-Рад М., Хосрави А. (май 2012 г.). «Распространенность депрессии и депрессивных симптомов у больных системной красной волчанкой: иранский опыт». Международная ревматология . 32 (5): 1179–1187. дои : 10.1007/s00296-010-1791-9 . ПМИД 21253731 . S2CID 19597373 .
- ^ Даммакко Р. (май 2018 г.). «Системная красная волчанка и поражение глаз: обзор». Клиническая и экспериментальная медицина . 18 (2): 135–149. дои : 10.1007/s10238-017-0479-9 . ПМИД 29243035 . S2CID 13757311 .
- ^ Клоуз МЭ (май 2007 г.). «Активность волчанки при беременности» . Клиники ревматических заболеваний Северной Америки . 33 (2): 237–52, v. doi : 10.1016/j.rdc.2007.01.002 . ПМК 2745966 . ПМИД 17499705 .
- ^ Смит А., Оливейра Г.Х., Лар Б.Д., Бейли К.Р., Норби С.М., Гарович В.Д. (ноябрь 2010 г.). «Систематический обзор и метаанализ исходов беременности у пациенток с системной красной волчанкой и волчаночным нефритом» . Клинический журнал Американского общества нефрологов . 5 (11): 2060–2068. дои : 10.2215/CJN.00240110 . ПМК 3001786 . ПМИД 20688887 .
- ^ Кортес-Эрнандес Х, Орди-Рос Х, Паредес Ф, Касельяс М, Кастильо Ф, Вилардель-Таррес М (июнь 2002 г.). «Клинические предикторы исходов для плода и матери при системной красной волчанке: проспективное исследование 103 беременностей» . Ревматология . 41 (6): 643–650. дои : 10.1093/ревматология/41.6.643 . ПМИД 12048290 .
- ^ Перейти обратно: а б thefreedictionary.com > неонатальная волчанка. Цитирование: Медицинский словарь Дорланда для потребителей медицинских услуг. Авторское право 2007 г.
- ^ «Волчанка и репродуктивное здоровье женщин | Американский фонд волчанки» . Американский фонд волчанки . Проверено 1 декабря 2021 г.
- ^ «Метотрексат – Макстрекс, Методжект. Побочные действия и дозировка» . пациент.информация . Проверено 30 июня 2022 г.
- ^ Д'Круз ДП (апрель 2006 г.). «Системная красная волчанка» . БМЖ . 332 (7546): 890–894. дои : 10.1136/bmj.332.7546.890 . ПМК 1440614 . ПМИД 16613963 .
- ^ Джамп Р.Л., Робинсон М.Э., Армстронг А.Е., Барнс Э.В., Килборн К.М., Ричардс Х.Б. (сентябрь 2005 г.). «Усталость при системной красной волчанке: вклад активности заболевания, боли, депрессии и воспринимаемой социальной поддержки» . Журнал ревматологии . 32 (9): 1699–1705. ПМИД 16142863 . Архивировано из оригинала 16 августа 2007 г.
- ^ Шнайдер Л., Дос Сантос А.С., Сантос М., да Силва Чакр Р.М., Монтисьело О.А. (август 2014 г.). «Витамин D и системная красная волчанка: современное состояние». Клиническая ревматология . 33 (8): 1033–1038. дои : 10.1007/s10067-014-2530-5 . ПМИД 24573738 . S2CID 28033436 .
- ^ Мартенс Х.А., Нолте И.М., ван дер Стидж Г., Шиппер М., Калленберг К.Г., Те Меерман Г.Дж. и др. (март 2009 г.). «Обширный скрининг региона HLA показывает независимую связь HLA класса I и класса II с восприимчивостью к системной красной волчанке». Скандинавский журнал ревматологии . 38 (4): 256–262. дои : 10.1080/03009740802552469 . ПМИД 19255932 . S2CID 1514217 .
- ^ Перейти обратно: а б с Ян В., Нг П., Чжао М., Хиранкарн Н., Лау К.С., Мок К.С. и др. (апрель 2009 г.). «Популяционные различия в генах предрасположенности к СКВ: STAT4 и BLK, но не PXK, связаны с системной красной волчанкой у китайцев из Гонконга». Гены и иммунитет . 10 (3): 219–226. дои : 10.1038/gen.2009.1 . ПМИД 19225526 . S2CID 22026222 .
- ^ Ким К., Сунг Ю.К., Кан КП, Чой CB, Кан С., Бэ СК (июль 2009 г.). «Регуляторный SNP в положении -899 в CDKN1A связан с системной красной волчанкой и волчаночным нефритом» . Гены и иммунитет . 10 (5): 482–486. дои : 10.1038/gen.2009.5 . ПМИД 19262578 .
- ^ Роудс Б., Вайс Т.Дж. (ноябрь 2008 г.). «Генетика СКВ: обновленная информация в свете общегеномных исследований ассоциаций» . Ревматология . 47 (11): 1603–1611. дои : 10.1093/ревматология/ken247 . ПМИД 18611920 .
- ^ Перейти обратно: а б Мозер К.Л., Келли Дж.А., Лессард С.Дж., Харли Дж.Б. (июль 2009 г.). «Недавние открытия о генетической основе системной красной волчанки» . Гены и иммунитет . 10 (5): 373–379. дои : 10.1038/gen.2009.39 . ПМК 3144759 . ПМИД 19440199 .
- ^ Келли Дж.А., Мозер К.Л., Харли Дж.Б. (октябрь 2002 г.). «Генетика системной красной волчанки: собрать воедино» . Гены и иммунитет . 3 (Приложение 1): S71–S85. дои : 10.1038/sj.gene.6363885 . ПМИД 12215907 .
- ^ Прокунина Л., Аларкон-Рикельме М. (апрель 2004 г.). «Генетическая основа системной красной волчанки – знания сегодняшнего дня и мысли на будущее» . Молекулярная генетика человека . 13 Спецификация № 1 (90001): R143–R148. дои : 10.1093/hmg/ddh076 . ПМИД 14764622 .
- ^ Роберт Л. Рубин, доктор философии. «Лекарственная красная волчанка» . Американский фонд волчанки . (неархивная версия больше не доступна). Архивировано из оригинала 13 октября 2006 г. Проверено 20 июня 2018 г.
- ^ Миллард Л.Г., Роуэлл Н.Р. (сентябрь 1979 г.). «Аномальные результаты лабораторных исследований и их связь с прогнозом при дискоидной красной волчанке. Долгосрочное наблюдение за 92 пациентами». Архив дерматологии . 115 (9): 1055–1058. дои : 10.1001/archderm.1979.04010090005011 . ПМИД 314780 .
- ^ МК Ворона (февраль 2008 г.). «Сотрудничество, генетические ассоциации и красная волчанка». Медицинский журнал Новой Англии . 358 (9): 956–961. дои : 10.1056/NEJMe0800096 . ПМИД 18204099 .
- ^ Хом Г., Грэм Р.Р., Модрек Б., Тейлор К.Е., Ортманн В., Гарнье С. и др. (февраль 2008 г.). «Ассоциация системной красной волчанки с C8orf13-BLK и ITGAM-ITGAX» . Медицинский журнал Новой Англии . 358 (9): 900–909. doi : 10.1056/NEJMoa0707865 . ПМИД 18204098 . S2CID 18987547 .
- ^ «Конспекты лекций Медицинской школы Университета Южной Каролины, Иммунология, реакции гиперчувствительности. Общее обсуждение гиперчувствительности, неспецифической для СКВ» . Pathmicro.med.sc.edu. 07.07.2010. Архивировано из оригинала 3 августа 2011 г. Проверено 6 августа 2011 г.
- ^ Шейнфельд Н.С., ДиКостанзо Д.Д., Коэн С.Р. (декабрь 2003 г.). «Сетчатая и звездчатая акральная пигментация, связанная с системной красной волчанкой и высокими титрами циркулирующих антикардиолипиновых антител: возможная связь с акральным микроливедо». Журнал лекарств в дерматологии . 2 (6): 674–676. ПМИД 14711150 .
- ^ Перейти обратно: а б Д'Круз Д.П., Хамашта М.А., Хьюз Г.Р. (февраль 2007 г.). «Системная красная волчанка». Ланцет . 369 (9561): 587–596. CiteSeerX 10.1.1.1008.5428 . дои : 10.1016/S0140-6736(07)60279-7 . ПМИД 17307106 . S2CID 28468112 .
- ^ Канта Х, Мохан С (июль 2009 г.). «Три контрольных точки в развитии волчанки: центральная толерантность адаптивного иммунитета, периферическая амплификация врожденного иммунитета и воспаление органов-мишеней». Гены и иммунитет . 10 (5): 390–396. дои : 10.1038/gen.2009.6 . ПМИД 19262576 . S2CID 12936040 .
- ^ «Комплемент C3 (кровь) — Энциклопедия здоровья — Медицинский центр Университета Рочестера» . www.urmc.rochester.edu . Архивировано из оригинала 24 сентября 2016 г.
- ^ Гайпл У.С., Кун А., Шериф А., Муньос Л.Е., Франц С., Фолл Р.Э. и др. (2006). «Клиренс апоптотических клеток при СКВ у человека». В Элькон КБ (ред.). Апоптоз и его значение для аутоиммунитета . Современные направления в области аутоиммунитета. Том. 9. Каргер. стр. 173–187. дои : 10.1159/000090781 . ISBN 978-3-8055-8036-6 . ПМИД 16394661 .
- ^ Гергели П., Гроссман С., Ниланд Б., Пушкаш Ф., Нойпане Х., Аллам Ф. и др. (январь 2002 г.). «Гиперполяризация митохондрий и истощение АТФ у больных системной красной волчанкой» . Артрит и ревматизм . 46 (1): 175–190. doi : 10.1002/1529-0131(200201)46:1<175::AID-ART10015>3.0.CO;2-H . ПМК 4020417 . ПМИД 11817589 .
- ^ Монтейт А.Дж., Канг С., Скотт Э., Хиллман К., Раджфур З., Джейкобсон К. и др. (апрель 2016 г.). «Дефекты созревания лизосом способствуют активации врожденных сенсоров при системной красной волчанке» . Труды Национальной академии наук Соединенных Штатов Америки . 113 (15): Е2142–Е2151. Бибкод : 2016PNAS..113E2142M . дои : 10.1073/pnas.1513943113 . ПМЦ 4839468 . ПМИД 27035940 .
- ^ Кан С., Роджерс Дж.Л., Монтейт А.Дж., Цзян С., Шмитц Дж., Кларк С.Х. и др. (май 2016 г.). «Апоптотический мусор накапливается на кроветворных клетках и способствует заболеванию системной красной волчанкой у мышей и людей» . Журнал иммунологии . 196 (10): 4030–4039. doi : 10.4049/jimmunol.1500418 . ПМЦ 4868781 . ПМИД 27059595 .
- ^ Хакким А., Фюрнрор Б.Г., Аманн К., Лаубе Б., Абед У.А., Бринкманн В. и др. (май 2010 г.). «Нарушение деградации внеклеточных ловушек нейтрофилов связано с волчаночным нефритом» . Труды Национальной академии наук Соединенных Штатов Америки . 107 (21): 9813–9818. Бибкод : 2010PNAS..107.9813H . дои : 10.1073/pnas.0909927107 . ПМК 2906830 . ПМИД 20439745 .
- ^ Ясутомо К., Хориучи Т., Кагами С., Цукамото Х., Хашимура С., Урушихара М. и др. (август 2001 г.). «Мутация ДНКазы 1 у людей с системной красной волчанкой». Природная генетика . 28 (4): 313–314. дои : 10.1038/91070 . ПМИД 11479590 . S2CID 21277651 .
- ^ Перейти обратно: а б Гайпл У.С., Муньос Л.Е., Гроссмайер Г., Лаубер К., Франц С., Сартер К. и др. (2007). «Дефицит клиренса и системная красная волчанка (СКВ)». Журнал аутоиммунитета . 28 (2–3): 114–121. дои : 10.1016/j.jaut.2007.02.005 . PMID 17368845 .
- ^ Пул Б.Д., Шнайдер Р.И., Гатридж Дж.М., Велте К.А., Райхлин М., Харли Дж.Б. и др. (март 2009 г.). «Ранние мишени гуморального аутоиммунитета ядерного RNP при системной красной волчанке человека» . Артрит и ревматизм . 60 (3): 848–859. дои : 10.1002/арт.24306 . ПМЦ 2653589 . ПМИД 19248110 .
- ^ Пан ХФ, Ву GC, Ли WP, Ли XP, Йе DQ (март 2010 г.). «Группа высокой мобильности, блок 1: потенциальная терапевтическая мишень для системной красной волчанки». Отчеты по молекулярной биологии . 37 (3): 1191–1195. дои : 10.1007/s11033-009-9485-7 . ПМИД 19247800 . S2CID 7214396 .
- ^ Арингер М., Костенбадер К., Дайх Д., Бринкс Р., Моска М., Рэмси-Голдман Р. и др. (сентябрь 2019 г.). «Критерии классификации системной красной волчанки Европейской лиги борьбы с ревматизмом / Американской коллегии ревматологов 2019 года» . Артрит и ревматология . 71 (9): 1400–1412. дои : 10.1002/арт.40930 . ПМЦ 6827566 . ПМИД 31385462 .
- ^ Райх А., Марцинов К., Бялиницкий-Бирула Р. (январь 2011 г.). «Тест волчаночной ленты у больных системной красной волчанкой» . Терапия и управление клиническими рисками . 7 : 27–32. дои : 10.2147/TCRM.S10145 . ПМК 3039011 . ПМИД 21339940 .
- ^ Путтерман С., Фьюри Р., Рэмси-Голдман Р., Асканасе А., Буйон Дж., Калунян К. и др. (2014). «Продукты активации клеточно-связанного комплемента при системной красной волчанке: сравнение с анти-двухцепочечной ДНК и стандартными измерениями комплемента» . Волчаночная наука и медицина . 1 (1): e000056. дои : 10.1136/lupus-2014-000056 . ПМЦ 4225732 . ПМИД 25396070 .
- ^ О'Мэлли Т., Се Ф., Су Ю, Клинтон С., Зак Дж., Хэчунг С. и др. (сентябрь 2022 г.). «Продукты активации комплемента и стандартное тестирование ANA: результаты лечения, диагностика и экономическое воздействие (CAPSTONE) при системной красной волчанке». Журнал управляемого ухода и специализированной аптеки . 28 (9): 1021–1032. дои : 10.18553/jmcp.2022.22039 . ПМИД 35775579 . S2CID 250175290 .
- ^ Буйон Дж.П., Клэнси Р.М. (декабрь 2003 г.). «Материнские аутоантитела и врожденная блокада сердца: медиаторы, маркеры и терапевтический подход». Семинары по артриту и ревматизму . 33 (3): 140–154. дои : 10.1016/j.semarthrit.2003.09.002 . ПМИД 14671725 .
- ^ «Тест LE-клеток» . Медлайн Плюс . Национальная медицинская библиотека США. Архивировано из оригинала 6 октября 2006 года.
- ^ «Статья о классификации ревматических болезней» . Ревматология.орг. 08.06.2011. Архивировано из оригинала 18 июля 2011 г. Проверено 6 августа 2011 г.
- ^ «Пересмотр диагностических критериев Rheumatology.org» . Ревматология.орг. 08.06.2011. Архивировано из оригинала 18 июля 2011 г. Проверено 6 августа 2011 г.
- ^ Перейти обратно: а б с д и ж г час я дж к л Эдворти С.М., Затарайн Э., МакШейн DJ, Блох Д.А. (октябрь 1988 г.). «Анализ набора данных критериев волчанки ARA 1982 года с использованием методологии рекурсивного разделения: новое понимание относительной ценности отдельных критериев». Журнал ревматологии . 15 (10): 1493–1498. ПМИД 3060613 .
- ^ Вайнштейн А., Бордвелл Б., Стоун Б., Тиббетс С., Ротфилд Н.Ф. (февраль 1983 г.). «Антитела к нативной ДНК и уровням сывороточного комплемента (C3). Применение для диагностики и классификации системной красной волчанки». Американский медицинский журнал . 74 (2): 206–216. дои : 10.1016/0002-9343(83)90613-7 . ПМИД 6600582 .
- ^ «Информационная статья для пациентов UpToDate о ДНК-антителах» . Пациенты.uptodate.com. Архивировано из оригинала 11 октября 2007 г. Проверено 6 августа 2011 г.
- ^ «Общие симптомы волчанки» . Американский фонд волчанки. Архивировано из оригинала 19 апреля 2013 г. Проверено 7 июня 2013 г.
- ^ Перейти обратно: а б Ашерсон Р.А., Сервера Р., де Гроот П.Г., Эркан Д., Боффа М.К., Пиетт Дж.К. и др. (2003). «Катастрофический антифосфолипидный синдром: заявление международного консенсуса по критериям классификации и рекомендациям по лечению». Волчанка . 12 (7): 530–534. дои : 10.1191/0961203303lu394oa . ПМИД 12892393 . S2CID 29222615 .
- ^ Сэнгл С., Д'Круз Д.П., Хьюз Г.Р. (январь 2005 г.). «Сетчатое ливедо и заболеваемость беременных у пациенток, отрицательных по антифосфолипидным антителам» . Анналы ревматических болезней . 64 (1): 147–148. дои : 10.1136/ard.2004.020743 . ПМК 1755191 . ПМИД 15608315 .
- ^ Хьюз Г.Р., Хамашта М.А. (декабрь 2003 г.). «Серонегативный антифосфолипидный синдром» . Анналы ревматических болезней . 62 (12): 1127. doi : 10.1136/ard.2003.006163 . ПМЦ 1754381 . ПМИД 14644846 .
- ^ Хьюз Г. Р. (1998). «Это волчанка? «Альтернативные» критерии больницы Святого Томаса». Клиническая и экспериментальная ревматология . 16 (3): 250–252. ПМИД 9631744 .
- ^ Фернандес Моса Тревисани V, Кастро А.А., Феррейра Невес Нето Дж., Аталлах А.Н. (февраль 2013 г.). «Циклофосфамид в сравнении с метилпреднизолоном для лечения нервно-психических нарушений при системной красной волчанке» . Кокрановская база данных систематических обзоров . 2013 (2): CD002265. дои : 10.1002/14651858.cd002265.pub3 . ПМК 6823222 . ПМИД 23450535 .
- ^ Перейти обратно: а б с д и ж Васудеван А.Р., Гинзлер Э.М. (4 августа 2009 г.). «Установленные и новые методы лечения волчанки» . Журнал скелетно-мышечной медицины . 26 (8). [ постоянная мертвая ссылка ]
- ^ Перейти обратно: а б «FDA одобрило первый новый препарат от волчанки за 56 лет» . Управление по контролю за продуктами и лекарствами . Архивировано из оригинала 3 мая 2011 года . Проверено 6 мая 2011 г.
- ^ Перейти обратно: а б Винсент Ф.Б., Моран Э.Ф., Маккей Ф. (март 2012 г.). «BAFF и врожденный иммунитет: новые терапевтические цели при системной красной волчанке» . Иммунология и клеточная биология . 90 (3): 293–303. дои : 10.1038/icb.2011.111 . ПМИД 22231653 . S2CID 39602817 .
- ^ Мурими-Уорстелл И.Б., Лин Д.Х., Кан Х., Тирс Дж., Ван Х., Наб Х. и др. (март 2021 г.). «Использование медицинских услуг и затраты при системной красной волчанке в зависимости от тяжести заболевания в Соединенных Штатах» . Журнал ревматологии . 48 (3): 385–393. дои : 10.3899/jrheum.191187 . ПМИД 32611669 .
- ^ «Предупреждение FDA: микофенолат мофетил (продается как CellCept) и микофеноловая кислота (продается как Myfortic)» . Управление по контролю за продуктами и лекарствами США. 16 мая 2008 г. Архивировано из оригинала 3 августа 2010 г.
- ^ Родзевич М., Дайболл С., Лант М., Макдональд С., Саттон Е., Паркер Б. и др. (01.05.2023). «Риск раннего заражения у пациентов с системной красной волчанкой, получающих ритуксимаб или белимумаб из Регистра биологических препаратов Британской группы по оценке волчанки (BILAG-BR): проспективное продольное исследование S2665-9913 (23) 00091-7». Журнал «Ланцет по ревматологии» . 5 (5): е284–е292. дои : 10.1016/s2665-9913(23)00091-7 . ISSN 2665-9913 . ПМИД 38251591 . S2CID 258325970 .
- ^ «Новые биологические методы лечения волчанки не увеличивают риск серьезных инфекций» . Доказательства НИХР . 6 декабря 2023 г. doi : 10.3310/nihrevidence_61092 . S2CID 266066283 .
- ^ Суарес-Альмасор М.Э., Белсек Э., Ши Б., Уэллс Г., Тагвелл П. (23 октября 2000 г.). «Циклофосфамид для лечения ревматоидного артрита» . Кокрановская база данных систематических обзоров . 2010 (4): CD001157. дои : 10.1002/14651858.cd001157 . ПМЦ 8407281 . ПМИД 11034702 .
- ^ «Раздаточный материал по здоровью: системная красная волчанка, Национальный институт артрита, скелетно-мышечных и кожных заболеваний, Национальные институты здравоохранения, Министерство здравоохранения и социальных служб США» . Архивировано из оригинала 4 декабря 2010 г. Проверено 13 октября 2010 г.
- ^ «Внутривенные иммуноглобулины (ВВИГ) на центральной станции волчанки, полученные из Национального института артрита, скелетно-мышечных и кожных заболеваний, Национальных институтов здравоохранения, Министерства здравоохранения и социальных служб США» . Архивировано из оригинала 20 октября 2011 г. Проверено 13 октября 2010 г.
- ^ Перейти обратно: а б с Пародис И., Жирар-Гийонвар С., Арно Л., Дистлер О., Домьян А., Энде CH и др. (10 июля 2023 г.). «Рекомендации EULAR по немедикаментозному лечению системной красной волчанки и системной склеродермии» . Анналы ревматических болезней . 83 (6): 720–729. дои : 10.1136/ard-2023-224416 . ISSN 0003-4967 . ПМИД 37433575 . S2CID 259502512 .
- ^ Кочат П., Фарг С., Местралле Г., Юнграйтмайр Т., Кох-Ногейра П., Ранчин Б. и др. (ноябрь 2009 г.). «Рецидив заболевания при трансплантации почки у детей» . Детская нефрология . 24 (11): 2097–2108. дои : 10.1007/s00467-009-1137-6 . ПМЦ 2753770 . ПМИД 19247694 .
- ^ Юнлю О, Зуйли С, Эркан Д (июнь 2016 г.). «Клиническое значение антифосфолипидных антител при системной красной волчанке» . Европейский журнал ревматологии . 3 (2): 75–84. дои : 10.5152/eurjrheum.2015.0085 . ПМК 5042235 . ПМИД 27708976 .
- ^ Перейти обратно: а б с д и ж Данченко Н., Сатиа Дж.А., Энтони М.С. (2006). «Эпидемиология системной красной волчанки: сравнение мирового бремени болезней». Волчанка . 15 (5): 308–318. дои : 10.1191/0961203306lu2305xx . ПМИД 16761508 . S2CID 6465663 .
- ^ «Раздаточный материал по здоровью: системная красная волчанка» . Национальный институт артрита, скелетно-мышечных и кожных заболеваний . Национальные институты здравоохранения. Август 2003 г. Архивировано из оригинала 18 октября 2007 г. Проверено 23 ноября 2007 г.
- ^ «Прогноз и обнадеживающее будущее» . Веб-сайт Американского фонда волчанки . Архивировано из оригинала 20 марта 2011 года . Проверено 14 декабря 2010 г.
- ^ Сингх Р.Р., Йен Е.Ю. (сентябрь 2018 г.). «Смертность от СКВ остается непропорционально высокой, несмотря на улучшения, произошедшие за последнее десятилетие» . Волчанка . 27 (10): 1577–1581. дои : 10.1177/0961203318786436 . ПМК 6082727 . ПМИД 30016928 .
- ^ Перейти обратно: а б «ОМГД|АМГ|Информационные бюллетени|Волчанка» . Архивировано из оригинала 11 января 2009 г. Проверено 15 сентября 2017 г.
- ^ Борджиа Р.Э., Сильверман Э.Д. (сентябрь 2015 г.). «Системная красная волчанка, возникшая в детстве: обновленная информация». Современное мнение в ревматологии . 27 (5): 483–492. doi : 10.1097/bor.0000000000000208 . ПМИД 26200474 . S2CID 27063466 .
- ^ Суле С., Петри М. (2006). «Социально-экономический статус при системной красной волчанке». Волчанка . 15 (11): 720–723. дои : 10.1177/0961203306070008 . ПМИД 17153841 . S2CID 11080101 .
- ^ Перейти обратно: а б с д и ж г Понс-Эстель Г.Дж., Аларкон Г.С., Скофилд Л., Рейнлиб Л., Купер Г.С. (февраль 2010 г.). «Понимание эпидемиологии и прогрессирования системной красной волчанки» . Семинары по артриту и ревматизму . 39 (4): 257–268. дои : 10.1016/j.semarthrit.2008.10.007 . ПМЦ 2813992 . ПМИД 19136143 .
- ^ Ow MY, Ho PC, Thumboo J, Wee HL (ноябрь – декабрь 2010 г.). «Факторы, связанные с использованием медицинских услуг у пациентов с системной красной волчанкой: систематический обзор». Клиническая и экспериментальная ревматология . 28 (6): 892–904. ПМИД 21122271 .
- ^ Перейти обратно: а б Елин Э., Яздани Дж., Тоннер С., Трупин Л., Крисвелл Л.А., Кац П. и др. (март 2015 г.). «Взаимодействие между пациентами, поставщиками услуг и системами здравоохранения и техническое качество медицинской помощи» . Уход и исследование артрита . 67 (3): 417–424. дои : 10.1002/acr.22427 . ПМК 4320034 . ПМИД 25132660 .
- ^ Цокос ГК (декабрь 2011 г.). «Системная красная волчанка». Медицинский журнал Новой Англии . 365 (22): 2110–2121. CiteSeerX 10.1.1.1008.5428 . дои : 10.1056/NEJMra1100359 . ПМИД 22129255 .
- ^ Мусави М.Дж., Махмуди М., Готлу С. (2020). «Бегство от инактивации Х-хромосомы и женской предрасположенности к аутоиммунным заболеваниям» . Молекулярная медицина . 26 (1): 127. дои : 10.1186/s10020-020-00256-1 . ПМЦ 7727198 . ПМИД 33297945 . Искусство. № 127.
- ^ Зандман-Годдард Г., Пеева Э., Шонфельд Ю. (июнь 2007 г.). «Гендер и аутоиммунитет». Обзоры аутоиммунитета . 6 (6): 366–372. дои : 10.1016/j.autrev.2006.10.001 . ПМИД 17537382 .
- ^ Доу Д.Р., Чжао Ю., Белк Дж.А., Чжао Ю., Кейси К.М., Чен Д.С. и др. (2024). «Xist-рибонуклеопротеины способствуют развитию аутоиммунитета по признаку пола у женщин» . Клетка . 187 (3): 733–749.e16. дои : 10.1016/j.cell.2023.12.037 . PMC 10949934. PMID 38306984 .
- ^ Джастис Вайллант А.А., Варакалло М (2019). «артикул-24526». Красная волчанка . Остров сокровищ (Флорида): StatPearls Publishing. ПМИД 30571026 . Проверено 21 декабря 2019 г.
- ^ Американский фонд волчанки. «Какова история волчанки?» . Архивировано из оригинала 4 ноября 2014 года . Проверено 11 октября 2014 г.
- ^ «Определение в Dictionary.com» . Словарь.reference.com. Архивировано из оригинала 26 октября 2012 г. Проверено 24 октября 2012 г.
- ^ «волчанка» . Словарь средневековой латыни из британских источников – через Logeion .
- ^ Фатович-Ференчич С., Голубар К. Ранняя история и иконография красной волчанки. Клин Дерматол. 2004 март-апрель;22(2):100-4. doi : 10.1016/j.clindermatol.2003.12.015 . ПМИД 15234009.
- ^ Томас-младший DE (2014). Энциклопедия волчанки: комплексное руководство для пациентов и их семей . Балтимор, Мэриленд: Издательство Университета Джонса Хопкинса. п. 4. ISBN 978-1-4214-0984-9 .
- ^ Томас-младший DE (2014). Энциклопедия волчанки: комплексное руководство для пациентов и их семей . Балтимор, Мэриленд: Издательство Университета Джонса Хопкинса. п. 463. ИСБН 978-1-4214-0984-9 .
- ^ Филлипс Р.Х. (2012). Борьба с волчанкой: практическое руководство по облегчению проблем, связанных с системной красной волчанкой (4-е изд.). Нью-Йорк, штат Нью-Йорк: The Penguin Group. стр. 11–12 . ISBN 978-1-58333-445-4 .
- ^ Перейти обратно: а б с д Тэлботт Дж. Х. (1966). «Историческая справка о дискоидной и системной красной волчанке». В Дюбуа Э.Л. (ред.). Красная волчанка: обзор текущего статуса дискоидной и системной красной волчанки . Нью-Йорк: МакГроу Хилл. стр. 1–9.
- ^ Гебра Ф (1866 г.). Фагг Ч. (ред.). Болезни кожи, в том числе экзантемы (Том 1-е изд.). Лондон, Англия: Общество Нью-Сиденхема. С. 114–116 .
- ^ Блау С.П., Шульц Д. (1984). Волчанка: Тело против самого себя (2-е изд.). Нью-Йорк: Doubleday & Company Inc., с. 6.
- ^ Ростейн Дж., Каргар С. (1974). «Иммуносупрессия, системная красная волчанка». Ревматология: Ежегодный обзор . 5 (5 томов 1967–1974): 52–53.
- ^ Карр Р.И. (1986). Красная волчанка: Справочник для врачей, пациентов и их семей (2-е изд.). Lupus Foundation of America Inc. с. 3.
- ^ Уоллес диджей (1995). Книга Люпуса . Нью-Йорк: Издательство Оксфордского университета. п. 8 . ISBN 978-0-19-508443-6 .
- ^ Карр Р.И. (1986). Красная волчанка: Справочник для врачей, пациентов и их семей (2-е изд.). Lupus Foundation of America Inc. с. 15.
- ^ Лахита Р.Х. , Филлипс Р.Г. (2004). Вопросы и ответы о волчанке: все, что вам нужно знать (2-е изд.). Нью-Йорк, штат Нью-Йорк: Penguin Group (США). стр. 65–66 . ISBN 978-1-58333-196-5 .
- ^ Филлипс Р.Х. (2012). Борьба с волчанкой: практическое руководство по облегчению проблем, связанных с системной красной волчанкой (4-е изд.). Нью-Йорк, штат Нью-Йорк: The Penguin Group. п. 24 . ISBN 978-1-58333-445-4 .
- ^ Томас-младший DE (2014). Энциклопедия волчанки: комплексное руководство для пациентов и их семей . Балтимор, США: Издательство Университета Джонса Хопкинса. п. 26. ISBN 978-1-4214-0984-9 .
- ^ Томас-младший DE (2014). Энциклопедия волчанки: комплексное руководство для пациентов и их семей . Балтимор, США: Издательство Университета Джонса Хопкинса. стр. 17–21. ISBN 978-1-4214-0984-9 .
- ^ Перейти обратно: а б Хохберг MC (октябрь 1991 г.). «История красной волчанки». Медицинский журнал Мэриленда . 40 (10): 871–873. ПМИД 1943516 .
- ^ Джордан Н., Д'Круз ДП (февраль 2015 г.). «Белимумаб для лечения системной красной волчанки». Экспертное обозрение клинической иммунологии . 11 (2): 195–204. дои : 10.1586/1744666X.2015.996550 . ПМИД 25543845 . S2CID 21559971 .
- ^ Кузен-Франке Дж. (6 марта 2019 г.). «Генетически модифицированные иммунные клетки уничтожают волчанку у мышей» . Наука . АААС . Проверено 8 мая 2019 г.
- ^ Образец I (15 сентября 2022 г.). «Ученые приветствуют прорыв в терапии аутоиммунных заболеваний» . Хранитель . Проверено 18 сентября 2022 г.
- ^ Макенсен А., Мюллер Ф., Мугиакакос Д., Бёльц С., Вильгельм А., Айгнер М. и др. (октябрь 2022 г.). «Анти-CD19 CAR Т-клеточная терапия рефрактерной системной красной волчанки». Природная медицина . 28 (10): 2124–2132. дои : 10.1038/s41591-022-02017-5 . ПМИД 36109639 . S2CID 252309312 .
- ^ Уилсон Дж. (16 августа 2012 г.). «Битва олимпийского футболиста Шеннон Бокс с волчанкой» . CNN . Проверено 29 января 2023 г.
- ^ «Мужские лица волчанки» . www.vice.com . 5 января 2017 года . Проверено 29 января 2023 г.
- ^ Социальная драма в социальных сетях
- ^ «Как волчанка Селены Гомес привела к пересадке почки | Американский фонд волчанки» .
- ^ «Салли Хокинс» . Люпус Траст, Великобритания . 6 декабря 2017 г.
- ^ О'Коннор Ф (1979). Фицджеральд С. (ред.). Привычка быть: письма Фланнери О'Коннор . Фаррар, Штраус и Жиру . п. 40. ИСБН 978-0-374-52104-2 . (письмо Салли Фицджеральд, без даты, лето 1952 г.)
- ^ Розенберг А. (2 февраля 2016 г.). «Чтобы понять Майкла Джексона и его кожу, нужно выйти за рамки расы» . Вашингтон Пост . Проверено 17 сентября 2019 г.
- ^ Эванс М. (5 июля 2018 г.). «Сил рассказывает о битве с волчанкой, когда он объединяется с Майлин Класс и Найлом Роджерсом для создания благотворительного сингла NHS» . Метро . Проверено 15 октября 2023 г.