Болезнь «трансплантат против хозяина»
| Болезнь «трансплантат против хозяина» | |
|---|---|
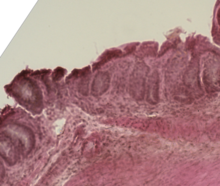 | |
| Толстая кишка мыши поражена острой болезнью «трансплантат против хозяина» | |
| Специальность | Экстренная медицина |
Реакция «трансплантат против хозяина» ( РТПХ ) — синдром , характеризующийся воспалением в различных органах. РТПХ обычно ассоциируется с трансплантацией костного мозга и стволовых клеток .
Лейкоциты иммунной системы донора, оставшиеся в донорской ткани (трансплантате), распознают реципиента (хозяина) как чужеродного (чужого). Лейкоциты, присутствующие в трансплантированной ткани, затем атакуют клетки организма реципиента, что приводит к РТПХ. Это не следует путать с отторжением трансплантата , которое происходит, когда иммунная система реципиента трансплантата отторгает пересаженную ткань; РТПХ возникает, когда лейкоциты иммунной системы донора отторгают реципиента. Основной принцип ( аллоиммунитет ) тот же, но детали и течение могут отличаться.
РТПХ также может возникнуть после переливания крови , известное как реакция «трансплантат против хозяина», связанная с переливанием крови , или ТА-РТПХ, если используемые продукты крови не подвергались гамма-облучению или не обрабатывались одобренной системой снижения лейкоцитов . В отличие от РТПХ, связанного с трансплантацией органов/тканей, частота ТА-РТПХ увеличивается при совпадении HLA (первой степени родства или близких родственниках). [1]
Типы [ править ]

В клинических условиях реакция «трансплантат против хозяина» делится на острую и хроническую формы и оценивается в зависимости от пораженной ткани и тяжести реакции. [3] [4]
В классическом понимании острая реакция «трансплантат против хозяина» характеризуется избирательным поражением печени , кожи ( сыпь), слизистых оболочек и желудочно-кишечного тракта . Новые исследования показывают, что другие органы-мишени реакции «трансплантат против хозяина» включают саму иммунную систему ( кроветворную систему , например, костный мозг и тимус ) и легкие в форме иммуноопосредованного пневмонита . [5] Биомаркеры могут использоваться для выявления конкретных причин РТПХ, таких как элафин в коже. [6] Хроническая реакция «трансплантат против хозяина» также поражает вышеуказанные органы, но при длительном течении может также вызывать повреждение соединительной ткани и экзокринных желез . [7]
Повреждение слизистой оболочки влагалища может привести к сильной боли и образованию рубцов и проявляется как при острой, так и при хронической РТПХ. Это может привести к невозможности полового акта . [8]
Острый [ править ]
Острая или форма заболевания ( молниеносная оРТПХ) обычно наблюдается в течение первых 10–100 дней после трансплантации. [9] [10] и представляет собой серьезную проблему для трансплантации из-за связанной с этим заболеваемости и смертности. [11] Примерно от одной трети до половины реципиентов аллогенных трансплантатов разовьется острая РТПХ. [10] Это менее распространено у более молодых пациентов и у пациентов с более близкими совпадениями человеческих лейкоцитарных антигенов (HLA) между донором и пациентом. [10]
Первыми признаками обычно являются сыпь, жжение и покраснение кожи на ладонях и подошвах. Это может распространиться по всему телу. Другие симптомы могут включать тошноту, рвоту, спазмы желудка, диарею (водянистую, а иногда и кровавую), потерю аппетита, желтуху, боли в животе и потерю веса. [10]
Острая РТПХ желудочно-кишечного тракта может привести к тяжелому воспалению кишечника, отторжению слизистой оболочки, тяжелой диарее, болям в животе, тошноте и рвоте. [12] Обычно это диагностируется с помощью биопсии кишечника. У пациентов с острым заболеванием РТПХ печени измеряется по уровню билирубина. [13] Кожная РТПХ приводит к появлению диффузной красной пятнисто-папулезной сыпи . [14] иногда с кружевным узором.
Острая РТПХ классифицируется следующим образом: общая степень (кожа-печень-кишечник), при этом каждый орган оценивается индивидуально от низкой 1 до высокой 4. Пациенты с IV степенью РТПХ обычно имеют плохой прогноз. Если РТПХ тяжелая и для контроля требуется интенсивная иммуносупрессия с использованием стероидов и дополнительных препаратов, у пациента могут развиться тяжелые инфекции. [12] в результате иммуносупрессии и может умереть от инфекции. Однако исследование 2016 года показало, что прогноз для пациентов с РТПХ IV степени за последние годы улучшился. [15]
Хронический [ править ]
Хроническая . форма реакции «трансплантат против хозяина» (cGvHD) обычно начинается через 90–600 дней после трансплантации [10] Появление умеренных и тяжелых случаев хРТПХ отрицательно влияет на долгосрочную выживаемость. [16]
Первым симптомом ХРТПХ обычно является сыпь на ладонях рук или подошвах ног. Сыпь может распространяться и обычно бывает зудящей и сухой. В тяжелых случаях кожа может покрываться волдырями и шелушиться, как при сильном солнечном ожоге. Также может развиться лихорадка. Другие симптомы хронической РТПХ могут включать: [10]
- Снижение аппетита
- Диарея
- Спазмы в животе (животе)
- Потеря веса
- Пожелтение кожи и глаз (желтуха)
- Увеличенная печень
- Вздутый живот (живот)
- Боль в верхней правой части живота (живота)
- Повышенный уровень печеночных ферментов в крови (видно по анализам крови)
- Кожа, которая чувствует себя стянутой
- Сухие, горящие глаза
- Сухость или болезненные язвы во рту.
- Ощущение жжения при употреблении кислой пищи
- Бактериальные инфекции
- Закупорка мелких дыхательных путей легких
В полости рта хроническая реакция «трансплантат против хозяина» проявляется в виде красного плоского лишая с более высоким риском злокачественной трансформации в плоскоклеточный рак полости рта. [17] по сравнению с классическим плоским лишаем полости рта. Рак полости рта, связанный с реакцией «трансплантат против хозяина», может иметь более агрессивное поведение с худшим прогнозом по сравнению с раком полости рта у пациентов, не перенесших трансплантацию гемопоэтических стволовых клеток. [15]
Причины [ править ]

Для возникновения РТПХ необходимо соблюдение трех критериев, известных как критерии Биллингема. [18]
- трансплантат с жизнеспособными и функциональными иммунными клетками. иммунокомпетентный Вводится
- Реципиент иммунологически отличается от донора – гистонесовместим .
- Реципиент имеет ослабленный иммунитет и поэтому не может уничтожить или инактивировать трансплантированные клетки. реципиента В частности, это связано с неспособностью клеточного иммунитета разрушать или инактивировать жизнеспособные лимфоциты донора. [19]
После трансплантации костного мозга Т-клетки , присутствующие в трансплантате либо в виде контаминантов, либо намеренно введенные в организм хозяина, атакуют ткани реципиента трансплантата после того, как воспринимают ткани хозяина как антигенно чужеродные. Т-клетки производят избыток цитокинов , включая TNF-α и интерферон-гамма (IFNγ). Широкий спектр антигенов хозяина может инициировать реакцию «трансплантат против хозяина», в том числе человеческие лейкоцитарные антигены (HLA). [20] Однако реакция «трансплантат против хозяина» может возникнуть даже в том случае, если донорами являются HLA-идентичные братья и сестры. [21] HLA-идентичные братья и сестры или HLA-идентичные неродственные доноры часто имеют генетически разные белки (называемые минорными антигенами гистосовместимости ), которые могут быть презентированы молекулами главного комплекса гистосовместимости (MHC) Т-клеткам донора, которые воспринимают эти антигены как чужеродные и таким образом устанавливают иммунный ответ. [22]
Антигенами, наиболее ответственными за потерю трансплантата, являются HLA-DR (первые шесть месяцев), HLA-B (первые два года) и HLA-A (долгосрочная выживаемость). [23]
реципиента Хотя донорские Т-клетки нежелательны в качестве эффекторных клеток реакции «трансплантат против хозяина», они ценны для приживления, предотвращая отторжение остаточной иммунной системой трансплантата костного мозга ( хозяин против трансплантата ). Кроме того, поскольку трансплантация костного мозга часто используется для лечения рака , главным образом лейкозов , донорские Т-клетки доказали свою эффективность в борьбе «трансплантат против опухоли » . [24] Большая часть текущих исследований по аллогенной трансплантации костного мозга включает попытки отделить нежелательные аспекты реакции «трансплантат против хозяина» в физиологии Т-клеток от желательного эффекта «трансплантат против опухоли» . [25]
- ассоциированная Трансфузионно РТПХ
Этот тип РТПХ связан с переливанием необлученной крови реципиентам с ослабленным иммунитетом. Это также может произойти в ситуациях, когда донор крови гомозиготен , а реципиент гетерозиготен по HLA гаплотипу . Оно связано с более высокой смертностью (80–90%) из-за поражения лимфоидной ткани костного мозга, однако клинические проявления аналогичны РТПХ, возникающему в результате трансплантации костного мозга. В современной медицине трансфузионно-ассоциированная РТПХ встречается редко. Его почти полностью можно предотвратить путем контролируемого облучения продуктов крови с целью инактивации находящихся внутри лейкоцитов (включая лимфоциты). [26]
Трансплантация тимуса [ править ]
Можно сказать, что трансплантация тимуса способна вызвать особый тип РТПХ, поскольку тимоциты реципиента будут использовать донорские клетки тимуса в качестве моделей при прохождении отрицательного отбора для распознавания аутоантигенов и, следовательно, все равно могут ошибаться в собственных структурах в остальных случаях. тело для того, чтобы быть безличным. Это скорее косвенная РТПХ, поскольку ее вызывают не непосредственно клетки в самом трансплантате, а клетки в трансплантате, которые заставляют Т-клетки реципиента действовать как Т-клетки донора. его можно рассматривать как мультиорганный аутоиммунитет . В экспериментах по ксенотрансплантации тимуса между разными видами [27] Аутоиммунное заболевание является частым осложнением после аллогенной трансплантации тимуса человека и обнаруживается у 42% субъектов в течение года после трансплантации. [28] Однако частично это объясняется тем, что само показание, то есть полный синдром ДиДжорджа , увеличивает риск аутоиммунного заболевания. [29]
Мультиорганный аутоиммунитет, ассоциированный с тимомой ТАМА ( )
РТПХ-подобное заболевание, называемое мультиорганным аутоиммунитетом, связанным с тимомой У пациентов с тимомой может возникнуть (ТАМА). У этих пациентов, а не донор, являющийся источником патогенных Т-клеток, собственный злокачественный тимус пациента производит самонаправленные Т-клетки. Это связано с тем, что злокачественный тимус не способен соответствующим образом обучать развивающиеся тимоциты элиминации аутореактивных Т-клеток. В результате возникает заболевание, практически неотличимое от РТПХ. [30]
Механизм [ править ]
Патофизиология РТПХ включает три фазы: [31]
- Афферентная фаза: активация АПК ( антигенпредставляющих клеток ).
- Эфферентная фаза: активация, пролиферация, дифференцировка и миграция эффекторных клеток.
- Эффекторная фаза: разрушение ткани-мишени
Активация АПК происходит на первой стадии РТПХ. До трансплантации гемопоэтических стволовых клеток лучевая или химиотерапия приводит к повреждению и активации тканей хозяина, особенно слизистой оболочки кишечника. Это позволяет микробным продуктам проникать и стимулировать провоспалительные цитокины, такие как IL-1 и TNF-α . Эти провоспалительные цитокины увеличивают экспрессию MHC и молекул адгезии на APC, тем самым увеличивая способность APC презентировать антиген. [32] Вторая фаза характеризуется активацией эффекторных клеток. Активация донорских Т-клеток дополнительно усиливает экспрессию MHC и молекул адгезии, хемокинов, а также экспансию CD8+ и CD4+ Т-клеток и гостевых B-клеток. На заключительной фазе эти эффекторные клетки мигрируют к органам-мишеням и опосредуют повреждение тканей, что приводит к полиорганной недостаточности. [33]
Профилактика [ править ]
- Типирование тканей на основе ДНК позволяет более точно сопоставить HLA между донорами и пациентами, перенесшими трансплантацию, что, как было доказано, снижает частоту и тяжесть РТПХ и увеличивает долгосрочную выживаемость. [34]
- Т-клетки пуповинной крови (УКБ) обладают присущей им иммунологической незрелостью. [35] а использование стволовых клеток UCB при трансплантации неродственных доноров снижает частоту и тяжесть РТПХ. [36]
- Метотрексат , циклоспорин и такролимус являются распространенными препаратами, используемыми для профилактики РТПХ. [37] Необходимы дальнейшие исследования, чтобы оценить, можно ли также использовать мезенхимальные стромальные клетки для профилактики. [38]
- Реакции «трансплантат против хозяина» можно в значительной степени избежать, выполнив трансплантацию костного мозга, обедненного Т-клетками. Однако за эти типы трансплантатов приходится уменьшать эффект «трансплантат против опухоли», повышать риск неудачного приживления или рецидива рака. [39] и общий иммунодефицит , в результате чего пациент становится более восприимчивым к вирусным , бактериальным и грибковым инфекциям . В многоцентровом исследовании безрецидивная выживаемость в течение трех лет не отличалась между трансплантатами с истощением Т-клеток и трансплантацией с избытком Т-клеток. [40]
Лечение [ править ]
Глюкокортикоиды [ править ]
Внутривенное введение глюкокортикоидов , таких как преднизолон , является стандартом лечения острой РТПХ. [11] и хроническая РТПХ. [41] Использование этих глюкокортикоидов предназначено для подавления опосредованного Т-клетками иммунного нападения на ткани хозяина; однако в высоких дозах такое подавление иммунитета повышает риск инфекций и рецидива рака. Таким образом, желательно снизить высокие дозы стероидов после трансплантации до более низких уровней, после чего появление легкой РТПХ может быть желанным, особенно у пациентов с несоответствующим HLA-сочетанием, поскольку это обычно связано с трансплантацией трансплантата. противоопухолевый эффект. [ нужна ссылка ] .Хотя глюкокортикоиды остаются первой линией лечения острой РТПХ, только около 50% пациентов отвечают на лечение, в противном случае у них имеется стероидорефрактерная РТПХ (СР-РТПХ). [42] В последнее время изучается все больше вариантов лечения СР-РТПХ, таких как экстракорпоральный фотоферез (ЭКФ), мезенхимальные стволовые клетки (МСК), фекальная микробная трансплантация (ФМТ) и препарат руксолитиниб. [42]
Стероид-сберегающая иммуномодуляция иммуносупрессия /
Циклоспорин и такролимус являются ингибиторами кальциневрина . Вещества структурно различны, но имеют одинаковый механизм действия. Циклоспорин связывается с цитозольным белком пептидил-пролил-цис-транс-изомеразой А (известным как циклофилин), тогда как такролимус связывается с цитозольным белком пептидил-пролил-цис-транс-изомеразой FKBP12. Эти комплексы ингибируют кальциневрин, блокируют дефосфорилирование транскрипционного фактора NFAT активированных Т-клеток и его транслокацию в ядро. [43] Стандартная профилактика включает применение циклоспорина в течение шести месяцев с метотрексатом. Уровень циклоспорина следует поддерживать выше 200 нг/мл. [44]
Другие вещества, которые изучались для лечения РТПХ, включают, например: сиролимус , пентостатин , этанерцепт и алемтузумаб . [44]
В августе 2017 года FDA США одобрило ибрутиниб для лечения хронической РТПХ после неэффективности одного или нескольких других системных методов лечения. [45]
Клинические исследования
В настоящее время или недавно завершено большое количество клинических исследований по изучению лечения и профилактики реакции «трансплантат против хозяина». [46]
17 мая 2012 года Osiris Therapeutics объявила, что канадские регулирующие органы здравоохранения одобрили Prochymal , ее препарат для лечения острой реакции «трансплантат против хозяина» у детей, которые не ответили на лечение стероидами. Прохимал — первый препарат на основе стволовых клеток , одобренный для лечения системных заболеваний. [47]
В январе 2016 года компания Mesoblast опубликовала результаты второй фазы клинического исследования с участием 241 ребенка с острой формой реакции «трансплантат против хозяина», которая не реагировала на стероиды. [48] Испытание проводилось по терапии мезенхимальными стволовыми клетками, известной как реместемцел-L или MSC-100-IV. Выживаемость составила 82% (против 39% контрольной группы) для тех, кто показал некоторое улучшение через месяц, и в долгосрочной перспективе 72% (против 18% контрольной группы) для тех, у кого эффект был незначительным через месяц. [48]
ВИЧ Элиминация
Реакция «трансплантат против хозяина» способствовала ликвидации нескольких случаев ВИЧ, в том числе «Берлинского пациента» и шести других случаев в Испании. [49]
См. также [ править ]
Ссылки [ править ]
- ^ Уильямсон, Лорна М. (1 сентября 1998 г.). «Болезнь трансплантат против хозяина, связанная с переливанием крови, и ее профилактика» . Сердце . 80 (3): 211–212. дои : 10.1136/hrt.80.3.211 . ISSN 1355-6037 . ПМК 1761088 . ПМИД 9875072 .
- ^ Гимир С., Вебер Д., Мавин Э., Ван К.С., Дикинсон А.М., Холлер Э. (2017). «Патофизиология РТПХ и других серьезных осложнений, связанных с ТГСК» . Границы в иммунологии . 8 : 79. дои : 10.3389/fimmu.2017.00079 . ПМЦ 5357769 . ПМИД 28373870 .
- ^ Мартино Р., Ромеро П., Субира М., Беллидо М., Альтес А., Суреда А. и др. (август 1999 г.). «Сравнение классических критериев Глюксберга и индекса тяжести IBMTR для оценки острой реакции трансплантат против хозяина после HLA-идентичной трансплантации родственных стволовых клеток. Международный реестр трансплантаций костного мозга» . Трансплантация костного мозга . 24 (3): 283–7. дои : 10.1038/sj.bmt.1701899 . ПМИД 10455367 . S2CID 24811357 .
- ^ Филипович А.Х., Вайсдорф Д., Павлетич С., Сосье Дж., Вингард Дж.Р., Ли С.Дж. и др. (декабрь 2005 г.). «Проект разработки консенсуса Национальных институтов здравоохранения по критериям клинических исследований хронической реакции трансплантат против хозяина: I. Отчет рабочей группы по диагностике и постановке» . Биология трансплантации крови и костного мозга . 11 (12): 945–56. дои : 10.1016/j.bbmt.2005.09.004 . ПМЦ 4329079 . ПМИД 16338616 .
- ^ Морисс-Прадье Х., Нове-Жоссеранд Р., Филит Ф., Сенешаль А., Бергер Ф., Калле-Баучю Э. и др. (февраль 2016 г.). «[Болезнь трансплантат против хозяина, редкое осложнение трансплантации легких]». Revue de Pneumologie Clinique . 72 (1): 101–7. дои : 10.1016/j.pneumo.2015.05.004 . ПМИД 26209034 .
- ^ Пачесны С., Браун Т.М., Левин Дж.Э., Хоган Дж., Кроуфорд Дж., Коффинг Б. и др. (январь 2010 г.). «Элафин является биомаркером реакции трансплантат против хозяина кожи» . Наука трансляционной медицины . 2 (13): 13–14. дои : 10.1016/j.bbmt.2008.12.039 . ПМК 2895410 . ПМИД 20371463 .
- ^ Огава Ю., Шиммура С., Догру М., Цубота К. (ноябрь 2010 г.). «Иммунные процессы и патогенный фиброз при хронической реакции трансплантат против хозяина глаза и клинические проявления после аллогенной трансплантации гемопоэтических стволовых клеток». Роговица . 29 Приложение 1 (ноябрьское приложение 1): S68-77. doi : 10.1097/ICO.0b013e3181ea9a6b . ПМИД 20935546 . S2CID 39209313 .
- ^ Спирида Л.Б., Лауфер М.Р., Сойффер Р.Дж., Антин Дж.А. (декабрь 2003 г.). «Болезнь «трансплантат против хозяина» вульвы и/или влагалища: диагностика и лечение» . Биология трансплантации крови и костного мозга . 9 (12): 760–5. дои : 10.1016/j.bbmt.2003.08.001 . ПМИД 14677115 .
- ^ Функе В.А., Морейра MC, Вигорито AC (октябрь 2016 г.). «Острая и хроническая реакция трансплантат против хозяина после трансплантации гемопоэтических стволовых клеток» . Журнал Бразильской медицинской ассоциации . 62 (приложение 1): 44–50. дои : 10.1590/1806-9282.62.suppl1.44 . ПМИД 27982319 .
- ^ Jump up to: Перейти обратно: а б с д и ж «Побочные эффекты трансплантации стволовых клеток или костного мозга» . www.cancer.org . Проверено 1 сентября 2020 г.
- ^ Jump up to: Перейти обратно: а б Гокер Х., Хазнедароглу И.С., Чао, Нью-Джерси (март 2001 г.). «Острая реакция трансплантат против хозяина: патобиология и лечение» . Экспериментальная гематология . 29 (3): 259–77. дои : 10.1016/S0301-472X(00)00677-9 . ПМИД 11274753 .
- ^ Jump up to: Перейти обратно: а б «Болезнь трансплантат против хозяина» . МедлайнПлюс . Национальная медицинская библиотека . Проверено 6 мая 2019 г.
- ^ Крейчи М., Камеландер Дж., Поспишил З., Майер Дж. (2012). «Кинетика билирубина и ферментов печени полезна для прогнозирования реакции «трансплантат против хозяина»» . Новообразование . 59 (3): 264–8. дои : 10.4149/neo_2012_034 . ПМИД 22296496 .
- ^ Фейто-Родригес М., де Лукас-Лагуна Р., Гомес-Фернандес С., Сендагорта-Кудос Е., Коллантес Е., Беато М.Дж., Болуда Э.Р. (2013). «Кожный трансплантат против хозяина при педиатрической мультивисцеральной трансплантации». Детская дерматология . 30 (3): 335–41. дои : 10.1111/j.1525-1470.2012.01839.x . ПМИД 22957989 . S2CID 25151282 .
- ^ Jump up to: Перейти обратно: а б Эль-Джавахри А., Ли С., Антин Дж.Х., Спитцер Т.Р., Арманд П.А., Корет Дж. и др. (май 2016 г.). «Повышение смертности, связанной с лечением, и общей выживаемости пациентов с острой РТПХ IV степени в современные годы» . Биология трансплантации крови и костного мозга . 22 (5): 910–8. дои : 10.1016/j.bbmt.2015.12.024 . ПМИД 26748160 .
- ^ Ли С.Дж., Фогельсанг Дж., Flowers ME (апрель 2003 г.). «Хроническая болезнь трансплантат против хозяина» . Биология трансплантации крови и костного мозга . 9 (4): 215–33. дои : 10.1053/bbmt.2003.50026 . ПМИД 12720215 .
- ^ Цукада С., Итонага Х., Тагучи Дж., Миёси Т., Хаяшида С., Сато С. и др. (2019). «[Плоскоклеточный рак десны, диагностированный по поводу остеонекроза челюсти у пациента с хронической РТПХ]». [Ринсё Кецуэки] Японский журнал клинической гематологии . 60 (1): 22–27. дои : 10.11406/rinketsu.60.22 . ПМИД 30726819 .
- ^ Биллингем Р.Э. (1966). «Биология реакций трансплантат против хозяина». Лекции Харви . 62 (62): 21–78. ПМИД 4875305 .
- ^ Ясуда Х., Ото Х., Абэ Р. (1993). «Механизм трансфузионно-ассоциированной реакции трансплантат против хозяина» . Фукусима J Med Sci . 39 (2): 69–75. ПМИД 7927137 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Канда Дж. (сентябрь 2013 г.). «Влияние несоответствия HLA на острую реакцию трансплантат против хозяина» . Международный журнал гематологии . 98 (3): 300–8. дои : 10.1007/s12185-013-1405-x . ПМИД 23893313 . S2CID 1585777 .
- ^ Бонифази Ф., Солано С., Вольшке С., Сесса М., Патриарка Ф., Заллио Ф. и др. (февраль 2019 г.). «Профилактика острой РТПХ плюс ATLG после миелоаблативной аллогенной трансплантации гемопоэтических стволовых клеток периферической крови от HLA-идентичных братьев и сестер у пациентов с острым миелоидным лейкозом в стадии ремиссии: окончательные результаты качества жизни и анализ долгосрочных результатов рандомизированного исследования фазы 3». «Ланцет». Гематология . 6 (2): е89–е99. дои : 10.1016/S2352-3026(18)30214-X . hdl : 10138/311714 . ПМИД 30709437 . S2CID 73449161 .
- ^ Тейлор С.Дж., Болтон Э.М., Брэдли Дж.А. (август 2011 г.). «Иммунологические соображения по банкированию эмбриональных и индуцированных плюрипотентных стволовых клеток» . Философские труды Лондонского королевского общества. Серия Б, Биологические науки . 366 (1575): 2312–22. дои : 10.1098/rstb.2011.0030 . ПМК 3130422 . ПМИД 21727137 .
- ^ Соломон С., Питосси Ф., Рао М.С. (февраль 2015 г.). «Банковское обслуживание iPSC – возможно ли и стоит ли оно того? » Обзоры и отчеты о стволовых клетках . 11 (1): 1–10. дои : 10.1007/s12015-014-9574-4 . ПМЦ 4333229 . ПМИД 25516409 .
- ^ Фалькенбург Дж. Х., Джедема I (декабрь 2017 г.). «Эффект трансплантата против опухоли и почему у людей случается рецидив» . Гематология. Американское общество гематологии. Образовательная программа . 2017 (1): 693–698. doi : 10.1182/asheducation-2017.1.693 . ПМК 6142614 . ПМИД 29222323 .
- ^ Сунь К., Ли М., Сэйерс Т.Дж., Вельняк Л.А., Мерфи У.Дж. (август 2008 г.). «Дифференциальное влияние цитокинов донорских Т-клеток на исход при непрерывном применении бортезомиба после аллогенной трансплантации костного мозга» . Кровь . 112 (4): 1522–9. дои : 10.1182/blood-2008-03-143461 . ПМК 2515132 . ПМИД 18539902 .
- ^ Морофф Г., Лейтман С.Ф., Любан Н.Л. (октябрь 1997 г.). «Принципы облучения крови, валидация дозы и контроль качества» . Переливание . 37 (10): 1084–92. дои : 10.1046/j.1537-2995.1997.371098016450.x . ПМИД 9354830 . S2CID 7462268 .
- ^ Ся Г, Гебельс Дж, Рутгертс О, Вандепутте М, Ваер М (февраль 2001 г.). «Трансплантационная толерантность и аутоиммунитет после ксеногенной трансплантации тимуса» . Журнал иммунологии . 166 (3): 1843–54. doi : 10.4049/jimmunol.166.3.1843 . ПМИД 11160231 . S2CID 24007739 .
- ^ Маркерт М.Л., Девлин Б.Х., Маккарти Э.А., Чинн И.К., Хейл Л.П. (2008). «Трансплантация тимуса» . В Lavini C, Moran CA, Morandi U и др. (ред.). Патология вилочковой железы: клинико-диагностические и терапевтические особенности . стр. 255–267. дои : 10.1007/978-88-470-0828-1_30 . ISBN 978-88-470-0827-4 . S2CID 219575147 .
- ^ Маркерт М.Л., Девлин Б.Х., Алексиев М.Дж., Ли Дж., Маккарти Э.А., Гуптон С.Е. и др. (май 2007 г.). «Обзор 54 пациентов с полной аномалией ДиДжорджа, включенных в протоколы трансплантации тимуса: результат 44 последовательных трансплантаций» . Кровь . 109 (10): 4539–47. дои : 10.1182/blood-2006-10-048652 . ПМК 1885498 . ПМИД 17284531 .
- ^ Вадхера А., Маверакис Э., Мициадес Н., Лара П.Н., Фунг М.А., Линч П.Дж. (октябрь 2007 г.). «Мультиорганный аутоиммунитет, связанный с тимомой: болезнь типа трансплантат против хозяина». Журнал Американской академии дерматологии . 57 (4): 683–9. дои : 10.1016/j.jaad.2007.02.027 . ПМИД 17433850 .
- ^ Насереддин С., Рафей Х., Эльбахеш Э., Таббара I (апрель 2017 г.). «Против болезни хозяина: всесторонний обзор» . Противораковые исследования . 37 (4): 1547–1555. doi : 10.21873/anticanres.11483 . ПМИД 28373413 .
- ^ Ронкароло М.Г., Батталья М. (август 2007 г.). «Регуляторная Т-клеточная иммунотерапия толерантности к аутоантигенам и аллоантигенам у человека». Обзоры природы. Иммунология . 7 (8): 585–98. дои : 10.1038/nri2138 . ПМИД 17653126 . S2CID 7043844 .
- ^ Чжан Л., Чу Дж., Ю Дж., Вэй В. (февраль 2016 г.). «Клеточные и молекулярные механизмы реакции трансплантат против хозяина» . Журнал биологии лейкоцитов . 99 (2): 279–87. дои : 10.1189/jlb.4ru0615-254rr . ПМИД 26643713 . S2CID 25250676 .
- ^ Моришима И., Сасадзуки Т., Иноко Х., Джуджи Т., Аказа Т., Ямамото К. и др. (июнь 2002 г.). «Клиническое значение совместимости аллелей человеческого лейкоцитарного антигена (HLA) у пациентов, получивших трансплантат костного мозга от серологически совпадающих по HLA-A, HLA-B и HLA-DR неродственных доноров». Кровь . 99 (11): 4200–6. дои : 10.1182/blood.V99.11.4200 . ПМИД 12010826 . S2CID 6859250 .
- ^ Гревал С.С., Баркер Дж.Н., Дэвис С.М., Вагнер Дж.Э. (июнь 2003 г.). «Трансплантация гемопоэтических клеток неродственного донора: костного мозга или пуповинной крови?». Кровь . 101 (11): 4233–44. дои : 10.1182/кровь-2002-08-2510 . ПМИД 12522002 . S2CID 6486524 .
- ^ Лафлин М.Дж., Баркер Дж., Бамбах Б., Кок О.Н., Рицциери Д.А., Вагнер Дж.Э. и др. (июнь 2001 г.). «Гематопоэтическое приживление и выживаемость у взрослых реципиентов пуповинной крови от неродственных доноров» . Медицинский журнал Новой Англии . 344 (24): 1815–22. дои : 10.1056/NEJM200106143442402 . ПМИД 11407342 .
- ^ Тёрлен Дж., Рингден О., Гарминг-Легерт К., Юнгман П., Виниарски Дж., Ремес К. и др. (ноябрь 2016 г.). «Проспективное рандомизированное исследование, сравнивающее циклоспорин/метотрексат и такролимус/сиролимус в качестве профилактики реакции «трансплантат против хозяина» после аллогенной трансплантации гемопоэтических стволовых клеток» . Гематологическая . 101 (11): 1417–1425. дои : 10.3324/haematol.2016.149294 . ПМЦ 5394879 . ПМИД 27662016 .
- ^ Фишер С.А., Катлер А., Дори С., Бранскилл С.Дж., Стэнворт С.Дж., Наваррете С., Гердлстоун Дж. и др. (Кокрейновская группа по гематологическим злокачественным новообразованиям) (январь 2019 г.). «Мезенхимальные стромальные клетки как лечение или профилактика острой или хронической реакции трансплантат против хозяина у реципиентов трансплантата гемопоэтических стволовых клеток (ТГСК) с гематологическими заболеваниями» . Кокрановская база данных систематических обзоров . 1 (1): CD009768. дои : 10.1002/14651858.CD009768.pub2 . ПМК 6353308 . ПМИД 30697701 .
- ^ Хейл Дж., Вальдманн Х. (май 1994 г.). «Контроль реакции трансплантат против хозяина и отторжение трансплантата путем истощения Т-клеток донора и реципиента с помощью антител Campath-1. Результаты подходящих трансплантатов братьев и сестер при злокачественных заболеваниях». Трансплантация костного мозга . 13 (5): 597–611. ПМИД 8054913 .
- ^ Вагнер Дж. Э., Томпсон Дж. С., Картер С. Л., Кернан Н. А. (2005). «Влияние профилактики реакции «трансплантат против хозяина» на 3-летнюю выживаемость без болезней у реципиентов костного мозга неродственного донора (исследование истощения Т-клеток): многоцентровое рандомизированное исследование фазы II-III». Ланцет . 366 (9487): 733–41. дои : 10.1016/S0140-6736(05)66996-6 . ПМИД 16125590 . S2CID 33732870 .
- ^ Менилло С.А., Голдберг С.Л., Маккирнан П., Пекора А.Л. (октябрь 2001 г.). «Внутриротовое ультрафиолетовое облучение псораленом А (ПУВА) лечение рефрактерной оральной хронической болезни трансплантат против хозяина после аллогенной трансплантации стволовых клеток» . Трансплантация костного мозга . 28 (8): 807–8. дои : 10.1038/sj.bmt.1703231 . ПМИД 11781637 . S2CID 27292769 .
- ^ Jump up to: Перейти обратно: а б Флинн, Эшлинг М; Дженнери, Эндрю Р. (06 марта 2023 г.). «Последние достижения в области реакции трансплантат против хозяина» . Обзоры факультетов . 12 :4. дои : 10.12703/r/12-4 . ISSN 2732-432X . ПМЦ 10009889 . ПМИД 36923700 .
- ^ Лю Дж., Фармер Дж.Д., Лейн В.С., Фридман Дж., Вайсман И., Шрайбер С.Л. (август 1991 г.). «Кальцинеурин является общей мишенью комплексов циклофилин-циклоспорин А и FKBP-FK506». Клетка . 66 (4): 807–15. дои : 10.1016/0092-8674(91)90124-h . ПМИД 1715244 . S2CID 22094672 .
- ^ Jump up to: Перейти обратно: а б Манданас РА. «Лечение и лечение болезни «трансплантат против хозяина: медицинская помощь»» . Медскейп . Проверено 30 августа 2017 г.
- ^ Исследования, Центр оценки лекарств и (9 февраля 2019 г.). «FDA расширяет показания к применению ибрутиниба при хронической РТПХ» . FDA – через www.fda.gov.
- ^ «Поиск: реакция «трансплантат против хозяина» — результаты списка — ClinicalTrials.gov» . www.clinicaltrials.gov .
- ^ «В Канаде получено первое в мире одобрение препарата на основе стволовых клеток» . Обзор национального законодательства . Дринкер Биддл и Рит ЛЛП. 12 июня 2012 г. Проверено 1 июля 2012 г.
- ^ Jump up to: Перейти обратно: а б «Повышение выживаемости с использованием клеток MSB у детей с РТПХ» . Проверено 22 февраля 2016 г.
- ^ «Иммунная война с донорскими клетками после трансплантации может уничтожить ВИЧ» . ? . НовыйУченый. 03 мая 2017 г. Проверено 23 ноября 2018 г.
Дальнейшее чтение [ править ]
- Феррара JLM, Диг Х.Дж., Буракофф С.Дж. Болезнь «трансплантат против хозяина»: иммунология, патофизиология и лечение. Марсель Деккер, 1990 г. ISBN 0-8247-9728-0
- Полсдорфер, Дж. Р. Медицинская энциклопедия Гейла: болезнь «трансплантат против хозяина»