Центральная толерантность
В иммунологии , центральная толерантность (также известная как негативный отбор ) — это процесс устранения любых развивающихся Т- или В-лимфоцитов которые являются аутореактивными, то есть реагируют на сам организм. [ 1 ] Благодаря устранению аутореактивных лимфоцитов толерантность гарантирует, что иммунная система не атакует собственные пептиды . [ 2 ] Созревание лимфоцитов (и центральная толерантность) происходит в первичных лимфоидных органах, таких как костный мозг и тимус . У млекопитающих В-клетки созревают в костном мозге, а Т-клетки — в тимусе. [ 1 ]
Центральная толерантность не идеальна, поэтому периферическая толерантность существует как вторичный механизм, гарантирующий, что Т- и В-клетки не будут самореактивными после того, как они покинут первичные лимфоидные органы. [ 3 ] [ нужна страница ] Периферическая толерантность отличается от центральной толерантности тем, что она возникает, когда развивающиеся иммунные клетки покидают первичные лимфоидные органы (тимус и костный мозг) до их экспорта на периферию. [ 1 ]
Функция
[ редактировать ]Центральная толерантность необходима для правильного функционирования иммунных клеток, поскольку она помогает гарантировать, что зрелые В-клетки и Т-клетки не распознают аутоантигены как чужеродные микробы. [ 2 ] Более конкретно, необходима центральная толерантность, поскольку рецепторы Т-клеток (TCR) и рецепторы В-клеток (BCR) образуются клетками посредством случайной соматической перестройки. [ 1 ] Этот процесс, известный как рекомбинация V(D)J , важен, поскольку он увеличивает разнообразие рецепторов, что увеличивает вероятность того, что В-клетки и Т-клетки будут иметь рецепторы для новых антигенов. [ 1 ] Разнообразие соединений возникает во время рекомбинации и служит для дальнейшего увеличения разнообразия BCR и TCR. [ 1 ] Производство случайных TCR и BCR является важным методом защиты от микробов из-за их высокой частоты мутаций. Этот процесс также играет важную роль в обеспечении выживания вида, поскольку внутри вида будет существовать множество рецепторов – это обеспечивает очень высокую вероятность того, что хотя бы у одного представителя вида будут рецепторы для нового антигена. [ 1 ]
Хотя процесс соматической рекомбинации важен для успешной иммунной защиты, он может привести к аутореактивности. Например, отсутствие функционального RAG1/2 , ферментов, необходимых для соматической рекомбинации, связано с развитием иммунной цитопении, при которой антитела вырабатываются против клеток крови пациента. [ 4 ] Из-за природы случайной рекомбинации рецепторов будут вырабатываться некоторые BCR и TCR, которые распознают аутоантигены как чужеродные. [ 2 ] Это проблематично, поскольку эти В- и Т-клетки, если они активированы, вызовут иммунный ответ против самих себя, если не будут убиты или инактивированы центральными механизмами толерантности. [ 5 ] [ нужна страница ] Следовательно, без центральной толерантности иммунная система может атаковать себя, что не является устойчивым и может привести к аутоиммунному заболеванию. [ 3 ] [ нужна страница ]
Механизм
[ редактировать ]Результатом центральной толерантности является популяция лимфоцитов, которые не вызывают иммунного ответа на аутоантигены. Эти клетки используют свою специфичность TCR или BCR для распознавания чужеродных антигенов, чтобы играть свою специфическую роль в иммунной реакции против этих антигенов. [ 2 ] [ 6 ]
Таким образом, механизмы центральной толерантности гарантируют, что лимфоциты, которые распознают аутоантигены таким образом, что это может поставить под угрозу хозяина, не высвободятся на периферию.
Примечательно, что Т-клетки, несмотря на механизмы толерантности, по крайней мере в некоторой степени являются аутореактивными. TCR обычных Т-клеток должен быть способен распознавать части молекул главного комплекса гистосовместимости (MHC) ( класс I MHC в случае CD8+ Т-клеток или класс MHC II в случае CD4+ Т-клеток), чтобы обеспечить правильное взаимодействие с антигенпрезентирующей клеткой. Более того, TCR регуляторных Т-клеток (Treg-клеток) напрямую реагируют на аутоантигены (хотя их аутореактивность не очень сильна) и используют эту аутореактивность для регулирования иммунных реакций путем подавления иммунной системы, когда она не должна быть активной. [ 6 ] [ 7 ] [ 8 ] Важно отметить, что лимфоциты могут развивать толерантность только к антигенам, которые присутствуют в костном мозге (для В-клеток) и тимусе (для Т-клеток). [ 9 ]
Т-клетка
[ редактировать ]Предшественники Т-клеток (также называемые тимоцитами ) создаются в костном мозге , а затем мигрируют в тимус , где продолжают свое развитие. [ 1 ] [ 10 ] Во время этого развития тимоциты выполняют рекомбинацию V(D)J , и некоторые из развивающихся клонов Т-клеток продуцируют TCR, который совершенно нефункционален (не способен связывать комплексы пептид-MHC), а некоторые продуцируют TCR, который является самореактивным и, следовательно, может способствовать аутоиммунитет. [ 11 ] [ 2 ] Таким образом, эти «проблемные» клоны удаляются из пула Т-клеток с помощью определенных механизмов.
Сначала во время « положительного отбора » тимоциты проверяют, работают ли их TCR правильно, а те, у кого TCR нефункциональны, удаляются путем апоптоза . [ 6 ] [ 7 ] Механизм получил свое название, потому что он отбирает для выживания только те тимоциты, TCR которых действительно взаимодействуют с комплексами пептид-MHC на антигенпредставляющих клетках в тимусе.
На поздней стадии положительного отбора другой процесс, называемый « ограничением MHC происходит » (или обязательством по линии). В этом процессе тимоциты, TCR которых распознают молекулы MHCI ( класс MHC I ), становятся CD4-CD8+, а тимоциты, TCR которых распознают MHCII ( класс MHC II ), становятся CD4+ CD8-.
Впоследствии положительно отобранные тимоциты проходят « негативный отбор », который проверяет тимоциты на самореактивность. Клетки, которые обладают сильной самореактивностью (и, следовательно, склонны атаковать клетки-хозяева), удаляются путем апоптоза. Тимоциты, которые все еще являются самореактивными, но лишь незначительно развиваются в Т-регуляторные (Treg) клетки. Тимоциты, которые не являются самореактивными, становятся зрелыми наивными Т-клетками. И Treg, и зрелые наивные Т-клетки впоследствии мигрируют во вторичные лимфоидные органы. [ 6 ] [ 7 ] Негативный отбор получил свое название потому, что он отбирает для выживания только те тимоциты, TCR которых не взаимодействуют (или взаимодействуют лишь незначительно) с комплексами пептид-MHC на антигенпредставляющих клетках тимуса.
Два других термина - рецессивная и доминантная толерантность также важны в отношении центральной толерантности Т-клеток. Оба термина относятся к двум возможным путям установления толерантности к конкретному антигену (обычно аутоантигену). « Рецессивная толерантность » означает, что антиген переносится за счет удаления тех Т-клеток, которые способствуют иммунному ответу против антигена (удаление аутореактивных клеток при отрицательной селекции). « Доминантная толерантность » означает, что клоны Т-клеток, специфичные для антигена, превращаются в Treg-клетки и, следовательно, подавляют иммунный ответ против антигена (селекция Treg во время отрицательной селекции). [ 6 ] [ 7 ] [ 12 ]
Этапы толерантности Т-клеток [ 2 ] [ 13 ]
- Развитие предшественников Т-клеток [ 14 ] [ 15 ] [ 16 ] Предшественники Т-клеток происходят из костного мозга (КМ). Популяция самых ранних гемопоэтических предшественников не несет маркеров дифференцированных клеток (за это их называют Lin- «линейно-негативными»), но экспрессирует такие молекулы, как SCA1 (антиген стволовых клеток) и KIT (рецептор фактора стволовых клеток SCF). На основании этих маркеров клетки называются LSK (Lineage-SCA1-KIT). Эту популяцию можно далее разделить на основе экспрессии таких маркеров, как CD150 и FMS-родственная тирозинкиназа 3 (FLT3), на CD150+ FLT3-гематопоэтические стволовые клетки (HSC) и мультипотентные предшественники CD150-FLT3low (MPP). ЗКП являются «настоящими гемопоэтическими стволовыми клетками », поскольку они обладают способностью к самообновлению (генерации новых ЗКП), а также потенциалом дифференцироваться во все типы клеток крови. Прямыми потомками ГСК являются более зрелые мультипотентные предшественники (МПП), которые быстро пролиферируют, могут дифференцироваться во все типы клеток крови, но не способны к самообновлению (не обладают способностью бесконечно генерировать новые МПП, и поэтому ГСК необходимы для создание новых МПП). Некоторые из MPP дополнительно усиливают экспрессию FLT3 (становясь CD150-FLT3high) и начинают активировать гены, специфичные для лимфоидной линии (например, Rag1) (но остаются Lin-). Эти предшественники (все еще принадлежащие клеткам LSK) состоят из двух сходных популяций, называемых MPPs с лимфоидной праймацией (LMPPs) и ранними лимфоидными предшественниками (ELPs). LMPPs/ELPs впоследствии дают начало общим лимфоидным предшественникам (CLP). Эти клетки (FLT3high LIN-KITlow) не принадлежат к пулу LSK, являются более зрелыми и более склонными к лимфоидному клону, а это означает, что при нормальных обстоятельствах они в конечном итоге дают начало Т- или В-клеткам или другим лимфоцитам ( NK-клетки ). Но поскольку они являются лишь предшественниками, судьба их клеток строго не предопределена, и они все еще обладают способностью дифференцироваться в другие линии.
- Миграция в тимус [ 14 ] [ 16 ] [ 17 ] Предшественники костного мозга (BM), даже HSC, обладают способностью случайным образом выходить из BM в кровоток и, таким образом, могут быть легко обнаружены там. Следовательно, после образования предшественники Т-клеток покидают BM и случайным образом разносятся кровью по всему организму. В момент достижения посткапиллярных венул в кортико-медуллярном соединении тимуса они начинают замедляться и катиться по эндотелию, поскольку все предшественники, включая клетки LSK, экспрессируют на своей поверхности гликопротеин PSGL1, который является лигандом P-селектина, экспрессируется на эндотелии тимуса. Но из всех вышеупомянутых предшественников Т-клеток только LMPP/ELP и CLP экспрессируют хемокиновые рецепторы CCR7 и CCR9, которые позволяют им проникать в тимус. Эндотелий тимуса экспрессирует хемокины CCL19 и CCL21, которые являются лигандами для CCR7, и CCL25, который является лигандом для CCR9. Заключительная часть входа в тимус еще полностью не изучена. Предлагаемая модель состоит в том, что рецепторное восприятие хемокинов предшественниками активирует их интегрины (предполагаемые интегрины - VLA-4 и LFA-1), которые взаимодействуют с лигандами на эндотелии. Это взаимодействие останавливает вращение, приводит к остановке клеток и, наконец, к трансмиграции по градиенту хемокинов внутри тимуса. Следовательно, все предшественники будут перемещаться по эндотелию тимуса, но только LMPPs/ELP и CLPs войдут в тимус, потому что только они имеют для этого соответствующий рецепторный аппарат. Механизм очень похож на трансмиграция , которая используется лейкоцитами для проникновения в лимфатические узлы или воспаленные ткани.
- Раннее развитие тимуса [ 14 ] [ 17 ] [ 18 ] [ 19 ] С момента, когда LMPPs/ETP и CLP входят в тимус в кортикомедуллярном соединении, они называются предшественниками заселения тимуса (TSP). TSP сильно пролиферируют и начинают мигрировать в субкапсулярную зону тимуса. Неизвестно, какие сигналы стимулируют миграцию. Одна из возможностей заключается в том, что они мигрируют по хемокиновым градиентам, используя рецепторы CXCR4, CCR7 и CCR9, но миграция также может осуществляться только за счет взаимодействия интегринов и других клеток и ECM (внеклеточного матрикса) без прямого участия хемокинов. [ 14 ] По мере того, как они мигрируют в субкапсулярную зону, TSP продолжают свою дифференцировку, которая обусловлена главным образом микроокружением тимуса. Из многих сигналов, которые TSP и др. последующие предшественники получают из микроокружения, передача сигналов Notch особенно важна для управления судьбой их дифференцировки. Предшественники экспрессируют рецептор Notch1, который активируется лигандами, присутствующими в ткани тимуса. Последующая активация пути Notch приводит к постепенной утрате способности предшественников генерировать другие клеточные линии, и в конечном итоге они становятся способны создавать только Т-клетки, но это происходит на более поздних стадиях дифференцировки. На стадии TSP предшественники еще сохраняют способность создавать как лимфоидные, так и миелоидные клетки. Учитывая их способность генерировать другие клеточные линии (в основном in vitro), даже обсуждается, что они могут физиологически, по крайней мере частично, способствовать образованию других типов клеток, присутствующих в тимусе, главным образом плазмацитоидных дендритных клеток (pDC). Но это еще не было четко доказано. [ 19 ]
- Ступени от DN до DP [ 14 ] [ 17 ] [ 18 ] [ 19 ] На следующем этапе TSP дают начало ранним предшественникам тимуса (ETP), также называемым клетками двойного негативного 1 (DN1). Термин «двойной негатив» относится к тому факту, что на этой стадии предшественники не экспрессируют корецепторы CD4 и CD8 (иногда их даже называют «тройным негативом», поскольку они также не экспрессируют комплекс CD3). Стадии DN можно отличить по экспрессии поверхностных маркеров CD44 и CD25, при этом клетки DN1 представляют собой CD44+ CD25-. Подобно TSP, клетки DN1 по-прежнему способны генерировать другие типы клеток, помимо Т-клеток, такие как B-клетки, NK-клетки, DC и макрофаги (лимфоидного и миелоидного происхождения). [ 18 ] Но благодаря передаче сигналов Notch они начинают переходить к линии Т-клеток путем экспрессии факторов транскрипции (TF), таких как GATA3 и TCF1. Впоследствии клетки DN1 дифференцируются в клетки DN2, то есть CD44+ и CD25+. Стадию DN2 можно разделить на две подстадии DN2a и DN2b. Переход от более ранней подстадии DN2a к более поздней DN2b также называется коммитентацией, поскольку именно в этот момент предшественники Т-клеток окончательно и полностью теряют способность генерировать другие клеточные линии и с этого момента они могут (даже in vitro) только дифференцироваться в Т-клетки. После коммитирования, на подстадии DN2b, предшественники также начинают продуцировать комплекс CD3 (сигнальный компонент будущего рецепторного комплекса TCR). Далее предшественники продолжают дифференцировку в фазу DN3, в которой они представляют собой CD44-CD25+. На этом этапе клетки наконец достигают субкапсулярной зоны тимуса, продолжают пролиферировать и, самое главное, начинают экспрессировать Rag1 и Rag2. (рекомбиназы V(D)J-рекомбинации Т- или В-клеточных рецепторов). Следовательно, именно на стадии DN3 предшественники Т-клеток начинают строить свои TCR. [ 18 ] [ 19 ] Также на этом этапе предшественники решают, станут ли они αβ или γδ Т-клетками. Есть две возможные модели того, как принимается этот шаг решения. Первая возможность состоит в том, что судьба клеток просто определяется во время развития предшественника путем детерминации, аналогичной развитию других клеточных линий. Следовательно, некоторые предшественники Т-клеток коммитируются с γδ Т-клеткой и, следовательно, на этом этапе рекомбинируют γδTCR, а некоторые коммитируются с αβ Т-клеткой и аналогичным образом рекомбинируют αβTCR. Другая и более общепринятая модель состоит в том, что обязательство определяется во время реаранжировки и формирования TCR. Поскольку рекомбинация V(D)J представляет собой поэтапный процесс, предшественники сначала рекомбинируют свои гены с образованием γδTCR. На данный момент решает сила сигнала, который производит вновь сформированный TCR. Если γδTCR сформирован правильно и получает сильный сигнал при взаимодействии с лигандами, присутствующими в тимусе, то предшественник продолжает свое развитие в γδ Т-клетку посредством специфических процессов отбора. Если предшественник Т-клеток получает только слабый сигнал, то образование γδTCR нарушается и начинается рекомбинация в сторону αβTCR. [ 18 ] [ 20 ] [ 21 ] Эти предшественники сначала рекомбинируют цепь TCRβ и объединяют ее с инвариантным TCRα (цепью-заменителем), а на предыдущих стадиях образуют комплекс CD3 с образованием так называемого пре-TCR. С этим преждевременным TCR они вступают в процесс, называемый β-отбором . Это этап контроля, на котором предшественнику необходимо получить положительный сигнал от пре-TCR, чтобы выжить. Кроме того, им необходим сигнал от CXCR4 (лиганд - CXCL12), который здесь служит не для прямой миграции, а как сигнал выживания наряду с передачей сигналов Notch. Следовательно, этап β-отбора контролирует, правильно ли сформирована и функциональна цепь TCRβ. Его также можно понимать как позитивный отбор, специфичный только для цепи TCRβ (цепь TCRα еще не сформирована), но контроль аутореактивности не включен в этот этап и происходит позже, особенно в медуллярном отделе. Клетки, которые не создают функциональный γδTCR или пре-TCR или не проходят успешно β-селекцию, удаляются путем апоптоза. [ 18 ] [ 20 ] Клетки, успешно прошедшие β-селекцию, продолжают свое развитие до стадии DN4, прекращают экспрессию CD25, превращаясь в CD44-CD25-, и начинают миграцию внутри коры тимуса. Опять же, не совсем ясно, что движет миграцией. Вероятно, рецепторы CXCR4 и CXCR9 на клетках DN4 управляют миграцией по градиентам хемокинов CXCL12 и CCL25, хотя были установлены и другие модели миграции в кору, в основном основанные на динамике движения клеток за счет их обширной пролиферации или токов жидкости в тимусе. без прямого участия миграции, управляемой хемокинами. Клетки DN4 впоследствии начинают экспрессировать корецепторы CD8 и CD4, превращаясь в клетки CD8+ CD4+ DP (DP означает двойной положительный результат, поскольку они экспрессируют оба корецептора). Попав в кору тимуса, клетки DP завершают перестройку цепи TCRα, что приводит к образованию полного комплекса αβTCR, который отмечает, что клетки готовы к положительному отбору, который происходит в коре тимуса. [ 14 ] [ 18 ]
- Во время положительной селекции Т-клетки проверяют на их способность аффинно связывать комплексы пептид-MHC. Если Т-клетка не может связывать комплекс MHC класса I или MHC класса II , она не получает сигналов выживания и погибает в результате апоптоза. Рецепторы Т-клеток с достаточным сродством к комплексам пептид-MHC отбираются для выживания.
- Во время негативного отбора Т-клетки проверяются на их близость к самим себе. Если они связывают собственный пептид, то им передается сигнал к апоптозу (процессу клональной делеции).
- Эпителиальные клетки тимуса проявляют аутоантиген к Т-клеткам, чтобы проверить их сродство к себе.
- Регуляторы транскрипции AIRE и Fezf2 играют важную роль в экспрессии собственных тканевых антигенов на эпителиальных клетках тимуса в тимусе.
- Негативная селекция происходит в кортико-медуллярном соединении и в мозговом веществе тимуса.
- Т-клетки, которые не связываются с самим собой, но распознают комплексы антиген/MHC и представляют собой либо CD4+, либо CD8+, мигрируют во вторичные лимфоидные органы как зрелые наивные Т-клетки.
Регуляторные Т-клетки — это еще один тип Т-клеток, созревающих в тимусе. Селекция Т-рег-клеток происходит в мозговом веществе тимуса и сопровождается транскрипцией FOXP3 . T-reg-клетки важны для регулирования аутоиммунитета, подавляя иммунную систему, когда она не должна быть активной. [ 8 ]
В-клетка
[ редактировать ]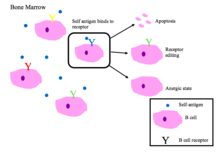
Незрелые В-клетки костного мозга подвергаются негативному отбору, когда они связывают собственные пептиды. [ 2 ]
Правильно функционирующие рецепторы В-клеток распознают чужеродные антигены или молекулярные белки, связанные с патогеном ( PAMP ). [ 1 ]
Основные последствия аутореактивности BCR [ 1 ] [ 2 ]
- Апоптоз (клональная делеция)
- Редактирование рецепторов : аутореактивные В-клетки меняют специфичность путем перестройки генов и развивают новый BCR, который не реагирует на себя. Этот процесс дает В-клетке возможность редактировать BCR до того, как она получит сигнал об апоптозе или станет анергической.
- Индукция анергии (состояние нереактивности)
Генетические заболевания
[ редактировать ]Генетические дефекты центральной толерантности могут привести к аутоиммунитету.
- Синдром аутоиммунной полиэндокринопатии I типа вызван мутациями человеческого гена AIRE . Это приводит к отсутствию экспрессии периферических антигенов в тимусе и, следовательно, к отсутствию негативного отбора в отношении ключевых периферических белков, таких как инсулин. [ 22 ] [ 23 ] В результате возникают множественные аутоиммунные симптомы.
История
[ редактировать ]Впервые центральную толерантность использовал Рэй Оуэн в 1945 году, когда он заметил, что дизиготные близнецы крупного рогатого скота не производят антитела, когда одному из близнецов вводили кровь другого. [ 24 ] Его выводы были подтверждены более поздними экспериментами Гашека и Биллингема. [ 24 ] Результаты были объяснены гипотезой клонального отбора Бёрнета . [ 25 ] Бёрнет и Медавар получили Нобелевскую премию в 1960 году за работу по объяснению того, как работает иммунная толерантность. [ 25 ] [ 26 ]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а б с д и ж г час я дж Оуэн Дж.А., Пунт Дж., Стрэнфорд С.А., Джонс П.П., Куби Дж. (2013). Куби иммунология (7-е изд.). Нью-Йорк: WH Freeman. ISBN 978-1-4292-1919-8 . OCLC 820117219 .
- ^ Jump up to: а б с д и ж г час Романьяни С (2006). «Иммунологическая толерантность и аутоиммунитет». Внутренняя и неотложная медицина . 1 (3): 187–196. дои : 10.1007/bf02934736 . ПМИД 17120464 . S2CID 27585046 .
- ^ Jump up to: а б Джейнвей-младший, Калифорния, Трэверс П., Уолпорт М., Шломчик М.Дж. (2001). Иммунобиология 5: Иммунная система в здоровье и болезнях (5-е изд.). Нью-Йорк: Гарленд. ISBN 978-0-8153-3642-6 . OCLC 45708106 .
- ^ Чен К., Ву В., Мэтью Д., Чжан Ю., Браун С.К., Розен Л.Б. и др. (март 2014 г.). «Аутоиммунитет из-за дефицита RAG и предполагаемая заболеваемость мутациями RAG1/2» . Журнал аллергии и клинической иммунологии . 133 (3): 880–2.e10. дои : 10.1016/j.jaci.2013.11.038 . ПМК 4107635 . ПМИД 24472623 .
- ^ Джейнвей-младший, Калифорния, Трэверс П., Уолпорт М., Шломчик М.Дж. (2001). «Глава 13 – Самотолерантность и ее потеря» . Иммунобиология 5: Иммунная система в здоровье и болезнях (5-е изд.). Нью-Йорк, штат Нью-Йорк: Garland Science. стр. 533–546. ISBN 978-0-443-07098-3 .
- ^ Jump up to: а б с д и Кляйн Л., Роби Э.А., Се К.С. (январь 2019 г.). «Центральный CD4 + Толерантность к Т-клеткам: делеция или регуляторная дифференцировка Т-клеток» (PDF) . Nature Reviews. Immunology . 19 (1): 7–18. doi : 10.1038/s41577-018-0083-6 . PMID 30420705 .
- ^ Jump up to: а б с д Лю Ю.Дж. (май 2006 г.). «Единая теория центральной толерантности вилочковой железы». Тенденции в иммунологии . 27 (5): 215–221. дои : 10.1016/j.it.2006.03.004 . ПМИД 16580260 .
- ^ Jump up to: а б Беттелли Э., Кэрриер Ю., Гао В., Корн Т., Стром Т.Б., Оукка М. и др. (май 2006 г.). «Реципрокные пути развития для генерации патогенных эффекторных TH17 и регуляторных Т-клеток». Природа . 441 (7090): 235–238. Бибкод : 2006Natur.441..235B . дои : 10.1038/nature04753 . ПМИД 16648838 . S2CID 4391497 .
- ^ Малхотра Д., Линехан Дж.Л., Дилипан Т., Ли Ю.Дж., Пурта В.Е., Лу Дж.В. и др. (февраль 2016 г.). «Толерантность устанавливается в поликлональных CD4(+) Т-клетках с помощью различных механизмов в соответствии с паттернами экспрессии собственных пептидов» . Природная иммунология . 17 (2): 187–195. дои : 10.1038/ni.3327 . ПМЦ 4718891 . ПМИД 26726812 .
- ^ Косвей Э.Дж., Охигаши И., Шаубле К., Парнелл С.М., Дженкинсон В.Е., Лютер С. и др. (июль 2018 г.). «Формирование внутритимического пула дендритных клеток требует CCL21-опосредованного рекрутирования CCR7. + Прародители тимуса» . Журнал иммунологии . 201 (2): 516–523. : 10.4049 /jimmunol.1800348 . PMC 6036229. . PMID 29784760 doi
- ^ Палмер Э. (май 2003 г.). «Негативный отбор – удаление плохих парней из репертуара Т-клеток». Обзоры природы. Иммунология . 3 (5): 383–391. дои : 10.1038/nri1085 . ПМИД 12766760 .
- ^ Ким Дж.М., Расмуссен Дж.П., Руденский А.Ю. (февраль 2007 г.). «Регуляторные Т-клетки предотвращают катастрофический аутоиммунитет на протяжении всей жизни мышей». Природная иммунология . 8 (2): 191–197. дои : 10.1038/ni1428 . ПМИД 17136045 .
- ^ Срент Дж., Кисимото Х. (май 2001 г.). «Тимус и центральная толерантность» . Философские труды Лондонского королевского общества . Серия Б, Биологические науки. 356 (1409): 609–616. дои : 10.1098/rstb.2001.0846 . ПМЦ 1088448 . ПМИД 11375064 .
- ^ Jump up to: а б с д и ж С любовью, Пол Э.; Бхандула, Авинаш (2011). «Интеграция сигналов и перекрестные помехи во время миграции и эмиграции тимоцитов» . Обзоры природы Иммунология . 11 (7): 469–477. дои : 10.1038/nri2989 . ISSN 1474-1733 . ПМК 3710714 . ПМИД 21701522 .
- ^ Злотов, Дэниел А.; Шварц, Бенджамин А.; Бхандула, Авинаш (2008). «Долгий путь к тимусу: генерация, мобилизация и циркуляция предшественников Т-клеток у мышей и человека» . Семинары по иммунопатологии . 30 (4): 371–382. дои : 10.1007/s00281-008-0133-4 . ISSN 1863-2297 . ПМИД 18925398 .
- ^ Jump up to: а б Злотов, Дэниел А.; Самбандам, Ариважаган; Логан, Теодор Д.; Белл, Дж. Джеремия; Шварц, Бенджамин А.; Бхандула, Авинаш (11 марта 2010 г.). «CCR7 и CCR9 вместе рекрутируют гемопоэтические предшественники во взрослый тимус» . Кровь . 115 (10): 1897–1905. дои : 10.1182/blood-2009-08-237784 . ISSN 0006-4971 . ПМЦ 2837318 . ПМИД 19965655 .
- ^ Jump up to: а б с Злотов, Дэниел А.; Бхандула, Авинаш (2011). «Миграция гемопоэтических предшественников во взрослый тимус» . Анналы Нью-Йоркской академии наук . 1217 (1): 122–138. Бибкод : 2011NYASA1217..122Z . дои : 10.1111/j.1749-6632.2010.05881.x . ISSN 0077-8923 . ПМК 3076003 . ПМИД 21251013 .
- ^ Jump up to: а б с д и ж г Шах, Дивья К.; Суньига-Пфлюкер, Хуан Карлос (1 мая 2014 г.). «Обзор внутритимических сложностей развития Т-клеток» . Журнал иммунологии . 192 (9): 4017–4023. doi : 10.4049/jimmunol.1302259 . ISSN 0022-1767 . ПМИД 24748636 .
- ^ Jump up to: а б с д Ротенберг, Эллен В. (2021). «Одноклеточное понимание гематопоэтической генерации предшественников Т-лимфоцитов у мышей и человека» . Экспериментальная гематология . 95 : 1–12. дои : 10.1016/j.exphem.2020.12.005 . ПМЦ 8018899 . ПМИД 33454362 .
- ^ Jump up to: а б Паркер, Морган Э.; Чиофани, Мария (2020). «Регуляция диверсификации эффекторов γδ Т-клеток в тимусе» . Границы в иммунологии . 11:42 . дои : 10.3389/fimmu.2020.00042 . ISSN 1664-3224 . ПМК 6992645 . ПМИД 32038664 .
- ^ Чиофани, Мария; Суньига-Пфлюкер, Хуан Карлос (2010). «Определение развития γδ и αβ Т-клеток» . Обзоры природы. Иммунология . 10 (9): 657–663. дои : 10.1038/nri2820 . ISSN 1474-1741 . ПМИД 20725107 .
- ^ Андерсон М.С., Венанци Э.С., Кляйн Л., Чен З., Берзиньш С.П., Терли С.Дж. и др. (ноябрь 2002 г.). «Проекция иммунологической собственной тени в тимусе с помощью белка aire». Наука . 298 (5597): 1395–1401. Бибкод : 2002Sci...298.1395A . дои : 10.1126/science.1075958 . ПМИД 12376594 . S2CID 13989491 .
- ^ Листон А., Лесаж С., Уилсон Дж., Пелтонен Л., Гуднау CC (апрель 2003 г.). «Aire регулирует отрицательный отбор органоспецифичных Т-клеток». Природная иммунология . 4 (4): 350–354. дои : 10.1038/ni906 . ПМИД 12612579 . S2CID 4561402 .
- ^ Jump up to: а б Шварц Р.Х. (апрель 2012 г.). «Исторический обзор иммунологической толерантности» . Перспективы Колд-Спринг-Харбор в биологии . 4 (4): а006908. doi : 10.1101/cshperspect.a006908 . ПМК 3312674 . ПМИД 22395097 .
- ^ Jump up to: а б Листон А (январь 2011 г.). «Иммунологическая толерантность через 50 лет после Нобелевской премии Бёрнета» . Иммунология и клеточная биология . 89 (1): 14–15. дои : 10.1038/icb.2010.138 . ПМИД 21209621 .
- ^ Сильверстайн А.М. (март 2016 г.). «Любопытный случай с Нобелевской премией 1960 года Бёрнету и Медавару» . Иммунология . 147 (3): 269–274. дои : 10.1111/imm.12558 . ПМЦ 4754613 . ПМИД 26790994 .


