Гуморальный иммунитет
Гуморальный иммунитет — это аспект иммунитета , который опосредуется макромолекулами , включая секретируемые антитела , белки комплемента и некоторые антимикробные пептиды , расположенные во внеклеточных жидкостях . Гуморальный иммунитет назван так потому, что он включает в себя вещества, находящиеся в юморе или жидкостях организма . Он контрастирует с клеточным иммунитетом . Гуморальный иммунитет также называют иммунитетом, опосредованным антителами .
Изучение молекулярных и клеточных компонентов , формирующих иммунную систему , включая их функции и взаимодействие, является центральной наукой иммунологии . Иммунная система делится на более примитивную врожденную иммунную систему и приобретенную или иммунную систему позвоночных адаптивную , каждая из которых содержит как гуморальные, так и клеточные иммунные элементы.
Гуморальный иммунитет относится к выработке антител и сопутствующим ей процессам, включая: активацию Th2 и выработку цитокинов , образование зародышевых центров и изотипов переключение , а также созревание аффинности и генерацию клеток памяти . Это также относится к эффекторным функциям антител, которые включают патогенов и токсинов нейтрализацию , классическую активацию комплемента и опсонином стимулирование фагоцитоза и элиминации патогенов. [1]
История
[ редактировать ]Концепция гуморального иммунитета разработана на основе анализа антибактериальной активности компонентов сыворотки крови. Гансу Бюхнеру приписывают развитие гуморальной теории. [2] В 1890 году Бюхнер описал алексины как «защитные вещества», существующие в сыворотке крови и других жидкостях организма и способные убивать микроорганизмы . как «комплементы» Было показано, что алексины, позже переопределенные Паулем Эрлихом , являются растворимыми компонентами врожденного ответа, который приводит к сочетанию клеточного и гуморального иммунитета. Это открытие помогло соединить особенности врожденного и приобретенного иммунитета . [2]
После открытия в 1888 году бактерий, вызывающих дифтерию и столбняк , Эмиль фон Беринг и Китасато Сибасабуро показали, что болезнь не обязательно должна быть вызвана самими микроорганизмами. Они обнаружили, что бесклеточных фильтратов достаточно, чтобы вызвать заболевание. В 1890 году фильтраты дифтерии, позже названные дифтерийными токсинами , использовались для вакцинации животных в попытке продемонстрировать, что иммунизированная сыворотка содержит антитоксин , который может нейтрализовать активность токсина и может передавать иммунитет неиммунным животным. [3] В 1897 году Пауль Эрлих показал, что образуются антитела против растительных токсинов рицина и абрина , и предположил, что эти антитела отвечают за иммунитет. [2] Эрлих вместе со своим коллегой фон Берингом продолжил разработку дифтерийного антитоксина , который стал первым крупным успехом современной иммунотерапии . [3] Открытие специфических совместимых антител стало важным инструментом в стандартизации иммунитета и выявлении затяжных инфекций . [3]
| Вещество | Активность | Открытие |
|---|---|---|
| Алексин(а)/ Комплемент (ы) | Растворимые компоненты сыворотки которые способны убивать микроорганизмы | Бюхнер (1890), Эрлих (1892) |
| Антитоксины | Вещества в сыворотке, которые могут нейтрализовать активность токсинов, обеспечивая пассивную иммунизацию. | Беринга и Сибасабуро (1890 г.) |
| Бактериолизины | Сывороточные вещества, действующие с белки комплемента, вызывающие лизис бактерий | Ричард Пфайффер (1895) |
| Бактериальные агглютинины и преципитины | Сывороточные вещества, агрегирующие бактерии и осаждают бактериальные токсины | фон Грубер и Дарем (1896 г.), Краус (1897) |
| Гемолизины | Сывороточные вещества, работающие с комплементом лизировать эритроциты | Жюль Борде (1899) |
| Опсонины | Сывороточные вещества, которые покрывают внешнюю мембрану чужеродных веществ и повышают скорость фагоцитоза макрофагов . | Райт и Дуглас (1903) [4] |
| антитело | Первоначальное открытие (1900 г.), гипотеза связывания антиген-антитело (1938 г.), продуцируемая В-клетками (1948 г.), структура (1972 г.), гены иммуноглобулинов (1976 г.) | Эрлих [2] |
Антитела
[ редактировать ]Антитела или иммуноглобулины представляют собой гликопротеины , находящиеся в крови и лимфе . Структурно антитела представляют собой крупные глобулярные белки Y-образной формы . У млекопитающих существует пять типов антител: иммуноглобулин А , иммуноглобулин D , иммуноглобулин Е , иммуноглобулин G и иммуноглобулин М. Каждый класс иммуноглобулинов отличается по своим биологическим свойствам и эволюционировал для борьбы с разными антигенами. [5] Антитела синтезируются и секретируются плазматическими клетками, происходящими из В-клеток иммунной системы.
Приобретенная иммунная система использует антитела для идентификации и нейтрализации посторонних объектов, таких как бактерии и вирусы. Каждое антитело распознает специфический антиген, уникальный для своей мишени. Связывая свои специфические антигены, антитела могут вызывать и другими клетками , агглютинацию и осаждение продуктов антитело-антиген, стимулировать фагоцитоз макрофагами блокировать вирусные рецепторы и стимулировать другие иммунные реакции, такие как путь комплемента .
Переливание несовместимой крови вызывает трансфузионную реакцию , опосредованную гуморальным иммунным ответом. Этот тип реакции, называемый острой гемолитической реакцией, приводит к быстрому разрушению (гемолизу) донорских эритроцитов антителами хозяина. Причиной обычно является техническая ошибка, например, если не тому пациенту перелили не ту дозу крови. Симптомами являются лихорадка и озноб, иногда с болью в спине и розовой или красной мочой ( гемоглобинурия ). Основное осложнение заключается в том, что гемоглобин, высвобождаемый при разрушении эритроцитов, может вызвать острую почечную недостаточность .
Производство антител
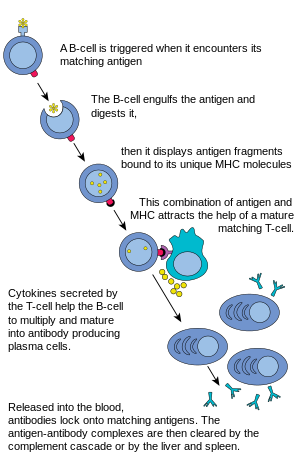
[ редактировать ]При гуморальном иммунном ответе наивные В-клетки начинают процесс созревания в костном мозге, приобретая В-клеточные рецепторы (BCR) на поверхности клетки. [6] Эти BCR представляют собой мембраносвязанные белковые комплексы, обладающие высокой аффинностью связывания со специфическими антигенами ; эта специфичность обусловлена аминокислотной последовательностью тяжелых и легких полипептидных цепей, составляющих вариабельную область BCR. [7] Как только BCR взаимодействует с антигеном, он создает сигнал связывания, который направляет В-клетку на выработку уникального антитела , которое связывается только с этим антигеном . Зрелые В-клетки затем мигрируют из костного мозга в лимфатические узлы или другие лимфатические органы , где они начинают встречаться с патогенами.

Активация В-клеток
[ редактировать ]Когда В-клетка встречает антиген, активируется сигнал, антиген связывается с рецептором и попадает внутрь В-клетки путем эндоцитоза . Антиген процессируется и снова презентируется на поверхности В-клетки белками MHC-II . Белки MHC-II распознаются Т-хелперами , стимулируя выработку белков, позволяя В-клеткам размножаться, а их потомкам дифференцироваться в клетки, секретирующие антитела, циркулирующие в крови. [8] В-клетки могут активироваться с помощью определенных микробных агентов без помощи Т-клеток и обладать способностью работать непосредственно с антигенами, обеспечивая реакцию на присутствующие патогены. [8]
Пролиферация В-клеток
[ редактировать ]В-клетка ожидает, пока Т-хелперная клетка (TH ) свяжется с комплексом. Это связывание активирует Т - клетку, которая затем высвобождает цитокины , которые побуждают В-клетки быстро делиться, создавая тысячи идентичных клонов В-клетки. Эти дочерние клетки либо становятся плазматическими клетками , либо клетками памяти . В-клетки памяти здесь остаются неактивными; позже, когда эти В-клетки памяти сталкиваются с тем же антигеном из-за повторной инфекции, они делятся и образуют плазматические клетки. С другой стороны, плазматические клетки производят большое количество антител, которые свободно попадают в систему кровообращения .
Реакция антитело-антиген
[ редактировать ]Эти антитела встретят антигены и свяжутся с ними. Это либо будет мешать химическому взаимодействию между клетками-хозяевами и чужеродными клетками, либо они могут образовывать мосты между своими антигенными сайтами, препятствуя их правильному функционированию. Их присутствие может также привлечь макрофаги или клетки-киллеры для атаки и фагоцитирования .
Система дополнений
[ редактировать ]Система комплемента — это биохимический каскад врожденной иммунной системы , который помогает выводить патогены из организма. клетки-мишени, Он получен из множества небольших белков плазмы крови, которые вместе разрушают плазматическую мембрану что приводит к цитолизу клетки. Система комплемента состоит из более чем 35 растворимых и связанных с клетками белков, 12 из которых непосредственно участвуют в путях комплемента. [1] Система комплемента участвует в деятельности как врожденного, так и приобретенного иммунитета.
Активация этой системы приводит к цитолизу, хемотаксису , опсонизации , иммунному клиренсу и воспалению , а также маркировке возбудителей для фагоцитоза. Белки составляют 5% фракции сывороточных глобулинов . Большинство этих белков циркулируют в виде зимогенов , которые неактивны до протеолитического расщепления . [1]
Три биохимических пути активируют систему комплемента: классический путь комплемента , альтернативный путь комплемента и маннозо-связывающий лектиновый путь . [9] Эти процессы различаются лишь процессом активации конвертазы С3 , [10] который является начальным шагом активации комплемента, и последующий процесс в конечном итоге одинаковы.
Классический путь инициируется воздействием свободно плавающих антител, связанных с антигеном. Это приводит к ферментативному расщеплению более мелких субъединиц комплемента, которые синтезируются с образованием конвертазы C3.
Это отличается от маннозо-связывающего лектинового пути, который инициируется бактериальными углеводными мотивами, такими как манноза, обнаруженными на поверхности бактерий. После процесса связывания происходит то же расщепление и синтез субъединиц, что и при классическом пути. Альтернативный путь комплемента полностью отличается от предыдущих путей, поскольку этот путь спонтанно инициируется в присутствии гидролизованного C3, который затем рекрутирует другие субъединицы, которые могут быть расщеплены с образованием конвертазы C3. Во всех трех путях после синтеза конвертазы C3 комплементы расщепляются на субъединицы, которые либо образуют структуру, называемую мембраноатакующим комплексом (MAC), на клеточной стенке бактерий, чтобы уничтожить бактерии. [11] или действуют как цитокины и хемокины, усиливая иммунный ответ.
См. также
[ редактировать ]- Клеточно-опосредованный иммунитет (по сравнению с гуморальным иммунитетом)
- Иммунная система
- Поликлональный ответ
- Серология
Ссылки
[ редактировать ]- ^ Jump up to: а б с Джейнвей-младший, Калифорния (2001). Иммунобиология (5-е изд.). Издательство «Гирлянда». ISBN 0-8153-3642-Х .
- ^ Jump up to: а б с д Мечников Э (1905). Иммунитет при инфекционных заболеваниях . Издательство Кембриджского университета.
- ^ Jump up to: а б с д Герарди Э. «Экспериментальные основы иммунологии» . Курс иммунологии, Медицинская школа . Университет Павии. Архивировано из оригинала 30 мая 2011 г.
- ^ Гектоен Л. (февраль 1909 г.). «Опсонины и другие антитела» . Наука . 29 (737): 241–248. Бибкод : 1909Sci....29..241H . дои : 10.1126/science.29.737.241 . JSTOR 1634893 . ПМИД 17788933 .
- ^ Пьер ГБ, Лычак Дж.Б., Вецлер Л.М. (2004). Иммунология, инфекции и иммунитет . АСМ Пресс. ISBN 9781683672111 .
- ^ Безграничный (26 мая 2016 г.). «Гуморальный иммунный ответ» . Безграничный . Архивировано из оригинала 12 октября 2016 г. Проверено 15 апреля 2017 г.
- ^ Эйзен Х.Н. (01 мая 2014 г.). «Повышение аффинности антител: как антитела с низким сродством, вырабатываемые на ранних стадиях иммунных ответов, сопровождаются антителами с высоким сродством позже и в ответах B-клеток памяти» . Исследования в области иммунологии рака . 2 (5): 381–392. doi : 10.1158/2326-6066.CIR-14-0029 . ISSN 2326-6066 . ПМИД 24795350 .
- ^ Jump up to: а б Джейнвей-младший, Калифорния, Трэверс П., Уолпорт М., Шломчик М.Дж. (2001). «Активация B-клеток вооруженными Т-хелперами» . Иммунобиология: иммунная система в здоровье и болезни. (5-е изд.).
- ^ Кэрролл MC (декабрь 2008 г.). «Комплементарный и гуморальный иммунитет» . Вакцина . 26 (8): И28–И33. doi : 10.1016/j.vaccine.2008.11.022 . ПМК 4018718 . ПМИД 19388161 .
- ^ Джейнвей-младший, Калифорния, Трэверс П., Уолпорт М., Шломчик М.Дж. (21 ноября 2001 г.). «Система комплемента и врожденный иммунитет» . Иммунобиология: Иммунная система в здоровье и болезнях (5-е изд.). Нью-Йорк: Garland Science – через www.ncbi.nlm.nih.gov.
- ^ Матерн Д.Р., Хигер П.С. (сентябрь 2015 г.). «Молекулы большие и малые: система комплемента» . Клинический журнал Американского общества нефрологов . 10 (9): 1636–1650. дои : 10.2215/CJN.06230614 . ISSN 1555-9041 . ПМК 4559511 . ПМИД 25568220 .
Дальнейшее чтение
[ редактировать ]- Мельцер С.Дж., Норрис С. (ноябрь 1897 г.). «Бактерицидное действие лимфы, взятой из грудного протока собаки» . Журнал экспериментальной медицины . 2 (6): 701–709. дои : 10.1084/jem.2.6.701 . ПМК 2117951 . ПМИД 19866859 .