Антинуклеарное антитело

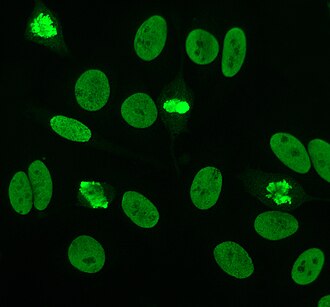
Антинуклеарные антитела ( ANA , также известные как антинуклеарный фактор или ANF ) [2] представляют собой аутоантитела , которые связываются с содержимым ядра клетки . У нормальных людей иммунная система вырабатывает антитела к чужеродным белкам ( антигенам ), но не к белкам человека ( аутоантигенам ). В некоторых случаях вырабатываются антитела к антигенам человека; они известны как аутоантитела. [3]
Существует множество подтипов ANA, таких как антитела против Ro , антитела против La , антитела против Sm , антитела против nRNP , антитела против Scl-70 , антитела против дцДНК , антитела против гистонов , антитела к комплексам ядерных пор. , антицентромерные антитела и антитела против sp100 . Каждый из этих подтипов антител связывается с различными белками или белковыми комплексами внутри ядра. Они обнаруживаются при многих заболеваниях, включая аутоиммунитет , рак и инфекции , с разной распространенностью антител в зависимости от состояния. Это позволяет использовать АНА в диагностике некоторых аутоиммунных заболеваний, в том числе системной красной волчанки , синдрома Шегрена , [4] склеродермия , [5] смешанное заболевание соединительной ткани , [6] полимиозит , дерматомиозит , аутоиммунный гепатит [7] и лекарственная волчанка . [8]
человека Тест ANA обнаруживает аутоантитела, присутствующие в сыворотке крови . Обычными тестами, используемыми для обнаружения и количественного определения АНА, являются непрямая иммунофлуоресценция и иммуноферментный анализ (ИФА). При иммунофлуоресценции уровень аутоантител определяют в виде титра . Это наибольшее разведение сыворотки, при котором еще обнаруживаются аутоантитела. Положительные титры аутоантител в разведении, равном или превышающем 1:160, обычно считаются клинически значимыми. Положительные титры менее 1:160 наблюдаются у 20% здорового населения, особенно у пожилых людей. Хотя положительные титры 1:160 и выше тесно связаны с аутоиммунными заболеваниями, они также обнаруживаются у 5% здоровых людей. [9] [10] Скрининг аутоантител полезен при диагностике аутоиммунных заболеваний, а мониторинг уровней помогает прогнозировать прогрессирование заболевания. [8] [11] [12] Положительный тест на АНА редко бывает полезен, если отсутствуют другие клинические или лабораторные данные, подтверждающие диагноз. [13]
Иммунитет и аутоиммунитет [ править ]
Организм человека имеет множество защитных механизмов против болезнетворных микроорганизмов , одним из которых является гуморальный иммунитет . Этот защитный механизм вырабатывает антитела (большие гликопротеины ) в ответ на иммунный стимул. Для этого процесса необходимы многие клетки иммунной системы, включая лимфоциты ( Т-клетки и В-клетки ) и антигенпредставляющие клетки . Эти клетки координируют иммунный ответ при обнаружении чужеродных белков ( антигенов ), продуцируя антитела, которые связываются с этими антигенами. В нормальной физиологии лимфоциты, распознающие человеческие белки ( аутоантигены ), либо подвергаются запрограммированной гибели клеток ( апоптоз ), либо становятся нефункциональными. Эта аутотолерантность означает, что лимфоциты не должны вызывать иммунный ответ против клеточных антигенов человека. Однако иногда этот процесс нарушается, и против человеческих антигенов вырабатываются антитела, что может привести к аутоиммунному заболеванию. [3]
Подтипы ANA [ править ]
АНА обнаруживаются при многих заболеваниях, а также у некоторых здоровых людей. К этим заболеваниям относятся: системная красная волчанка (СКВ), ревматоидный артрит , синдром Шегрена , склеродермия , полимиозит , дерматомиозит , первичный билиарный цирроз печени , лекарственная волчанка , аутоиммунный гепатит , рассеянный склероз , дискоидная волчанка , заболевания щитовидной железы , антифосфолипидный синдром , ювенильный идиопатический артрит , псориатический артрит , ювенильный дерматомиозит , идиопатическая тромбоцитопеническая пурпура , инфекции и рак . Эти антитела можно подразделить в зависимости от их специфичности, и каждая подгруппа имеет различную склонность к конкретным заболеваниям. [8] [14]
ядерные Экстрагируемые антигены
Экстрагируемые ядерные антигены (ENA) представляют собой группу аутоантигенов , которые первоначально были идентифицированы как мишени антител у людей с аутоиммунными заболеваниями. Их называют ЭНА, потому что их можно извлечь из ядра клетки с помощью физиологического раствора. [8] [15] ENA состоят из рибонуклеопротеинов и негистоновых белков, названных либо по имени донора, предоставившего прототип сыворотки (Sm, Ro, La, Jo), либо по названию заболевания, при котором были обнаружены антитела (SS- А, СС-Б, Scl-70). [16]
Анти-Ро/СС-А и анти-Ла/СС-Б [ править ]

Антитела анти-Ro и анти-La , также известные как SS-A и SS-B соответственно, обычно обнаруживаются при первичном синдроме Шегрена , аутоиммунном заболевании , поражающем экзокринные железы . Наличие обоих антител обнаруживается в 30–60% случаев синдрома Шегрена, одни анти-Ro антитела обнаруживаются в 50–70% случаев синдрома Шегрена и в 30% случаев СКВ с поражением кожи, а анти-La антитела редко обнаруживаются изолированно. . [11] [17] Антитела против La также обнаруживаются при СКВ; однако обычно также присутствует синдром Шегрена. [18] Антитела против Ro также реже обнаруживаются при других заболеваниях, включая аутоиммунные заболевания печени, целиакию , аутоиммунные ревматические заболевания, сердечную красную волчанку новорожденных и полимиозит . [19] [20] Во время беременности антитела против Ro могут проникнуть через плаценту и вызвать блокаду сердца. [21] [22] и неонатальная волчанка у младенцев. [23] При синдроме Шегрена анти-Ro и анти-La антитела коррелируют с ранним началом, увеличением продолжительности заболевания, увеличением околоушных желез , поражением вне желез и инфильтрацией желез лимфоцитами. [12] Антитела против Ro специфичны к компонентам комплекса Ro-RNP, включающего белки массой 45 кДа, 52 кДа, 54 кДа и 60 кДа и РНК . /РНК-связывающий белок массой 60 кДа ДНК и регуляторный белок Т-клеток массой 52 кДа являются наиболее охарактеризованными антигенами антител против Ro. В совокупности эти белки являются частью рибонуклеопротеинового человека комплекса (РНП), который связывается с Y-РНК hY1-hY5. La-антиген представляет собой транскрипции фактор терминации массой 48 кДа РНК-полимеразы III , который связывается с комплексом Ro-RNP. [16] [17] [24] [25]
Механизм выработки антител при синдроме Шегрена до конца не изучен, но апоптоз (запрограммированная гибель клеток) и молекулярная мимикрия могут играть определенную роль. [12] Антигены Ro и La экспрессируются на поверхности клеток, подвергающихся апоптозу, и могут вызывать воспаление внутри слюнной железы при взаимодействии с клетками иммунной системы. Антитела также можно получать посредством молекулярной мимикрии, при которой перекрестно-реактивные антитела связываются как с вирусными, так и с человеческими белками. Это может произойти с одним из антигенов, Ro или La, и впоследствии может привести к образованию антител к другим белкам посредством процесса, известного как распространение эпитопа . Ретровирусный белок gag имеет сходство с белком La и предлагается в качестве возможного примера молекулярной мимикрии при синдроме Шегрена. [12] [20]
Анти-См [ править ]
Антитела Анти-Смита (Anti-Sm) являются очень специфичным маркером СКВ. Примерно у 99% людей без СКВ отсутствуют антитела против Sm, но только у 20% людей с СКВ они есть. Они связаны с поражением центральной нервной системы , заболеванием почек , фиброзом легких и перикардитом при СКВ, но не связаны с активностью заболевания. Антигены антител против Sm представляют собой основные единицы малых ядерных рибонуклеопротеинов (мяРНП), называемых от A до G, и связываются с мяРНП U1, U2, U4, U5 и U6. Чаще всего антитела специфичны к единицам B, B' и D. [26] [27] Молекулярные и эпидемиологические исследования показывают, что антитела против Sm могут индуцироваться молекулярной мимикрией, поскольку этот белок демонстрирует некоторое сходство с белками вируса Эпштейна-Барр . [28] [29]
Анти-nRNP/анти-U1-RNP [ править ]
Антиядерные рибонуклеопротеиновые антитела (анти-нРНП) , также известные как антитела против U1-РНП, обнаруживаются в 30–40% случаев СКВ. Их часто обнаруживают вместе с антителами против Sm, но они могут быть связаны с различными клиническими ассоциациями. Помимо СКВ, эти антитела тесно связаны со смешанными заболеваниями соединительной ткани . Антитела против нРНП распознают основные единицы А и С мяРНП и поэтому в первую очередь связываются с U1-мяРНП. [26] [30] Иммунный ответ на РНП может быть вызван презентацией ядерных компонентов на клеточной мембране в виде апоптотических пузырей. Молекулярная мимикрия также была предложена в качестве возможного механизма продукции антител к этим белкам из-за сходства между полипептидами U1-RNP и полипептидами вируса Эпштейна-Барр. [31]
Анти-Scl-70/анти-топоизомераза I [ править ]
Антитела против Scl-70 связаны со склеродермией . [32] Чувствительность антител к склеродермии составляет примерно 34%, но выше при диффузном поражении кожи (40%) и ниже при ограниченном поражении кожи (10%). Специфичность антител составляет 98% и 99,6% при других ревматических заболеваниях и нормальных людях соответственно. [8] [33] Помимо склеродермии, эти антитела обнаруживаются примерно у 5% больных СКВ. [34] Антигенной мишенью антител против Scl-70 является топоизомераза I. [35]
Анти-Джо-1 [ править ]
Хотя антитела против Jo-1 часто включаются в состав ANA, на самом деле они представляют собой антитела к цитоплазматическому белку, гистидил-тРНК-синтетазе – аминоацил-тРНК-синтетазе, необходимой для синтеза тРНК, нагруженной гистидином. [15] Они тесно связаны с полимиозитом и дерматомиозитом и редко встречаются при других заболеваниях соединительной ткани. Около 20–40% случаев полимиозита являются положительными по антителам Jo-1, и у большинства из них наблюдаются интерстициальные заболевания легких, маркеры HLA-DR3 и HLA-DRw52 человеческого лейкоцитарного антигена (HLA); известный под общим названием синдром Джо-1. [26] [36]
Анти-дцДНК [ править ]

Антитела против двухцепочечной ДНК (анти-дцДНК) тесно связаны с СКВ. Они являются очень специфичным маркером заболевания, причем некоторые исследования указывают почти на 100%. [8] Данные о чувствительности колеблются от 25 до 85%. Уровни антител против дцДНК, известные как титры, коррелируют с активностью заболевания при СКВ; высокие уровни указывают на более активную волчанку. Наличие антител против дцДНК также связано с волчаночным нефритом , и есть доказательства того, что они являются его причиной. Некоторые антитела против дцДНК перекрестно реагируют с другими антигенами, обнаруженными на базальной мембране клубочков (GBM) почек, такими как гепарансульфат , коллаген IV, фибронектин и ламинин . Связывание этих антигенов в почках может вызвать воспаление и фиксацию комплемента , что приводит к повреждению почек. Было показано, что наличие высокого уровня связывания ДНК и низкого уровня C3 имеет чрезвычайно высокую прогностическую ценность (94%) для диагностики СКВ. [37] Также возможно, что антитела против дцДНК интернализуются клетками, когда они связывают мембранные антигены, а затем отображаются на поверхности клетки. Это может способствовать воспалительной реакции Т-клеток в почках. Важно отметить, что не все антитела против дцДНК связаны с волчаночным нефритом и что при их отсутствии этот симптом могут вызвать другие факторы. Антиген антител против дцДНК представляет собой двухцепочечную ДНК . [38] [39]
Антигистоновые антитела
Антигистоновые антитела обнаруживаются в сыворотке до 75–95% людей с лекарственной волчанкой и у 75% идиопатической СКВ. В отличие от антител против дцДНК при СКВ, эти антитела не фиксируют комплемент. [ нужна ссылка ] Хотя они чаще всего обнаруживаются при лекарственной волчанке, их также обнаруживают в некоторых случаях СКВ, склеродермии , ревматоидного артрита и недифференцированных заболеваний соединительной ткани . Известно, что многие лекарства вызывают лекарственную волчанку и образуют различные антигенные мишени внутри нуклеосомы, которые часто перекрестно реагируют с несколькими гистоновыми белками и ДНК. Прокаинамид вызывает форму лекарственной волчанки, при которой вырабатываются антитела к комплексу гистонов H2A и H2B. [40] [41]
Анти-gp210 и анти-p62 [ править ]
Как антитела к гликопротеину-210 (анти-gp210), так и антитела к нуклеопорину 62 (анти-p62) представляют собой антитела к компонентам ядерной мембраны и обнаруживаются при первичном билиарном циррозе печени (ПБЦ). Каждое антитело присутствует примерно в 25–30% ПБЦ. Антигены обоих антител являются составляющими ядерной мембраны . gp210 представляет собой белок массой 200 кДа, участвующий в прикреплении компонентов ядерной поры к ядерной мембране. Антиген p62 представляет собой комплекс ядерных пор массой 60 кДа. [42] [43]
Антицентромерные антитела
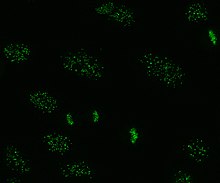
Антицентромерные антитела связаны с ограниченным кожным системным склерозом, также известным как синдром CREST , первичным билиарным циррозом печени и проксимальной склеродермией. [44] Известно шесть антигенов, все из которых связаны с центромерой ; CENP-A – CENP-F. CENP-A представляет собой белок, подобный гистону H3, массой 17 кДа . CENP-B представляет собой ДНК-связывающий белок массой 80 кДа, участвующий в сворачивании гетерохроматина . CENP-C представляет собой белок массой 140 кДа, участвующий в сборке кинетохор . CENP-D представляет собой белок массой 50 кДа с неизвестной функцией, но может быть гомологичен другому белку, участвующему в конденсации хроматина , RCC1 . CENP-E представляет собой белок массой 312 кДа из семейства моторных белков кинезина . CENP-F представляет собой белок ядерного матрикса массой 367 кДа, который связывается с кинетохорой в поздней фазе G2 во время митоза. Антитела CENP-A, B и C встречаются наиболее часто (16–42% случаев системной склеродермии) и связаны с феноменом Рейно, телеангиэктазиями , поражением легких и ранним началом системной склеродермии. [33] [45] [46]
Анти-sp100 [ править ]
Антитела против sp100 обнаруживаются примерно в 20–30% случаев первичного билиарного цирроза печени (ПБЦ). Они обнаруживаются у немногих людей без ПБЦ и поэтому являются очень специфичным маркером заболевания. Антиген sp100 находится в ядерных тельцах; большие белковые комплексы в ядре, которые могут играть роль в росте и дифференцировке клеток. [47]
Анти-PM-Scl [ править ]
Антитела против PM-Scl обнаруживаются почти в 50% случаев синдрома перекрытия полимиозита/системной склеродермии (PM/SSc) . Около 80% людей, у которых в сыворотке крови присутствуют антитела, страдают этим заболеванием. Присутствие антител связано с ограниченным поражением кожи при синдроме перекрытия ПМ/ССД. Антигенными мишенями антител являются компоненты РНК -процессинга экзосомного комплекса в ядрышке . [33] В этот комплекс входят десять белков, и антитела к восьми из них обнаруживаются с разной частотой; PM/Scl-100 (70–80%), PM/Scl-75 (46–80%), hRrp4 (50%), hRrp42 (21%), hRrp46 (18%), hCs14 (14%), hRrp41 ( 10%) и hRrp40 (7%). [48]
против DFS70 Антитела
Антитела против DFS70 образуют плотный мелкий пятнистый рисунок при непрямой иммунофлуоресценции и обнаруживаются в норме и при различных состояниях, но не связаны с системной аутоиммунной патологией. Следовательно, их можно использовать, чтобы исключить такие состояния у ANA-позитивных людей. У значительного числа пациентов диагностируется системная красная волчанка или недифференцированное заболевание соединительной ткани, в основном на основании положительного АНА. В случае, если определенные аутоантитела не могут быть обнаружены (например, антитела против ENA), для подтверждения диагноза рекомендуется тестирование антител против DFS70. Тесты на антитела к DFS70 доступны в виде тестов с маркировкой CE. До сих пор не существует одобренного FDA анализа. [49]
ANA-тест [ править ]


Наличие АНА в крови можно подтвердить с помощью скринингового теста. Хотя существует множество тестов для обнаружения АНА, наиболее распространенными тестами, используемыми для скрининга, являются непрямая иммунофлуоресценция и иммуноферментный анализ (ИФА). [50] После обнаружения ANA определяются различные подтипы. [8]
Непрямая иммунофлуоресценция [ править ]
Непрямая иммунофлуоресценция является одним из наиболее часто используемых тестов на АНА. Обычно клетки HEp-2 используются в качестве субстрата для обнаружения антител в сыворотке человека. Предметные стекла микроскопа покрыты клетками HEp-2, и сыворотка инкубируется с клетками. Если указанные и целевые антитела присутствуют, они будут связываться с антигенами на клетках; в случае ANA антитела связываются с ядром. Их можно визуализировать, добавив с флуоресцентной меткой (обычно FITC античеловеческое антитело или родопсин B), которое связывается с антителами. Молекула будет флуоресцировать, когда на нее светит свет определенной длины волны, что можно увидеть под микроскопом. В зависимости от антитела, присутствующего в сыворотке человека, и локализации антигена в клетке, на клетках HEp-2 будут наблюдаться различные образцы флуоресценции. [51] [52] Уровни антител анализируются путем разведения сыворотки крови. Тест на АНА считается положительным, если флуоресценция наблюдается при титре 1:40/1:80. Более высокие титры более клинически значимы, поскольку низкие положительные результаты (<1:160) обнаруживаются у 20% здоровых людей, особенно у пожилых людей. Лишь около 5% здорового населения имеют титры АНА 1:160 или выше. [8] [53]
ТЭП-2 [ править ]
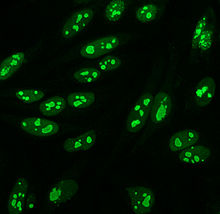
Примерно до 1975 года, когда были введены клетки HEp-2, ткани животных использовались в качестве стандартного субстрата для иммунофлуоресценции. [11] Клетки HEp-2 в настоящее время являются одним из наиболее распространенных субстратов для обнаружения АНА методом иммунофлуоресценции. [54]
Первоначально возникший штамм карциномы гортани, клеточная линия была загрязнена и вытеснена клетками HeLa , и теперь ее идентифицируют как клетки HeLa. [55]
Они превосходят ранее использовавшиеся ткани животных из-за большого размера и высокой скорости митоза (деление клеток) в клеточной линии . Это позволяет обнаруживать антитела к митоз-специфичным антигенам, например центромерные антитела. Они также позволяют идентифицировать антитела против Ro, поскольку ацетон (другие фиксаторы могут вымыть антиген). используется для фиксации клеток [56]
На клетках HEp-2 наблюдается множество моделей окрашивания ядер: гомогенное, крапчатое, ядрышковое, ядерно-мембранозное, центромерное, ядерное точечное и плеоморфное. Гомогенная картина наблюдается при окрашивании конденсированных хромосом и интерфазного хроматина . Этот паттерн связан с антителами против дцДНК , антителами к нуклеосомным компонентам и антителами против гистонов. Есть два крапчатых узора: мелкий и грубый. Мелкий крапчатый рисунок имеет мелкое ядерное окрашивание с неокрашенным метафазным хроматином, который связан с антителами против Ro и против La. Грубая картина окрашивания имеет крупнозернистое ядерное окрашивание, вызванное антителами против U1-RNP и против Sm. Характер ядрышкового окрашивания связан со многими антителами, включая анти-Scl-70, анти-PM-Scl, анти-фибрилларин и анти-Th/To. Окрашивание ядерной мембраны проявляется в виде флуоресцентного кольца вокруг ядра клетки и вызывается антителами анти-gp210 и анти-p62. На центромерном рисунке видны множественные ядерные точки. в интерфазных и митотических клетках, что соответствует числу хромосом в клетке. клетках имеется от 13 до 25 ядерных точек На рисунках ядерных точек в интерфазных , которые продуцируются антителами против sp100 . Плеоморфный паттерн обусловлен антителами к ядерному антигену пролиферирующей клетки . [26] [53] [57] [58] Было показано, что непрямая иммунофлуоресценция немного превосходит ELISA при обнаружении ANA в клетках HEp-2. [54]
Crithidia luciliae [ править ]

Crithidia luciliae — гемофлагелатные одноклеточные протисты . Их используют в качестве субстрата в иммунофлуоресценции для обнаружения антител против дцДНК. Они обладают органеллой, известной как кинетопласт , которая представляет собой большую митохондрию с сетью взаимосвязанных кольцевых молекул дцДНК. После инкубации с сывороткой, содержащей антитела против дцДНК и флуоресцентно-меченные античеловеческие антитела, кинетопласт будет флуоресцировать. Отсутствие других ядерных антигенов в этой органелле означает, что использование C. luciliae в качестве субстрата позволяет специфично выявлять антитела против дцДНК. [8] [59] [60]
ИФА [ править ]
В иммуноферментном анализе используются покрытые антигеном микротитровальные планшеты . (ИФА) для обнаружения АНА [61] Каждая лунка микротитровального планшета покрыта либо одним антигеном, либо несколькими антигенами для обнаружения специфических антител или для скрининга ANA соответственно. Антигены происходят либо из клеточных экстрактов, либо из рекомбинантных. Сыворотка крови инкубируется в лунках планшета и отмывается. Если присутствуют антитела, связывающиеся с антигеном, они останутся после промывания. вторичное античеловеческое антитело, конъюгированное с таким ферментом, как пероксидаза хрена Добавляют . Ферментативная реакция приведет к изменению цвета раствора, пропорциональному количеству антител, связанных с антигеном. [11] [52] [62] Существуют значительные различия в обнаружении АНА с помощью иммунофлуоресценции и различных наборов ИФА, и между ними существует лишь незначительное согласие. Врач должен быть знаком с различиями, чтобы оценить результаты различных анализов. [61]
Чувствительность [ править ]
В следующей таблице указана чувствительность различных типов АНА к различным заболеваниям.
| тип АНА | Целевой антиген | Чувствительность (%) | ||||||
|---|---|---|---|---|---|---|---|---|
| СЛЕ | Лекарственная LE | Диффузный системный склероз | Ограниченная системная склеродермия | синдром Шегрена | Воспалительная миопатия | МЦТД | ||
| Все АНА (косвенным ЕСЛИ ) | Различный | 95 [63] | 100 [63] | 80 [63] | 80 [63] | 70 [63] | 40–60 | 95 [63] |
| Анти-дцДНК | ДНК | 60 [63] | – [63] | – [63] | – [63] | 30 [63] | – | - [63] |
| Анти-См | Основные белки мяРНП | 40 [63] | – [63] | – [63] | – [63] | – [63] | – | - [63] |
| Антигистон | Гистоны | 60 [63] | 90 [63] | – [63] | – [63] | – [63] | – | - [63] |
| Анти Scl-70 | Топоизомераза I типа | – [63] | – [63] | 20 [63] | 10 [63] | – [63] | – | - [63] |
| Антицентромерный | Центромерные белки | – [63] | – [63] | 30 [63] | 80 [63] | – [63] | – | - [63] |
| СС-А (Румыния) | РНП | 40 [63] | – [63] | – [63] | – [63] | 50 [63] | 10 | - [63] |
| СС-Б (Ла) | РНП | 10–15 | – | – | – | 60–90 | – | |
| – = чувствительность менее 5 % | ||||||||
Некоторые ANA появляются при нескольких типах заболеваний, что приводит к снижению специфичности теста. Например, было показано, что IgM- ревматоидный фактор (IgM-RF) перекрестно реагирует с ANA, вызывая ложноположительную иммунофлюоресценцию . [64] Положительные ANA-антитела, а также антитела против ДНК были зарегистрированы у пациентов с аутоиммунным заболеванием щитовидной железы . [65] [66] ANA может иметь положительный результат теста у до 45% людей с аутоиммунными заболеваниями щитовидной железы или ревматоидным артритом и до 15% людей с ВИЧ или гепатитом С. [66] [67] [68] [69] По данным Американского фонда волчанки , «около 5% населения в целом будут иметь положительный ANA. Однако по крайней мере 95% людей, у которых есть положительный ANA, не страдают волчанкой. Положительный тест ANA может иногда передаваться в семьях. даже если у членов семьи нет признаков волчанки». [10] С другой стороны, говорят они, хотя 95% пациентов с волчанкой на самом деле имеют положительный тест на АНА, «лишь небольшой процент имеет отрицательный АНА, и у многих из них есть другие антитела (такие как антифосфолипидные антитела, анти-фосфолипидные антитела , анти -фосфолипидные антитела, Ro, анти-SSA) или их ANA, преобразованная из положительной в отрицательную под воздействием стероидов , цитотоксических препаратов или уремии (почечной недостаточности)». [10]
История [ править ]

Клетка LE была обнаружена в костном мозге в 1948 году Харгрейвсом и соавт. [70] В 1957 г. Холборов и др. впервые продемонстрировал АНА с помощью непрямой иммунофлуоресценции. [71] Это было первое указание на то, что за СКВ ответственны процессы, затрагивающие клеточное ядро. В 1959 году было обнаружено, что сыворотка людей с СКВ содержит антитела, которые осаждаются солевыми экстрактами ядер, известные как экстрагируемые ядерные антигены (ЭНА). Это привело к характеристике антигенов ENA и соответствующих им антител. Так, антитела против Sm и против RNP были открыты в 1966 и 1971 годах соответственно. В 1970-х годах были открыты антитела анти-Ro/анти-SS-A и анти-La/анти-SS-B. В 1979 году было известно, что антитело Scl-70 является специфическим антителом против склеродермии, однако антиген (топоизомераза-I) не был охарактеризован до 1986 года. Антиген и антитело Jo-1 были охарактеризованы в 1980 году. [8] [20]
См. также [ править ]
Ссылки [ править ]
- ^ Аль-Мугхалес Дж.А. (2022). «Характеристики антиядерных антител у больных системной красной волчанкой и их корреляция с другими диагностическими иммунологическими показателями» . Фронт Иммунол . 13 : 850759. дои : 10.3389/fimmu.2022.850759 . ПМЦ 8964090 . ПМИД 35359932 .
Небольшие правки Микаэль Хэггстрем, доктор медицинских наук
- Международная лицензия Attribution 4.0 (CC BY 4.0) - ^ «Медицинские предметные рубрики (МеШ)» . Национальная медицинская библиотека . Проверено 12 февраля 2013 г.
- ^ Jump up to: Перейти обратно: а б Рис, Джейн, Кэмпбелл, Нил (2005). Биология (7-е изд.). Сан-Франциско: Пирсон/Бенджамин-Каммингс. ISBN 978-0805371468 . [ нужна страница ]
- ^ Сервера Р., Фонт, Х., Рамос-Касальс, М., Гарсия-Карраско, М., Росас, Х., Морла, Р.М., Муньос, Ф.Дж., Артигес, А., Палларес, Л., Ингельмо, М. (2000). «Первичный синдром Шегрена у мужчин: клинико-иммунологическая характеристика». Волчанка . 9 (1): 61–4. дои : 10.1177/096120330000900111 . ПМИД 10713648 . S2CID 39696993 .
- ^ Барнетт А.Дж., Макнейладж, Эл.Дж. (май 1993 г.). «Антинуклеарные антитела у больных склеродермией (системной склеродермией) и у их кровных родственников и супругов» . Анналы ревматических болезней . 52 (5): 365–8. дои : 10.1136/ard.52.5.365 . ПМЦ 1005051 . ПМИД 8323384 .
- ^ Бердт М.А., Хоффман, Роберт В., Дойчер, Сьюзен Л., Ван, Грейс С., Джонсон, Джейн К., Шарп, Гордон К. (1 мая 1999 г.). «Долгосрочный результат смешанного заболевания соединительной ткани: продольные клинические и серологические данные». Артрит и ревматизм . 42 (5): 899–909. doi : 10.1002/1529-0131(199905)42:5<899::AID-ANR8>3.0.CO;2-L . ПМИД 10323445 .
- ^ Обермайер-Штрауб П., Страсбург, КП, Маннс, член парламента (2000). «Аутоиммунный гепатит». Журнал гепатологии . 32 (1 приложение): 181–97. дои : 10.1016/S0168-8278(00)80425-0 . ПМИД 10728804 .
- ^ Jump up to: Перейти обратно: а б с д и ж г час я дж Кавано А., Томар Р., Ревей Дж., Соломон Д.Х., Хомбургер Х.А. (январь 2000 г.). «Руководство по клиническому использованию теста на антинуклеарные антитела и тестов на специфические аутоантитела к ядерным антигенам. Американский колледж патологов». Архивы патологии и лабораторной медицины . 124 (1): 71–81. doi : 10.5858/2000-124-0071-GFCUOT . ПМИД 10629135 .
- ^ Тан Э.М., Фельткамп, Т.Э., Смолен, Дж.С., Батчер, Б., Докинз, Р., Фритцлер, М.Дж., Гордон, Т., Хардин, Дж.А., Калден, Дж.Р., Лахита, Р.Г. , Майни, Р.Н., Макдугал, Дж.С., Ротфилд, Н.Ф. , Сминк, Р.Дж., Такасаки, Ю., Вийк, А., Уилсон, М.Р., Козиол, Дж.А. (сентябрь 1997 г.). «Диапазон антинуклеарных антител у «здоровых» людей». Артрит и ревматизм . 40 (9): 1601–11. дои : 10.1002/арт.1780400909 . ПМИД 9324014 .
- ^ Jump up to: Перейти обратно: а б с «Тест на антинуклеарные антитела: что это значит» . Американский фонд волчанки . Проверено 7 июня 2013 г.
- ^ Jump up to: Перейти обратно: а б с д Кумар Ю., Бхатия А., Минц Р.В. (2 января 2009 г.). «Антинуклеарные антитела и методы их обнаружения в диагностике заболеваний соединительной ткани: новое путешествие» . Диагностическая патология . 4 :1. дои : 10.1186/1746-1596-4-1 . ПМЦ 2628865 . ПМИД 19121207 .
- ^ Jump up to: Перейти обратно: а б с д Ямамото К. (январь 2003 г.). «Патогенез синдрома Шегрена». Аутоиммун Рев . 2 (1): 13–8. дои : 10.1016/S1568-9972(02)00121-0 . ПМИД 12848970 .
- ^ Ричардсон Б., Эпштейн, Западная Вирджиния (сентябрь 1981 г.). «Полезность флуоресцентного теста на антинуклеарные антитела у одного пациента». Анналы внутренней медицины . 95 (3): 333–8. дои : 10.7326/0003-4819-95-3-333 . ПМИД 7023311 .
- ^ Маллесон П.Н., Маккиннон М.Дж., Зайлер-Хук М., Спенсер CH (2010). «Обзор для специалиста: Тест на антинуклеарные антитела у детей – когда его использовать и что делать при положительном титре» . Педиатр Ревматол Онлайн Дж . 8:27 . дои : 10.1186/1546-0096-8-27 . ПМЦ 2987328 . ПМИД 20961429 .
- ^ Jump up to: Перейти обратно: а б Дамуазо Ж.Г., Терварт Дж.В. (январь 2006 г.). «От ANA к ENA: как действовать?». Обзоры аутоиммунитета . 5 (1): 10–7. дои : 10.1016/j.autrev.2005.05.007 . ПМИД 16338206 .
- ^ Jump up to: Перейти обратно: а б Венцель Дж., Гердсен Р., Юрлих М., Бауэр Р., Бибер Т., Бём И. (декабрь 2001 г.). «Антитела, нацеленные на экстрагируемые ядерные антигены: историческое развитие и современные знания». Британский журнал дерматологии . 145 (6): 859–67. дои : 10.1046/j.1365-2133.2001.04577.x . ПМИД 11899137 . S2CID 45350044 .
- ^ Jump up to: Перейти обратно: а б Эрнандес-Молина Г., Леаль-Алегри Г., Мишель-Перегрина М. (январь 2011 г.). «Значение антител против Ro и против La при первичном синдроме Шегрена». Обзоры аутоиммунитета . 10 (3): 123–5. дои : 10.1016/j.autrev.2010.09.001 . ПМИД 20833272 .
- ^ Кассан СС, Мутсопулос, Его Величество (июнь 2004 г.). «Клинические проявления и ранняя диагностика синдрома Шегрена». Arch Intern Med . 164 (12): 1275–84. дои : 10.1001/archinte.164.12.1275 . ПМИД 15226160 .
- ^ Дефенденти К, Ацени, Ф, Спина, МФ, Гроссо, С, Середа, А, Герчилена, Г, Боллани, С, Сайбени, С, Путтини, ПС (январь 2011 г.). «Клинические и лабораторные аспекты аутоантител Ro/SSA-52». Обзоры аутоиммунитета . 10 (3): 150–4. дои : 10.1016/j.autrev.2010.09.005 . ПМИД 20854935 .
- ^ Jump up to: Перейти обратно: а б с Венейблс П.Дж. (июнь 2004 г.). «Синдром Шегрена». Лучшие практики и исследования. Клиническая ревматология . 18 (3): 313–29. дои : 10.1016/j.berh.2004.02.010 . ПМИД 15158743 .
- ^ Клоуз М.Э., Юди А.М., Кирнан Э., Уильямс М.Р., Бермас Б., Чакраварти Э., Саммаритано Л.Р., Чемберс К.Д., Буйон Дж. (1 июля 2018 г.). «Профилактика, скрининг и лечение врожденной блокады сердца при неонатальной волчанке: обзор практики поставщиков услуг» . Ревматология . 57 (дополнение_5): v9–v17. doi : 10.1093/ревматология/key141 . ISSN 1462-0332 . ПМК 6099126 . ПМИД 30137589 .
- ^ Сонессон С.Е., Хедлунд М., Амбрози А., Варен-Херлениус М. (1 октября 2017 г.). «Факторы, влияющие на сердечную проводимость плода при анти-Ro/SSA-позитивной беременности» . Ревматология . 56 (10): 1755–1762. doi : 10.1093/ревматология/kex263 . ISSN 1462-0332 . ПМИД 28957562 . S2CID 3803597 .
- ^ Скофилд Р.Х. (8 мая 2004 г.). «Аутоантитела как предикторы заболеваний». Ланцет . 363 (9420): 1544–6. дои : 10.1016/S0140-6736(04)16154-0 . ПМИД 15135604 . S2CID 13983923 .
- ^ Дешмук У.С., Багавант Х., Льюис Дж., Гаскин Ф., Фу С.М. (ноябрь 2005 г.). «Эпитоп, распространяющийся внутри волчаночно-ассоциированных рибонуклеопротеиновых антигенов». Клиническая иммунология (Орландо, Флорида) . 117 (2): 112–20. дои : 10.1016/j.clim.2005.07.002 . ПМИД 16095971 .
- ^ Бен-Четрит Э (май 1993 г.). «Молекулярная основа антигенов SSA/Ro и клиническое значение их аутоантител». Британский журнал ревматологии . 32 (5): 396–402. дои : 10.1093/ревматология/32.5.396 . ПМИД 8495261 .
- ^ Jump up to: Перейти обратно: а б с д фон Мюлен, Калифорния, Тан, Э.М. (апрель 1995 г.). «Аутоантитела в диагностике системных ревматических заболеваний». Семинары по артриту и ревматизму . 24 (5): 323–58. дои : 10.1016/S0049-0172(95)80004-2 . ПМИД 7604300 .
- ^ Лайонс Р., Нараин С., Николс К., Сато М., Ривз В.Х. (июнь 2005 г.). «Эффективное использование тестов на аутоантитела в диагностике системных аутоиммунных заболеваний». Анналы Нью-Йоркской академии наук . 1050 (1): 217–28. Бибкод : 2005NYASA1050..217L . дои : 10.1196/анналы.1313.023 . ПМИД 16014537 . S2CID 7150107 .
- ^ Зиве Г.В., Хусиал, PR (сентябрь 2003 г.). «Иммунный ответ против Sm в аутоиммунитете и клеточной биологии». Обзоры аутоиммунитета . 2 (5): 235–40. дои : 10.1016/S1568-9972(03)00018-1 . ПМИД 12965173 .
- ^ Мильорини П., Бальдини К., Рокки В., Бомбардьери С. (февраль 2005 г.). «Антитела к Sm и анти-РНП». Аутоиммунитет . 38 (1): 47–54. дои : 10.1080/08916930400022715 . ПМИД 15804705 . S2CID 1627719 .
- ^ Бенито-Гарсия Э., Шур, PH, Лахита, Р., Специальный комитет Американского колледжа ревматологии по иммунологическому тестированию, Рекомендации (15 декабря 2004 г.). «Методические рекомендации по проведению иммунологических лабораторных исследований при ревматических заболеваниях: тесты на антитела к Sm и к RNP». Артрит и ревматизм . 51 (6): 1030–44. дои : 10.1002/арт.20836 . ПМИД 15593352 .
- ^ Венейблс П.Дж. (2006). «Смешанное заболевание соединительной ткани» . Волчанка . 15 (3): 132–7. дои : 10.1191/0961203306lu2283rr . ПМИД 16634365 . S2CID 25736411 .
- ^ Хименес С.А., Дерк, Коннектикут (6 января 2004 г.). «Следуя молекулярным путям к пониманию патогенеза системной склеродермии». Анналы внутренней медицины . 140 (1): 37–50. дои : 10.7326/0003-4819-140-2-200401200-00013 . ПМИД 14706971 .
- ^ Jump up to: Перейти обратно: а б с Хо КТ, Ревей, JD (2003). «Клиническое значение аутоантител при склеродермии» . Исследования и терапия артрита . 5 (2): 80–93. дои : 10.1186/ar628 . ПМК 165038 . ПМИД 12718748 .
- ^ Малер М., Сильверман Э.Д., Шульте-Пелкум Дж., Фрицлер М.Дж. (сентябрь 2010 г.). «Антитела к Scl-70 (топо-I) при СКВ: миф или реальность?». Аутоиммун Рев . 9 (11): 756–60. дои : 10.1016/j.autrev.2010.06.005 . ПМИД 20601198 .
- ^ Гульднер Х.Х., Шостецкий К., Восберг Х.П., Лакомек Х.Дж., Пеннер Э., Баутц Ф.А. (1986). «Аутоантитела к Scl 70 больных склеродермией распознают белок массой 95 кДа, идентифицированный как ДНК-топоизомераза I». Хромосома . 94 (2): 132–8. дои : 10.1007/BF00286991 . ПМИД 2428564 . S2CID 24851422 .
- ^ Шмидт В.А., Ветцель В., Фридлендер Р., Ланге Р., Соренсен Х.Ф., Личи Х.Дж., Гент Э., Мирау Р., Громница-Иле Э. (2000). «Клинические и серологические аспекты пациентов с антителами против Jo-1 - развивающийся спектр проявлений заболевания». Клиническая ревматология . 19 (5): 371–7. дои : 10.1007/s100670070030 . ПМИД 11055826 . S2CID 3014699 .
- ^ Вайнштейн А., Бордвелл Б., Стоун Б., Тиббеттс С., Ротфилд Н.Ф. (февраль 1983 г.). «Антитела к нативной ДНК и уровням сывороточного комплемента (C3). Применение для диагностики и классификации системной красной волчанки». Американский медицинский журнал . 74 (2): 206–16. дои : 10.1016/0002-9343(83)90613-7 . ПМИД 6600582 .
- ^ Мок CC, Лау, CS (июль 2003 г.). «Патогенез системной красной волчанки» . Журнал клинической патологии . 56 (7): 481–90. дои : 10.1136/jcp.56.7.481 . ПМЦ 1769989 . ПМИД 12835292 .
- ^ Юнг С., Чан, ТМ (февраль 2008 г.). «Анти-ДНК-антитела в патогенезе волчаночного нефрита - новые механизмы». Обзоры аутоиммунитета . 7 (4): 317–21. дои : 10.1016/j.autrev.2007.12.001 . ПМИД 18295737 .
- ^ Васу С (2006). «Лекарственная волчанка: обновленная информация». Волчанка . 15 (11): 757–61. дои : 10.1177/0961203306070000 . ПМИД 17153847 . S2CID 17593016 .
- ^ Кац У, Зандман-Годдард, Дж. (ноябрь 2010 г.). «Лекарственная волчанка: обновленная информация». Обзоры аутоиммунитета . 10 (1): 46–50. дои : 10.1016/j.autrev.2010.07.005 . ПМИД 20656071 .
- ^ Ху Т, Гуан Т, Джераче Л (август 1996 г.). «Молекулярная и функциональная характеристика комплекса p62, совокупности гликопротеинов комплекса ядерных пор» . Журнал клеточной биологии . 134 (3): 589–601. дои : 10.1083/jcb.134.3.589 . ПМК 2120945 . ПМИД 8707840 .
- ^ Маккей И.Р., Уиттингем, С., Фида, С., Майерс, М., Икуно, Н., Гершвин, М.Э., Роули, М.Дж. (апрель 2000 г.). «Особый аутоиммунитет первичного билиарного цирроза». Иммунологические обзоры . 174 : 226–37. дои : 10.1034/j.1600-0528.2002.017410.x . ПМИД 10807519 . S2CID 596338 .
- ^ Калленберг К.Г. (март 1990 г.). «Антицентромерные антитела (ACA)». Клиническая ревматология . 9 (1 Приложение 1): 136–9. дои : 10.1007/BF02205562 . ПМИД 2203592 . S2CID 43833409 .
- ^ Раттнер Дж. Б., Мак Г. Дж., Фрицлер М. Дж. (июль 1998 г.). «Аутоантитела к компонентам митотического аппарата». Отчеты по молекулярной биологии . 25 (3): 143–55. дои : 10.1023/А:1016523013819 . ПМИД 9700050 . S2CID 8595680 .
- ^ Ренц Х (2012). Аутоиммунная диагностика . Берлин: Де Грюйтер. ISBN 978-3-11-022864-9 .
- ^ Ворман Х.Дж., Курвалин Дж.К. (июнь 2003 г.). «Антинуклеарные антитела, специфичные для первичного билиарного цирроза». Обзоры аутоиммунитета . 2 (4): 211–7. дои : 10.1016/S1568-9972(03)00013-2 . ПМИД 12848948 .
- ^ Малер М., Райджмейкерс Р. (август 2007 г.). «Новые аспекты аутоантител к комплексу PM/Scl: клинические, генетические и диагностические данные». Обзоры аутоиммунитета . 6 (7): 432–7. дои : 10.1016/j.autrev.2007.01.013 . ПМИД 17643929 .
- ^ Малер М., Мерони П.Л., Андраде Л.Е., Хамашта М., Биццаро Н., Касиано К.А., Фрицлер М.Дж. (2016). «На пути к лучшему пониманию клинической ассоциации аутоантител к DFS70». Обзоры аутоиммунитета . 15 (2): 198–201. дои : 10.1016/j.autrev.2015.11.006 . ПМИД 26588998 .
- ^ Гранито А., Муратори П., Кварнети С., Паппас Г., Чикола Р., Муратори Л. (январь 2012 г.). «Антинуклеарные антитела как вспомогательные маркеры при первичном билиарном циррозе». Экспертный обзор молекулярной диагностики . 12 (1): 65–74. дои : 10.1586/эр.11.82 . ПМИД 22133120 . S2CID 28444340 .
- ^ Кляйн ВБ (2000). Иммунофлуоресценция в клинической иммунологии: учебник и атлас . Базель [ua]: Биркхойзер. ISBN 978-3764361822 .
- ^ Jump up to: Перейти обратно: а б Гонсалес-Буитраго Х.М., Гонсалес, К. (март 2006 г.). «Настоящее и будущее лаборатории аутоиммунитета». Клиника Химика Акта; Международный журнал клинической химии . 365 (1–2): 50–7. дои : 10.1016/j.cca.2005.07.023 . ПМИД 16126186 .
- ^ Jump up to: Перейти обратно: а б Тоццоли Р., Биццаро Н., Тонутти Э., Вильялта Д., Бассетти Д., Манони Ф., Пьяцца А., Праделла М., Риццотти П. (февраль 2002 г.). «Методические рекомендации по лабораторному использованию тестов на аутоантитела в диагностике и мониторинге аутоиммунных ревматических заболеваний» . Американский журнал клинической патологии . 117 (2). Исследовательская группа Итальянского общества лабораторной медицины по диагностике аутоиммунных заболеваний: 316–24. doi : 10.1309/Y5VF-C3DM-L8XV-U053 . ПМИД 11863229 .
- ^ Jump up to: Перейти обратно: а б Ульвестад Э (март 2001 г.). «Рабочие характеристики и клиническая полезность гибридного ИФА для обнаружения АНА» . АПМИС . 109 (3): 217–22. дои : 10.1034/j.1600-0463.2001.090305.x . ПМИД 11430499 . S2CID 22229427 .
- ^ Лакруа М. (январь 2008 г.). «Постоянное использование «ложных» клеточных линий» . Межд. Дж. Рак . 122 (1): 1–4. дои : 10.1002/ijc.23233 . ПМИД 17960586 . S2CID 27432788 .
- ^ Керен Д.Ф. (июнь 2002 г.). «Тестирование антиядерных антител». Клиники лабораторной медицины . 22 (2): 447–74. дои : 10.1016/S0272-2712(01)00012-9 . ПМИД 12134471 .
- ^ Нешер Г., Маргалит Р., Ашкенази Ю.Дж. (апрель 2001 г.). «Антитела к ядерной оболочке: Клинические ассоциации». Семинары по артриту и ревматизму . 30 (5): 313–20. дои : 10.1053/sarh.2001.20266 . ПМИД 11303304 .
- ^ Сак У, Конрад, К, Чернок, Э, Франк, И, Хипе, Ф, Кригер, Т, Кромминга, А, Ланденберг, Пв, Мессер, Г, Витте, Т, Мирау, Р (июнь 2009 г.). «Обнаружение аутоантител методом непрямой иммунофлуоресценции на клетках HEp-2» (PDF) . Немецкий медицинский еженедельник . 134 (24). Немецкая группа EASI (Европейская инициатива по стандартизации аутоиммунитета): 1278–82. дои : 10.1055/s-0029-1225278 . ПМИД 19499499 . S2CID 260097757 .
- ^ Слейтер Н.Г., Кэмерон Дж.С., Лессоф М.Х. (сентябрь 1976 г.). «Иммунофлуоресцентный тест кинетопласта Crithidia luciliae при системной красной волчанке» . Клиническая и экспериментальная иммунология . 25 (3): 480–6. ПМЦ 1541410 . ПМИД 786521 .
- ^ Шапиро Т.А., Энглунд П.Т. (1995). «Строение и репликация ДНК кинетопластов». Ежегодный обзор микробиологии . 49 : 117–43. дои : 10.1146/annurev.mi.49.100195.001001 . ПМИД 8561456 .
- ^ Jump up to: Перейти обратно: а б Эмлен В., О'Нил Л. (сентябрь 1997 г.). «Клиническое значение антинуклеарных антител: сравнение обнаружения с иммунофлуоресцентным и иммуноферментным анализом». Артрит и ревматизм . 40 (9): 1612–8. дои : 10.1002/арт.1780400910 . ПМИД 9324015 .
- ^ Дешпанде, СС (1996). Иммуноферментные анализы: от концепции к разработке продукта . Лондон: Чепмен и Холл. ISBN 978-0-412-05601-7 .
- ^ Jump up to: Перейти обратно: а б с д и ж г час я дж к л м н тот п д р с т в v В х и С аа аб и объявление но из в ах есть также и аль являюсь а к ап Таблица 6-2 в: Элизабет Д. Агабеги, Агабеги, Стивен С. (2008). Шаг вперед к медицине (серия «Шаг вперед») . Хагерствон, доктор медицины: Липпинкотт Уильямс и Уилкинс. ISBN 978-0-7817-7153-5 .
- ^ Фрокьяер В.Г., Мортенсен, Эрик Л., Нильсен, Финн О., Хаугбол, Стивен, Пинборг, Ларс Х., Адамс, Карен Х., Сварер, Клаус, Хассельбальх, Стин Г., Холм, Серен, Полсон, Олаф Б. , Кнудсен, Гитте М. (29 февраля 2008 г.). «Связывание фронтолимбического рецептора серотонина 2А у здоровых людей связано с личностными факторами риска аффективного расстройства». Биологическая психиатрия . 63 (6): 569–576. doi : 10.1016/j.biopsych.2007.07.009 . ПМИД 17884017 . S2CID 25979780 .
- ^ Тектониду М.Г., Анаплиоту М., Влахояннопулос П., Мутсопулос Х.М. (1 сентября 2004 г.). «Наличие системных аутоиммунных нарушений у больных аутоиммунными заболеваниями щитовидной железы» . Анналы ревматических болезней . 63 (9): 1159–1161. дои : 10.1136/ard.2004.022624 . ПМЦ 1755126 . ПМИД 15308528 .
- ^ Jump up to: Перейти обратно: а б Петри М., Карлсон Э.В., Купер Д.С., Ладенсон П.В. (октябрь 1991 г.). «Тесты на аутоантитела при аутоиммунном заболевании щитовидной железы: исследование случай-контроль». Журнал ревматологии . 18 (10): 1529–31. ПМИД 1765977 .
- ^ Чарльз П.Дж., Сминк, Р.Дж.Т., Де Йонг, Дж., Фельдманн, М., Майни, Р.Н. (1 ноября 2000 г.). «Оценка антител к двухцепочечной ДНК, индуцированных у пациентов с ревматоидным артритом после лечения инфликсимабом, моноклональным антителом к фактору некроза опухоли α: результаты открытых и рандомизированных плацебо-контролируемых исследований». Артрит и ревматизм . 43 (11): 2383–2390. doi : 10.1002/1529-0131(200011)43:11<2383::AID-ANR2>3.0.CO;2-D . ПМИД 11083258 .
- ^ Кассани Ф, Каталета, М, Валентини, П, Муратори, П, Джостра, Ф, Франческони, Р, Муратори, Л, Лензи, М, Бьянки, Г, Заули, Д, Бьянки, ФБ (1 сентября 1997 г.). «Сывороточные аутоантитела при хроническом гепатите С: сравнение с аутоиммунным гепатитом и влияние на профиль заболевания» . Гепатология . 26 (3): 561–566. дои : 10.1002/hep.510260305 . ПМИД 9303483 . S2CID 3228360 .
- ^ Медина-Родригес Ф., Гусман, К., Хара, Л.Дж., Эрмида, К., Альбукрек, Д., Сервера, Х., Миранда, Дж.М., Фрага, А. (ноябрь 1993 г.). «Ревматические проявления у лиц, положительных и отрицательных по вирусу иммунодефицита человека: исследование двух популяций со схожими факторами риска». Журнал ревматологии . 20 (11): 1880–4. ПМИД 8308773 .
- ^ Харгрейвс М., Ричмонд Х., Мортон Р. Представление двух компонентов костного мозга: терпкой клетки и клетки LE. Мэйо Клин Proc 1948; 27: 25–28.
- ^ Холбороу Э.Дж., Вейр, Д.М., Джонсон, Г.Д. (28 сентября 1957 г.). «Сывороточный фактор при красной волчанке, обладающий сродством к ядрам тканей» . БМЖ . 2 (5047): 732–734. дои : 10.1136/bmj.2.5047.732 . ЧВК 1962253 . ПМИД 13460368 .
Внешние ссылки [ править ]
- Блог аутоиммунитета – обзор ANA HEp-2
- Антинуклеарные + антитела Национальной медицинской библиотеки США по медицинским предметным рубрикам (MeSH)
- Грейдингер Э.Л., Хоффман, Д.О., Роберт В. (31 января 2003 г.). «Обновление CE [химия | иммунология]: Тестирование на антинуклеарные антитела: методы, показания и интерпретация» . Лабораторная медицина . 34 (2): 113–117. дои : 10.1309/VUB90VTPMEWV3W0F .