Топоизомераза I типа
В этой статье отсутствует информация о блоке pfam для реального каталитического домена; член суперсемейства ферментов разрыва-воссоединения (BRE); связь между BRE и гомеобоксом AraC согласно ECOD. ( февраль 2021 г. ) |
| ДНК-топоизомераза I, N-концевая (некаталитическая), вирусная | |||
|---|---|---|---|
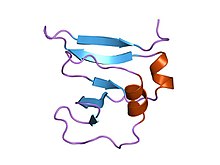 Аминоконцевой домен 9 кДа топоизомеразы i ДНК вируса коровьей оспы, остатки 1–77, экспериментальная электронная плотность для остатков 1–77 | |||
| Идентификаторы | |||
| Символ | VirDNA-topo-I_N | ||
| Пфам | PF09266 | ||
| ИнтерПро | ИПР015346 | ||
| ОБЛАСТЬ ПРИМЕНЕНИЯ 2 | 1vcc / СКОПе / СУПФАМ | ||
| |||
В молекулярной биологии топоизомеразы I типа представляют собой ферменты , которые разрезают одну из двух цепей двухцепочечной ДНК, расслабляют цепь и повторно отжигают ее. Далее они подразделяются на две структурно и механически различные топоизомеразы: тип IA и тип IB.
- Топоизомеразы типа IA изменяют число связей кольцевой цепи ДНК на единицы, равные строго 1.
- Топоизомеразы типа IB изменяют число связываний кратно 1 (n).
Исторически топоизомеразы типа IA называются прокариотическими топоизомеразами, а топоизомеразы типа IB - эукариотическими топоизомеразами. Однако это различие больше не применяется, поскольку топоизомеразы типа IA и типа IB существуют во всех сферах жизни.
Функционально эти подклассы выполняют очень специализированные функции. Прокариотическая топоизомераза I (topo IA) может релаксировать только отрицательную сверхспиральную ДНК, тогда как эукариотическая топоизомераза I (topo IB) может создавать положительные суперспирали, разделяя ДНК дочерних хромосом после репликации ДНК, и релаксировать ДНК.
Функция
[ редактировать ]Эти ферменты выполняют несколько функций: удалять суперспирали ДНК во время транскрипции и репликации ДНК ; для обрыва цепи при рекомбинации ; для конденсации хромосом ; и распутывать переплетенную ДНК во время митоза . [ 1 ] [ 2 ]
Структура
[ редактировать ]Этот домен предполагает складку бета(2)-альфа-бета-альфа-бета(2) с левым кроссинговером между цепями бета2 и бета3. Он имеет четыре перекрещенные бета-цепи, окруженные четырьмя альфа-спиралями, расположенными в виде складки Россмана. [ 3 ]
Механизмы
[ редактировать ]Топоизомеразы I типа являются АТФ -независимыми ферментами (кроме обратной гиразы и механизмам реакций подразделяются на ) и по строению тип IA (бактериальная и архейная топоизомераза I, топоизомераза III и обратная гираза) и тип IB (эукариотическая топоизомераза I и обратная гираза). топоизомераза V). Эти ферменты в первую очередь ответственны за расслабление положительно и/или отрицательно сверхспиральной ДНК, за исключением обратной гиразы, которая может создавать в ДНК положительные суперспирали.
ДНК -топоизомеразы регулируют количество топологических связей между двумя нитями ДНК (т.е. изменяют количество суперспиральных витков), катализируя временные одно- или двухцепочечные разрывы, пересекая цепи друг через друга, а затем повторно запечатывая разрывы. [ 4 ]
Классы
[ редактировать ]ДНК-топоизомеразы делятся на два класса: ферменты I типа ( ЭК ; топоизомеразы I, III и V) разрывают одноцепочечную ДНК, а ферменты II типа ( ЭК ; топоизомеразы II, IV и VI) разрывают двухцепочечную ДНК. [ 5 ]
Топоизомеразы типа IA
[ редактировать ]
Введение
[ редактировать ]Топоизомеразы типа IA, которые исторически считались обнаруженными у прокариот, создают одиночный разрыв в ДНК и пропускают через разрыв вторую цепь или дуплекс. Этот механизм прохождения цепи имеет несколько общих черт с топоизомеразами типа IIA. Они оба образуют 5'-промежуточный фосфотирозин, и для выполнения своей работы им требуется ион двухвалентного металла. В отличие от топоизомераз типа II , топоизомеразы типа IA не используют энергию для выполнения своей работы (за заметным исключением обратной гиразы, см. ниже).
Структура
[ редактировать ]Топоизомеразы типа IA имеют несколько доменов, часто число доменов 1–4. Домен I содержит домен Toprim (складка Россмана, которая, как известно, координирует ионы магния), домен IV и домен III состоят из домена спираль-поворот-спираль (HTH); каталитический тирозин находится в HTH домена III. Домен II представляет собой гибкий мост между доменами III и IV. Структура топоизомеразы типа IA напоминает замок, домены I, III и IV расположены в нижней части структуры. [ 6 ] Структура топо III (см. ниже), связанного с одноцепочечной ДНК. [ 7 ] (pdb id = 1I7D) показывает, как домены HTH и Toprim координируются вокруг ДНК.
Варианты топоизомеразы типа IA
[ редактировать ]Существует несколько вариантов топоизомераз типа IA, различающихся придатками, прикрепленными к основному ядру (иногда называемыми «топо-складкой»). Члены этого подкласса включают топо I, топо III (которые содержат дополнительные мотивы, связывающие цинк) и обратную гиразу. Обратная гираза представляет особый интерес, поскольку к ней присоединяется АТФазный домен, который напоминает геликазоподобный домен транскрипционного фактора Rho (структура обратной гиразы была раскрыта Родригесом и Стоком, EMBO J 2002). Фермент использует гидролиз АТФ для создания положительных суперспиралей и перекручивания ДНК - особенность, привлекательная для гипертермофилов, у которых, как известно, существует обратная гираза. Родригес и Сток проделали дальнейшую работу по выявлению «защелки», которая участвует в передаче гидролиза АТФ с введением положительных суперспиралей.
Вариант topo III также очень интересен, поскольку он имеет цинк-связывающие мотивы, которые, как полагают, связывают одноцепочечную ДНК. Было обнаружено, что Topo III связан с хеликазой BLM (синдром Блума) во время рекомбинации.
Механизм
[ редактировать ]Топоизомеразы типа IA действуют по механизму прохождения цепи с использованием одиночных ворот (в отличие от топоизомераз типа II). Во-первых, одноцепочечная ДНК связывает домены III и I. Каталитический тирозин расщепляет основную цепь ДНК, создавая временный 5'-промежуточный фосфотирозин. Затем разрыв разделяется, используя домен II в качестве шарнира, и через него пропускают второй дуплекс или цепь ДНК. Домен III и I закрываются, и ДНК повторно отжигается.
Топоизомеразы типа IB
[ редактировать ]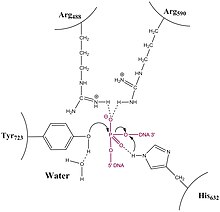

Введение
[ редактировать ]В отличие от топоизомераз типа IA, топоизомераза типа 1B решает проблему перемотки и недокрутки (также называемой положительно или отрицательно сверхспирализованной) ДНК посредством механизма затрудненного вращения. Кристаллические структуры, биохимия и эксперименты с отдельными молекулами внесли свой вклад в общий механизм. Фермент сначала обволакивает ДНК и создает единственный промежуточный 3'-фосфотирозин. Затем 5'-конец может свободно вращаться, скручивая его вокруг другой цепи, чтобы расслабить ДНК, пока топоизомераза повторно не свяжет разорванные цепи.
Структура
[ редактировать ]Решена структура topo IB, связанного с ДНК (pdb id = 1A36). Topo IB состоит из NTD, кэпирующей доли, каталитической доли и С-концевого домена. Покрывающая доля и каталитическая доля охватывают ДНК.
Механизм
[ редактировать ]Релаксация не является активным процессом, и энергия (в форме АТФ ) не расходуется на этапах надреза или лигирования; это связано с тем, что реакция между остатком тирозина в активном центре фермента с остовом фосфодиэфирной ДНК просто заменяет одну фосфомоноэфирную связь другой. Топоизомераза также не использует АТФ при раскручивании ДНК; скорее, крутящий момент, присутствующий в ДНК, приводит к раскручиванию и в среднем энергетически идет вниз. Недавние эксперименты с отдельными молекулами подтвердили то, что было предложено ранее в экспериментах по релаксации объемных плазмид, а именно, что раскручивание ДНК происходит за счет крутящего момента и продолжается до тех пор, пока не произойдет повторное лигирование. Никакие данные не позволяют предположить, что Topo IB «контролирует» поворот, поскольку у него есть механизм, который запускает повторное соединение после удаления определенного количества суперспиралей. Напротив, эксперименты на одиночных молекулах предполагают, что повторное лигирование является случайным процессом и имеет некоторую вероятность происходить каждый раз, когда поворотный 5'-ОН-конец оказывается в непосредственной близости от места прикрепления связанного с ферментом 3'-конца.
Топоизомеразы типа IB первоначально были идентифицированы у эукариот и вирусов. Вирусный топо I уникален, поскольку он связывает ДНК специфичным для последовательности образом.
в статье TOP1 Дополнительную информацию об этой хорошо изученной топоизомеразе типа 1B см. .
Топоизомеразы типа IC
[ редактировать ]Третий тип топоизомеразы I был идентифицирован, topo V, у археи Methanopyrus kandleri . Topo V является основателем и пока единственным членом топоизомеразы типа IC, хотя некоторые авторы предполагают, что она может иметь вирусное происхождение. [ 8 ] Кристаллическая структура топо V была решена. [ 9 ] Топоизомеразы типа IC действуют посредством управляемого вращательного механизма, во многом аналогично топоизомеразам типа IB. [ 10 ] (pdb ID = 2CSB и 2CSD ), но сгиб уникален.
Промежуточные продукты
[ редактировать ]Все топоизомеразы образуют промежуточный фосфотирозин между каталитическим тирозином фермента и разрезаемым фосфорилом основной цепи ДНК.
- Топоизомеразы типа IA образуют ковалентную связь между каталитическим тирозином и 5'-фосфорилом.
- Ферменты типа IB образуют ковалентный промежуточный продукт 3'-фосфотирозин.
- Топоизомеразы типа IC образуют ковалентный промежуточный 3'-фосфотирозин.
Этот промежуточный продукт является изоэнергетическим, что означает, что прямая реакция расщепления и обратная реакция религирования энергетически равны. Таким образом, для проведения этой реакции не требуется никакого внешнего источника энергии.
Торможение
[ редактировать ]Поскольку топоизомеразы генерируют разрывы в ДНК, они являются мишенью низкомолекулярных ингибиторов, которые ингибируют фермент. Топоизомераза типа 1 ингибируется иринотеканом , топотеканом , гексилрезорцином и камптотецином .
Фермент топоизомераза человека типа IB образует ковалентный промежуточный 3'-фосфотирозин, комплекс расщепления топоизомеразы 1 (Top1cc). Активный . метаболит иринотекана, SN-38 , действует путем захвата (создания тройного комплекса ) подмножества Top1cc, тех, которые содержат гуанин +1 в последовательности ДНК [ 11 ] Одна молекула SN-38, полученная из иринотекана, укладывается против пар оснований, фланкирующих сайт расщепления, индуцированного топоизомеразой, и отравляет (инактивирует) фермент топоизомеразы 1. [ 11 ]
При инфицировании бактериофагом (фагом) Т4 своего бактериального хозяина, Escherichia coli , в геноме фага определяется генный продукт (gp55.2), который ингибирует бактериальную топоизомеразу I. [ 12 ] Gp55.2 связывает ДНК и специфически блокирует релаксацию отрицательно сверхспиральной ДНК с помощью топоизомеразы I. Это ингибирование, по-видимому, является адаптацией, позволяющей тонко модулировать активность топоизомеразы I хозяина во время инфекции для обеспечения оптимального выхода фага.
Синтетическая летальность
[ редактировать ]Синтетическая летальность возникает, когда сочетание нарушений экспрессии двух или более генов приводит к гибели клеток, тогда как дефицит только одного из этих генов не приводит. Дефицит может возникнуть в результате мутации, эпигенетического изменения или ингибирования экспрессии гена.
Ингибирование топоизомеразы 1 является синтетически летальным при дефиците экспрессии определенных генов репарации ДНК. У пациентов-людей дефицитные гены репарации ДНК включают WRN. [ 13 ] и МРЭ11 . [ 14 ] В доклинических исследованиях, связанных с раком, дефектные гены репарации ДНК включают ATM. [ 15 ] и НДРГ1 . [ 16 ] [ 17 ]
Аутоантитела
[ редактировать ]Аутоантитела, нацеленные против топоизомеразы типа I, называются антителами против Scl-70 , названными в связи с склеродермии эродермией и экстрагируемым иммунореактивным фрагментом массой 70 кДа , который можно получить из более крупного (100-105 кДа) целевого антигена топоизомеразы (так называемого SCL). -70 Антиген) антител. [ 18 ]
Ссылки
[ редактировать ]- ^ Ван Дж.К. (июнь 2002 г.). «Клеточная роль ДНК-топоизомераз: молекулярная перспектива». Нат. Преподобный мол. Клеточная Биол . 3 (6): 430–40. дои : 10.1038/nrm831 . ПМИД 12042765 . S2CID 205496065 .
- ^ Шампу Джей-Джей (2001). «ДНК-топоизомеразы: структура, функции и механизм». Анну. Преподобный Биохим . 70 : 369–413. doi : 10.1146/annurev.biochem.70.1.369 . ПМИД 11395412 .
- ^ Шарма А; Ханаи Р; Мондрагон А (август 1994 г.). «Кристаллическая структура аминоконцевого фрагмента ДНК-топоизомеразы I вируса коровьей оспы при разрешении 1,6 А» . Структура . 2 (8): 767–77. дои : 10.1016/s0969-2126(94)00077-8 . ПМИД 7994576 .
- ^ Рока Дж (апрель 1995 г.). «Механизмы ДНК-топоизомераз». Тенденции биохимии. Наука . 20 (4): 156–60. дои : 10.1016/s0968-0004(00)88993-8 . ПМИД 7770916 .
- ^ Гадель Д., Файле Дж., Бюлер С., Фортер П. (март 2003 г.). «Филогеномика ДНК-топоизомераз типа II». Биоэссе . 25 (3): 232–42. дои : 10.1002/bies.10245 . ПМИД 12596227 . S2CID 4642743 .
- ^ Лима, CD; Ван, JC; Мондрагон, А (1994). «Трехмерная структура N-концевого фрагмента 67K ДНК-топоизомеразы I E. Coli». Природа . 367 (6459): 138–46. Бибкод : 1994Natur.367..138L . дои : 10.1038/367138a0 . ПМИД 8114910 . S2CID 4314431 .
- ^ Чангела, А; Дигейт, Р.Дж.; Мондрагон, А (2001). «Кристаллическая структура комплекса ДНК-топоизомеразы типа IA с одноцепочечной молекулой ДНК». Природа . 411 (6841): 1077–81. Бибкод : 2001Natur.411.1077C . дои : 10.1038/35082615 . ПМИД 11429611 . S2CID 4426078 .
- ^ Фортерре П (июнь 2006 г.). «ДНК-топоизомераза V: новая складка загадочного происхождения». Тенденции Биотехнологии . 24 (6): 245–7. дои : 10.1016/j.tibtech.2006.04.006 . ПМИД 16650908 .
- ^ Танеха Б., Патель А., Слесарев А., Мондрагон А. (январь 2006 г.). «Структура N-концевого фрагмента топоизомеразы V открывает новое семейство топоизомераз» . ЭМБО Дж . 25 (2): 398–408. дои : 10.1038/sj.emboj.7600922 . ПМК 1383508 . ПМИД 16395333 .
- ^ Танеха, Б; Шнурр, Б; Слесарев А; Марко, Дж. Ф.; Мондрагон, А (2007). «Топоизомераза V расслабляет сверхспиральную ДНК с помощью механизма ограниченного поворота» . Труды Национальной академии наук . 104 (37): 14670–5. Бибкод : 2007PNAS..10414670T . дои : 10.1073/pnas.0701989104 . ЧВК 1976220 . ПМИД 17804808 .
- ^ Jump up to: а б Помье Ю (2013). «Лекарственное воздействие топоизомераз: уроки и проблемы» . АКС хим. Биол . 8 (1): 82–95. дои : 10.1021/cb300648v . ПМЦ 3549721 . ПМИД 23259582 .
- ^ Маттенбергер Ю., Сильва Ф., Белин Д. 55.2, ген ORFan фага T4, кодирует ингибитор топоизомеразы I Escherichia coli и повышает приспособленность фага. ПЛОС Один. 14 апреля 2015 г.; 10(4):e0124309. doi: 10.1371/journal.pone.0124309. PMID: 25875362; PMCID: PMC4396842
- ^ Агрело Р., Ченг В.Х., Сетьен Ф., Роперо С., Эспада Дж., Фрага М.Ф., Херранц М., Пас М.Ф., Санчес-Сеспедес М., Артига М.Дж., Герреро Д., Кастельс А., фон Коббе С., Бор В.А., Эстеллер М. (2006) . «Эпигенетическая инактивация гена синдрома преждевременного старения Вернера при раке человека» . Учеб. Натл. акад. наук. США . 103 (23): 8822–7. Бибкод : 2006PNAS..103.8822A . дои : 10.1073/pnas.0600645103 . ПМЦ 1466544 . ПМИД 16723399 .
- ^ Павелиц Т., Ренфро Л., Фостер Н.Р., Каракол А., Уэлш П., Лао В.В., Грейди В.Б., Недзвецки Д., Зальц Л.Б., Бертаньолли М.М., Гольдберг Р.М., Рабинович П.С., Эмонд М., Моннат Р.Дж., Майзелс Н. (2014). «Дефицит MRE11 связан с улучшением долгосрочной безрецидивной выживаемости и общей выживаемости у подгруппы пациентов с раком толстой кишки III стадии в рандомизированном исследовании CALGB 89803» . ПЛОС ОДИН . 9 (10): e108483. Бибкод : 2014PLoSO...9j8483P . дои : 10.1371/journal.pone.0108483 . ПМК 4195600 . ПМИД 25310185 .
- ^ Субхаш В.В., Тан Ш., Йео М.С., Ян Ф.Л., Питала ПК, Лием Н., Кришнан В., Йонг В.П. (2016). «Экспрессия ATM предсказывает чувствительность Велипариба и Иринотекана при раке желудка, опосредуя независимую от P53 регуляцию клеточного цикла и апоптоза» . Мол. Рак Там . 15 (12): 3087–3096. дои : 10.1158/1535-7163.MCT-15-1002 . ПМИД 27638859 .
- ^ Виссинг М.Д., Мендонка Дж., Ким Э., Ким Е., Шим Дж.С., Кельбер Н.С., Кант Х., Хаммерс Х., Коммес Т., Ван Дист П.Дж., Лю Дж.О., Качхап С.К. (2013). «Идентификация бромида цетримония и иринотекана как соединений с синтетической летальностью против клеток рака предстательной железы с дефицитом NDRG1» . Рак Биол. Там . 14 (5): 401–10. дои : 10.4161/cbt.23759 . ПМЦ 3672184 . ПМИД 23377825 .
- ^ Доминик Дж., Боуман Дж., Ли Икс, Миллер Р.А., Гарсия Г.Г. (2016). «mTOR регулирует экспрессию ферментов реакции на повреждение ДНК у долгоживущих карликовых мышей Snell, GHRKO и PAPPA-KO» . Стареющая клетка . 16 (1): 52–60. дои : 10.1111/acel.12525 . ПМК 5242303 . ПМИД 27618784 .
- ^ Название продукта: Антиген SCL-70. Архивировано 19 марта 2006 г. на Wayback Machine на ImmunoVision.com, получено в апреле 2011 г.
Внешние ссылки
[ редактировать ]- ДНК + топоизомеразы + Тип + I в Национальной медицинской библиотеке США по медицинским предметным рубрикам (MeSH)