Версиканский
| ВКАН | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | VCAN , CSPG2, ERVR, GHAP, PG-M, WGN, WGN1, версикан | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | ОМИМ : 118661 ; МГИ : 102889 ; Гомологен : 3228 ; Генные карты : VCAN ; ОМА : VCAN — ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Версикан представляет собой крупный протеогликан внеклеточного матрикса , который присутствует во многих тканях человека. Он кодируется геном VCAN . [5] [6]
Версикан представляет собой крупный протеогликан хондроитинсульфата с кажущейся молекулярной массой более 1000 кДа. В 1989 году Циммерманн и Руослахти клонировали и секвенировали основной белок протеогликана фибробластов хондроитинсульфата. [7] Они назвали его versican в знак признания его универсальной модульной структуры.
Версикан принадлежит к семейству белков лектиканов , в состав которого входят аггрекан (в изобилии содержится в хряще ), бревикан и нейрокан (протеогликаны нервной системы). Версикан также известен как основной белок 2 протеогликана хондроитинсульфата или протеогликан 2 хондроитинсульфата (CSPG2) и PG-M.
Структура
[ редактировать ]Эти протеогликаны имеют гомологичные глобулярные N-концевые , C-концевые и гликозаминогликановые (ГАГ) связывающие области.
N-концевой (G1) глобулярный домен состоит из Ig -подобной петли и двух звеньевых модулей и обладает гиалуронана свойствами связывания (HA).
Версикан встречается в 5 изоформах: V0, V1, V2, V3, V4. [8] Центральный домен версикана V0 содержит домены GAG-α и GAG-β. Изоформы V1 имеют домен GAG-β, V2 имеют домен GAG-α, V3 лишены каких-либо доменов прикрепления GAG, а V4 содержит часть домена GAG-β. ГАГ, состоящие из повторяющихся дисахаридных единиц, способствуют отрицательному заряду и многим другим свойствам протеогликанов.
С-концевой (G3) глобулярный домен состоит из одного или двух повторов эпидермального фактора роста (EGF), лектинового домена C-типа и домена, подобного регуляторному белку комплемента (CRP). С-концевой домен связывает различные лиганды в ЕСМ, которые вносят значительный вклад в функции лектиканов.
Функция
[ редактировать ]Роль версикана в клеточной адгезии, миграции и пролиферации широко изучена. Версикан часто считают антиадгезионной молекулой. Учитывая большой размер (>1000 кДа) и гидратационную способность версикана, возможно, что взаимодействие интегринов (большого семейства молекул клеточной адгезии) с их рецепторами на клеточной поверхности стерически затруднено.
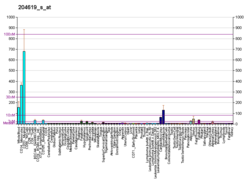
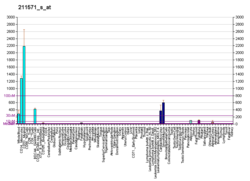
Экспрессия версикана наблюдается в различных тканях взрослых, таких как кровеносные сосуды, кожа и развивающееся сердце. Гладкомышечные клетки кровеносных сосудов, эпителиальные клетки кожи и клетки центральной и периферической нервной системы являются несколькими примерами типов клеток, которые физиологически экспрессируют версикан. Версикан участвует в развитии, направляя миграцию эмбриональных клеток, важную для формирования сердца, и прокладывая путь миграции клеток нервного гребня .
N-конец
[ редактировать ]N-конец версикана играет важную роль в поддержании целостности ЕСМ путем взаимодействия с гиалуроновой кислотой. Также было изучено его взаимодействие со ссылочным белком.
Область связывания гликозаминогликанов
[ редактировать ]Центральный домен Версикана украшен гликозаминогликанами. Структурное и функциональное разнообразие Версикана увеличивается за счет различий в характере сульфатирования ГАГ и типе цепей ГАГ, связанных с коровым белком. Существует единственный ген версикана, однако альтернативный сплайсинг его мРНК дает 4 различные изоформы версикана, которые различаются потенциальным количеством цепей GAG. Все изоформы имеют гомологичные N-концевой (HA-связывающий) и C-концевой (лектиноподобный) домены. Центральный домен версикана V0 содержит домены GAG-α и GAG-β. Изоформы V1 имеют домен GAG-β, V2 имеют домен GAG-α, а V3 лишен каких-либо доменов прикрепления GAG и состоит только из N-концевых и C-концевых глобулярных доменов. Известно, что изоформы по-разному экспрессируются в разных типах тканей. Биологическое значение альтернативного сплайсинга еще предстоит определить.
Из-за отрицательно заряженных сульфатов или карбоксильных групп цепи хондроитинсульфата притягиваются к различным положительно заряженным молекулам, таким как определенные факторы роста, цитокины и хемокины. Это взаимодействие во внеклеточном матриксе или на поверхности клетки важно для формирования иммобилизованных градиентов этих факторов, их защиты от протеолитического расщепления и представления специфическим рецепторам клеточной поверхности. Связывание версикана с молекулами адгезии лейкоцитов L-селектином, Р-селектином и CD44 также опосредовано взаимодействием CS-цепей версикана с углеводсвязывающим доменом этих молекул. И CD44, и L-селектин участвуют в торговле лейкоцитами. Также была изучена способность версикана связывать большую группу хемокинов и биологические последствия такого связывания. Версикан может связывать специфические хемокины через свои цепи CS, и это взаимодействие подавляет функцию хемокинов. Недавно, в свете результатов о том, что изоформы V1 и V2 версикана оказывают противоположные эффекты на пролиферацию клеток, гликозаминогликановый домен GAG-β был вовлечен в усиленную версиканом пролиферацию клеток и индуцированное версиканом снижение клеточного апоптоза.
C-терминал
[ редактировать ]С-конец версикана взаимодействует с множеством молекул матрикса. Одним из важных семейств лигандов является семейство тенасцина . [9] Например, домен C-лектина версикана взаимодействует с тенасцином R через его домен повторов 3-5 фибронектина типа III (FnIII) кальций-зависимым образом, in vivo . Различные домены тенасцина взаимодействуют с широким спектром клеточных рецепторов, включая интегрины, молекулы клеточной адгезии и членов семейств синдеканов и глипикановых протеогликанов. С-концевой домен версикана взаимодействует с фибулином-2 , белком, экспрессия которого связана с экспрессией версикана в развивающемся сердце. Домен EGF на С-конце версикана также связывает молекулу рецептора EGF in vivo .
Клиническое значение
[ редактировать ]Версикан является ключевым фактором воспаления за счет взаимодействия с молекулами адгезии на поверхности воспалительных лейкоцитов и взаимодействия с хемокинами , которые участвуют в рекрутировании воспалительных клеток.
В центральной нервной системе взрослых версикан обнаруживается в перинейрональных сетях , где он может стабилизировать синаптические связи. Версикан также может ингибировать регенерацию нервной системы и рост аксонов после повреждения центральной нервной системы.
Рак и метастазы
[ редактировать ]Повышенная экспрессия версикана часто наблюдается при росте опухолей в таких тканях, как молочная железа, головной мозг, [10] яичников, желудочно-кишечного тракта, предстательной железы, меланомы , саркомы и мезотелиомы брюшины . Пятая изоформа версикана, V4, похожая на V1, но с укороченной областью бета-ГАГ, присутствует и активируется при молочной железы человека. раке [8]
Версикан необходим для метастазирования карциномы легких Льюиса у мышей в легкие, печень и надпочечники, действуя через TLR2 для активации миелоидных клеток и продукции TNF-альфа . [11]
Заболевания легких
[ редактировать ]Уровень версикана увеличивается в изменяющемся внеклеточном матриксе ткани при воспалительных заболеваниях легких, таких как хроническая обструктивная болезнь легких (ХОБЛ), астма и синдром облитерирующего бронхиолита (СОБ). [12] Клетки ( миофибробласты , макрофаги и другие воспалительные клетки) могут легче мигрировать через внеклеточный матрикс , который имеет более высокое содержание верзикана.
Кожные заболевания
[ редактировать ]Отложения версикана отсутствуют в нормальной коже , но обнаруживаются в ретикулярной дерме при келоидном рубцевании, состоянии, при котором образование рубца становится неконтролируемым и кожной на месте раны происходит разрастание ткани . [13]
Взаимодействия
[ редактировать ]Было показано, что версикан взаимодействует с гиалуроновой кислотой и связующим белком (связывающим белком 1 гиалуронана и протеогликана; HAPLN1 ). [14]
Ссылки
[ редактировать ]- ^ Jump up to: а б с GRCh38: Версия Ensembl 89: ENSG00000038427 – Ensembl , май 2017 г.
- ^ Jump up to: а б с GRCm38: выпуск Ensembl 89: ENSMUSG00000021614 – Ensembl , май 2017 г.
- ^ «Ссылка на Human PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Ссылка на Mouse PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Энтрез Джин: VCAN versican» .
- ^ Иоззо Р.В., Насо М.Ф., Канниццаро Л.А., Васмут Дж.Дж., Макферсон Дж.Д. (1992). «Картирование гена протеогликана версикана (CSPG2) на длинном плече хромосомы 5 человека (5q12-5q14)». Геномика . 14 (4): 845–51. дои : 10.1016/S0888-7543(05)80103-X . ПМИД 1478664 .
- ^ Циммерманн Д.Р., Руослахти Э. (октябрь 1989 г.). «Множественные домены большого протеогликана фибробластов, версикана» . ЭМБО Дж . 8 (10): 2975–81. дои : 10.1002/j.1460-2075.1989.tb08447.x . ПМК 401368 . ПМИД 2583089 .
- ^ Jump up to: а б Кишель П., Валтреньи Д., Дюмон Б., Туртой А., Греффе Ю., Кирш С., Де Пау Э., Кастроново В. (февраль 2010 г.). «Сверхэкспрессия версикана при поражениях рака молочной железы человека: известные и новые изоформы для воздействия на стромальные опухоли» . Международный журнал рака . 126 (3): 640–50. дои : 10.1002/ijc.24812 . ПМИД 19662655 . S2CID 36289786 .
- ^ Аспберг А., Миура Р., Бурдулус С., Шимонака М., Хайнегард Д., Шахнер М., Руослахти Е., Ямагути Ю. (1997). «Домены лектина C-типа лектиканов, семейства агрегирующих протеогликанов хондроитинсульфата, связывают тенасцин-R посредством белок-белковых взаимодействий, независимых от углеводной части» . Учеб. Натл. акад. наук. США . 94 (19): 10116–21. Бибкод : 1997PNAS...9410116A . дои : 10.1073/pnas.94.19.10116 . ПМК 23322 . ПМИД 9294172 .
- ^ Паулюс В., Баур И., Дурс-Циммерманн М.Т., Циммерманн Д.Р. (1996). «Дифференциальная экспрессия изоформ версикана в опухолях головного мозга» . Дж. Нейропатол. Эксп. Нейрол . 55 (5): 528–33. дои : 10.1097/00005072-199605000-00005 . ПМИД 8627343 . S2CID 24838751 .
- ^ Ким С., Такахаши Х., Лин В.В., Дескарг П., Гривенников С., Ким Ю., Луо Дж.Л., Карин М. (январь 2009 г.). «Факторы, продуцируемые карциномой, активируют миелоидные клетки через TLR2, чтобы стимулировать метастазирование» . Природа . 457 (7225): 102–6. Бибкод : 2009Natur.457..102K . дои : 10.1038/nature07623 . ПМЦ 2746432 . ПМИД 19122641 .
- ^ Андерссон-Шёланд А, Халлгрен О, Роландссон С, Вейтофт М, Тайкессон Э, Ларссон-Каллерфельт А.К., Риделл-Тёрманен К, Бьермер Л., Мальмстрём А, Карлссон Дж.К., Вестергрен-Торссон Г (2015). «Версикан при воспалении и ремоделировании тканей: влияние на заболевания легких» . Гликобиология . 25 (3): 243–251. дои : 10.1093/гликоб/cwu120 . ПМК 4310351 . ПМИД 25371494 .
- ^ Джампер Н, Паус Р, Баят А (22 апреля 2015 г.). «Функциональная гистопатология келоидной болезни». Гистол. Гистопатол . 30 (11624): 1033–57. дои : 10.14670/HH-11-624 . ПМИД 25900252 .
- ^ Мацумото К., Шионю М., Го М., Симидзу К., Синомура Т., Кимата К., Ватанабэ Х. (октябрь 2003 г.). «Особое взаимодействие версикана/PG-M с гиалуроновой кислотой и связывающим белком» . Ж. Биол. Хим . 278 (42): 41205–12. дои : 10.1074/jbc.M305060200 . ПМИД 12888576 . S2CID 45915209 .
Дальнейшее чтение
[ редактировать ]- Уайт Т.Н., Меррилис М.Дж. (2004). «Протеогликаны при атеросклерозе и рестенозе: ключевая роль версикана» . Цирк. Рез . 94 (9): 1158–67. дои : 10.1161/01.RES.0000126921.29919.51 . ПМИД 15142969 .
- Кенаги Р.Д., Плаас А.Х., Уайт, Теннесси (2006). «Версиканская деградация и сосудистые заболевания» . Тенденции Кардиоваск. Мед . 16 (6): 209–15. дои : 10.1016/j.tcm.2006.03.011 . ПМК 3169384 . ПМИД 16839865 .
- Перидес Г., Рахемтулла Ф., Лейн В.С., Ашер Р.А., Бигнами А. (1992). «Выделение крупного агрегирующего протеогликана из мозга человека» . Ж. Биол. Хим . 267 (33): 23883–7. дои : 10.1016/S0021-9258(18)35919-2 . ПМИД 1429726 .
- Иоззо Р.В., Насо М.Ф., Канниццаро Л.А., Васмут Дж.Дж., Макферсон Дж.Д. (1993). «Картирование гена протеогликана версикана (CSPG2) на длинном плече хромосомы 5 человека (5q12-5q14)». Геномика . 14 (4): 845–51. дои : 10.1016/S0888-7543(05)80103-X . ПМИД 1478664 .
- Перидес Г., Лейн В.С., Эндрюс Д., Даль Д., Бигнами А. (1989). «Выделение и частичная характеристика глиального гиалуронатсвязывающего белка» . Ж. Биол. Хим . 264 (10): 5981–7. дои : 10.1016/S0021-9258(18)83646-8 . ПМИД 2466833 .
- Бигнами А., Лейн В.С., Эндрюс Д., Даль Д. (1989). «Структурное сходство гиалуронатсвязывающих белков в головном мозге и хрящах». Мозговой Рес. Бык . 22 (1): 67–70. дои : 10.1016/0361-9230(89)90129-9 . ПМИД 2469524 . S2CID 25745740 .
- Циммерманн Д.Р., Руослахти Э. (1990). «Множественные домены большого протеогликана фибробластов, версикана» . ЭМБО Дж . 8 (10): 2975–81. дои : 10.1002/j.1460-2075.1989.tb08447.x . ПМК 401368 . ПМИД 2583089 .
- Крузиус Т., Гельсен К.Р., Руослахти Э. (1987). «Коровой белок протеогликана хондроитинсульфата фибробластов содержит последовательности, подобные лектину и фактору роста» . Ж. Биол. Хим . 262 (27): 13120–5. дои : 10.1016/S0021-9258(18)45176-9 . ПМИД 2820964 .
- Насо М.Ф., Циммерманн Д.Р., Иоццо Р.В. (1995). «Характеристика полной геномной структуры гена версикана человека и функциональный анализ его промотора» . Ж. Биол. Хим . 269 (52): 32999–3008. дои : 10.1016/S0021-9258(20)30090-9 . ПМИД 7528742 .
- Браун Д.М., Грэмигер Р.А., Хергерсберг М., Шинцель А., Мессмер Э.П., Нимейер Г., Шнебергер С.А., Стреб Л.М., Тейлор СМ, Кимура А.Е. (1995). «Генетическая связь болезни Вагнера и эрозивной витреоретинопатии с хромосомой 5q13-14». Арх. Офтальмол . 113 (5): 671–5. doi : 10.1001/archopht.1995.01100050139045 . ПМИД 7748141 .
- Дурс-Циммерманн М.Т., Циммерманн Д.Р. (1995). «Новый домен прикрепления гликозаминогликанов, идентифицированный в двух альтернативных вариантах сплайсинга человеческого версикана» . Ж. Биол. Хим . 269 (52): 32992–8. дои : 10.1016/S0021-9258(20)30089-2 . ПМИД 7806529 .
- Зако М., Шиномура Т., Удзита М., Ито К., Кимата К. (1995). «Экспрессия PG-M (V3), альтернативно сплайсированной формы PG-M без присоединения хондроитинсульфата в определенной области в тканях мыши и человека» . Ж. Биол. Хим . 270 (8): 3914–8. дои : 10.1074/jbc.270.8.3914 . ПМИД 7876137 . S2CID 26136117 .
- Яо Л.И., Муди С., Шёнхерр Э., Уайт Т.Н., Сэнделл Л.Дж. (1994). «Идентификация протеогликана версикана в клетках аорты и гладкомышечных клеток путем анализа последовательности ДНК, гибридизации in situ и иммуногистохимии». Матрица Биол . 14 (3): 213–25. дои : 10.1016/0945-053X(94)90185-6 . ПМИД 7921538 .
- Боде-Лесневска Б., Дурс-Циммерманн М.Т., Одерматт Б.Ф., Бринер Дж., Хайтц П.У., Циммерманн Д.Р. (1996). «Распределение крупного агрегирующего протеогликана версикана в тканях взрослого человека» . Дж. Гистохим. Цитохим . 44 (4): 303–12. дои : 10.1177/44.4.8601689 . ПМИД 8601689 . S2CID 23190687 .
- Сартипи П., Йохансен Б., Камехо Г., Розенгрен Б., Бонджерс Г., Хёрт-Камехо Э. (1996). «Связывание человеческой фосфолипазы А2 типа II с протеогликанами. Дифференциальное влияние гликозаминогликанов на активность ферментов» . Ж. Биол. Хим . 271 (42): 26307–14. дои : 10.1074/jbc.271.42.26307 . ПМИД 8824283 . S2CID 21537718 .
- Сартипи П., Бонджерс Г., Хёрт-Камехо Э. (1999). «Фосфолипаза А2 типа II связывается с бигликаном внеклеточного матрикса: модуляция ее активности в отношении ЛПНП путем колокализации в гликозаминогликановых матрицах» . Артериосклер. Тромб. Васк. Биол . 18 (12): 1934–41. дои : 10.1161/01.ATV.18.12.1934 . ПМИД 9848887 .
- Первин Р., Харт-Холден Н., Диксон М.Дж., Вишневски В., Фрайер А.Е., Бруннер Х.Г., Пинкнерс А.Дж., ван Бирсум С.Е., Блэк GC (1999). «Уточненная генетическая и физическая локализация локуса болезни Вагнера (WGN1) и генов CRTL1 и CSPG2 в участке размером от 2 до 2,5 см хромосомы 5q14.3». Геномика . 57 (2): 219–26. дои : 10.1006/geno.1999.5766 . ПМИД 10198161 . S2CID 43814139 .
- Лемир Дж.М., Браун К.Р., Морел П., Каплан Э.Д., Шварц С.М., Уайт Т.Н. (1999). «Изоформы Версикана/PG-M в гладкомышечных клетках сосудов» . Артериосклер. Тромб. Васк. Биол . 19 (7): 1630–9. дои : 10.1161/01.ATV.19.7.1630 . ПМИД 10397680 .
- Ян Ю, Цинь Д, Ху Б, Чжан С, Лю С, У Д, Хуан В, Хуан Х, Ван Л, Чэнь Х, Чжан Л (апрель 2019 г.). «Удаление миР-126а способствовало старению и воспалению печени на мышиной модели холестаза» . Молекулярная терапия-нуклеиновые кислоты . 16 : 494–504. дои : 10.1016/j.omtn.2019.04.002 . ПМК 6495079 . ПМИД 31051334 .
Версикан идентифицирован как прямая мишень миР-126a-5p, которая индуцирует укорочение теломер, старение и активатор пути ядерного фактора κB (NF-κB).