Конканавалин А
| Конканавалин А | |||
|---|---|---|---|
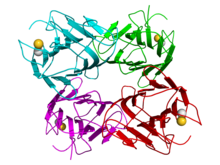 Кристаллографическая структура тетрамера конканавалина А фасоли (мономеры окрашены в голубой, зеленый, красный и пурпурный цвета соответственно). кальция (золото) и марганца Катионы (серый) изображены в виде сфер. [1] | |||
| Идентификаторы | |||
| Организм | |||
| Символ | КонА | ||
| ПДБ | 3CNA | ||
| ЮниПрот | P81461 | ||
| |||
Конканавалин А ( ConA ) представляет собой лектин ( углеводы , связывающий белок ), первоначально извлеченный из фасоли ( Canavalia ensiformis ). Это член семейства лектинов бобовых . Он специфически связывается с определенными структурами, обнаруженными в различных сахарах , гликопротеинах и гликолипидах , главным образом с внутренними и невосстанавливающими концевыми α-D- маннозильными и α-D-глюкозильными группами. [2] [3] Однако его физиологическая функция у растений до сих пор неизвестна. ConA представляет собой растительный митоген и известен своей способностью стимулировать субпопуляции Т-клеток мыши, приводя к образованию четырех функционально различных популяций Т-клеток, включая предшественников регуляторных Т-клеток ; [4] подмножество человеческих супрессорных Т-клеток также чувствительно к ConA. [4] ConA был первым лектином, доступным на коммерческой основе, и широко используется в биологии и биохимии для характеристики гликопротеинов и других сахаросодержащих веществ на поверхности различных клеток. [5] Он также используется для очистки гликозилированных макромолекул в аффинной хроматографии лектинов . [6] а также изучить иммунную регуляцию различными иммунными клетками. [4]
Структура и свойства
[ редактировать ]Как и большинство лектинов, ConA является гомотетрамером : каждая субъединица (26,5 кДа , 235 аминокислот , сильно гликированная) связывает атом металла (обычно Mn 2+ и Ca 2+ ). Имеет D2 симметрию . [1] Была выяснена его третичная структура. [7] как и молекулярная основа его взаимодействия с металлами, а также его сродство к сахарам, маннозе и глюкозе. [8] хорошо известны.
ConA специфически связывает остатки α-D-маннозы и α-D-глюкозила (две гексозы, отличающиеся только спиртом при углероде 2) в концевом положении разветвленных структур B-гликанов (богатых α-маннозой, или гибридных и двухантенных гликановые комплексы). Он имеет 4 сайта связывания, соответствующие 4 субъединицам. [3] Молекулярная масса составляет 104–112 кДа , а изоэлектрическая точка (pI) находится в диапазоне 4,5–5,5.
ConA также может инициировать деление клеток (митогенез), воздействуя в первую очередь на Т-лимфоциты, стимулируя их энергетический метаболизм в течение нескольких секунд после воздействия. [9]
Процесс созревания
[ редактировать ]ConA и его варианты (обнаруженные в близкородственных растениях) являются единственными белками, которые, как известно, подвергаются посттрансляционному расположению последовательностей, известному как круговая перестановка в белках , при которой N-концевая половина предшественника conA заменяется местами и становится C-концевой половиной в белках. зрелая форма; все другие известные циклические перестановки происходят на генетическом уровне. [10] [11] Круговая перестановка ConA осуществляется аспарагинилэндопептидазой бобов, [12] универсальный фермент, способный расщеплять и лигировать пептидные субстраты в одном активном центре. [13] Чтобы преобразовать conA в зрелую форму, аспарагинилэндопептидаза фасоли расщепляет предшественник conA в середине и лигирует два исходных конца.
Биологическая активность
[ редактировать ]Конканавалин А взаимодействует с различными рецепторами, содержащими маннозные углеводы, особенно с родопсином, групп крови маркерами , рецепторами инсулина, [14] иммуноглобулины (СЕА ) и карцино-эмбриональный антиген . Он также взаимодействует с липопротеинами . [15]
ConA сильно агглютинирует эритроциты независимо от группы крови и различные раковые клетки. [16] [17] [18] Было продемонстрировано, что трансформированные клетки и нормальные клетки, обработанные трипсином, не агглютинируют при 4 ° C, что позволяет предположить, что в ConA-опосредованной агглютинации участвует температурно-чувствительный этап. [19] [20]
Сообщалось о ConA-опосредованной агглютинации других типов клеток, включая мышечные клетки . [21] В- лимфоциты (через поверхностные иммуноглобулины ), [22] фибробласты , [23] крысы тимоциты , [24] плода (но не взрослого) человека эпителиальные клетки кишечника , [25] и адипоциты . [26]
ConA — лимфоцитов митоген . Подобно фитогемагглютинину (ФГА), он является селективным митогеном Т-клеток относительно его воздействия на В-клетки. PHA и ConA связывают и перекрестно сшивают компоненты рецептора Т-клеток , и их способность активировать Т-клетки зависит от экспрессии рецептора Т-клеток. [27] [28]
ConA взаимодействует с поверхностными остатками маннозы многих микробов, включая бактерии E. coli , [29] и Bacillus subtilis [30] и простейший Dictyostelium discoideum . [31]
Также было показано, что он является стимулятором нескольких матриксных металлопротеиназ (ММП). [32]
ConA оказался полезным в приложениях, требующих твердофазной иммобилизации гликоферментов, особенно тех, которые оказалось трудно иммобилизовать традиционным ковалентным связыванием. Используя матрицы ConA-пар, такие ферменты можно иммобилизовать в больших количествах без одновременной потери активности или стабильности. Такие нековалентные связи ConA-гликофермент могут быть относительно легко обращены вспять путем конкуренции с сахарами или при кислом pH. При необходимости для определенных приложений эти связи можно преобразовать в ковалентные связи путем химических манипуляций. [33]
Отчет из Тайваня (2009 г.) продемонстрировал мощный терапевтический эффект ConA против экспериментальной гепатомы (рака печени); в исследовании Лея и Чанга, [34] Было обнаружено, что ConA в большей степени секвестрируется опухолевыми клетками печени, а не окружающими нормальными гепатоцитами. Интернализация ConA происходит преимущественно в митохондриях после связывания с гликопротеинами клеточной мембраны, что вызывает аутофагическую гибель клеток. Было обнаружено, что ConA частично ингибирует рост опухолевых узелков независимо от активации лимфоцитов; эрадикация опухоли на мышиной модели гепатомы in-situ в этом исследовании была дополнительно объяснена митогенным/лимфопролиферативным действием ConA, которое могло активировать опосредованную CD8+ Т-клетками, а также NK- и NK-T-клеточную активность. опосредованный иммунный ответ в печени. [34]
Интравитреальную инъекцию ConA можно использовать при моделировании пролиферативной витреоретинопатии у крыс. [35] [36]
Ссылки
[ редактировать ]- ^ Перейти обратно: а б ВВП : 3CNA ; Хардман К.Д., Эйнсворт К.Ф. (декабрь 1972 г.). «Структура конканавалина А с разрешением 2,4-А». Биохимия . 11 (26): 4910–4919. дои : 10.1021/bi00776a006 . ПМИД 4638345 .
- ^ Гольдштейн, Ирвин Дж.; Порец, Рональд Д. (2012). «Выделение, физико-химическая характеристика и специфичность лектинов к связыванию углеводов» . В Линере, Ирвин Э.; Шэрон, Натан; Гольдштейн, Ирвин Дж. (ред.). Свойства, функции и применение лектинов в биологии и медицине . Эльзевир. стр. 33–247. ISBN 978-0-323-14444-5 .
- ^ Перейти обратно: а б Самнер Дж. Б., Грален Н., Эрикссон-Квенсель И.Б. (апрель 1938 г.). «Молекулярная масса уреазы, канавалина, конканавалина а и конканавалина B». Наука . 87 (2261): 395–396. Бибкод : 1938Sci....87..395S . дои : 10.1126/science.87.2261.395 . ПМИД 17746464 .
- ^ Перейти обратно: а б с Дуайер Дж. М. , Джонсон С. (ноябрь 1981 г.). «Использование конканавалина А для изучения иммунорегуляции Т-клеток человека» . Клиническая и экспериментальная иммунология . 46 (2): 237–249. ПМК 1536405 . ПМИД 6461456 .
- ^ Шифер Х.Г., Краусс Х., Бруннер Х., Герхардт У. (декабрь 1975 г.). «Ультраструктурная визуализация поверхностных углеводных структур на мембранах микоплазмы с помощью конканавалина А» . Журнал бактериологии . 124 (3): 1598–1600. дои : 10.1128/JB.124.3.1598-1600.1975 . ПМК 236075 . ПМИД 1104592 .
- ^ GE Healthcare Life Sciences, Иммобилизованный лектин. Архивировано 3 марта 2012 г. в Wayback Machine. [ нужна полная цитата ]
- ^ Мин В., Данн А.Дж., Джонс Д.Х. (апрель 1992 г.). «Негликозилированный рекомбинантный проконканавалин А активен без расщепления полипептида» . Журнал ЭМБО . 11 (4): 1303–1307. дои : 10.1002/j.1460-2075.1992.tb05174.x . ПМК 556578 . ПМИД 1563347 .
- ^ Лорис Р., Хамелрик Т., Букерт Дж., Винс Л. (март 1998 г.). «Структура лектина бобовых». Biochimica et Biophysical Acta (BBA) - Структура белка и молекулярная энзимология . 1383 (1): 9–36. дои : 10.1016/S0167-4838(97)00182-9 . ПМИД 9546043 .
- ^ Краусс С., Бутгерайт Ф., Бранд, доктор медицинских наук (июнь 1999 г.). «Влияние митогена конканавалина А на пути энергетического метаболизма тимоцитов» . Biochimica et Biophysica Acta (BBA) — Биоэнергетика . 1412 (2): 129–138. дои : 10.1016/S0005-2728(99)00058-4 . ПМИД 10393256 .
- ^ Кэррингтон Д.М., Оффрет А., Ханке Д.Е. (1985). «Лигирование полипептида происходит во время посттрансляционной модификации конканавалина А». Природа . 313 (5997): 64–67. Бибкод : 1985Natur.313...64C . дои : 10.1038/313064a0 . ПМИД 3965973 . S2CID 4359482 .
- ^ Хендрикс Р.В. (апрель 1991 г.). «Белковое столярное дело». Современная биология . 1 (2): 71–73. дои : 10.1016/0960-9822(91)90280-а . ПМИД 15336168 . S2CID 45963307 .
- ^ Нонис С.Г., Хейвуд Дж., Шмидбергер Дж.В., Маки Э.Р., Соарес да Коста Т.П., Бонд К.С., Милн Дж.С. (август 2021 г.). «Структурный и биохимический анализ конканавалина А. Круговая перестановка аспарагинилэндопептидазой фасоли» . Растительная клетка . 33 (8): 2794–2811. дои : 10.1093/plcell/koab130 . ПМЦ 8408470 . ПМИД 34235541 .
- ^ Нонис С.Г., Хейвуд Дж., Милн Дж.С. (апрель 2021 г.). «Растительные аспарагинилэндопептидазы и их структурные детерминанты функции» . Труды Биохимического общества . 49 (2): 965–976. дои : 10.1042/BST20200908 . ПМК 8106488 . ПМИД 33666219 .
- ^ Куатрекасас П., Телль GP (февраль 1973 г.). «Инсулиноподобная активность конканавалина А и агглютинина зародышей пшеницы - прямое взаимодействие с рецепторами инсулина» . Труды Национальной академии наук Соединенных Штатов Америки . 70 (2): 485–489. Бибкод : 1973PNAS...70..485C . дои : 10.1073/pnas.70.2.485 . JSTOR 62526 . ПМК 433288 . ПМИД 4510292 .
- ^ Хармони Дж.А., Кордес Э.Х. (ноябрь 1975 г.). «Взаимодействие липопротеинов низкой плотности плазмы человека с конканавалином А и рицином» . Журнал биологической химии . 250 (22): 8614–8617. дои : 10.1016/S0021-9258(19)40714-X . ПМИД 171260 . [ постоянная мертвая ссылка ]
- ^ Беттон GR (ноябрь 1976 г.). «Реакции агглютинации спонтанных опухолевых клеток собак, индуцированные конканавалином А, продемонстрированные с помощью изотопного анализа». Международный журнал рака . 18 (5): 687–696. дои : 10.1002/ijc.2910180518 . ПМИД 992901 . S2CID 36612952 .
- ^ Какидзоэ Т., Комацу Х., Нидзима Т., Кавачи Т., Сугимура Т. (июнь 1980 г.). «Повышенная агглютинируемость клеток мочевого пузыря конканавалином А после введения канцерогенов». Исследования рака . 40 (6): 2006–2009. ПМИД 7371036 .
- ^ Беккер Ф.Ф., Шургин А (октябрь 1975 г.). «Конканавалин А агглютинация клеток первичной гепатоцеллюлярной карциномы и печеночных узелков, индуцированная N-2-флуоренилацетамидом». Исследования рака . 35 (10): 2879–2883. ПМИД 168971 .
- ^ Инбар М., Бен-Бассат Х., Сакс Л. (ноябрь 1971 г.). «Специфическая метаболическая активность поверхностной мембраны при злокачественной трансформации клеток» . Труды Национальной академии наук Соединенных Штатов Америки . 68 (11): 2748–2751. Бибкод : 1971PNAS...68.2748I . дои : 10.1073/pnas.68.11.2748 . JSTOR 61219 . ПМК 389516 . ПМИД 4330939 .
- ^ Села Б.А., Лис Х., Шэрон Н., Сакс Л. (декабрь 1971 г.). «Количественное определение N-ацетил-D-галактозамин-подобных участков на поверхностной мембране нормальных и трансформированных клеток млекопитающих». Biochimica et Biophysical Acta (BBA) – Биомембраны . 249 (2): 564–568. дои : 10.1016/0005-2736(71)90132-5 . ПМИД 4332414 .
- ^ Гартнер Т.К., Подлесский Т.Р. (декабрь 1975 г.). «Доказательства того, что мембраносвязанный лектин опосредует слияние миобластов L6». Связь с биохимическими и биофизическими исследованиями . 67 (3): 972–978. дои : 10.1016/0006-291X(75)90770-6 . ПМИД 1201086 .
- ^ де Петрис С. (апрель 1975 г.). «Рецепторы конканавалина А, иммуноглобулины и тета-антиген поверхности лимфоцитов. Взаимодействие с конканавалином А и с цитоплазматическими структурами» . Журнал клеточной биологии . 65 (1): 123–146. дои : 10.1083/jcb.65.1.123 . ПМК 2111157 . ПМИД 1092699 .
- ^ Нунан К.Д., Бургер М.М. (октябрь 1973 г.). «Взаимосвязь связывания конканавалина А с агглютинацией клеток, инициированной лектином» . Журнал клеточной биологии . 59 (1): 134–142. дои : 10.1083/jcb.59.1.134 . ПМК 2110924 . ПМИД 4201706 .
- ^ Капо С., Гарруст Ф., Бенолиэль А.М., Бонгранд П., Райтер А., Белл Дж.И. (август 1982 г.). «Конканавалин-А-опосредованная агглютинация тимоцитов: модель для количественного изучения клеточной адгезии». Журнал клеточной науки . 56 : 21–48. дои : 10.1242/jcs.56.1.21 . ПМИД 7166565 .
- ^ Вайзер М.М. (август 1972 г.). «Конканавалин Агглютинация кишечных клеток плода человека». Наука . 177 (4048): 525–526. Бибкод : 1972Sci...177..525W . дои : 10.1126/science.177.4048.525 . ПМИД 5050484 . S2CID 23661797 .
- ^ Куатрекасас П. (март 1973 г.). «Взаимодействие агглютинина зародышей пшеницы и конканавалина А с изолированными жировыми клетками». Биохимия . 12 (7): 1312–1323. дои : 10.1021/bi00731a011 . ПМИД 4696755 .
- ^ Вайс А., Шилдс Р., Ньютон М., Мангер Б., Имбоден Дж. (апрель 1987 г.). «Взаимодействия лиганд-рецептор, необходимые для активации гена интерлейкина 2» . Журнал иммунологии . 138 (7): 2169–2176. дои : 10.4049/jimmunol.138.7.2169 . ПМИД 3104454 . S2CID 35173412 .
- ^ Канеллопулос Дж. М., Де Петрис С., Лека Дж., Крамптон М. Дж. (май 1985 г.). «Митогенный лектин Phaseolus vulgaris не распознает антиген Т3 Т-лимфоцитов человека». Европейский журнал иммунологии . 15 (5): 479–486. дои : 10.1002/eji.1830150512 . ПМИД 3873340 . S2CID 21414006 .
- ^ Офек И., Мирельман Д., Шэрон Н. (февраль 1977 г.). «Прикрепление Escherichia coli к клеткам слизистой оболочки человека, опосредованное рецепторами маннозы». Природа . 265 (5595): 623–625. Бибкод : 1977Natur.265..623O . дои : 10.1038/265623a0 . ПМИД 323718 . S2CID 4223466 .
- ^ Дойл Р.Дж., Бердселл, округ Колумбия (февраль 1972 г.). «Взаимодействие конканавалина А с клеточной стенкой Bacillus subtilis» . Журнал бактериологии . 109 (2): 652–658. дои : 10.1128/JB.109.2.652-658.1972 . ПМК 285189 . ПМИД 4621684 .
- ^ Уэст CM, МакМахон Д. (июль 1977 г.). «Идентификация рецепторов конканавалина А и галактозосвязывающих белков в очищенных плазматических мембранах Dictyostelium discoideum» . Журнал клеточной биологии . 74 (1): 264–273. дои : 10.1083/jcb.74.1.264 . ПМК 2109878 . ПМИД 559679 .
- ^ Ю М., Сато Х., Сейки М., Томпсон Э.В. (август 1995 г.). «Комплексная регуляция экспрессии матричной металлопротеиназы мембранного типа и активации матриксной металлопротеиназы-2 конканавалином А в клетках рака молочной железы человека MDA-MB-231». Исследования рака . 55 (15): 3272–3277. ПМИД 7614461 .
- ^ Салимуддин М., Хусейн К. (апрель 1991 г.). «Конканавалин А: полезный лиганд для иммобилизации гликоферментов - обзор». Ферментные и микробные технологии . 13 (4): 290–295. дои : 10.1016/0141-0229(91)90146-2 . ПМИД 1367163 .
- ^ Перейти обратно: а б Лей ХИ, Чанг С.П. (январь 2009 г.). «Лектин конканавалина А как терапевтическое средство против гепатомы» . Журнал биомедицинской науки . 16 (1): 10. дои : 10.1186/1423-0127-16-10 . ПМК 2644972 . ПМИД 19272170 .
- ^ Эрдиаков А.К., Тихонович М.В., Ржавина Е.М., Гаврилова С.А. (май 2015 г.). «[Особенности сетчатки при развитии пролиферативной витреоретинопатии у крыс после внутриглазного введения конканавалина а и диспазы]». Российский физиологический журнал имени И. М. Сеченова . 101 (5): 572–585. ПМИД 26263683 .
- ^ Тихонович М.В., Эрдиаков А.К., Гаврилова С.А. (август 2018 г.). «Нестероидная противовоспалительная терапия подавляет развитие пролиферативной витреоретинопатии более эффективно, чем стероидная». Международная офтальмология . 38 (4): 1365–1378. дои : 10.1007/s10792-017-0594-3 . ПМИД 28639085 . S2CID 4017540 .
Внешние ссылки
[ редактировать ]- Конканавалин + А в Национальной медицинской библиотеке США по медицинским предметным рубрикам (MeSH)
- Конканавалин + А + Рецепторы в Национальной медицинской библиотеке США по медицинским предметным рубрикам (MeSH)
- Структура конканавалина А. Архивировано 20 августа 2008 г. в Wayback Machine.
- Мир лектинов, ворота в лектины
- Протеопедия 1bxh con A в комплексе с метилальфа1-2 маннобиозидом