Углеводосвязывающий модуль
| КБМ_1 | |||
|---|---|---|---|
 трехмерные структуры трех сконструированных целлюлозосвязывающих доменов целлобиогидролазы i из trichoderma reesei, ЯМР, 18 структур | |||
| Идентификаторы | |||
| Символ | КБМ_1 | ||
| Пфам | PF00734 | ||
| ИнтерПро | IPR000254 | ||
| PROSITE | PDOC00486 | ||
| ОБЛАСТЬ ПРИМЕНЕНИЯ 2 | 1сел / СКОПе / СУПФАМ | ||
| CAZy | КБМ1 | ||
| |||
| КБМ_2 | |||
|---|---|---|---|
 Структура раствора целлюлозосвязывающего домена из cellulomonas fimi методом спектроскопии ядерного магнитного резонанса | |||
| Идентификаторы | |||
| Символ | КБМ_2 | ||
| Пфам | PF00553 | ||
| Пфам Клан | CL0203 | ||
| ИнтерПро | ИПР001919 | ||
| PROSITE | PDOC00485 | ||
| ОБЛАСТЬ ПРИМЕНЕНИЯ 2 | 1exg / SCOPe / СУПФАМ | ||
| CAZy | КБМ2 | ||
| |||
| КБМ_3 | |||
|---|---|---|---|
 кристаллическая структура cbd семейства iiia из Clostridium cellulolyticum | |||
| Идентификаторы | |||
| Символ | КБМ_3 | ||
| Пфам | PF00942 | ||
| Пфам Клан | CL0203 | ||
| ИнтерПро | ИПР001956 | ||
| ОБЛАСТЬ ПРИМЕНЕНИЯ 2 | 1nbc / SCOPe / СУПФАМ | ||
| CAZy | КБМ3 | ||
| |||
| КБМ_5/12 | |||
|---|---|---|---|
 Взаимодействие хитиназы семейства 18 с разработанным ингибитором hm508 и продуктом его деградации хитобионо-дельта-лактоном | |||
| Идентификаторы | |||
| Символ | CBM_5_12 | ||
| Пфам | PF02839 | ||
| ИнтерПро | ИПР003610 | ||
| ОБЛАСТЬ ПРИМЕНЕНИЯ 2 | 1ед7 / СКОПе / СУПФАМ | ||
| CAZy | КБМ12 | ||
| |||
| КБМ_6 | |||
|---|---|---|---|
 cbm6ct из Clostridium thermocellum в комплексе с ксилопентаозой | |||
| Идентификаторы | |||
| Символ | КБМ_6 | ||
| Пфам | PF03422 | ||
| Пфам Клан | CL0202 | ||
| ИнтерПро | ИПР005084 | ||
| ОБЛАСТЬ ПРИМЕНЕНИЯ 2 | 1гмм / ОБЛАСТЬ ПРИМЕНЕНИЯ / СУПФАМ | ||
| CAZy | КБМ6 | ||
| |||
| КБМ_4/9 | |||
|---|---|---|---|
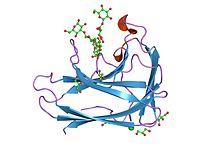 структура и функции cbm4 | |||
| Идентификаторы | |||
| Символ | CBM_4_9 | ||
| Пфам | PF02018 | ||
| Пфам Клан | CL0202 | ||
| ИнтерПро | ИПР003305 | ||
| ОБЛАСТЬ ПРИМЕНЕНИЯ 2 | 1ulp / SCOPe / СУПФАМ | ||
| CAZy | КБМ22 | ||
| |||
| CBM_10 | |||
|---|---|---|---|
 структура решения типа x куб.м. | |||
| Идентификаторы | |||
| Символ | CBM_10 | ||
| Пфам | PF02013 | ||
| ИнтерПро | ИПР002883 | ||
| ОБЛАСТЬ ПРИМЕНЕНИЯ 2 | 1qld / SCOPe / СУПФАМ | ||
| CAZy | КБМ10 | ||
| |||
| CBM_11 | |||
|---|---|---|---|
 углеводсвязывающий модуль семейства 11 целлюлозосомной целлюлазы lic26a-cel5e Clostridium thermocellum | |||
| Идентификаторы | |||
| Символ | CBM_11 | ||
| Пфам | PF03425 | ||
| Пфам Клан | CL0202 | ||
| ИнтерПро | ИПР005087 | ||
| CAZy | CBM11 | ||
| |||
| CBM_14 | |||
|---|---|---|---|
| Идентификаторы | |||
| Символ | CBM_14 | ||
| Пфам | PF01607 | ||
| Пфам Клан | CL0155 | ||
| ИнтерПро | ИПР002557 | ||
| ОБЛАСТЬ ПРИМЕНЕНИЯ 2 | 1dqc / SCOPe / СУПФАМ | ||
| CAZy | CBM14 | ||
| |||
| CBM_15 | |||
|---|---|---|---|
 модуль связывания ксилана cbm15 | |||
| Идентификаторы | |||
| Символ | CBM_15 | ||
| Пфам | PF03426 | ||
| Пфам Клан | CL0202 | ||
| ИнтерПро | ИПР005088 | ||
| ОБЛАСТЬ ПРИМЕНЕНИЯ 2 | 1гний / СКОПе / СУПФАМ | ||
| CAZy | КБМ15 | ||
| |||
| CBM_17/28 | |||
|---|---|---|---|
 Структура углеводсвязывающего модуля fam17 из Clostridium cellulovorans | |||
| Идентификаторы | |||
| Символ | CBM_17_28 | ||
| Пфам | PF03424 | ||
| Пфам Клан | CL0202 | ||
| ИнтерПро | ИПР005086 | ||
| ОБЛАСТЬ ПРИМЕНЕНИЯ 2 | 1g0c / SCOPe / СУПФАМ | ||
| CAZy | КБМ28 | ||
| |||
| Хитин_bind_1 (CBM18) | |||
|---|---|---|---|
 анализ кристаллической структуры сшитого комплекса wga3/glcnacbeta1,4glcnac | |||
| Идентификаторы | |||
| Символ | Хитин_bind_1 | ||
| Пфам | PF00187 | ||
| ИнтерПро | IPR001002 | ||
| PROSITE | PDOC00025 | ||
| ОБЛАСТЬ ПРИМЕНЕНИЯ 2 | 1wgt / ОБЛАСТЬ ПРИМЕНЕНИЯ / СУПФАМ | ||
| CAZy | CBM18 | ||
| |||
| CBM_19 | |||
|---|---|---|---|
| Идентификаторы | |||
| Символ | CBM_19 | ||
| Пфам | PF03427 | ||
| Пфам Клан | CL0155 | ||
| ИнтерПро | ИПР005089 | ||
| CAZy | CBM19 | ||
| |||
| CBM_20 | |||
|---|---|---|---|
 глюкоамилаза, гранулярный крахмалсвязывающий доменный комплекс с циклодекстрином, ЯМР, минимизированная средняя структура | |||
| Идентификаторы | |||
| Символ | CBM_20 | ||
| Пфам | PF00686 | ||
| Пфам Клан | CL0369 | ||
| ИнтерПро | ИПР002044 | ||
| ОБЛАСТЬ ПРИМЕНЕНИЯ 2 | 1cdg / SCOPe / СУПФАМ | ||
| CAZy | КБМ20 | ||
| |||
| CBM_21 | |||
|---|---|---|---|
| Идентификаторы | |||
| Символ | CBM_21 | ||
| Пфам | PF03370 | ||
| ИнтерПро | ИПР005036 | ||
| CAZy | CBM21 | ||
| |||
| CBM_25 | |||
|---|---|---|---|
| Идентификаторы | |||
| Символ | CBM_25 | ||
| Пфам | PF03423 | ||
| ИнтерПро | ИПР005085 | ||
| CAZy | КБМ25 | ||
| |||
| CBM27 | |||
|---|---|---|---|
 структурное и термодинамическое исследование специфического распознавания маннана с помощью углеводсвязывающего модуля, tmcbm27 | |||
| Идентификаторы | |||
| Символ | CBM27 | ||
| Пфам | PF09212 | ||
| ИнтерПро | ИПР015295 | ||
| ОБЛАСТЬ ПРИМЕНЕНИЯ 2 | 1ох4 / СКОПе / СУПФАМ | ||
| |||
| Хитин_bind_3 (CBM33) | |||
|---|---|---|---|
 Кристаллическая структура мутанта хитинсвязывающего белка serratia marcescens cbp21 y54a. | |||
| Идентификаторы | |||
| Символ | Хитин_bind_3 | ||
| Пфам | PF03067 | ||
| ИнтерПро | ИПР004302 | ||
| CAZy | КБМ33 | ||
| |||
| CBM_48 | |||
|---|---|---|---|
 Кристаллическая структура гликозилтрегалозо-трегалогидролазы из sulfolobus solfataricus | |||
| Идентификаторы | |||
| Символ | CBM_48 | ||
| Пфам | PF02922 | ||
| Пфам Клан | CL0369 | ||
| ИнтерПро | ИПР004193 | ||
| ОБЛАСТЬ ПРИМЕНЕНИЯ 2 | 1bf2 / СКОПе / СУПФАМ | ||
| CAZy | CBM48 | ||
| |||
| CBM49 | |||
|---|---|---|---|
| Идентификаторы | |||
| Символ | CBM49 | ||
| Пфам | PF09478 | ||
| Пфам Клан | CL0203 | ||
| ИнтерПро | ИПР019028 | ||
| |||
В молекулярной биологии углеводсвязывающий модуль (CBM) представляет собой белковый домен , обнаруженный в углевод -активных ферментах (например, гликозидгидролазах ). Большинство этих доменов обладают углеводсвязывающей активностью. Некоторые из этих доменов обнаружены в белках целлюлосомного каркаса . CBM ранее были известны как целлюлозосвязывающие домены. [ 1 ] CBM подразделяются на многочисленные семейства на основе аминокислотных сходства последовательностей. В настоящее время (июнь 2011 г.) в базе данных CAZy имеется 64 семейства CBM. [ 2 ]
CBM микробных гликозидгидролаз играют центральную роль в рециркуляции фотосинтетически фиксированного углерода посредством его связывания со специфическими растений структурными полисахаридами . [ 3 ] CBM могут распознавать как кристаллические, так и аморфные формы целлюлозы. [ 4 ] CBM являются наиболее распространенными некаталитическими модулями, связанными с ферментами, клеточной стенки растений активными при гидролизе . Многие предполагаемые CBM были идентифицированы путем аминокислотных последовательностей выравнивания , но экспериментально было показано, что лишь несколько представителей обладают функцией связывания углеводов. [ 5 ]
КБМ1
[ редактировать ]Семейство 1 углеводсвязывающих модулей (CBM1) состоит из 36 аминокислот. Этот домен содержит 4 консервативных остатка цистеина , которые участвуют в образовании двух дисульфидных связей .
КБМ2
[ редактировать ]Семейство 2 углеводсвязывающих модулей (CBM2) содержит два консервативных цистеина — по одному на каждом конце домена, что, как было показано, [ 6 ] участвовать в дисульфидной связи . Есть также четыре консервативных триптофана , два из которых участвуют в связывании целлюлозы. [ 7 ] [ 8 ] [ 9 ]
КБМ3
[ редактировать ]Семейство 3 углеводсвязывающих модулей (CBM3) участвует в целлюлозы. связывании [ 10 ] и обнаружено, что он связан с широким спектром бактериальных гликозилгидролаз. Структура ; этого домена известна это образует бета-сэндвич . [ 11 ]
КБМ4
[ редактировать ]Семейство 4 углеводсвязывающих модулей (CBM4) включает два целлюлозосвязывающих домена, CBD(N1) и CBD(N2), расположенных тандемно на N-конце 1,4-бета-глюканазы CenC из Cellulomonas fimi . Эти гомологичные CBM отличаются своей селективностью связывания аморфной, а не кристаллической целлюлозы. [ 12 ] Многомерную спектроскопию гетероядерного ядерного магнитного резонанса (ЯМР) использовали для определения третичной структуры 152 аминокислот N-концевого целлюлозосвязывающего домена из C. fimi 1,4-бета-глюканазы CenC (CBDN1) . Третичная структура CBDN1 поразительно похожа на структуру бактериальных 1,3-1,4-бета-глюканаз, а также других сахарсвязывающих белков со складками желеобразного рулета . [ 13 ] CBM4 и CBM9 тесно связаны.
КБМ5
[ редактировать ]Семейство 5 углеводсвязывающих модулей (CBM5) связывает хитин. [ 14 ] CBM5 и CBM12 являются отдаленными родственниками.
КБМ6
[ редактировать ]Семейство 6 углеводсвязывающих модулей (CBM6) необычно тем, что оно содержит два сайта связывания субстрата: щель A и щель B. Эндоглюканаза 5A Cellvibrio mixtus содержит два домена CBM6, домен CBM6 на С-конце демонстрирует четкую специфичность связывания лиганда в каждую из щелей, связывающих субстрат. И щель А, и щель B могут связывать целлоолигосахариды , ламинарин преимущественно связывается с щелью А, ксилоолигосахариды связываются только с щелью А, а бета1,4,-бета1,3-смешанные связанные глюканы связываются только с щелью B. [ 15 ]
CBM9
[ редактировать ]Семейство 9 углеводсвязывающих модулей (CBM9) связывается с кристаллической целлюлозой. [ 16 ] CBM4 и CBM9 тесно связаны.
КБМ10
[ редактировать ]Семейство 10 углеводсвязывающих модулей (CBM10) встречается в двух различных наборах белков с разными функциями. Те, что обнаружены в аэробных бактериях, связывают целлюлозу (или другие углеводы); но у анаэробных грибов они представляют собой белковые домены, называемые доменами докерина . Считается, что домены докерина ответственны за сборку мультипротеинового комплекса целлюлаза/гемицеллюлаза, подобного целлюлосоме, обнаруженной у некоторых анаэробных бактерий . [ 17 ] [ 18 ]
У анаэробных бактерий , которые разрушают стенки растительных клеток, примером которых является Clostridium thermocellum , докериновые домены каталитических полипептидов могут одинаково хорошо связываться с любым когезином из того же организма . Совсем недавно анаэробные грибы, типичным представителем которых является Piromyces equi было высказано предположение, что , также синтезируют целлюлосомный комплекс, хотя последовательности докеринов бактериальных и грибковых ферментов совершенно различны. [ 19 ] Например, грибковые ферменты содержат одну, две или три копии последовательности докерина, расположенные в тандеме внутри каталитического полипептида. Напротив, все каталитические компоненты целлюлосомы C. thermocellum содержат один домен докерина. Анаэробные бактериальные докерины гомологичны EF-рукам (мотивы, связывающие кальций) и требуют для активности кальция, тогда как грибковый докерин не требует кальция. Наконец, взаимодействие между когезином и докерином, по-видимому, является видоспецифичным у бактерий, видоспецифичность связывания внутри видов грибов почти отсутствует, а также не идентифицированы сайты, которые различают разные виды.
Докерин P. equi содержит два спиральных участка и четыре короткие бета-цепи, которые образуют антипараллельную листовую структуру, примыкающую к дополнительной короткой скрученной параллельной цепи. N- и C-концы примыкают друг к другу. [ 19 ]
CBM11
[ редактировать ]Семейство 11 углеводсвязывающих модулей (CBM11) обнаружено в ряде бактериальных целлюлаз . Одним из примеров является CBM11 Clostridium thermocellum Cel26A-Cel5E. Было показано, что этот домен связывает как β-1,4-глюкан, так и β-1,3-1,4-смешанно связанные глюканы. [ 20 ] CBM11 имеет бета-сэндвич-структуру с вогнутой стороной, образующей щель, связывающую субстрат. [ 20 ]
КБМ12
[ редактировать ]Семейство 12 углеводсвязывающих модулей (CBM12) состоит из двух бета-листов , состоящих из двух и трех антипараллельных бета-цепей соответственно. Он связывает хитин через ароматические кольца остатков триптофана . [ 14 ] CBM5 и CBM12 являются отдаленными родственниками.
CBM14
[ редактировать ]Семейство 14 углеводсвязывающих модулей (CBM14) также известно как домен перитрофина-А. Он обнаружен в хитинсвязывающих белках, особенно в перитрофических матриксных белках насекомых и хитиназах животных . [ 21 ] [ 22 ] [ 23 ] Копии домена также обнаружены в некоторых бакуловирусах . Это внеклеточный домен, содержащий шесть консервативных цистеинов , которые, вероятно, образуют три дисульфидных мостика . Связывание хитина было продемонстрировано для белка, содержащего только два из этих доменов. [ 21 ]
КБМ15
[ редактировать ]Было показано, что семейство 15 углеводсвязывающих модулей (CBM15), обнаруженное в бактериальных ферментах, связывается с ксиланами и ксилоолигосахаридами. Он имеет складку из бета-желе с бороздкой на вогнутой поверхности одного из бета-листов . [ 3 ]
CBM17
[ редактировать ]Семейство 17 углеводсвязывающих модулей (CBM17), по-видимому, имеет очень неглубокую связывающую щель, которая может быть более доступной для целлюлозных цепей в некристаллической целлюлозе, чем более глубокие связывающие щели CBM семейства 4. [ 24 ] Консервативность последовательности и структуры в семействах CBM17 и CBM28 позволяет предположить, что они развились посредством дупликации генов и последующей дивергенции. [ 4 ] CBM17 не конкурирует с модулями CBM28 при связывании с некристаллической целлюлозой. Было показано, что разные CBM связываются с разными сайтами в аморфной целлюлозе, CBM17 и CBM28 распознают отдельные неперекрывающиеся сайты в аморфной целлюлозе. [ 25 ]
CBM18
[ редактировать ]Семейство 18 углеводсвязывающих модулей (CBM18) (также известное как хитин-связывающий 1 или хитин-распознающий белок) обнаружено в ряде растительных и грибных белков , которые связывают N-ацетилглюкозамин (например, пасленовые лектины томатов и картофеля, растительные эндохитиназы , раневые -индуцированные белки: гевеин , win1 и win2, а также Kluyveromyces Lactis -киллера альфа-субъединица токсина ). [ 26 ] Домен может встречаться в одной или нескольких копиях и, как полагают, участвует в распознавании или связывании субъединиц хитина . [ 27 ] [ 28 ] В хитиназах, а также в белках, индуцированных раной картофеля , этот домен из 43 остатков непосредственно следует за сигнальной последовательностью и, следовательно, находится на N-конце зрелого белка; в альфа-субъединице киллерного токсина он расположен в центральном отделе белка.
CBM19
[ редактировать ]Семейство углеводсвязывающих модулей 19 (CBM19), обнаруженное в хитиназах грибов , связывает хитин . [ 29 ]
КБМ20
[ редактировать ]Семейство 20 углеводсвязывающих модулей (CBM20) связывается с крахмалом . [ 30 ] [ 31 ]
CBM21
[ редактировать ]Семейство 21 углеводсвязывающих модулей (CBM21), обнаруженное во многих эукариотических белках, участвующих в метаболизме гликогена , связывается с гликогеном. [ 32 ]
КБМ25
[ редактировать ]Семейство 25 углеводсвязывающих модулей (CBM25) связывает альфа-глюкоолигосахариды, особенно те, которые содержат альфа-1,6-связи, и гранулированный крахмал. [ 33 ]
CBM27
[ редактировать ]Семейство 27 углеводсвязывающих модулей (CBM27) связывается с бета-1,4-манноолигосахаридами, рожкового дерева галактоманнаном и конжаковым глюкоманнаном, но не с целлюлозой (нерастворимой и растворимой) или растворимым ксиланом березы. CBM27 имеет бета-сэндвич-структуру, состоящую из 13 бета-цепей с одной небольшой альфа-спиралью и одним атомом металла . [ 34 ]
КБМ28
[ редактировать ]Семейство 28 углеводсвязывающих модулей (CBM28) не конкурирует с модулями CBM17 при связывании с некристаллической целлюлозой. Было показано, что разные CBM связываются с разными сиртами в аморфной целлюлозе, CBM17 и CBM28 распознают отдельные неперекрывающиеся сайты в аморфной целлюлозе. CBM28 имеет топологию «бета-желе», которая по структуре аналогична доменам CBM17. Консервативность последовательности и структуры в семействах CBM17 и CBM28 позволяет предположить, что они развились посредством дупликации генов и последующей дивергенции. [ 4 ] [ 25 ]
КБМ32
[ редактировать ]Семейство 32 углеводсвязывающих модулей (CBM32) связывается с различными субстратами, от полисахаридов клеточной стенки растений до сложных гликанов. [ 35 ] На данный момент модуль обнаружен у микроорганизмов, включая археи, эубактерии и грибы. [ 35 ] CBM32 имеет бета-сэндвич-складку и имеет связанный атом металла, чаще всего это кальций. [ 36 ] Модули CBM32 связаны с каталитическими модулями, такими как сиалидазы, BN-ацетилглюкозаминидазы, α-N-ацетилглюкозаминидазы, маннаназы и галактозооксидазы. [ 36 ]
КБМ33
[ редактировать ]Семейство 33 углеводсвязывающих модулей (CBM33) представляет собой хитинсвязывающий домен. [ 37 ] Он имеет отпочковавшуюся складку фибронектина III типа, состоящую из двух бета-листов, расположенных в виде сэндвича с бета-листами, и зачаток, состоящий из трех коротких спиралей, расположенных между бета-нитями 1 и 2. Он связывает хитин через консервативные полярные аминокислоты. [ 38 ] Этот домен изолированно обнаружен в бакуловирусных белках сфероидина и спиндолина.
CBM48
[ редактировать ]Семейство 48 углеводсвязывающих модулей (CBM48) часто встречается в ферментах, содержащих каталитические домены гликозилгидролазы 13 семейства. Он обнаружен в ряде ферментов , которые действуют на разветвленные субстраты, например, в изоамилазе, пуллуланазе и ферменте разветвления. Изоамилаза гидролизует 1,6-альфа-D-глюкозидные разветвленные связи в гликогене, амилопектине и декстрине ; Фермент разветвления 1,4-альфа-глюкана участвует в образовании 1,6-глюкозидных связей гликогена; и пуллуланаза представляет собой фермент, разветвляющий крахмал. CBM48 связывает гликоген. [ 39 ] [ 40 ] [ 41 ] [ 42 ]
CBM49
[ редактировать ]Семейство 49 углеводсвязывающих модулей (CBM49) обнаружено на С-конце целлюлазы, и исследования связывания in vitro показали, что он связывается с кристаллической целлюлозой. [ 43 ]
Ссылки
[ редактировать ]- ^ Гилкс Н.Р., Хенриссат Б., Килберн Д.Г., Миллер Р.К., Уоррен Р.А. (июнь 1991 г.). «Домены микробных бета-1,4-гликаназ: сохранение последовательности, функции и семейства ферментов» . Микробиол. Преподобный . 55 (2): 303–15. дои : 10.1128/MMBR.55.2.303-315.1991 . ПМЦ 372816 . ПМИД 1886523 .
- ^ Кантарель, БЛ; Коутиньо, премьер-министр; Ранкурел, К.; Бернард, Т.; Ломбард, В.; Генриссат, Б. (2009). «База данных углеводно-активных ферментов (CAZy): экспертный ресурс по гликогеномике» . Исследования нуклеиновых кислот . 37 (Проблема с базой данных): D233–D238. дои : 10.1093/нар/gkn663 . ПМК 2686590 . ПМИД 18838391 .
- ^ Jump up to: а б Сабо, Л.; Джамал, С.; Се, Х.; Чарнок, С.Дж.; Болам, Д.Н.; Гилберт, HJ ; Дэвис, Дж.Дж. (2001). «Структура углеводсвязывающего модуля семейства 15 в комплексе с ксилопентаозой. Доказательства того, что ксилан связывается примерно в 3-кратной спиральной конформации» . Журнал биологической химии . 276 (52): 49061–49065. дои : 10.1074/jbc.M109558200 . ПМИД 11598143 .
- ^ Jump up to: а б с Джамал С., Нуриццо Д., Борастон А.Б., Дэвис Г.Дж. (май 2004 г.). «Рентгеновская кристаллическая структура некристаллического специфического для целлюлозы углеводсвязывающего модуля: CBM28». Дж. Мол. Биол . 339 (2): 253–8. дои : 10.1016/j.jmb.2004.03.069 . ПМИД 15136030 .
- ^ Роске Й., Сунна А., Пфейл В., Хайнеманн У. (июль 2004 г.). «Кристаллические структуры высокого разрешения углеводсвязывающего модуля штамма Caldicellulosiruptor Rt8B.4 CBM27-1 и его комплекса с манногексазой». Дж. Мол. Биол . 340 (3): 543–54. дои : 10.1016/j.jmb.2004.04.072 . ПМИД 15210353 .
- ^ Гилкс Н.Р., Клейссенс М., Эберсолд Р., Хенриссат Б., Мейнке А., Моррисон Х.Д., Килберн Д.Г., Уоррен Р.А., Миллер Р.К. (декабрь 1991 г.). «Структурные и функциональные взаимоотношения в двух семействах бета-1,4-гликаназ». Евро. Дж. Биохим . 202 (2): 367–77. дои : 10.1111/j.1432-1033.1991.tb16384.x . ПМИД 1761039 .
- ^ Мейнке А., Гилкс Н.Р., Килберн Д.Г., Миллер Р.К., Уоррен Р.А. (декабрь 1991 г.). «Бактериальные целлюлозосвязывающие доменоподобные последовательности в эукариотических полипептидах». Белок сек. Анал данных . 4 (6): 349–53. ПМИД 1812490 .
- ^ Симпсон П.Дж., Се Х., Болам Д.Н., Гилберт Х.Дж., Уильямсон, член парламента (декабрь 2000 г.). «Структурная основа лигандной специфичности углеводсвязывающих модулей семейства 2» . Ж. Биол. Хим . 275 (52): 41137–42. дои : 10.1074/jbc.M006948200 . ПМИД 10973978 .
- ^ Сюй, ГЯ; Онг, Э.; Гилкс, Северная Каролина; Килберн, генеральный директор; Мухандирам, ДР; Харрис-Брандтс, М.; Карвер, JP; Кей, Л.Э.; Харви, Т.С. (1995). «Структура раствора целлюлозосвязывающего домена Cellulomonas fimi по данным спектроскопии ядерного магнитного резонанса». Биохимия . 34 (21): 6993–7009. дои : 10.1021/bi00021a011 . ПМИД 7766609 .
- ^ Пул Д.М., Мораг Э., Ламед Р., Байер Э.А., Хэзлвуд Г.П., Гилберт Х.Дж. (декабрь 1992 г.). «Идентификация целлюлозосвязывающего домена субъединицы S1 целлюлосомы Clostridium thermocellum YS» . ФЭМС Микробиол. Летт . 78 (2–3): 181–6. дои : 10.1016/0378-1097(92)90022-г . ПМИД 1490597 .
- ^ Тормо Дж., Ламед Р., Чирино А.Дж., Мораг Э., Байер Э.А., Шохам Ю., Стейц Т.А. (ноябрь 1996 г.). «Кристаллическая структура целлюлозосвязывающего домена бактериального семейства III: общий механизм прикрепления к целлюлозе» . ЭМБО Дж . 15 (21): 5739–51. дои : 10.1002/j.1460-2075.1996.tb00960.x . ПМК 452321 . ПМИД 8918451 .
- ^ Брун Э., Джонсон П.Е., Криг А.Л., Томм П., Вебстер П., Хейнс Калифорния, Макинтош Л.П. (март 2000 г.). «Структура и специфичность связывания второго N-концевого целлюлозосвязывающего домена эндоглюканазы C Cellulomonas fimi». Биохимия . 39 (10): 2445–58. дои : 10.1021/bi992079u . ПМИД 10704194 .
- ^ Джонсон П.Е., Джоши МД, Томм П., Килберн Д.Г., Макинтош Л.П. (ноябрь 1996 г.). «Структура N-концевого целлюлозосвязывающего домена Cellulomonas fimi CenC, определенная методом спектроскопии ядерного магнитного резонанса». Биохимия . 35 (45): 14381–94. дои : 10.1021/bi961612s . ПМИД 8916925 .
- ^ Jump up to: а б Акаги, К.-И.; Ватанабэ, Дж.; Хара, М.; Кезука, Ю.; Чикаиси, Э.; Ямагучи, Т.; Акуцу, Х.; Нонака, Т.; Ватанабэ, Т.; Икегами, Т. (2006). «Идентификация области взаимодействия с субстратом хитинсвязывающего домена хитиназы C Streptomyces griseus». Журнал биохимии . 139 (3): 483–493. дои : 10.1093/jb/mvj062 . ПМИД 16567413 .
- ^ Хеншоу, JL; Болам, Д.Н.; Пирес, В.М.; Чжек, М.; Генриссат, Б.; Феррейра, LM; Фонтес, СМ; Гилберт, HJ (2004). «Модуль связывания углеводов CmCBM6-2 семейства 6 содержит два сайта связывания лигандов с различной специфичностью» . Журнал биологической химии . 279 (20): 21552–21559. дои : 10.1074/jbc.M401620200 . ПМИД 15004011 .
- ^ Винтерхальтер, К.; Генрих П.; Кандуссио, А.; Вич, Г.; Либл, В. (1995). «Идентификация нового целлюлозосвязывающего домена в мультидоменной ксиланазе XynA массой 120 кДа гипертермофильной бактерии Thermotoga maritima». Молекулярная микробиология . 15 (3): 431–444. дои : 10.1111/j.1365-2958.1995.tb02257.x . ПМИД 7783614 . S2CID 25985173 .
- ^ Миллуорд-Сэдлер С.Дж., Дэвидсон К., Хэзлвуд Г.П., Блэк Г.В., Гилберт Х.Дж., Кларк Дж.Х. (ноябрь 1995 г.). «Новые целлюлозосвязывающие домены, гомологи NodB и консервативная модульная архитектура в ксиланазах аэробных почвенных бактерий Pseudomonas fluorescens subsp. cellulosa и Cellvibrio mixtus» . Биохим. Дж . 312 (1): 39–48. дои : 10.1042/bj3120039 . ПМЦ 1136224 . ПМИД 7492333 .
- ^ Фанутти С., Поньи Т., Блэк Г.В., Хэзлвуд Г.П., Гилберт Х.Дж. (декабрь 1995 г.). «Консервативная некаталитическая последовательность из 40 остатков в целлюлазах и гемицеллюлазах анаэробных грибов функционирует как домен стыковки белка» . Ж. Биол. Хим . 270 (49): 29314–22. дои : 10.1074/jbc.270.49.29314 . ПМИД 7493964 .
- ^ Jump up to: а б Раготама С., Эберхардт Р.Ю., Симпсон П., Вигелсворт Д., Уайт П., Хэзлвуд Г.П., Надь Т., Гилберт Х.Дж., Уильямсон член парламента (сентябрь 2001 г.). «Характеристика целлюлосомного домена докерина анаэробного гриба Piromyces equi». Нат. Структура. Биол . 8 (9): 775–8. дои : 10.1038/nsb0901-775 . ПМИД 11524680 . S2CID 6442375 .
- ^ Jump up to: а б Карвальо, Алабама; Гоял, А.; Пратес, Дж. А.; Болам, Д.Н.; Гилберт, HJ ; Пирес, В.М.; Феррейра, LM; Планас, А.; Ромао, MJ; Фонтес, CM (2004). «Углеводсвязывающий модуль семейства 11 Clostridium thermocellum Lic26A-Cel5E размещает -1,4- и -1,3-1,4-смешанные связанные глюканы в одном сайте связывания» . Журнал биологической химии . 279 (33): 34785–34793. дои : 10.1074/jbc.M405867200 . ПМИД 15192099 .
- ^ Jump up to: а б Шен З., Джейкобс-Лорена М. (июль 1998 г.). «Белок перитрофического матрикса I типа из малярийного вектора Anopheles gambiae связывается с хитином. Клонирование, экспрессия и характеристика» . Ж. Биол. Хим . 273 (28): 17665–70. дои : 10.1074/jbc.273.28.17665 . ПМИД 9651363 .
- ^ Элвин С.М., Вуоколо Т., Пирсон Р.Д., Ист И.Дж., Райдинг Г.А., Эйземанн Ч., Теллам Р.Л. (апрель 1996 г.). «Характеристика основного перитрофического мембранного белка, перитрофина-44, из личинок Lucilia cuprina. кДНК и выведенные аминокислотные последовательности» . Ж. Биол. Хим . 271 (15): 8925–35. дои : 10.1074/jbc.271.15.8925 . ПМИД 8621536 .
- ^ Касу Р., Эйземанн К., Пирсон Р., Райдинг Дж., Ист И., Дональдсон А., Кадоган Л., Теллам Р. (август 1997 г.). «Опосредованное антителами ингибирование роста личинок насекомых, вызывающих кожный миаз у млекопитающих» . Учеб. Натл. акад. наук. США . 94 (17): 8939–44. Бибкод : 1997PNAS...94.8939C . дои : 10.1073/pnas.94.17.8939 . ПМК 22971 . ПМИД 9256413 .
- ^ Нотенбум В., Борастон А.Б., Чиу П., Фрилав А.С., Килберн Д.Г., Роуз Д.Р. (декабрь 2001 г.). «Распознавание целлоолигосахаридов по углеводсвязывающему модулю семейства 17: рентгенокристаллографическое, термодинамическое и мутагенное исследование». Дж. Мол. Биол . 314 (4): 797–806. дои : 10.1006/jmbi.2001.5153 . ПМИД 11733998 .
- ^ Jump up to: а б Джамал, С.; Нуриццо, Д.; Борастон, AB; Дэвис, Дж.Дж. (2004). «Рентгено-кристаллическая структура некристаллического целлюлозосвязывающего модуля, специфичного для углевода: CBM28». Журнал молекулярной биологии . 339 (2): 253–258. дои : 10.1016/j.jmb.2004.03.069 . ПМИД 15136030 .
- ^ Райт Х.Т., Сандрасегарам Дж., Райт К.С. (сентябрь 1991 г.). «Эволюция семейства белков, связывающих N-ацетилглюкозамин, содержащих богатый дисульфидами домен агглютинина зародышей пшеницы». Дж. Мол. Эвол . 33 (3): 283–94. Бибкод : 1991JMolE..33..283W . дои : 10.1007/bf02100680 . ПМИД 1757999 . S2CID 8327744 .
- ^ Батлер А.Р., О'Доннелл Р.В., Мартин В.Дж., Гудэй Г.В., Старк М.Дж. (июль 1991 г.). «Токсин Kluyveromyces Lactis обладает существенной хитиназной активностью» . Евро. Дж. Биохим . 199 (2): 483–8. дои : 10.1111/j.1432-1033.1991.tb16147.x . ПМИД 2070799 .
- ^ Лернер Д.Р., Райхель Н.В. (июнь 1992 г.). «Ген лектина крапивы двудомной (агглютинин Urtica dioica) кодирует как лектин, так и хитиназу» . Ж. Биол. Хим . 267 (16): 11085–91. дои : 10.1016/S0021-9258(19)49878-5 . ПМИД 1375935 .
- ^ Куранда, MJ; Роббинс, PW (1991). «Хитиназа необходима для разделения клеток во время роста Saccharomyces cerevisiae» . Журнал биологической химии . 266 (29): 19758–19767. дои : 10.1016/S0021-9258(18)55057-2 . ПМИД 1918080 .
- ^ Пеннинга, Д.; Ван дер Вин, бакалавр; Кнегтель, РМ; Ван Хиджум, ЮАР; Роузбум, HJ; Кальк, КХ; Дейкстра, BW; Дейхуизен, Л. (1996). «Сырой крахмалсвязывающий домен циклодекстрингликозилтрансферазы из штамма 251 Bacillus circulans» . Журнал биологической химии . 271 (51): 32777–32784. дои : 10.1074/jbc.271.51.32777 . ПМИД 8955113 .
- ^ Ояма, Т.; Кусуноки, М.; Кисимото, Ю.; Такасаки, Ю.; Нитта, Ю. (1999). «Кристаллическая структура бета-амилазы из Bacillus cereus var. Mycoides при разрешении 2,2». Журнал биохимии . 125 (6): 1120–1130. doi : 10.1093/oxfordjournals.jbchem.a022394 . ПМИД 10348915 .
- ^ Армстронг, CG; Доэрти, MJ; Коэн, ПТ (1998). «Идентификация отдельных доменов в субъединице протеинфосфатазы 1, нацеленной на гликоген печени, которые взаимодействуют с фосфорилазой а, гликогеном и протеинфосфатазой 1» . Биохимический журнал . 336 (3): 699–704. дои : 10.1042/bj3360699 . ПМК 1219922 . ПМИД 9841883 .
- ^ Борастон, AB; Хили, М.; Классен, Дж.; Фицко-Блин, Э.; Ламмертс Ван Бюрен, А.; Закон, В. (2005). «Структурный и функциональный анализ распознавания -глюканов углеводсвязывающими модулями семейства 25 и 26 показывает консервативный режим распознавания крахмала» . Журнал биологической химии . 281 (1): 587–598. дои : 10.1074/jbc.M509958200 . ПМИД 16230347 .
- ^ Борастон AB, Реветт Т.Дж., Борастон СМ, Нуриццо Д., Дэвис Г.Дж. (июнь 2003 г.). «Структурное и термодинамическое исследование специфического распознавания маннана с помощью углеводсвязывающего модуля TmCBM27» . Структура . 11 (6): 665–75. дои : 10.1016/S0969-2126(03)00100-X . ПМИД 12791255 .
- ^ Jump up to: а б Эббот, Д.В.; Эйрин-Лопес, Дж. М.; Борастон, AB (январь 2008 г.). «Понимание разнообразия лигандов и новой биологической роли углеводсвязывающих модулей семейства 32». Молекулярная биология и эволюция . 25 (1): 155–67. дои : 10.1093/molbev/msm243 . ПМИД 18032406 .
- ^ Jump up to: а б Фико-Блин, Элизабет; Борастон, Алисдэр, «Семейство модулей связывания углеводов 32». Архивировано 20 августа 2016 г. на Wayback Machine , CAZypedia. Архивировано 28 апреля 2024 г. на Wayback Machine , 4 мая 2017 г.
- ^ Шнельманн, Дж.; Зельтинс, А.; Блаак, Х.; Шремпф, Х. (1994). «Новый лектиноподобный белок CHB1 кодируется хитин-индуцируемым геном Streptomyces olivaceoviridis и специфически связывается с кристаллическим альфа-хитином грибов и других организмов». Молекулярная микробиология . 13 (5): 807–819. дои : 10.1111/j.1365-2958.1994.tb00473.x . ПМИД 7815940 . S2CID 22470447 .
- ^ Ваае-Кольстад, Г.; Хьюстон, ДР; Римен, АХ; Эййсинк, В.Г.; Ван Аалтен, DM (2005). «Кристаллическая структура и связывающие свойства хитинсвязывающего белка Serratia marcescens CBP21» . Журнал биологической химии . 280 (12): 11313–11319. дои : 10.1074/jbc.M407175200 . ПМИД 15590674 .
- ^ Кацуя, Ю.; Мезаки, Ю.; Кубота, М.; Мацуура, Ю. (1998). «Трехмерная структура изоамилазы Pseudomonas с разрешением 2,2 Å1». Журнал молекулярной биологии . 281 (5): 885–897. дои : 10.1006/jmbi.1998.1992 . ПМИД 9719642 .
- ^ Вятровский, HA; Ван Дендерен, Би Джей; Берки, CD; Кемп, Британская Колумбия; Стэплтон, Д.; Карлсон, М. (2004). «Мутации в гликогенсвязывающем домене gal83 активируют киназный путь snf1/gal83 по гликоген-независимому механизму» . Молекулярная и клеточная биология . 24 (1): 352–361. дои : 10.1128/mcb.24.1.352-361.2004 . ПМК 303368 . ПМИД 14673168 .
- ^ Полехина Г.; Гупта, А.; Мичелл, Би Джей; Ван Дендерен, Б.; Мурти, С.; Фейл, Южная Каролина; Дженнингс, И.Г.; Кэмпбелл, диджей; Уиттерс, Луизиана; Паркер, Миссури; Кемп, Бельгия; Стэплтон, Д. (2003). «Бета-субъединица AMPK нацелена на чувствительность к метаболическому стрессу гликогена» . Современная биология . 13 (10): 867–871. дои : 10.1016/S0960-9822(03)00292-6 . ПМИД 12747837 . S2CID 16778615 .
- ^ Хадсон, скорая помощь; Пан, Д.А.; Джеймс, Дж.; Люкок, Дж. М.; Хоули, ЮАР; Грин, Калифорния; Баба, О.; Терашима, Т.; Харди, генеральный директор (2003). «Новый домен AMP-активируемой протеинкиназы вызывает образования гликогеновых телец, сходных с теми, которые наблюдаются при наследственных сердечных аритмиях» . Современная биология . 13 (10): 861–866. дои : 10.1016/S0960-9822(03)00249-5 . ПМИД 12747836 . S2CID 2295263 .
- ^ Урбанович Б.Р., Катала С., Ирвин Д., Уилсон Д.Б., Риполл Д.Р., Роуз Дж.К. (апрель 2007 г.). «Томатная эндо-бета-1,4-глюканаза, SlCel9C1, представляет собой отдельный подкласс с новым семейством углеводсвязывающих модулей (CBM49)» . Ж. Биол. Хим . 282 (16): 12066–74. дои : 10.1074/jbc.M607925200 . ПМИД 17322304 .