Рилин
| РЭЛН | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | РЭЛН , ЛИС2, ПРО1598, РЛ, релин, ЭТЛ7 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | ОМИМ : 600514 ; МГИ : 103022 ; Гомологен : 3699 ; GeneCards : РЭЛН ; ОМА : РЭЛН – ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Wikidata | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
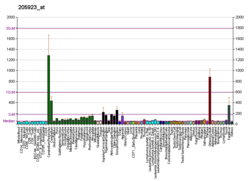
Рилин , кодируемый геном RELN , [5] представляет собой большой секретируемый внеклеточного матрикса гликопротеин , который помогает регулировать процессы миграции и позиционирования нейронов в развивающемся мозге, контролируя межклеточные взаимодействия . Помимо этой важной роли в раннем развитии , рилин продолжает работать в мозге взрослого человека. [6] Он модулирует синаптическую пластичность , усиливая индукцию и поддержание долгосрочной потенциации . [7] [8] Он также стимулирует дендриты [9] и дендритный шип [10] развитие и регулирует продолжающуюся миграцию нейробластов, образующихся в нейрогенеза взрослых, участках таких как субвентрикулярная и субгранулярная зоны . Он обнаружен не только в головном мозге , но также в печени , щитовидной железе , надпочечниках , фаллопиевых трубах , молочной железе и в сравнительно более низких уровнях в ряде анатомических областей. [11]
Reelin has been suggested to be implicated in pathogenesis of several brain diseases. The expression of the protein has been found to be significantly lower in schizophrenia and psychotic bipolar disorder,[12] but the cause of this observation remains uncertain, as studies show that psychotropic medication itself affects reelin expression. Moreover, epigenetic hypotheses aimed at explaining the changed levels of reelin expression[13] are controversial.[14][15] Total lack of reelin causes a form of lissencephaly. Reelin may also play a role in Alzheimer's disease,[16] височная эпилепсия и аутизм .
Reelin's name comes from the abnormal reeling gait of reeler mice,[17] which were later found to have a deficiency of this brain protein and were homozygous for mutation of the RELN gene.The primary phenotype associated with loss of reelin function is a failure of neuronal positioning throughout the developing central nervous system (CNS). The mice heterozygous for the reelin gene, while having little neuroanatomical defects, display the endophenotypic traits linked to psychotic disorders.[18]
Discovery
[edit]
Mutant mice have provided insight into the underlying molecular mechanisms of the development of the central nervous system. Useful spontaneous mutations were first identified by scientists who were interested in motor behavior, and it proved relatively easy to screen littermates for mice that showed difficulties moving around the cage. A number of such mice were found and given descriptive names such as reeler, weaver, lurcher, nervous, and staggerer.[citation needed]
The "reeler" mouse was described for the first time in 1951 by D.S.Falconer in Edinburgh University as a spontaneous variant arising in a colony of at least mildly inbred snowy-white bellied mice stock in 1948.[17] Histopathological studies in the 1960s revealed that the cerebellum of reeler mice is dramatically decreased in size while the normal laminar organization found in several brain regions is disrupted.[19] The 1970s brought about the discovery of cellular layer inversion in the mouse neocortex,[20] which attracted more attention to the reeler mutation.
In 1994, a new allele of reeler was obtained by means of insertional mutagenesis.[21] This provided the first molecular marker of the locus, permitting the RELN gene to be mapped to chromosome 7q22 and subsequently cloned and identified.[22] Japanese scientists at Kochi Medical School successfully raised antibodies against normal brain extracts in reeler mice, later these antibodies were found to be specific monoclonal antibodies for reelin, and were termed CR-50 (Cajal-Retzius marker 50).[23] They noted that CR-50 reacted specifically with Cajal-Retzius neurons, whose functional role was unknown until then.[citation needed]
The Reelin receptors, apolipoprotein E receptor 2 (ApoER2) and very-low-density lipoprotein receptor (VLDLR), were discovered by Trommsdorff, Herz and colleagues, who initially found that the cytosolic adaptor protein Dab1 interacts with the cytoplasmic domain of LDL receptor family members.[24] They then went on to show that the double knockout mice for ApoER2 and VLDLR, which both interact with Dab1, had cortical layering defects similar to those in reeler.[25]
The downstream pathway of reelin was further clarified with the help of other mutant mice, including yotari and scrambler. These mutants have phenotypes similar to that of reeler mice, but without mutation in reelin. It was then demonstrated that the mouse disabled homologue 1 (Dab1) gene is responsible for the phenotypes of these mutant mice, as Dab1 protein was absent (yotari) or only barely detectable (scrambler) in these mutants.[26] Targeted disruption of Dab1 also caused a phenotype similar to that of reeler. Pinpointing the DAB1 as a pivotal regulator of the reelin signaling cascade started the tedious process of deciphering its complex interactions.[citation needed]
There followed a series of speculative reports linking reelin's genetic variation and interactions to schizophrenia, Alzheimer's disease, autism and other highly complex dysfunctions. These and other discoveries, coupled with the perspective of unraveling the evolutionary changes that allowed for the creation of human brain, highly intensified the research. As of 2008, some 13 years after the gene coding the protein was discovered, hundreds of scientific articles address the multiple aspects of its structure and functioning.[27][28]
Tissue distribution and secretion
[edit]Studies show that reelin is absent from synaptic vesicles and is secreted via constitutive secretory pathway, being stored in Golgi secretory vesicles.[29] Reelin's release rate is not regulated by depolarization, but strictly depends on its synthesis rate. This relationship is similar to that reported for the secretion of other extracellular matrix proteins.[citation needed]
During the brain development, reelin is secreted in the cortex and hippocampus by the so-called Cajal-Retzius cells, Cajal cells, and Retzius cells.[30] Reelin-expressing cells in the prenatal and early postnatal brain are predominantly found in the marginal zone (MZ) of the cortex and in the temporary subpial granular layer (SGL), which is manifested to the highest extent in human,[31] and in the hippocampal stratum lacunosum-moleculare and the upper marginal layer of the dentate gyrus.
In the developing cerebellum, reelin is expressed first in the external granule cell layer (EGL), before the granule cell migration to the internal granule cell layer (IGL) takes place.[32]
Having peaked just after the birth, the synthesis of reelin subsequently goes down sharply, becoming more diffuse compared with the distinctly laminar expression in the developing brain. In the adult brain, reelin is expressed by GABA-ergic interneurons of the cortex and glutamatergic cerebellar neurons,[33] the glutamatergic stellate cells and fan cells in the superficial entorhinal cortex that are supposed to carry a role in encoding new episodic memories,[34] and by the few extant Cajal-Retzius cells. Among GABAergic interneurons, reelin seems to be detected predominantly in those expressing calretinin and calbindin, like bitufted, horizontal, and Martinotti cells, but not parvalbumin-expressing cells, like chandelier or basket neurons.[35][36] In the white matter, a minute proportion of interstitial neurons has also been found to stain positive for reelin expression.[37]

Outside the brain, reelin is found in adult mammalian blood, liver, pituitary pars intermedia, and adrenal chromaffin cells.[38] In the liver, reelin is localized in hepatic stellate cells.[39] The expression of reelin increases when the liver is damaged, and returns to normal following its repair.[40]In the eyes, reelin is secreted by retinal ganglion cells and is also found in the endothelial layer of the cornea.[41] Just as in the liver, its expression increases after an injury has taken place.[citation needed]
The protein is also produced by the odontoblasts, which are cells at the margins of the dental pulp. Reelin is found here both during odontogenesis and in the mature tooth.[42] Some authors suggest that odontoblasts play an additional role as sensory cells able to transduce pain signals to the nerve endings.[43] According to the hypothesis, reelin participates in the process[28] by enhancing the contact between odontoblasts and the nerve terminals.[44]
Structure
[edit]
Reelin is composed of 3461 amino acids with a relative molecular mass of 388 kDa. It also has serine protease activity.[46] Murine RELN gene consists of 65 exons spanning approximately 450 kb.[47] One exon, coding for only two amino acids near the protein's C-terminus, undergoes alternative splicing, but the exact functional impact of this is unknown.[28] Two transcription initiation sites and two polyadenylation sites are identified in the gene structure.[47]
The reelin protein starts with a signaling peptide 27 amino acids in length, followed by a region bearing similarity to F-spondin (the reeler domain), marked as "SP" on the scheme, and by a region unique to reelin, marked as "H". Next comes 8 repeats of 300–350 amino acids. These are called reelin repeats and have an epidermal growth factor motif at their center, dividing each repeat into two subrepeats, A (the BNR/Asp-box repeat) and B (the EGF-like domain). Despite this interruption, the two subdomains make direct contact, resulting in a compact overall structure.[48]
The final reelin domain contains a highly basic and short C-terminal region (CTR, marked "+") with a length of 32 amino acids. This region is highly conserved, being 100% identical in all investigated mammals. It was thought that CTR is necessary for reelin secretion, because the Orleans reeler mutation, which lacks a part of 8th repeat and the whole CTR, is unable to secrete the misshaped protein, leading to its concentration in cytoplasm. However, other studies have shown that the CTR is not essential for secretion itself, but mutants lacking the CTR were much less efficient in activating downstream signaling events.[49]
Reelin is cleaved in vivo at two sites located after domains 2 and 6 – approximately between repeats 2 and 3 and between repeats 6 and 7, resulting in the production of three fragments.[50] This splitting does not decrease the protein's activity, as constructs made of the predicted central fragments (repeats 3–6) bind to lipoprotein receptors, trigger Dab1 phosphorylation and mimic functions of reelin during cortical plate development.[51] Moreover, the processing of reelin by embryonic neurons may be necessary for proper corticogenesis.[52]
Function
[edit]
The primary functions of Reelin are the regulation of corticogenesis and neuronal cell positioning in the prenatal period, but the protein also continues to play a role in adults. Reelin is found in numerous tissues and organs, and one could roughly subdivide its functional roles by the time of expression and by localisation of its action.[11]
During development
[edit]A number of non-nervous tissues and organs express reelin during development, with the expression sharply going down after organs have been formed. The role of the protein here is largely unexplored, because the knockout mice show no major pathology in these organs. Reelin's role in the growing central nervous system has been extensively characterized. It promotes the differentiation of progenitor cells into radial glia and affects the orientation of its fibers, which serve as the guides for the migrating neuroblasts.[55] The position of reelin-secreting cell layer is important, because the fibers orient themselves in the direction of its higher concentration.[56] For example, reelin regulates the development of layer-specific connections in hippocampus and entorhinal cortex.[57][58]

Mammalian corticogenesis is another process where reelin plays a major role. In this process the temporary layer called preplate is split into the marginal zone on the top and subplate below, and the space between them is populated by neuronal layers in the inside-out pattern. Such an arrangement, where the newly created neurons pass through the settled layers and position themselves one step above, is a distinguishing feature of mammalian brain, in contrast to the evolutionary older reptile cortex, in which layers are positioned in an "outside-in" fashion. When reelin is absent, like in the mutant reeler mouse, the order of cortical layering becomes roughly inverted, with younger neurons finding themselves to be unable to pass the settled layers. Subplate neurons fail to stop and invade the upper most layer, creating the so-called superplate in which they mix with Cajal-Retzius cells and some cells normally destined for the second layer.[citation needed]

There is no agreement concerning the role of reelin in the proper positioning of cortical layers. The original hypothesis, that the protein is a stop signal for the migrating cells, is supported by its ability to induce the dissociation,[59] its role in asserting the compact granule cell layer in the hippocampus, and by the fact that migrating neuroblasts evade the reelin-rich areas. But an experiment in which murine corticogenesis went normally despite the malpositioned reelin secreting layer,[60] and lack of evidence that reelin affects the growth cones and leading edges of neurons, caused some additional hypotheses to be proposed. According to one of them, reelin makes the cells more susceptible to some yet undescribed positional signaling cascade.[citation needed]
Reelin may also ensure correct neuronal positioning in the spinal cord: according to one study, location and level of its expression affects the movement of sympathetic preganglionic neurons.[61]
The protein is thought to act on migrating neuronal precursors and thus controls correct cell positioning in the cortex and other brain structures. The proposed role is one of a dissociation signal for neuronal groups, allowing them to separate and go from tangential chain-migration to radial individual migration.[59] Dissociation detaches migrating neurons from the glial cells that are acting as their guides, converting them into individual cells that can strike out alone to find their final position.[citation needed]

Reelin takes part in the developmental change of NMDA receptor configuration, increasing mobility of NR2B-containing receptors and thus decreasing the time they spend at the synapse.[63][dead link][64][65] It has been hypothesized that this may be a part of the mechanism behind the "NR2B-NR2A switch" that is observed in the brain during its postnatal development.[66] Ongoing reelin secretion by GABAergic hippocampal neurons is necessary to keep NR2B-containing NMDA receptors at a low level.[62]
In adults
[edit]In the adult nervous system, reelin plays an eminent role at the two most active neurogenesis sites, the subventricular zone and the dentate gyrus. In some species, the neuroblasts from the subventricular zone migrate in chains in the rostral migratory stream (RMS) to reach the olfactory bulb, where reelin dissociates them into individual cells that are able to migrate further individually. They change their mode of migration from tangential to radial, and begin using the radial glia fibers as their guides. There are studies showing that along the RMS itself the two receptors, ApoER2 and VLDLR, and their intracellular adapter DAB1 function independently of Reelin,[67] most likely by the influence of a newly proposed ligand, thrombospondin-1.[53] In the adult dentate gyrus, reelin provides guidance cues for new neurons that are constantly arriving to the granule cell layer from subgranular zone, keeping the layer compact.[68]
Reelin also plays an important role in the adult brain by modulating cortical pyramidal neuron dendritic spine expression density, the branching of dendrites, and the expression of long-term potentiation[8] as its secretion is continued diffusely by the GABAergic cortical interneurons those origin is traced to the medial ganglionic eminence.
In the adult organism the non-neural expression is much less widespread, but goes up sharply when some organs are injured.[40][41] The exact function of reelin upregulation following an injury is still being researched.[citation needed]
Evolutionary significance
[edit]

Reelin-DAB1 interactions could have played a key role in the structural evolution of the cortex that evolved from a single layer in the common predecessor of the amniotes into multiple-layered cortex of contemporary mammals.[69] Research shows that reelin expression goes up as the cortex becomes more complex, reaching the maximum in the human brain in which the reelin-secreting Cajal-Retzius cells have significantly more complex axonal arbour.[70] Reelin is present in the telencephalon of all the vertebrates studied so far, but the pattern of expression differs widely. For example, zebrafish have no Cajal-Retzius cells at all; instead, the protein is being secreted by other neurons.[71][72] These cells do not form a dedicated layer in amphibians, and radial migration in their brains is very weak.[71]
As the cortex becomes more complex and convoluted, migration along the radial glia fibers becomes more important for the proper lamination. The emergence of a distinct reelin-secreting layer is thought to play an important role in this evolution.[56] There are conflicting data concerning the importance of this layer,[60] and these are explained in the literature either by the existence of an additional signaling positional mechanism that interacts with the reelin cascade,[60] or by the assumption that mice that are used in such experiments have redundant secretion of reelin[73] compared with more localized synthesis in the human brain.[31]
Cajal-Retzius cells, most of which disappear around the time of birth, coexpress reelin with the HAR1 gene that is thought to have undergone the most significant evolutionary change in humans compared with chimpanzee, being the most "evolutionary accelerated" of the genes from the human accelerated regions.[74] There is also evidence of that variants in the DAB1 gene have been included in a recent selective sweep in Chinese populations.[75][76]
Mechanism of action
[edit]
SFK: Src family kinases.
JIP: JNK-interacting protein 1
Receptors
[edit]Reelin's control of cell-cell interactions is thought to be mediated by binding of reelin to the two members of low density lipoprotein receptor gene family: VLDLR and the ApoER2.[78][79][80][81] The two main reelin receptors seem to have slightly different roles: VLDLR conducts the stop signal, while ApoER2 is essential for the migration of late-born neocortical neurons.[82] It also has been shown that the N-terminal region of reelin, a site distinct from the region of reelin shown to associate with VLDLR/ApoER2 binds to the alpha-3-beta-1 integrin receptor.[83] The proposal that the protocadherin CNR1 behaves as a Reelin receptor[84] has been disproven.[51]
As members of lipoprotein receptor superfamily, both VLDLR and ApoER2 have in their structure an internalization domain called NPxY motif. After binding to the receptors reelin is internalized by endocytosis, and the N-terminal fragment of the protein is re-secreted.[85] This fragment may serve postnatally to prevent apical dendrites of cortical layer II/III pyramidal neurons from overgrowth, acting via a pathway independent of canonical reelin receptors.[86]
Reelin receptors are present on both neurons and glial cells. Furthermore, radial glia express the same amount of ApoER2 but being ten times less rich in VLDLR.[55] beta-1 integrin receptors on glial cells play more important role in neuronal layering than the same receptors on the migrating neuroblasts.[87]
Reelin-dependent strengthening of long-term potentiation is caused by ApoER2 interaction with NMDA receptor. This interaction happens when ApoER2 has a region coded by exon 19. ApoER2 gene is alternatively spliced, with the exon 19-containing variant more actively produced during periods of activity.[88] According to one study, the hippocampal reelin expression rapidly goes up when there is need to store a memory, as demethylases open up the RELN gene.[89] The activation of dendrite growth by reelin is apparently conducted through Src family kinases and is dependent upon the expression of Crk family proteins,[90] consistent with the interaction of Crk and CrkL with tyrosine-phosphorylated Dab1.[91] Moreover, a Cre-loxP recombination mouse model that lacks Crk and CrkL in most neurons[92] was reported to have the reeler phenotype, indicating that Crk/CrkL lie between DAB1 and Akt in the reelin signaling chain.
Signaling cascades
[edit]Reelin activates the signaling cascade of Notch-1, inducing the expression of FABP7 and prompting progenitor cells to assume radial glial phenotype.[93] In addition, corticogenesis in vivo is highly dependent upon reelin being processed by embryonic neurons,[52] which are thought to secrete some as yet unidentified metalloproteinases that free the central signal-competent part of the protein. Some other unknown proteolytic mechanisms may also play a role.[94] It is supposed that full-sized reelin sticks to the extracellular matrix fibers on the higher levels, and the central fragments, as they are being freed up by the breaking up of reelin, are able to permeate into the lower levels.[52] It is possible that as neuroblasts reach the higher levels they stop their migration either because of the heightened combined expression of all forms of reelin, or due to the peculiar mode of action of the full-sized reelin molecules and its homodimers.[28]
The intracellular adaptor DAB1 binds to the VLDLR and ApoER2 through an NPxY motif and is involved in transmission of Reelin signals through these lipoprotein receptors. It becomes phosphorylated by Src[95] and Fyn[96] kinases and apparently stimulates the actin cytoskeleton to change its shape, affecting the proportion of integrin receptors on the cell surface, which leads to the change in adhesion. Phosphorylation of DAB1 leads to its ubiquitination and subsequent degradation, and this explains the heightened levels of DAB1 in the absence of reelin.[97] Such negative feedback is thought to be important for proper cortical lamination.[98] Activated by two antibodies, VLDLR and ApoER2 cause DAB1 phosphorylation but seemingly without the subsequent degradation and without rescuing the reeler phenotype, and this may indicate that a part of the signal is conducted independently of DAB1.[51]

A protein having an important role in lissencephaly and accordingly called LIS1 (PAFAH1B1), was shown to interact with the intracellular segment of VLDLR, thus reacting to the activation of reelin pathway.[77]
Complexes
[edit]Reelin molecules have been shown[99][100] to form a large protein complex, a disulfide-linked homodimer. If the homodimer fails to form, efficient tyrosine phosphorylation of DAB1 in vitro fails. Moreover, the two main receptors of reelin are able to form clusters[101] that most probably play a major role in the signaling, causing the intracellular adaptor DAB1 to dimerize or oligomerize in its turn. Such clustering has been shown in the study to activate the signaling chain even in the absence of Reelin itself.[101] In addition, reelin itself can cut the peptide bonds holding other proteins together, being a serine protease,[46] and this may affect the cellular adhesion and migration processes. Reelin signaling leads to phosphorylation of actin-interacting protein cofilin 1 at ser3; this may stabilize the actin cytoskeleton and anchor the leading processes of migrating neuroblasts, preventing their further growth.[102][103]
Interaction with Cdk5
[edit]Cyclin-dependent kinase 5 (Cdk5), a major regulator of neuronal migration and positioning, is known to phosphorylate DAB1[104][105][106] and other cytosolic targets of reelin signaling, such as Tau,[107] which could be activated also via reelin-induced deactivation of GSK3B,[108] and NUDEL,[109] associated with Lis1, one of the DAB1 targets. LTP induction by reelin in hippocampal slices fails in p35 knockouts.[110] P35 is a key Cdk5 activator, and double p35/Dab1, p35/RELN, p35/ApoER2, p35/VLDLR knockouts display increased neuronal migration deficits,[110][111] indicating a synergistic action of reelin → ApoER2/VLDLR → DAB1 and p35/p39 → Cdk5 pathways in the normal corticogenesis.
Possible pathological role
[edit]Lissencephaly
[edit]Disruptions of the RELN gene are considered to be the cause of the rare form of lissencephaly with cerebellar hypoplasia classed as a microlissencephaly called Norman-Roberts syndrome.[112][113] The mutations disrupt splicing of the RELN mRNA transcript, resulting in low or undetectable amounts of reelin protein. The phenotype in these patients was characterized by hypotonia, ataxia, and developmental delay, with lack of unsupported sitting and profound mental retardation with little or no language development. Seizures and congenital lymphedema are also present. A novel chromosomal translocation causing the syndrome was described in 2007.[114]
Schizophrenia
[edit]Reduced expression of reelin and its mRNA levels in the brains of schizophrenia sufferers had been reported in 1998[115] and 2000,[116] and independently confirmed in postmortem studies of the hippocampus,[12] cerebellum,[117] basal ganglia,[118] and cerebral cortex.[119][120] The reduction may reach up to 50% in some brain regions and is coupled with reduced expression of GAD-67 enzyme,[117] which catalyses the transition of glutamate to GABA. Blood levels of reelin and its isoforms are also altered in schizophrenia, along with mood disorders, according to one study.[121] Reduced reelin mRNA prefrontal expression in schizophrenia was found to be the most statistically relevant disturbance found in the multicenter study conducted in 14 separate laboratories in 2001 by Stanley Foundation Neuropathology Consortium.[122]
Epigenetic hypermethylation of DNA in schizophrenia patients is proposed as a cause of the reduction,[123][124] in agreement with the observations dating from the 1960s that administration of methionine to schizophrenic patients results in a profound exacerbation of schizophrenia symptoms in sixty to seventy percent of patients.[125][126][127][128] The proposed mechanism is a part of the "epigenetic hypothesis for schizophrenia pathophysiology" formulated by a group of scientists in 2008 (D. Grayson; A. Guidotti; E. Costa).[13][129] A postmortem study comparing a DNA methyltransferase (DNMT1) and Reelin mRNA expression in cortical layers I and V of schizophrenic patients and normal controls demonstrated that in the layer V both DNMT1 and Reelin levels were normal, while in the layer I DNMT1 was threefold higher, probably leading to the twofold decrease in the Reelin expression.[130] There is evidence that the change is selective, and DNMT1 is overexpressed in reelin-secreting GABAergic neurons but not in their glutamatergic neighbours.[131][132] Methylation inhibitors and histone deacetylase inhibitors, such as valproic acid, increase reelin mRNA levels,[133][134][135] while L-methionine treatment downregulates the phenotypic expression of reelin.[136]
One study indicated the upregulation of histone deacetylase HDAC1 in the hippocampi of patients.[137] Histone deacetylases suppress gene promoters; hyperacetylation of histones was shown in murine models to demethylate the promoters of both reelin and GAD67.[138] DNMT1 inhibitors in animals have been shown to increase the expression of both reelin and GAD67,[139] and both DNMT inhibitors and HDAC inhibitors shown in one study[140] to activate both genes with comparable dose- and time-dependence. As one study shows, S-adenosyl methionine (SAM) concentration in patients' prefrontal cortex is twice as high as in the cortices of non-affected people.[141] SAM, being a methyl group donor necessary for DNMT activity, could further shift epigenetic control of gene expression.[citation needed]
Chromosome region 7q22 that harbours the RELN gene is associated with schizophrenia,[142] and the gene itself was associated with the disease in a large study that found the polymorphism rs7341475 to increase the risk of the disease in women, but not in men. The women that have the single-nucleotide polymorphism (SNP) are about 1.4 times more likely to get ill, according to the study.[143] Allelic variations of RELN have also been correlated with working memory, memory and executive functioning in nuclear families where one of the members suffers from schizophrenia.[142] The association with working memory was later replicated.[144] In one small study, nonsynonymous polymorphism Val997Leu of the gene was associated with left and right ventricular enlargement in patients.[145]
One study showed that patients have decreased levels of one of reelin receptors, VLDLR, in the peripheral lymphocytes.[146] After six months of antipsychotic therapy the expression went up; according to authors, peripheral VLRLR levels may serve as a reliable peripheral biomarker of schizophrenia.[146]
Considering the role of reelin in promoting dendritogenesis,[9][90] suggestions were made that the localized dendritic spine deficit observed in schizophrenia[147][148] could be in part connected with the downregulation of reelin.[149][150]
Reelin pathway could also be linked to schizophrenia and other psychotic disorders through its interaction with risk genes. One example is the neuronal transcription factor NPAS3, disruption of which is linked to schizophrenia[151] and learning disability. Knockout mice lacking NPAS3 or the similar protein NPAS1 have significantly lower levels of reelin;[152] the precise mechanism behind this is unknown. Another example is the schizophrenia-linked gene MTHFR, with murine knockouts showing decreased levels of reelin in the cerebellum.[153] Along the same line, it is worth noting that the gene coding for the subunit NR2B that is presumably affected by reelin in the process of NR2B->NR2A developmental change of NMDA receptor composition,[65] stands as one of the strongest risk gene candidates.[154] Another shared aspect between NR2B and RELN is that they both can be regulated by the TBR1 transcription factor.[155]
The heterozygous reeler mouse, which is haploinsufficient for the RELN gene, shares several neurochemical and behavioral abnormalities with schizophrenia and bipolar disorder,[156] but the exact relevance of these murine behavioral changes to the pathophysiology of schizophrenia remains debatable.[157]
As previously described, reelin plays a crucial role in modulating early neuroblast migration during brain development. Evidences of altered neural cell positioning in post-mortem schizophrenia patient brains[158][159] and changes to gene regulatory networks that control cell migration[160][161] suggests a potential link between altered reelin expression in patient brain tissue to disrupted cell migration during brain development. To model the role of reelin in the context of schizophrenia at a cellular level, olfactory neurosphere-derived cells were generated from the nasal biopsies of schizophrenia patients, and compared to cells from healthy controls.[160] Schizophrenia patient-derived cells have reduced levels of reelin mRNA[160] and protein[162] when compared to healthy control cells, but expresses the key reelin receptors and DAB1 accessory protein.[162] When grown in vitro, schizophrenia patient-derived cells were unable to respond to reelin coated onto tissue culture surfaces; In contrast, cells derived from healthy controls were able to alter their cell migration when exposed to reelin.[162] This work went on to show that the lack of cell migration response in patient-derived cells were caused by the cell's inability to produce enough focal adhesions of the appropriate size when in contact with extracellular reelin.[162] More research into schizophrenia cell-based models are needed to look at the function of reelin, or lack of, in the pathophysiology of schizophrenia.
Bipolar disorder
[edit]Decrease in RELN expression with concurrent upregulation of DNMT1 is typical of bipolar disorder with psychosis, but is not characteristic of patients with major depression without psychosis, which could speak of specific association of the change with psychoses.[116] One study suggests that unlike in schizophrenia, such changes are found only in the cortex and do not affect the deeper structures in psychotic bipolar patients, as their basal ganglia were found to have the normal levels of DNMT1 and subsequently both the reelin and GAD67 levels were within the normal range.[118]
In a genetic study conducted in 2009, preliminary evidence requiring further DNA replication suggested that variation of the RELN gene (SNP rs362719) may be associated with susceptibility to bipolar disorder in women.[163]
Autism
[edit]Autism is a neurodevelopmental disorder that is generally believed to be caused by mutations in several locations, likely triggered by environmental factors. The role of reelin in autism is not decided yet.[164]
Reelin was originally in 2001 implicated in a study finding associations between autism and a polymorphic GGC/CGG repeat preceding the 5' ATG initiator codon of the RELN gene in an Italian population. Longer triplet repeats in the 5' region were associated with an increase in autism susceptibility.[165] However, another study of 125 multiple-incidence families and 68 single-incidence families from the subsequent year found no significant difference between the length of the polymorphic repeats in affected and controls. Although, using a family based association test larger reelin alleles were found to be transmitted more frequently than expected to affected children.[166] An additional study examining 158 subjects with German lineage likewise found no evidence of triplet repeat polymorphisms associated with autism.[167] And a larger study from 2004 consisting of 395 families found no association between autistic subjects and the CGG triplet repeat as well as the allele size when compared to age of first word.[168]In 2010 a large study using data from 4 European cohorts would find some evidence for an association between autism and the rs362780 RELN polymorphism.[169]
Studies of transgenic mice have been suggestive of an association, but not definitive.[170]
Temporal lobe epilepsy: granule cell dispersion
[edit]Decreased reelin expression in the hippocampal tissue samples from patients with temporal lobe epilepsy was found to be directly correlated with the extent of granule cell dispersion (GCD), a major feature of the disease that is noted in 45%–73% of patients.[171][172] The dispersion, according to a small study, is associated with the RELN promoter hypermethylation.[173] According to one study, prolonged seizures in a rat model of mesial temporal lobe epilepsy have led to the loss of reelin-expressing interneurons and subsequent ectopic chain migration and aberrant integration of newborn dentate granule cells. Without reelin, the chain-migrating neuroblasts failed to detach properly.[174] Moreover, in a kainate-induced mouse epilepsy model, exogenous reelin had prevented GCD, according to one study.[175]
Alzheimer's disease
[edit]The Reelin receptors ApoER2 and VLDLR belong to the LDL receptor gene family.[176] All members of this family are receptors for Apolipoprotein E (ApoE). Therefore, they are often synonymously referred to as 'ApoE receptors'. ApoE occurs in 3 common isoforms (E2, E3, E4) in the human population. ApoE4 is the primary genetic risk factor for late-onset Alzheimer's disease. This strong genetic association has led to the proposal that ApoE receptors play a central role in the pathogenesis of Alzheimer's disease.[176][177] According to one study, reelin expression and glycosylation patterns are altered in Alzheimer's disease. In the cortex of the patients, reelin levels were 40% higher compared with controls, but the cerebellar levels of the protein remain normal in the same patients.[178] This finding is in agreement with an earlier study showing the presence of Reelin associated with amyloid plaques in a transgenic AD mouse model.[179] A large genetic study of 2008 showed that RELN gene variation is associated with an increased risk of Alzheimer's disease in women.[180] The number of reelin-producing Cajal-Retzius cells is significantly decreased in the first cortical layer of patients.[181][182] Reelin has been shown to interact with amyloid precursor protein,[183] and, according to one in-vitro study, is able to counteract the Aβ-induced dampening of NMDA-receptor activity.[184] This is modulated by ApoE isoforms, which selectively alter the recycling of ApoER2 as well as AMPA and NMDA receptors.[185]
Cancer
[edit]DNA methylation patterns are often changed in tumours, and the RELN gene could be affected: according to one study, in the pancreatic cancer the expression is suppressed, along with other reelin pathway components[186] In the same study, cutting the reelin pathway in cancer cells that still expressed reelin resulted in increased motility and invasiveness. On the contrary, in prostate cancer the RELN expression is excessive and correlates with Gleason score.[187] Retinoblastoma presents another example of RELN overexpression.[188] This gene has also been seen recurrently mutated in cases of acute lymphoblastic leukaemia.[189]
Other conditions
[edit]Одно полногеномное ассоциативное исследование указывает на возможную роль вариации гена RELN в отосклерозе , аномальном росте кости среднего уха . [190] In a statistical search for the genes that are differentially expressed in the brains of cerebral malaria-resistant versus cerebral malaria-susceptible mice, Delahaye et al. detected a significant upregulation of both RELN and DAB1 and speculated on possible protective effects of such over-expression.[191] В 2020 году в исследовании сообщалось о новом варианте гена RELN (S2486G), который был связан с болезнью Бехтерева в большой семье. Это предполагает потенциальное понимание патофизиологического участия рилина в путях воспаления и остеогенеза при анкилозирующем спондилите и может расширить горизонты поиска новых терапевтических стратегий. [192] Исследование, проведенное в 2020 году Юго-западным медицинским центром UT, предполагает, что уровни циркулирующего рилина могут коррелировать с тяжестью и стадиями рассеянного склероза, и что снижение уровня рилина может быть новым способом лечения рассеянного склероза. [193]
Факторы, влияющие на экспрессию рилина
[ редактировать ]
Экспрессия рилина контролируется рядом факторов, помимо огромного количества клеток Кахаля-Ретциуса. Например, транскрипционный фактор TBR1 регулирует RELN наряду с другими генами, содержащими Т-элемент . [155] На более высоком уровне было обнаружено, что усиление материнской заботы коррелирует с экспрессией рилина у крысят; такая корреляция была зарегистрирована в гиппокампе [195] и в коре. [194] Согласно одному сообщению, длительное воздействие кортикостерона значительно снижает экспрессию рилина в гиппокампе мышей, что, возможно, имеет отношение к гипотетической роли кортикостероидов при депрессии . [196] Одно небольшое посмертное исследование выявило повышенное метилирование гена RELN в неокортексе людей, прошедших половое созревание, по сравнению с теми, кто еще не вступил в период взросления. [197]
Психотропные препараты
[ редактировать ]Поскольку рилин участвует в ряде заболеваний головного мозга, а его экспрессию обычно измеряют посмертно, важно оценить возможные эффекты лечения. [198]
Согласно эпигенетической гипотезе, препараты, которые смещают баланс в пользу деметилирования, потенциально могут облегчить предполагаемое вызванное метилированием подавление RELN и GAD67. В одном исследовании было показано, что клозапин и сульпирид, но не галоперидол и оланзапин, усиливают деметилирование обоих генов у мышей, предварительно обработанных L-метионином. [199] Предполагается, что вальпроевая кислота , ингибитор гистондеацетилазы , при приеме в сочетании с нейролептиками имеет некоторые преимущества. Но есть исследования, противоречащие основной предпосылке эпигенетической гипотезы, а также исследование Фатеми и соавт. не показано увеличение экспрессии RELN под действием вальпроевой кислоты; это указывает на необходимость дальнейшего расследования. [ нужна ссылка ]
Фатеми и др. провели исследование, в котором измеряли уровни мРНК RELN и белка рилина в префронтальной коре крыс после 21-дневного внутрибрюшинного введения следующих препаратов: [28]
| Выражение Рилина | Клозапин | Флуоксетин | Галоперидол | Литий | Оланзапин | Вальпроевая кислота |
|---|---|---|---|---|---|---|
| белок | ↓ | ↔ | ↓ | ↓ | ↑ | ↔ |
| мРНК | ↑ | ↑ | ↓ | ↑ | ↑ | ↓ |
В 2009 году Фатеми и др. опубликовали более подробную работу на крысах, принимавших то же лекарство. Здесь, помимо самого рилина, измерялась корковая экспрессия нескольких участников ( VLDLR , DAB1 , GSK3B ) сигнальной цепи, а также экспрессия GAD65 и GAD67 . [200]
Ссылки
[ редактировать ]- ^ Jump up to: а б с GRCh38: Версия Ensembl 89: ENSG00000189056 – Ensembl , май 2017 г.
- ^ Jump up to: а б с GRCm38: выпуск Ensembl 89: ENSMUSG00000042453 – Ensembl , май 2017 г.
- ^ «Ссылка на Human PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Ссылка на Mouse PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Ген RELN» . Домашний справочник по генетике . 1 августа 2013 года . Проверено 11 сентября 2022 г.
- ^ Бош С., Мухайсен А., Пухадас Л., Сориано Э., Мартинес А. (2016). «Рилин осуществляет структурную, биохимическую и транскрипционную регуляцию пресинаптических и постсинаптических элементов в гиппокампе взрослого человека» . Границы клеточной нейронауки . 10 : 138. дои : 10.3389/fncel.2016.00138 . ПМЦ 4884741 . ПМИД 27303269 .
- ^ Уибер Э.Дж., Бефферт Ю., Джонс С., Кристиан Дж.М., Форстер Э., Суэтт Дж.Д. и др. (октябрь 2002 г.). «Рилин и рецепторы ApoE взаимодействуют, улучшая синаптическую пластичность и обучение гиппокампа» . Журнал биологической химии . 277 (42): 39944–52. дои : 10.1074/jbc.M205147200 . ПМИД 12167620 .
- ^ Jump up to: а б Д'Арканджело Дж. (август 2005 г.). «Apoer2: рецептор рилина, который стоит запомнить» . Нейрон . 47 (4): 471–3. дои : 10.1016/j.neuron.2005.08.001 . ПМИД 16102527 . S2CID 15091293 .
- ^ Jump up to: а б Ниу С., Ренфро А., Кватрокки CC, Шелдон М., Д'Арканджело Дж. (январь 2004 г.). «Рилин способствует развитию дендритов гиппокампа посредством пути VLDLR/ApoER2-Dab1» . Нейрон . 41 (1): 71–84. дои : 10.1016/S0896-6273(03)00819-5 . ПМИД 14715136 . S2CID 10716252 .
- ^ Ниу С., Ябут О., Д'Арканджело Дж. (октябрь 2008 г.). «Сигнальный путь Рилина способствует развитию дендритных отростков в нейронах гиппокампа» . Журнал неврологии . 28 (41): 10339–48. doi : 10.1523/JNEUROSCI.1917-08.2008 . ПМЦ 2572775 . ПМИД 18842893 .
- ^ Jump up to: а б «Тканевая экспрессия RELN - Резюме - Атлас белков человека» . www.proteinatlas.org . Проверено 28 мая 2018 г.
- ^ Jump up to: а б Фатеми С.Х., Эрл Дж.А., МакМеноми Т. (ноябрь 2000 г.). «Снижение иммунореактивности рилина в гиппокампе у больных шизофренией, биполярным расстройством и большой депрессией» . Молекулярная психиатрия . 5 (6): 654–63, 571. doi : 10.1038/sj.mp.4000783 . ПМИД 11126396 .
- ^ Jump up to: а б Грейсон Д.Р., Гуидотти А., Коста Э. (17 января 2008 г.). «Современные гипотезы» . Форум по исследованию шизофрении . шизофренияфорум.орг. Архивировано из оригинала 17 сентября 2008 года . Проверено 23 августа 2008 г.
- ^ Тотиги М., Ивамото К., Бундо М., Комори А., Сасаки Т., Като Н. и др. (март 2008 г.). «Статус метилирования области промотора рилина в мозге больных шизофренией». Биологическая психиатрия . 63 (5): 530–3. doi : 10.1016/j.biopsych.2007.07.003 . ПМИД 17870056 . S2CID 11816759 .
- ^ Милль Дж., Тан Т., Каминский З., Харе Т., Язданпана С., Бушар Л. и др. (март 2008 г.). «Эпигеномное профилирование выявляет изменения метилирования ДНК, связанные с тяжелым психозом» . Американский журнал генетики человека . 82 (3): 696–711. дои : 10.1016/j.ajhg.2008.01.008 . ПМК 2427301 . ПМИД 18319075 .
- ^ Ковач К.А. (декабрь 2021 г.). «Значение новой модели эпизодических воспоминаний на уровне цепей для болезни Альцгеймера» . Международный журнал молекулярных наук . 23 (1): 462. doi : 10.3390/ijms23010462 . ПМЦ 8745479 . PMID 35008886 .
- ^ Jump up to: а б Фальконер Д.С. (январь 1951 г.). «Два новых мутанта, «тремблер» и «рилер», обладающие неврологическими действиями у домовой мыши (Mus musculus L.)» (PDF) . Журнал генетики . 50 (2): 192–201. дои : 10.1007/BF02996215 . ПМИД 24539699 . S2CID 37918631 .
- ^ Туетинг П., Дуэйри М.С., Гуидотти А., Дэвис Дж.М., Коста Э. (2006). «Снижение регуляции рилина у мышей и эндофенотипы психоза». Неврологические и биоповеденческие обзоры . 30 (8): 1065–77. doi : 10.1016/j.neubiorev.2006.04.001 . ПМИД 16769115 . S2CID 21156214 .
- ^ Гамбург М (октябрь 1963 г.). «Анализ последствий постнатального развития «рилера», неврологической мутации у мышей. Исследование генетики развития». Биология развития . 8 (2): 165–85. дои : 10.1016/0012-1606(63)90040-X . ПМИД 14069672 .
- ^ Кавинесс В.С. (декабрь 1976 г.). «Закономерности распределения клеток и волокон в неокортексе мыши-мутанта Рилера». Журнал сравнительной неврологии . 170 (4): 435–47. дои : 10.1002/cne.901700404 . ПМИД 1002868 . S2CID 34383977 .
- ^ Мяо Г.Г., Смейн Р.Дж., Д'Арканджело Дж., Коупленд Н.Г., Дженкинс Н.А., Морган Дж.И. и др. (ноябрь 1994 г.). «Выделение аллели Рилера методом инсерционного мутагенеза» . Труды Национальной академии наук Соединенных Штатов Америки . 91 (23): 11050–4. Бибкод : 1994PNAS...9111050M . дои : 10.1073/pnas.91.23.11050 . ПМК 45164 . ПМИД 7972007 .
- ^ Д'Арканджело Дж., Мяо Г.Г., Чен С.К., Соарес Х.Д., Морган Дж.И., Карран Т. (апрель 1995 г.). «Белок, родственный белкам внеклеточного матрикса, удаленным у мутантного рилера мыши». Природа . 374 (6524): 719–23. Бибкод : 1995Natur.374..719D . дои : 10.1038/374719a0 . ПМИД 7715726 . S2CID 4266946 .
- ^ Огава М., Мията Т., Накадзима К., Ягю К., Сейке М., Икенака К. и др. (май 1995 г.). «Антиген, ассоциированный с геном рилера, на нейронах Кахаля-Ретциуса является важной молекулой для ламинарной организации корковых нейронов» . Нейрон . 14 (5): 899–912. дои : 10.1016/0896-6273(95)90329-1 . ПМИД 7748558 . S2CID 17993812 .
- ^ Троммсдорф М., Борг Дж.П., Марголис Б., Герц Дж. (декабрь 1998 г.). «Взаимодействие цитозольных адаптерных белков с нейрональными рецепторами аполипопротеина Е и белком-предшественником амилоида» . Журнал биологической химии . 273 (50): 33556–60. дои : 10.1074/jbc.273.50.33556 . ПМИД 9837937 .
- ^ Троммсдорф М., Готхардт М., Хисбергер Т., Шелтон Дж., Стокингер В., Нимпф Дж. и др. (июнь 1999 г.). «Рилер/инвалид-подобное нарушение миграции нейронов у нокаутных мышей, у которых отсутствует рецептор VLDL и рецептор ApoE 2» . Клетка . 97 (6): 689–701. дои : 10.1016/S0092-8674(00)80782-5 . ПМИД 10380922 . S2CID 13492626 .
- ^ Шелдон М., Райс Д.С., Д'Арканджело Г., Ёнесима Х., Накадзима К., Микошиба К. и др. (октябрь 1997 г.). «Скремблер и йотари разрушают отключенный ген и вызывают у мышей фенотип, подобный рилеру». Природа . 389 (6652): 730–3. Бибкод : 1997Natur.389..730S . дои : 10.1038/39601 . ПМИД 9338784 . S2CID 4414738 .
- ↑ «Рилин» упоминается в названиях научной литературы – поиск в Google Scholar.
- ^ Jump up to: а б с д и Хосейн С. Фатеми, изд. (2008). Гликопротеин рилин: структура, биология и роль в здоровье и заболеваниях . Спрингер. п. 444. ИСБН 978-0-387-76760-4 .
- ^ Лакор П.Н., Грейсон Д.Р., Аута Дж., Сугая И., Коста Э., Гуидотти А. (март 2000 г.). «Секреция рилина глутаматергическими нейронами в культуре не зависит от регуляции нейротрансмиттеров» . Труды Национальной академии наук Соединенных Штатов Америки . 97 (7): 3556–61. Бибкод : 2000PNAS...97.3556L . дои : 10.1073/pnas.050589597 . ПМК 16278 . ПМИД 10725375 .
- ^ Мейер Г., Гоффине А.М., Файрен А. (декабрь 1999 г.). «Что такое клетка Кахаля-Ретциуса? Переоценка классического типа клеток, основанная на недавних наблюдениях за развивающимся неокортексом». Кора головного мозга . 9 (8): 765–75. дои : 10.1093/cercor/9.8.765 . ПМИД 10600995 .
- ^ Jump up to: а б Мейер Дж., Гоффине AM (июль 1998 г.). «Пренатальное развитие рилин-иммунореактивных нейронов в неокортексе человека». Журнал сравнительной неврологии . 397 (1): 29–40. doi : 10.1002/(SICI)1096-9861(19980720)397:1<29::AID-CNE3>3.3.CO;2-7 . ПМИД 9671277 .
- ^ Шиффманн С.Н., Бернье Б., Гоффине А.М. (май 1997 г.). «Экспрессия мРНК рилина во время развития мозга мышей». Европейский журнал неврологии . 9 (5): 1055–71. дои : 10.1111/j.1460-9568.1997.tb01456.x . ПМИД 9182958 . S2CID 22576790 .
- ^ Песольд С., Импаньятьелло Ф., Пису М.Г., Узунов Д.П., Коста Е., Гуидотти А. и др. (март 1998 г.). «Рилин преимущественно экспрессируется в нейронах, синтезирующих гамма-аминомасляную кислоту, в коре головного мозга и гиппокампе взрослых крыс» . Труды Национальной академии наук Соединенных Штатов Америки . 95 (6): 3221–6. Бибкод : 1998PNAS...95.3221P . дои : 10.1073/pnas.95.6.3221 . ЧВК 19723 . ПМИД 9501244 .
- ^ Ковач К.А. (сентябрь 2020 г.). «Эпизодические воспоминания: как гиппокамп и энторинальные кольцевые аттракторы взаимодействуют, создавая их?» . Границы системной нейронауки . 14:68 . дои : 10.3389/fnsys.2020.559186 . ПМЦ 7511719 . ПМИД 33013334 .
- ^ Алькантара С., Руис М., Д'Арканджело Г., Эзан Ф., де Лесеа Л., Карран Т. и др. (октябрь 1998 г.). «Региональные и клеточные закономерности экспрессии мРНК рилина в переднем мозге развивающихся и взрослых мышей» . Журнал неврологии . 18 (19): 7779–99. doi : 10.1523/JNEUROSCI.18-19-07779.1998 . ПМК 6792998 . ПМИД 9742148 .
- ^ Песольд С., Лю В.С., Гуидотти А., Коста Э., Карунчо Х.Дж. (март 1999 г.). «Кортикальные битуфтированные, горизонтальные клетки и клетки Мартинотти преимущественно экспрессируют и секретируют рилин в перинейрональные сети, несинаптически модулируя экспрессию генов» . Труды Национальной академии наук Соединенных Штатов Америки . 96 (6): 3217–22. Бибкод : 1999PNAS...96.3217P . дои : 10.1073/pnas.96.6.3217 . ПМК 15922 . ПМИД 10077664 .
- ^ Суарес-Сола М.Л., Гонсалес-Дельгадо Ф.Дж., Пуэйо-Морланс М., Медина-Боливар О.К., Эрнандес-Акоста Н.К., Гонсалес-Гомес М. и др. (2009). «Нейроны белого вещества неокортекса взрослого человека » Границы нейроанатомии . 3 :7.doi : 10.3389 /neuro.05.007.2009 . ПМК 2697018 . ПМИД 19543540 .
- ^ Смальхейзер Н.Р., Коста Э., Гуидотти А., Импаньятьелло Ф., Аута Дж., Лакор П. и др. (февраль 2000 г.). «Экспрессия рилина в крови взрослых млекопитающих, печени, промежуточной части гипофиза и хромаффинных клетках надпочечников» . Труды Национальной академии наук Соединенных Штатов Америки . 97 (3): 1281–6. Бибкод : 2000PNAS...97.1281S . дои : 10.1073/pnas.97.3.1281 . ПМК 15597 . ПМИД 10655522 .
- ^ Самама Б., Бём Н. (июль 2005 г.). «Иммунореактивность рилина в лимфатических сосудах и печени в период развития и взрослой жизни» . Анатомические записи, часть A: открытия в молекулярной, клеточной и эволюционной биологии . 285 (1): 595–9. дои : 10.1002/ar.a.20202 . ПМИД 15912522 .
- ^ Jump up to: а б Кобольд Д., Грундманн А., Пискалья Ф., Айзенбах С., Нойбауэр К., Стеффген Дж. и др. (май 2002 г.). «Экспрессия рилина в звездчатых клетках печени и во время восстановления печеночной ткани: новый маркер дифференциации HSC от других миофибробластов печени». Журнал гепатологии . 36 (5): 607–13. дои : 10.1016/S0168-8278(02)00050-8 . ПМИД 11983443 .
- ^ Jump up to: а б Пулидо Дж. С., Сугая И., Комсток Дж., Сугая К. (июнь 2007 г.). «Экспрессия рилина повышается после повреждения ткани глаза». Архив клинической и экспериментальной офтальмологии Грефе . 245 (6): 889–93. дои : 10.1007/s00417-006-0458-4 . ПМИД 17120005 . S2CID 12397364 .
- ^ Бюшай Р., Кубл М.Л., Маглуар Х., Блейхер Ф. (сентябрь 2000 г.). «Библиотека кДНК на основе субстрактивной ПЦР из клеток одонтобластов человека: идентификация новых генов, экспрессируемых в клетках, формирующих зубы». Матричная биология . 19 (5): 421–30. дои : 10.1016/S0945-053X(00)00091-3 . ПМИД 10980418 .
- ^ Аллард Б., Маглуар Х., Кубл М.Л., Морен Дж.К., Блейхер Ф. (сентябрь 2006 г.). «Потенциал-управляемые натриевые каналы придают возбудимость одонтобластам человека: возможная роль в передаче зубной боли» . Журнал биологической химии . 281 (39): 29002–10. дои : 10.1074/jbc.M601020200 . ПМИД 16831873 .
- ^ Морен Ж.К., Коубль М.Л., Дидье-Баз М., Бриссон С., Маглуар Х., Блейхер Ф. (август 2004 г.). «Экспрессия и локализация рилина в одонтобластах человека». Матричная биология . 23 (5): 277–85. дои : 10.1016/j.matbio.2004.06.005 . PMID 15464360 .
- ^ ВВП : 2E26 ; Ясуи Н., Ноги Т., Китао Т., Накано Ю., Хаттори М., Такаги Дж. (июнь 2007 г.). «Структура рецептор-связывающего фрагмента рилина и мутационный анализ выявили механизм распознавания, аналогичный эндоцитарным рецепторам» . Труды Национальной академии наук Соединенных Штатов Америки . 104 (24): 9988–93. Бибкод : 2007PNAS..104.9988Y . дои : 10.1073/pnas.0700438104 . ЧВК 1891246 . ПМИД 17548821 .
- ^ Jump up to: а б Quattrocchi CC, Wannenes F, Persico AM, Ciafré SA, D'Arcangelo G, Farace MG и др. (январь 2002 г.). «Рилин — сериновая протеаза внеклеточного матрикса» . Журнал биологической химии . 277 (1): 303–9. дои : 10.1074/jbc.M106996200 . hdl : 11380/1250927 . ПМИД 11689558 .
- ^ Jump up to: а б Руайо I, Ламбер де Рувруа С, Д'Арканджело Г, Демиров Д, Гоффине А.М. (декабрь 1997 г.). «Геномная организация гена рилина мыши». Геномика . 46 (2): 240–50. дои : 10.1006/geno.1997.4983 . ПМИД 9417911 .
- ^ ВВП : 2дду ; Ноги Т., Ясуи Н., Хаттори М., Ивасаки К., Такаги Дж. (август 2006 г.). «Структура сигнально-компетентного фрагмента рилина, выявленная с помощью рентгеновской кристаллографии и электронной томографии» . Журнал ЭМБО . 25 (15): 3675–83. дои : 10.1038/sj.emboj.7601240 . ПМЦ 1538547 . ПМИД 16858396 .
- ^ Накано Ю., Коно Т., Хиби Т., Коно С., Баба А., Микошиба К. и др. (июль 2007 г.). «Чрезвычайно консервативная С-концевая область рилина не необходима для секреции, но необходима для эффективной активации последующей передачи сигналов» . Журнал биологической химии . 282 (28): 20544–52. дои : 10.1074/jbc.M702300200 . ПМИД 17504759 .
- ^ Ламбер де Рувруа С, де Бергейк В, Кортвриндт С, Бар И, Экхаут Ю, Гоффине А.М. (март 1999 г.). «Рилин, белок внеклеточного матрикса, дефицитный у мышей-мутантов Рилера, процессируется металлопротеиназой». Экспериментальная неврология . 156 (1): 214–7. doi : 10.1006/exnr.1998.7007 . ПМИД 10192793 . S2CID 35222830 .
- ^ Jump up to: а б с Жоссен Ю., Игнатова Н., Хисбергер Т., Герц Дж., Ламбер де Рувруа С., Гоффине А.М. (январь 2004 г.). «Центральный фрагмент рилина, образующийся в результате протеолитического процессинга in vivo, имеет решающее значение для его функции во время развития кортикальной пластинки» . Журнал неврологии . 24 (2): 514–21. doi : 10.1523/JNEUROSCI.3408-03.2004 . ПМК 6730001 . ПМИД 14724251 .
- ^ Jump up to: а б с Жоссен Ю., Ги Л., Гоффине А.М. (апрель 2007 г.). «Обработка рилина эмбриональными нейронами важна для функционирования тканей, но не диссоциированных культивируемых нейронов» . Журнал неврологии . 27 (16): 4243–52. doi : 10.1523/JNEUROSCI.0023-07.2007 . ПМК 6672330 . ПМИД 17442808 .
- ^ Jump up to: а б Блейк С.М., Штрассер В., Андраде Н., Дуит С., Хофбауэр Р., Шнайдер В.Дж. и др. (ноябрь 2008 г.). «Тромбоспондин-1 связывается с рецептором ApoER2 и VLDL и участвует в постнатальной миграции нейронов» . Журнал ЭМБО . 27 (22): 3069–80. дои : 10.1038/emboj.2008.223 . ПМК 2585172 . ПМИД 18946489 .
- ^ Леннингтон Дж. Б., Ян З., Коновер Дж. К. (ноябрь 2003 г.). «Нейральные стволовые клетки и регуляция взрослого нейрогенеза» . Репродуктивная биология и эндокринология . 1:99 . дои : 10.1186/1477-7827-1-99 . ПМЦ 293430 . ПМИД 14614786 .
- ^ Jump up to: а б Хартфусс Э., Фёрстер Э., Бок Х.Х., Хак М.А., Лепринс П., Люке Дж.М. и др. (октябрь 2003 г.). «Передача сигналов рилина напрямую влияет на морфологию радиальной глии и биохимическое созревание» . Разработка . 130 (19): 4597–609. дои : 10.1242/dev.00654 . HDL : 10261/333510 . ПМИД 12925587 .
- ^ Jump up to: а б с д и Номура Т., Такахаши М., Хара Ю., Осуми Н. (январь 2008 г.). Рех Т. (ред.). «Паттерны нейрогенеза и амплитуда экспрессии рилина необходимы для создания коры головного мозга млекопитающих» . ПЛОС ОДИН . 3 (1): e1454. Бибкод : 2008PLoSO...3.1454N . дои : 10.1371/journal.pone.0001454 . ПМК 2175532 . ПМИД 18197264 .
- ^ Дель Рио Х.А., Хаймрих Б., Боррелл В., Форстер Э., Дрейкью А., Алькантара С. и др. (январь 1997 г.). «Роль клеток Кахаля-Ретциуса и рилина в развитии связей гиппокампа». Природа . 385 (6611): 70–4. Бибкод : 1997Natur.385...70D . дои : 10.1038/385070a0 . ПМИД 8985248 . S2CID 4352996 .
- ^ Боррелл В., Дель Рио Х.А., Алькантара С., Дерер М., Мартинес А., Д'Арканджело Г. и др. (февраль 1999 г.). «Рилин регулирует развитие и синаптогенез специфических слоев энторино-гиппокампальных связей» . Журнал неврологии . 19 (4): 1345–58. doi : 10.1523/JNEUROSCI.19-04-01345.1999 . ПМК 6786030 . ПМИД 9952412 .
- ^ Jump up to: а б Хак I, Банкила М., Лулье К., Кэрролл П., Кремер Х. (октябрь 2002 г.). «Рилин представляет собой сигнал отсоединения при тангенциальной цепной миграции во время постнатального нейрогенеза». Природная неврология . 5 (10): 939–45. дои : 10.1038/nn923 . ПМИД 12244323 . S2CID 7096018 .
- ^ Jump up to: а б с Йошида М., Ассимакопулос С., Джонс К.Р., Гроув Е.А. (февраль 2006 г.). «Массивная потеря клеток Кахаля-Ретциуса не нарушает порядок неокортикальных слоев». Разработка . 133 (3): 537–45. дои : 10.1242/dev.02209 . ПМИД 16410414 . S2CID 1702450 .
- ^ Йип Ю.П., Мехта Н., Магдалено С., Карран Т., Йип Дж.В. (июль 2009 г.). «Эктопическая экспрессия рилина изменяет миграцию симпатических преганглионарных нейронов спинного мозга». Журнал сравнительной неврологии . 515 (2): 260–8. дои : 10.1002/cne.22044 . ПМИД 19412957 . S2CID 21832778 .
- ^ Jump up to: а б Кампо К.Г., Синагра М., Верье Д., Манцони О.Дж., Чавис П. (2009). Окадзава Х (ред.). «Рилин, секретируемый ГАМКергическими нейронами, регулирует гомеостаз глутаматных рецепторов» . ПЛОС ОДИН . 4 (5): е5505. Бибкод : 2009PLoSO...4.5505C . дои : 10.1371/journal.pone.0005505 . ПМК 2675077 . ПМИД 19430527 .
- ^ INSERM - Оливье Манцони - Физиопатология синаптической передачи и пластичности. Архивировано 25 ноября 2006 г. в Wayback Machine - Институт нейробиологии Бордо.
- ^ Синагра М., Верье Д., Франкова Д., Корвек К.М., Блахос Дж., Уибер Э.Дж. и др. (июнь 2005 г.). «Рилин, рецептор липопротеина очень низкой плотности и рецептор аполипопротеина E 2 контролируют состав соматических рецепторов NMDA во время созревания гиппокампа in vitro» . Журнал неврологии . 25 (26): 6127–36. doi : 10.1523/JNEUROSCI.1757-05.2005 . ПМК 6725049 . ПМИД 15987942 .
- ^ Jump up to: а б Грок Л., Шоке Д., Стивенсон Ф.А., Веррье Д., Манцони О.Дж., Чавис П. (сентябрь 2007 г.). «Поверхностный транспорт рецептора NMDA и состав синаптических субъединиц регулируются белком внеклеточного матрикса Рилин» . Журнал неврологии . 27 (38): 10165–75. doi : 10.1523/JNEUROSCI.1772-07.2007 . ПМК 6672660 . ПМИД 17881522 .
- ^ Лю XB, Мюррей К.Д., Джонс Э.Г. (октябрь 2004 г.). «Переключение субъединиц рецептора NMDA 2A и 2B в таламических и корковых синапсах во время раннего постнатального развития» . Журнал неврологии . 24 (40): 8885–95. doi : 10.1523/JNEUROSCI.2476-04.2004 . ПМК 6729956 . ПМИД 15470155 .
- ^ Андраде Н., Комненович В., Блейк С.М., Жоссен Ю., Хауэлл Б., Гоффине А. и др. (май 2007 г.). «Рецептор ApoER2/VLDL и Dab1 в ростральном миграционном потоке функционируют в постнатальной миграции нейронов независимо от Рилина» . Труды Национальной академии наук Соединенных Штатов Америки . 104 (20): 8508–13. Бибкод : 2007PNAS..104.8508A . дои : 10.1073/pnas.0611391104 . ПМК 1895980 . ПМИД 17494763 .
- ^ Фротчер М., Хаас К.А., Фёрстер Э. (июнь 2003 г.). «Рилин контролирует миграцию гранулярных клеток в зубчатой извилине, воздействуя на радиальный глиальный каркас» . Кора головного мозга . 13 (6): 634–40. дои : 10.1093/cercor/13.6.634 . ПМИД 12764039 .
- ^ Бар I, Ламбер де Рувруа С, Гоффине AM (декабрь 2000 г.). «Эволюция развития коры. Гипотеза, основанная на роли сигнального пути Рилина». Тенденции в нейронауках . 23 (12): 633–8. дои : 10.1016/S0166-2236(00)01675-1 . ПМИД 11137154 . S2CID 13568642 .
- ^ Мольнар З., Метин С., Стойкова А., Тарабыкин В., Прайс DJ, Фрэнсис Ф. и др. (февраль 2006 г.). «Сравнительные аспекты развития коры головного мозга» . Европейский журнал неврологии . 23 (4): 921–34. дои : 10.1111/j.1460-9568.2006.04611.x . ЧВК 1931431 . ПМИД 16519657 .
- ^ Jump up to: а б Перес-Гарсия К.Г., Гонсалес-Дельгадо Ф.Дж., Суарес-Сола М.Л., Кастро-Фуэнтес Р., Мартин-Трухильо Х.М., Феррес-Торрес Р. и др. (январь 2001 г.). «Рилин-иммунореактивные нейроны мантии взрослых позвоночных». Журнал химической нейроанатомии . 21 (1): 41–5 дои : 10.1016/S0891-0618(00) 00104-6 ПМИД 11173219 . S2CID 23395046 .
- ^ Костальи А., Капсимали М., Уилсон С.В., Мионе М. (август 2002 г.). «Консервативные и расходящиеся паттерны экспрессии рилина в центральной нервной системе рыбок данио». Журнал сравнительной неврологии . 450 (1): 73–93. дои : 10.1002/cne.10292 . ПМИД 12124768 . S2CID 23110916 .
- ^ Гоффине А.М. (ноябрь 2006 г.). «Что делает нас людьми? Предвзятый взгляд с точки зрения сравнительной эмбриологии и генетики мышей» . Журнал биомедицинских открытий и сотрудничества . 1:16 . дои : 10.1186/1747-5333-1-16 . ПМЦ 1769396 . ПМИД 17132178 .
- ^ Поллард К.С., Салама С.Р., Ламберт Н., Ламбот М.А., Коппенс С., Педерсен Дж.С. и др. (сентябрь 2006 г.). «Ген РНК, экспрессируемый во время развития коры головного мозга, быстро эволюционировал у людей» (PDF) . Природа . 443 (7108): 167–72. Бибкод : 2006Natur.443..167P . дои : 10.1038/nature05113 . ПМИД 16915236 . S2CID 18107797 .
- ^ Уильямсон С.Х., Хубиш М.Дж., Кларк А.Г., Пайсёр Б.А., Бустаманте К.Д., Нильсен Р. (июнь 2007 г.). «Локализация недавней адаптивной эволюции в геноме человека» . ПЛОС Генетика . 3 (6): е90. дои : 10.1371/journal.pgen.0030090 . ПМЦ 1885279 . ПМИД 17542651 .
- ^ Уэйд Н. (26 июня 2007 г.). «Человек распространился по всему миру и эволюционировал локально» . Нью-Йорк Таймс . Проверено 23 августа 2008 г.
- ^ Jump up to: а б Чжан Г., Асади А.Х., МакНил Р.С., Бефферт У., Уиншоу-Борис А., Херц Дж. и др. (февраль 2007 г.). Мюллер Ю (ред.). «Комплекс Pafah1b взаимодействует с рецептором рилина VLDLR» . ПЛОС ОДИН . 2 (2): е252. Бибкод : 2007PLoSO...2..252Z . дои : 10.1371/journal.pone.0000252 . ПМЦ 1800349 . ПМИД 17330141 .
- ^ Д'Арканджело Дж., Хомаюни Р., Кешвара Л., Райс Д.С., Шелдон М., Карран Т. (октябрь 1999 г.). «Рилин является лигандом липопротеиновых рецепторов» . Нейрон . 24 (2): 471–9. дои : 10.1016/S0896-6273(00)80860-0 . ПМИД 10571240 . S2CID 14631418 .
- ^ Хисбергер Т., Троммсдорф М., Хауэлл Б.В., Гоффине А., Мамби М.С., Купер Дж.А. и др. (октябрь 1999 г.). «Прямое связывание рилина с рецептором ЛПОНП и рецептором АроЕ 2 индуцирует фосфорилирование тирозина инвалида-1 и модулирует фосфорилирование тау» . Нейрон . 24 (2): 481–9. дои : 10.1016/S0896-6273(00)80861-2 . ПМИД 10571241 . S2CID 243043 .
- ^ Андерсен О.М., Бенхайон Д., Карран Т., Уиллноу Т.Е. (август 2003 г.). «Дифференциальное связывание лигандов с рецептором аполипопротеина Е 2». Биохимия . 42 (31): 9355–64. дои : 10.1021/bi034475p . ПМИД 12899622 .
- ^ Бенхайон Д., Магдалено С., Карран Т. (апрель 2003 г.). «Связывание очищенного рилина с ApoER2 и VLDLR опосредует фосфорилирование тирозина Disabled-1». Исследования мозга. Молекулярные исследования мозга . 112 (1–2): 33–45. дои : 10.1016/S0169-328X(03)00032-9 . ПМИД 12670700 .
- ^ Хак И., Хеллвиг С., Юнгханс Д., Брунн Б., Бок Х.Х., Чжао С. и др. (ноябрь 2007 г.). «Различные роли ApoER2 и Vldlr в миграции корковых нейронов» . Разработка . 134 (21): 3883–91. дои : 10.1242/dev.005447 . ПМИД 17913789 .
- ^ Шмид Р.С., Джо Р., Шелтон С., Крейдберг Дж.А., Антон Э.С. (октябрь 2005 г.). «Взаимодействие рилина, интегрина и DAB1 во время эмбрионального развития коры головного мозга» . Кора головного мозга . 15 (10): 1632–6. дои : 10.1093/cercor/bhi041 . ПМИД 15703255 .
- ^ Сензаки К., Огава М., Яги Т. (декабрь 1999 г.). «Белки семейства CNR являются множественными рецепторами рилина» . Клетка . 99 (6): 635–47. дои : 10.1016/S0092-8674(00)81552-4 . ПМИД 10612399 . S2CID 14277878 .
- ^ Хиби Т., Хаттори М. (апрель 2009 г.). «N-концевой фрагмент рилина образуется после эндоцитоза и высвобождается по пути, регулируемому Rab11» . Письма ФЭБС . 583 (8): 1299–303. Бибкод : 2009FEBSL.583.1299H . дои : 10.1016/j.febslet.2009.03.024 . ПМИД 19303411 . S2CID 43542615 .
- ^ Шамо П., Инта Д., Виталис Т., Моньер Х., Вадман В.Дж., ван Хоофт Дж.А. (апрель 2009 г.). «N-концевая область рилина регулирует постнатальное дендритное созревание кортикальных пирамидных нейронов» . Труды Национальной академии наук Соединенных Штатов Америки . 106 (17): 7227–32. Бибкод : 2009PNAS..106.7227C . дои : 10.1073/pnas.0810764106 . ПМЦ 2678467 . ПМИД 19366679 .
- ^ Белвиндра Р., Граус-Порта Д., Геббельс С., Наве К.А., Мюллер У. (декабрь 2007 г.). «Интегрины бета1 в радиальной глии, но не в мигрирующих нейронах, необходимы для формирования клеточных слоев в коре головного мозга» . Журнал неврологии . 27 (50): 13854–65. doi : 10.1523/JNEUROSCI.4494-07.2007 . ПМК 6673609 . ПМИД 18077697 .
- ^ Бефферт У., Уибер Э.Дж., Дурудас А., Цю С., Масиулис И., Суэтт Дж.Д. и др. (август 2005 г.). «Модуляция синаптической пластичности и памяти с помощью Рилина включает дифференциальный сплайсинг липопротеинового рецептора Apoer2» . Нейрон . 47 (4): 567–79. дои : 10.1016/j.neuron.2005.07.007 . ПМИД 16102539 . S2CID 5854936 .
- ^ Миллер Калифорния, Суэтт Дж. Д. (март 2007 г.). «Ковалентная модификация ДНК регулирует формирование памяти» . Нейрон . 53 (6): 857–69. дои : 10.1016/j.neuron.2007.02.022 . ПМИД 17359920 . S2CID 62791264 .
- ^ Jump up to: а б Мацуки Т., Праматарова А., Хауэлл Б.В. (июнь 2008 г.). «Снижение экспрессии Crk и CrkL блокирует индуцированный рилином дендритогенез» . Журнал клеточной науки . 121 (11): 1869–75. дои : 10.1242/jcs.027334 . ПМЦ 2430739 . ПМИД 18477607 .
- ^ Баллиф Б.А., Арно Л., Артур В.Т., Гурис Д., Имамото А., Купер Дж.А. (апрель 2004 г.). «Активация пути Dab1/CrkL/C3G/Rap1 в стимулируемых рилином нейронах» . Современная биология . 14 (7): 606–10. Бибкод : 2004CBio...14..606B . дои : 10.1016/j.cub.2004.03.038 . ПМИД 15062102 . S2CID 52887334 .
- ^ Пак Т.Дж., Карран Т. (декабрь 2008 г.). «Crk и Crk-подобные играют важные перекрывающиеся роли после инвалида-1 в пути Рилина» . Журнал неврологии . 28 (50): 13551–62. doi : 10.1523/JNEUROSCI.4323-08.2008 . ПМЦ 2628718 . ПМИД 19074029 .
- ^ Jump up to: а б Кейлани С., Сугая К. (июль 2008 г.). «Рилин индуцирует фенотип радиальной глии в нервных клетках-предшественниках человека путем активации Notch-1» . Биология развития BMC . 8 (1): 69. дои : 10.1186/1471-213X-8-69 . ПМЦ 2447831 . ПМИД 18593473 .
- ^ Лугли Г., Крюгер Дж. М., Дэвис Дж. М., Персико А. М., Келлер Ф., Смальхейзер Н. Р. (сентябрь 2003 г.). «Методологические факторы, влияющие на измерение и обработку плазменного рилина у человека» . БМК Биохимия . 4 :9. дои : 10.1186/1471-2091-4-9 . ЧВК 200967 . ПМИД 12959647 .
- ^ Хауэлл Б.В., Гертлер Ф.Б., Купер Дж.А. (январь 1997 г.). «Мышь отключена (mDab1): белок, связывающий Src, участвующий в развитии нейронов» . Журнал ЭМБО . 16 (1): 121–32. дои : 10.1093/emboj/16.1.121 . ПМЦ 1169619 . ПМИД 9009273 .
- ^ Арно Л., Баллиф Б.А., Фёрстер Э., Купер Дж.А. (январь 2003 г.). «Фин-тирозинкиназа является важнейшим регулятором инвалидности-1 во время развития мозга» . Современная биология . 13 (1): 9–17. Бибкод : 2003CBio...13....9A . дои : 10.1016/S0960-9822(02)01397-0 . ПМИД 12526739 . S2CID 1739505 .
- ^ Фэн Л., Аллен Н.С., Симо С., Купер Дж.А. (ноябрь 2007 г.). «Кулин 5 регулирует уровень белка Dab1 и расположение нейронов во время развития коры» . Гены и развитие . 21 (21): 2717–30. дои : 10.1101/gad.1604207 . ПМК 2045127 . ПМИД 17974915 .
- ^ Керджан Дж., Глисон Дж.Г. (ноябрь 2007 г.). «Упущенный выход: Рилин запускает полиубиквитинирование Dab1, чтобы положить конец миграции нейронов» . Гены и развитие . 21 (22): 2850–4. дои : 10.1101/gad.1622907 . ПМИД 18006681 .
- ^ Уцуномия-Тейт Н., Кубо К., Тейт С., Кайношо М., Катаяма Э., Накадзима К. и др. (август 2000 г.). «Молекулы рилина собираются вместе, образуя большой белковый комплекс, который ингибируется антителом CR-50, блокирующим функцию» . Труды Национальной академии наук Соединенных Штатов Америки . 97 (17): 9729–34. Бибкод : 2000PNAS...97.9729U . дои : 10.1073/pnas.160272497 . ЧВК 16933 . ПМИД 10920200 .
- ^ Кубо К., Микосиба К., Накадзима К. (август 2002 г.). «Секретируемые молекулы рилина образуют гомодимеры». Неврологические исследования . 43 (4): 381–8. дои : 10.1016/S0168-0102(02)00068-8 . ПМИД 12135781 . S2CID 10656560 .
- ^ Jump up to: а б Штрассер В., Фашинг Д., Хаузер С., Майер Х., Бок Х.Х., Хисбергер Т. и др. (февраль 2004 г.). «Кластеризация рецепторов участвует в передаче сигналов Рилина» . Молекулярная и клеточная биология . 24 (3): 1378–86. дои : 10.1128/MCB.24.3.1378-1386.2004 . ПМК 321426 . ПМИД 14729980 .
- ^ Чай X, Фёрстер Э, Чжао С, Бок Х.Х., Фротшер М (январь 2009 г.). «Рилин стабилизирует актиновый цитоскелет нейрональных процессов, индуцируя фосфорилирование н-кофилина по серину3» . Журнал неврологии . 29 (1): 288–99. doi : 10.1523/JNEUROSCI.2934-08.2009 . ПМК 6664910 . ПМИД 19129405 .
- ^ Фротчер М., Чай Х., Бок Х.Х., Хаас К.А., Фёрстер Э., Чжао С. (ноябрь 2009 г.). «Роль Рилина в развитии и поддержании кортикальной пластинки». Журнал нейронной передачи . 116 (11): 1451–5. дои : 10.1007/s00702-009-0228-7 . ПМИД 19396394 . S2CID 1310387 .
- ^ Арно Л., Баллиф Б.А., Купер Дж.А. (декабрь 2003 г.). «Регуляция передачи сигналов протеинтирозинкиназы путем деградации субстрата во время развития мозга» . Молекулярная и клеточная биология . 23 (24): 9293–302. дои : 10.1128/MCB.23.24.9293-9302.2003 . ПМК 309695 . ПМИД 14645539 .
- ^ Осима Т., Сузуки Х., Моримура Т., Огава М., Микосиба К. (апрель 2007 г.). «Модуляция передачи сигналов рилина с помощью циклин-зависимой киназы 5». Исследования мозга . 1140 : 84–95. дои : 10.1016/j.brainres.2006.01.121 . ПМИД 16529723 . S2CID 23991327 .
- ^ Кешвара Л., Магдалено С., Бенхайон Д., Карран Т. (июнь 2002 г.). «Циклин-зависимая киназа 5 фосфорилирует 1 независимо от передачи сигналов рилина» . Журнал неврологии . 22 (12): 4869–77. doi : 10.1523/JNEUROSCI.22-12-04869.2002 . ПМЦ 6757745 . ПМИД 12077184 .
- ^ Кобаяши С., Исигуро К., Омори А., Такамацу М., Ариока М., Имахори К. и др. (декабрь 1993 г.). «Связанная с cdc2 киназа PSSALRE/cdk5 гомологична субъединице 30 кДа тау-протеинкиназы II, пролин-направленной протеинкиназы, связанной с микротрубочками». Письма ФЭБС . 335 (2): 171–5. Бибкод : 1993FEBSL.335..171K . дои : 10.1016/0014-5793(93)80723-8 . ПМИД 8253190 . S2CID 26474408 .
- ^ Бефферт У., Морфини Дж., Бок Х.Х., Рейна Х., Брэди С.Т., Херц Дж. (декабрь 2002 г.). «Передача сигналов, опосредованная Рилином, локально регулирует протеинкиназу B/Akt и киназу гликогенсинтазы 3beta» . Журнал биологической химии . 277 (51): 49958–64. дои : 10.1074/jbc.M209205200 . ПМИД 12376533 .
- ^ Сасаки С., Шионоя А., Исида М., Гамбелло М.Дж., Йинглинг Дж., Уиншоу-Борис А. и др. (декабрь 2000 г.). «Комплекс LIS1/NUDEL/цитоплазматический комплекс тяжелых цепей динеина в развивающейся и взрослой нервной системе» . Нейрон . 28 (3): 681–96. дои : 10.1016/S0896-6273(00)00146-X . ПМИД 11163259 . S2CID 17738599 .
- ^ Jump up to: а б Бефферт У., Уибер Э.Дж., Морфини Дж., Ко Дж., Брейди С.Т., Цай Л.Х. и др. (февраль 2004 г.). «Рилин и циклин-зависимые сигналы киназы 5 взаимодействуют в регуляции миграции нейронов и синаптической передачи» . Журнал неврологии . 24 (8): 1897–906. doi : 10.1523/JNEUROSCI.4084-03.2004 . ПМК 6730409 . ПМИД 14985430 .
- ^ Осима Т., Огава М., Хирасава М., Лонгенекер Г., Исигуро К., Пант Х.К. и др. (февраль 2001 г.). «Синергетический вклад циклин-зависимой киназы 5/p35 и Reelin/Dab1 в расположение корковых нейронов в развивающемся мозге мыши» . Труды Национальной академии наук Соединенных Штатов Америки . 98 (5): 2764–9. Бибкод : 2001PNAS...98.2764O . дои : 10.1073/pnas.051628498 . ПМК 30213 . ПМИД 11226314 .
- ^ Хонг С.Э., Шугарт Ю.Ю., Хуанг Д.Т., Шахван С.А., Грант П.Е., Хурихейн Д.О. и др. (сентябрь 2000 г.). «Аутосомно-рецессивная лиссэнцефалия с гипоплазией мозжечка связана с мутациями RELN человека». Природная генетика . 26 (1): 93–6. дои : 10.1038/79246 . ПМИД 10973257 . S2CID 67748801 .
- ^ Крино П. (ноябрь 2001 г.). «Новая мутация RELN, связанная с лиссэнцефалией и эпилепсией» . Течения эпилепсии . 1 (2): 72–73. дои : 10.1046/j.1535-7597.2001.00017.x . ПМК 320825 . ПМИД 15309195 .
- ^ Заки М., Шехаб М., Эль-Алим А.А., Абдель-Салам Г., Келлер Х.Б., Илькин Ю. и др. (май 2007 г.). «Идентификация новой рецессивной мутации RELN с использованием гомозиготной сбалансированной реципрокной транслокации». Американский журнал медицинской генетики. Часть А. 143А (9): 939–44. дои : 10.1002/ajmg.a.31667 . ПМИД 17431900 . S2CID 19126812 .
- ^ Импаньятьелло Ф., Гуидотти А.Р., Песольд С., Двиведи И., Карунчо Х., Пису М.Г. и др. (декабрь 1998 г.). «Снижение экспрессии рилина как предполагаемый фактор уязвимости при шизофрении» . Труды Национальной академии наук Соединенных Штатов Америки . 95 (26): 15718–23. Бибкод : 1998PNAS...9515718I . дои : 10.1073/pnas.95.26.15718 . ПМК 28110 . ПМИД 9861036 .
- ^ Jump up to: а б Гуидотти А., Аута Дж., Дэвис Дж.М., Ди-Джорджи-Геревини В., Двиведи Ю., Грейсон Д.Р. и др. (ноябрь 2000 г.). «Снижение экспрессии рилина и декарбоксилазы глутаминовой кислоты67 (GAD67) при шизофрении и биполярном расстройстве: посмертное исследование мозга». Архив общей психиатрии . 57 (11): 1061–9. дои : 10.1001/archpsyc.57.11.1061 . ПМИД 11074872 .
- ^ Jump up to: а б Фатеми С.Х., Хоссейн Фатеми С., Старый Дж.М., Эрл Дж.А., Араги-Никнам М., Иган Э. (январь 2005 г.). «ГАМКергическая дисфункция при шизофрении и расстройствах настроения, отражающаяся в снижении уровня декарбоксилазы глутаминовой кислоты 65 и 67 кДа и белков рилина в мозжечке». Исследования шизофрении . 72 (2–3): 109–22. doi : 10.1016/j.schres.2004.02.017 . ПМИД 15560956 . S2CID 35193802 .
- ^ Jump up to: а б Велдич М., Кадриу Б., Малоку Э., Агис-Бальбоа Р.К., Гуидотти А., Дэвис Дж.М. и др. (март 2007 г.). «Эпигенетические механизмы, экспрессируемые в ГАМКергических нейронах базальных ганглиев, отличают шизофрению от биполярного расстройства» . Исследования шизофрении . 91 (1–3): 51–61. дои : 10.1016/j.schres.2006.11.029 . ЧВК 1876737 . ПМИД 17270400 .
- ^ Иствуд С.Л., Харрисон П.Дж. (сентябрь 2003 г.). «Интерстициальные нейроны белого вещества экспрессируют меньше рилина и аномально распределяются при шизофрении: к интеграции молекулярных и морфологических аспектов гипотезы развития нервной системы». Молекулярная психиатрия . 8 (9): 769, 821–31. дои : 10.1038/sj.mp.4001371 . ПМИД 12931209 . S2CID 25020557 .
- ^ Абдолмалеки Х.М., Ченг К.Х., Руссо А., Смит К.Л., Фараоне С.В., Уилкокс М. и др. (апрель 2005 г.). «Гиперметилирование промотора рилина (RELN) в мозге больных шизофренией: предварительный отчет». Американский журнал медицинской генетики. Часть B. Нейропсихиатрическая генетика . 134Б (1): 60–6. дои : 10.1002/ajmg.b.30140 . ПМИД 15717292 . S2CID 23169492 .
- ^ Фатеми С.Х., Кролл Дж.Л., Старый Дж.М. (октябрь 2001 г.). «Измененные уровни рилина и его изоформ при шизофрении и расстройствах настроения». НейроОтчет . 12 (15): 3209–15. дои : 10.1097/00001756-200110290-00014 . ПМИД 11711858 . S2CID 43077109 .
- ^ Нэйбл М.Б., Торри Э.Ф., Вебстер М.Дж., Бартко Дж.Дж. (июль 2001 г.). «Многомерный анализ данных префронтальной коры, проведенный Консорциумом невропатологии Фонда Стэнли». Бюллетень исследований мозга . 55 (5): 651–9. дои : 10.1016/S0361-9230(01)00521-4 . ПМИД 11576762 . S2CID 23427111 .
- ^ Грейсон Д.Р., Цзя X, Чен Ю, Шарма Р.П., Митчелл С.П., Гуидотти А. и др. (июнь 2005 г.). «Гиперметилирование промотора рилина при шизофрении» . Труды Национальной академии наук Соединенных Штатов Америки . 102 (26): 9341–6. Бибкод : 2005PNAS..102.9341G . дои : 10.1073/pnas.0503736102 . ПМК 1166626 . ПМИД 15961543 .
- ^ Донг Э., Агис-Бальбоа Р.К., Симонини М.В., Грейсон Д.Р., Коста Э., Гуидотти А. (август 2005 г.). «Ремоделирование промотора декарбоксилазы 67 рилина и глутаминовой кислоты в эпигенетической мышиной модели шизофрении, индуцированной метионином» . Труды Национальной академии наук Соединенных Штатов Америки . 102 (35): 12578–83. Бибкод : 2005PNAS..10212578D . дои : 10.1073/pnas.0505394102 . ПМК 1194936 . ПМИД 16113080 .
- ^ Поллин В., Кардон П.В., Кети С.С. (январь 1961 г.). «Эффекты кормления аминокислотами у пациентов с шизофренией, получающих ипрониазид». Наука . 133 (3446): 104–5. Бибкод : 1961Sci...133..104P . дои : 10.1126/science.133.3446.104 . ПМИД 13736870 . S2CID 32080078 .
- ^ Брюн Г.Г., Химвич HE (май 1962 г.). «Влияние нагрузки метионином на поведение больных шизофренией». Журнал нервных и психических заболеваний . 134 (5): 447–50. дои : 10.1097/00005053-196205000-00007 . ПМИД 13873983 . S2CID 46617457 .
- ^ Парк Л.К., Балдессарини Р.Дж., Кети С.С. (апрель 1965 г.). «Влияние метионина на хронических шизофреников». Архив общей психиатрии . 12 (4): 346–51. дои : 10.1001/archpsyc.1965.01720340018003 . ПМИД 14258360 .
- ^ Антун Ф.Т., Бернетт ГБ, Купер А.Дж., Дейли Р.Дж., Смитис-младший, Зили А.К. (июнь 1971 г.). «Эффекты L-метионина (без ИМАО) при шизофрении». Журнал психиатрических исследований . 8 (2): 63–71. дои : 10.1016/0022-3956(71)90009-4 . ПМИД 4932991 .
- ^ Грейсон Д.Р., Чен Ю., Донг Э., Кундакович М., Гуидотти А. (апрель 2009 г.). «От транс-метилирования к метилированию цитозина: эволюция гипотезы метилирования шизофрении» . Эпигенетика . 4 (3): 144–9. дои : 10.4161/epi.4.3.8534 . ПМИД 19395859 .
- ^ Ружичка В.Б., Жуби А., Вельдич М., Грейсон Д.Р., Коста Э., Гуидотти А. (апрель 2007 г.). «Селективное эпигенетическое изменение ГАМКергических нейронов I слоя, выделенных из префронтальной коры больных шизофренией с помощью лазерной микродиссекции». Молекулярная психиатрия . 12 (4): 385–97. дои : 10.1038/sj.mp.4001954 . PMID 17264840 . S2CID 24045153 .
- ^ Велдик М., Карунчо Х.Дж., Лю В.С., Дэвис Дж., Сатта Р., Грейсон Д.Р. и др. (январь 2004 г.). «МРНК ДНК-метилтрансферазы 1 избирательно сверхэкспрессируется в телэнцефальных ГАМКергических интернейронах мозга при шизофрении» . Труды Национальной академии наук Соединенных Штатов Америки . 101 (1): 348–53. Бибкод : 2004PNAS..101..348V . дои : 10.1073/pnas.2637013100 . ПМК 314188 . ПМИД 14684836 .
- ^ Велдич М., Гуидотти А., Малоку Э., Дэвис Дж. М., Коста Э. (февраль 2005 г.). «При психозе кортикальные интернейроны сверхэкспрессируют ДНК-метилтрансферазу 1» . Труды Национальной академии наук Соединенных Штатов Америки . 102 (6): 2152–7. Бибкод : 2005ПНАС..102.2152В . дои : 10.1073/pnas.0409665102 . ПМЦ 548582 . ПМИД 15684088 .
- ^ Тремолиццо Л., Дуэйри М.С., Донг Э., Грейсон Д.Р., Дэвис Дж., Пинна Дж. и др. (март 2005 г.). «Вальпроат корректирует шизофреноподобные эпигенетические изменения поведения, вызванные метионином у мышей». Биологическая психиатрия . 57 (5): 500–9. doi : 10.1016/j.biopsych.2004.11.046 . ПМИД 15737665 . S2CID 29868395 .
- ^ Чен Ю, Шарма Р.П., Коста Р.Х., Коста Э., Грейсон Д.Р. (июль 2002 г.). «Об эпигенетической регуляции промотора рилина человека» . Исследования нуклеиновых кислот . 30 (13): 2930–9. дои : 10.1093/nar/gkf401 . ПМК 117056 . ПМИД 12087179 .
- ^ Митчелл С.П., Чен Ю., Кундакович М., Коста Э., Грейсон Д.Р. (апрель 2005 г.). «Ингибиторы гистондеацетилазы уменьшают метилирование промотора рилина in vitro». Журнал нейрохимии . 93 (2): 483–92. дои : 10.1111/j.1471-4159.2005.03040.x . ПМИД 15816871 . S2CID 12445076 .
- ^ Тремолиццо Л., Карбони Г., Ружичка В.Б., Митчелл С.П., Сугая И., Туетинг П. и др. (декабрь 2002 г.). «Эпигенетическая модель мышиных молекулярных и поведенческих нейропатологий, связанных с уязвимостью к шизофрении» . Труды Национальной академии наук Соединенных Штатов Америки . 99 (26): 17095–100. Бибкод : 2002PNAS...9917095T . дои : 10.1073/pnas.262658999 . ПМК 139275 . ПМИД 12481028 .
- ^ Бенес Ф.М., Лим Б., Мацилевич Д., Уолш Дж.П., Суббураджу С., Миннс М. (июнь 2007 г.). «Регуляция фенотипа клеток ГАМК в гиппокампе больных шизофренией и биполярным расстройством» . Труды Национальной академии наук Соединенных Штатов Америки . 104 (24): 10164–9. Бибкод : 2007PNAS..10410164B . дои : 10.1073/pnas.0703806104 . ПМК 1888575 . ПМИД 17553960 .
- ^ Донг Э., Гуидотти А., Грейсон Д.Р., Коста Э. (март 2007 г.). «Гиперацетилирование гистонов индуцирует деметилирование рилина и промоторов декарбоксилазы глутаминовой кислоты 67 кДа» . Труды Национальной академии наук Соединенных Штатов Америки . 104 (11): 4676–81. Бибкод : 2007PNAS..104.4676D . дои : 10.1073/pnas.0700529104 . ПМЦ 1815468 . ПМИД 17360583 .
- ^ Кундакович М., Чен Ю., Коста Э., Грейсон Д.Р. (март 2007 г.). «Ингибиторы ДНК-метилтрансферазы координально индуцируют экспрессию генов рилина человека и декарбоксилазы 67 глутаминовой кислоты». Молекулярная фармакология . 71 (3): 644–53. дои : 10.1124/моль.106.030635 . ПМИД 17065238 . S2CID 18421124 .
- ^ Кундакович М., Чен Ю., Гуидотти А., Грейсон Д.Р. (февраль 2009 г.). «Промоторы рилина и GAD67 активируются эпигенетическими препаратами, которые способствуют разрушению локальных репрессорных комплексов» . Молекулярная фармакология . 75 (2): 342–54. дои : 10.1124/моль.108.051763 . ПМЦ 2684898 . ПМИД 19029285 .
- ^ Гуидотти А., Ружичка В., Грейсон Д.Р., Велдик М., Пинна Г., Дэвис Дж.М. и др. (январь 2007 г.). «Сверхэкспрессия мРНК S-аденозилметионина и ДНК-метилтрансферазы-1 при психозе». НейроОтчет . 18 (1): 57–60. doi : 10.1097/WNR.0b013e32800fefd7 . ПМИД 17259861 . S2CID 25378736 .
- ^ Jump up to: а б Веденоя Дж., Лукола А., Туулио-Хенрикссон А., Паунио Т., Экелунд Дж., Силандер К. и др. (июль 2008 г.). «Репликация связи на хромосоме 7q22 и ассоциация регионального гена Рилина с рабочей памятью в семьях, страдающих шизофренией». Молекулярная психиатрия . 13 (7): 673–84. дои : 10.1038/sj.mp.4002047 . ПМИД 17684500 . S2CID 20658493 .
- ^ Шифман С., Йоханнессон М., Бронштейн М., Чен С.С., Кольер Д.А., Крэддок, Нью-Джерси, и др. (февраль 2008 г.). «Общегеномная ассоциация идентифицирует общий вариант гена рилина, который увеличивает риск шизофрении только у женщин» . ПЛОС Генетика . 4 (2): е28. дои : 10.1371/journal.pgen.0040028 . ПМК 2242812 . ПМИД 18282107 . бесплатный полный текст
- ^ Веденоя Дж., Туулио-Хенрикссон А., Сувисаари Дж., Лукола А., Паунио Т., Партонен Т. и др. (май 2010 г.). «Репликация связи между рабочей памятью и Рилином, потенциальным геном-модификатором шизофрении» . Биологическая психиатрия . 67 (10): 983–91. doi : 10.1016/j.biopsych.2009.09.026 . ПМК 3083525 . ПМИД 19922905 .
- ^ Грегорио С.П., Саллет ПК, До К.А., Лин Э, Гаттаз В.Ф., Диас-Нето Э (январь 2009 г.). «Полиморфизмы генов, участвующих в развитии нервной системы, могут быть связаны с измененной морфологией мозга при шизофрении: предварительные данные». Психиатрические исследования . 165 (1–2): 1–9. doi : 10.1016/j.psychres.2007.08.011 . ПМИД 19054571 . S2CID 43548414 .
- ^ Jump up to: а б Сузуки К., Накамура К., Ивата Ю., Секине Ю., Каваи М., Сугихара Г. и др. (январь 2008 г.). «Снижение экспрессии рецептора рилина VLDLR в периферических лимфоцитах пациентов с шизофренией, ранее не принимавших лекарства». Исследования шизофрении . 98 (1–3): 148–56. doi : 10.1016/j.schres.2007.09.029 . ПМИД 17936586 . S2CID 45594329 .
- ^ Свит Р.А., Хентелефф Р.А., Чжан В., Сэмпсон А.Р., Льюис Д.А. (январь 2009 г.). «Снижение плотности дендритных шипов в слуховой коре у больных шизофренией» . Нейропсихофармакология . 34 (2): 374–89. дои : 10.1038/нпп.2008.67 . ПМЦ 2775717 . ПМИД 18463626 .
- ^ Гланц Л.А., Льюис Д.А. (январь 2000 г.). «Снижение плотности дендритных отростков на пирамидных нейронах префронтальной коры при шизофрении». Архив общей психиатрии . 57 (1): 65–73. дои : 10.1001/archpsyc.57.1.65 . ПМИД 10632234 .
- ^ Родригес М.А., Песольд С., Лю В.С., Крихо В., Гуидотти А., Паппас Г.Д. и др. (март 2000 г.). «Колокализация рецепторов интегрина и рилина в постсинаптических плотностях дендритного позвоночника коры головного мозга взрослых приматов» . Труды Национальной академии наук Соединенных Штатов Америки . 97 (7): 3550–5. Бибкод : 2000PNAS...97.3550R . дои : 10.1073/pnas.050589797 . ПМК 16277 . ПМИД 10725376 .
- ^ Коста Э., Дэвис Дж., Грейсон Д.Р., Гуидотти А., Паппас Г.Д., Песолд К. (октябрь 2001 г.). «Гипопластика дендритов позвоночника и снижение регуляции рилина и ГАМКергического тонуса при уязвимости к шизофрении» . Нейробиология болезней . 8 (5): 723–42. дои : 10.1006/nbdi.2001.0436 . ПМИД 11592844 . S2CID 31279244 .
- ^ Камнасаран Д., Мьюир В.Дж., Фергюсон-Смит М.А., Кокс Д.В. (май 2003 г.). «Нарушение нейронального гена PAS3 в семье, больной шизофренией» . Журнал медицинской генетики . 40 (5): 325–32. дои : 10.1136/jmg.40.5.325 . ПМЦ 1735455 . ПМИД 12746393 .
- ^ Эрбель-Зилер С., Дадли С., Чжоу Ю., Ву Х., Эстилл С.Дж., Хан Т. и др. (сентябрь 2004 г.). «Поведенческие и регуляторные нарушения у мышей с дефицитом факторов транскрипции NPAS1 и NPAS3» . Труды Национальной академии наук Соединенных Штатов Америки . 101 (37): 13648–53. Бибкод : 2004PNAS..10113648E . дои : 10.1073/pnas.0405310101 . ПМК 518807 . ПМИД 15347806 .
- ^ Чен З, Шван Б.С., Ву Ц, Хе Х, Розен Р. (август 2005 г.). «Постнатальные дефекты мозжечка у мышей с дефицитом метилентетрагидрофолатредуктазы». Международный журнал нейробиологии развития . 23 (5): 465–74. doi : 10.1016/j.ijdevneu.2005.05.007 . ПМИД 15979267 . S2CID 37922852 .
- ^ Обзор генов всех опубликованных исследований ассоциации шизофрении для GRIN2B. Архивировано 13 сентября 2010 г. в Wayback Machine - База данных генов шизофрении.
- ^ Jump up to: а б Ван Г.С., Хун С.Дж., Йен Т.И., Хуан Х.И., Оу Ю., Хуан Т.Н. и др. (апрель 2004 г.). «Транкрипционная модификация с помощью CASK-взаимодействующего белка сборки нуклеосомы» . Нейрон . 42 (1): 113–28. дои : 10.1016/S0896-6273(04)00139-4 . ПМИД 15066269 . S2CID 14383387 .
- ^ Подхорна Дж., Дидриксен М. (август 2004 г.). «Гетерозиготная мышь-рилер: поведенческий фенотип» . Поведенческие исследования мозга . 153 (1): 43–54. дои : 10.1016/j.bbr.2003.10.033 . ПМИД 15219705 . S2CID 538066 .
- ^ Акбарян С., Ким Дж.Дж., Поткин С.Г., Хетрик В.П., Банни В.Е., Джонс Э.Г. (май 1996 г.). «Нарушение распределения интерстициальных нейронов в префронтальном белом веществе головного мозга больных шизофренией». Архив общей психиатрии . 53 (5): 425–36. doi : 10.1001/archpsyc.1996.01830050061010 . ПМИД 8624186 .
- ^ Джоши Д., Фунг С.Дж., Ротвелл А., Вейкерт К.С. (ноябрь 2012 г.). «Более высокая плотность нейронов гамма-аминомасляной кислоты в белом веществе орбитально-лобной коры при шизофрении». Биологическая психиатрия . 72 (9): 725–33. doi : 10.1016/j.biopsych.2012.06.021 . ПМИД 22841514 . S2CID 8400626 .
- ^ Jump up to: а б с Матигиан Н., Абрахамсен Г., Сутарсан Р., Кук А.Л., Витале А.М., Нувенс А. и др. (2010). «Специфические для заболевания клетки нейросферы как модели заболеваний головного мозга» (PDF) . Модели и механизмы заболеваний . 3 (11–12): 785–98. дои : 10.1242/dmm.005447 . ПМИД 20699480 .
- ^ Тополь А., Чжу С., Хартли Б.Дж., Инглиш Дж., Хауберг М.Э., Тран Н. и др. (май 2016 г.). «Нарушение регуляции микроРНК-9 в подмножестве нервных клеток-предшественников, полученных от больных шизофренией» . Отчеты по ячейкам . 15 (5): 1024–1036. дои : 10.1016/j.celrep.2016.03.090 . ПМЦ 4856588 . ПМИД 27117414 .
- ^ Jump up to: а б с д Ти JY, Сутарсан Р., Фан Ю, Маккей-Сим А (2016). «Клетки обонятельной нейросферы, полученные от пациента с шизофренией, не реагируют на внеклеточный рилин» . НПЖ Шизофрения . 2 : 16027. дои : 10.1038/npjschz.2016.27 . ПМЦ 4994154 . ПМИД 27602387 .
- ^ Гоес Ф.С., Уиллур В.Л., Занди П.П., Бельмонте П.Л., Маккиннон Д.Ф., Мондимор Ф.М. и др. (март 2010 г.). «Полоспецифичная ассоциация гена Рилина с биполярным расстройством» . Американский журнал медицинской генетики. Часть B. Нейропсихиатрическая генетика . 153Б (2): 549–553. дои : 10.1002/ajmg.b.31018 . ПМК 3032172 . ПМИД 19691043 .
- ^ Ламмерт Д.Б., Хауэлл Б.В. (31 марта 2016 г.). «Мутации RELN при расстройствах аутистического спектра» . Границы клеточной нейронауки . 10 (84): 84. doi : 10.3389/fncel.2016.00084 . ПМЦ 4814460 . ПМИД 27064498 .
- ^ Персико А.М., Д'Агрума Л., Майорано Н., Тотаро А., Милитерни Р., Браваччо С. и др. (март 2001 г.). «Аллели и гаплотипы гена рилина как фактор, предрасполагающий к аутистическому расстройству». Молекулярная психиатрия . 6 (2): 150–9. дои : 10.1038/sj.mp.4000850 . ПМИД 11317216 . S2CID 1472363 .
- ^ Чжан Х., Лю Х, Чжан С., Мундо Э., Маккарди Ф., Грейсон Д.Р. и др. (2002). «Аллели гена Рилина и предрасположенность к расстройствам аутистического спектра». Молекулярная психиатрия . 7 (9): 1012–7. дои : 10.1038/sj.mp.4001124 . ПМИД 12399956 . S2CID 30799924 .
- ^ Бонора Э., Бейер К.С., Лэмб Дж.А., Парр Дж.Р., Клаук С.М., Беннер А. и др. (октябрь 2003 г.). «Анализ рилина как гена-кандидата на развитие аутизма». Молекулярная психиатрия . 8 (10): 885–92. дои : 10.1038/sj.mp.4001310 . ПМИД 14515139 . S2CID 32279857 .
- ^ Девлин Б., Беннетт П., Доусон Г., Фиглевич Д.А., Григоренко Е.Л., МакМахон В. и др. (апрель 2004 г.). «Аллели повтора CGG не указывают на предрасположенность к аутизму в образце из сети CPEA» (PDF) . Американский журнал медицинской генетики. Часть B. Нейропсихиатрическая генетика . 126Б (1): 46–50. дои : 10.1002/ajmg.b.20125 . ПМИД 15048647 . S2CID 14966506 .
- ^ Холт Р., Барнби Дж., Маэстрини Е., Бачелли Е., Броклебанк Д., Соуза И. и др. (сентябрь 2010 г.). «Исследование связей и генов-кандидатов расстройств аутистического спектра в европейском населении» . Европейский журнал генетики человека . 18 (9): 1013–9. дои : 10.1038/ejhg.2010.69 . ПМК 2987412 . ПМИД 20442744 .
- ^ Пардо, Калифорния, Эберхарт, К.Г. (октябрь 2007 г.). «Нейробиология аутизма» . Патология головного мозга . 17 (4): 434–47. дои : 10.1111/j.1750-3639.2007.00102.x . ПМК 8095519 . ПМИД 17919129 . S2CID 37048272 .
- ^ Хаас К.А., Дудек О., Кирш М., Хушка С., Канн Г., Поллак С. и др. (июль 2002 г.). «Роль рилина в развитии дисперсии гранулярных клеток при височной эпилепсии» . Журнал неврологии . 22 (14): 5797–802. doi : 10.1523/JNEUROSCI.22-14-05797.2002 . ПМК 6757930 . ПМИД 12122039 .
- ^ Генрих С., Нитта Н., Флубахер А., Мюллер М., Фарнер А., Кирш М. и др. (апрель 2006 г.). «В основе формирования дисперсии гранулярных клеток в эпилептическом гиппокампе лежат дефицит рилина и смещение зрелых нейронов, а не нейрогенез» . Журнал неврологии . 26 (17): 4701–13. doi : 10.1523/JNEUROSCI.5516-05.2006 . ПМК 6674063 . ПМИД 16641251 .
- ^ Кобов К., Йеске И., Хильдебрандт М., Хауке Дж., Ханен Э., Буслей Р. и др. (апрель 2009 г.). «Увеличенное метилирование промотора рилина связано с дисперсией гранулярных клеток при височной эпилепсии человека» . Журнал невропатологии и экспериментальной неврологии . 68 (4): 356–64. дои : 10.1097/NEN.0b013e31819ba737 . ПМИД 19287316 .
- ^ Гонг С., Ван Т.В., Хуан Х.С., Родитель Дж.М. (февраль 2007 г.). «Рилин регулирует миграцию предшественников нейронов в интактном и эпилептическом гиппокампе» . Журнал неврологии . 27 (8): 1803–11. doi : 10.1523/JNEUROSCI.3111-06.2007 . ПМК 6673551 . ПМИД 17314278 .
- ^ Мюллер М.К., Оссвальд М., Тиннес С., Хойсслер У., Якоби А., Фёрстер Э. и др. (апрель 2009 г.). «Экзогенный рилин предотвращает дисперсию гранулярных клеток при экспериментальной эпилепсии». Экспериментальная неврология . 216 (2): 390–7. дои : 10.1016/j.expneurol.2008.12.029 . ПМИД 19185570 . S2CID 17173306 .
- ^ Jump up to: а б Герц Дж., Бефферт Ю. (октябрь 2000 г.). «Рецепторы аполипопротеина Е: связь развития мозга и болезни Альцгеймера». Обзоры природы. Нейронаука . 1 (1): 51–8. дои : 10.1038/35036221 . ПМИД 11252768 . S2CID 27105032 .
- ^ Герц Дж., Чен Ю. (ноябрь 2006 г.). «Рилин, липопротеиновые рецепторы и синаптическая пластичность». Обзоры природы. Нейронаука . 7 (11): 850–9. дои : 10.1038/nrn2009 . ПМИД 17053810 . S2CID 44317115 .
- ^ Ботелла-Лопес А., Бургайя Ф., Гэвин Р., Гарсия-Айон М.С., Гомес-Тортоса Е., Пенья-Казанова Дж. и др. (апрель 2006 г.). «Экспрессия рилина и характер гликозилирования изменяются при болезни Альцгеймера» . Труды Национальной академии наук Соединенных Штатов Америки . 103 (14): 5573–8. Бибкод : 2006PNAS..103.5573B . дои : 10.1073/pnas.0601279103 . ПМЦ 1414634 . ПМИД 16567613 .
- ^ Виртс О., Мультауп Г., Чех С., Бланшар В., Тремп Г., Прадье Л. и др. (декабрь 2001 г.). «Рилин в бляшках белка-предшественника бета-амилоида и двойных трансгенных мышей пресенилина-1». Письма по неврологии . 316 (3): 145–8. дои : 10.1016/S0304-3940(01)02399-0 . ПМИД 11744223 . S2CID 35475092 .
- ^ Серипа Д., Матера М.Г., Франчески М., Даниэле А., Биццарро А., Ринальди М. и др. (июль 2008 г.). «Локус RELN при болезни Альцгеймера». Журнал болезни Альцгеймера . 14 (3): 335–44. дои : 10.3233/jad-2008-14308 . ПМИД 18599960 .
- ^ Балояннис С.Дж. (июль 2005 г.). «Морфологические и морфометрические изменения клеток Кахаля-Ретциуса в ранних случаях болезни Альцгеймера: исследование Гольджи и электронного микроскопа». Международный журнал неврологии . 115 (7): 965–80. дои : 10.1080/00207450590901396 . ПМИД 16051543 . S2CID 36197073 .
- ^ Балояннис С.Дж., Коста В., Маурудис И., Псарулис Д., Манолидес С.Л., Манолидес Л.С. (апрель 2007 г.). «Дендритная и спинальная патология слуховой коры при болезни Альцгеймера: морфологическая и морфометрическая оценка методом Гольджи и электронной микроскопии». Acta Oto-Laryngologica . 127 (4): 351–4. дои : 10.1080/00016480601126986 . ПМИД 17453452 . S2CID 21625263 .
- ^ Хо Х.С., Ли К.Дж., Карни Р.С., Ли Дж., Маркова А., Ли Дж.Ю. и др. (июнь 2009 г.). «Взаимодействие рилина с белком-предшественником амилоида способствует росту нейритов» . Журнал неврологии . 29 (23): 7459–73. doi : 10.1523/JNEUROSCI.4872-08.2009 . ПМЦ 2759694 . ПМИД 19515914 .
- ^ Дуракоглугил М.С., Чен Ю, Уайт К.Л., Кавалали Э.Т., Герц Дж. (сентябрь 2009 г.). «Передача сигналов рилина противодействует бета-амилоиду в синапсе» . Труды Национальной академии наук Соединенных Штатов Америки . 106 (37): 15938–43. Бибкод : 2009PNAS..10615938D . дои : 10.1073/pnas.0908176106 . ПМЦ 2747222 . ПМИД 19805234 .
- ^ Чен Ю, Дуракоглугил М.С., Сянь Х, Герц Дж (июнь 2010 г.). «ApoE4 снижает функцию глутаматных рецепторов и синаптическую пластичность, избирательно нарушая рециркуляцию рецептора ApoE» . Труды Национальной академии наук Соединенных Штатов Америки . 107 (26): 12011–6. Бибкод : 2010PNAS..10712011C . дои : 10.1073/pnas.0914984107 . ПМК 2900641 . ПМИД 20547867 .
- ^ Сато Н., Фукусима Н., Чанг Р., Мацубаяси Х., Гоггинс М. (февраль 2006 г.). «Дифференциальное и эпигенетическое профилирование экспрессии генов выявляет частые нарушения пути RELN при раке поджелудочной железы» . Гастроэнтерология . 130 (2): 548–65. дои : 10.1053/j.gastro.2005.11.008 . ПМИД 16472607 .
- ^ Перроне Г., Винченци Б., Загами М., Сантини Д., Пантери Р., Фламмиа Г. и др. (март 2007 г.). «Экспрессия рилина при раке простаты человека: маркер агрессивности опухоли, основанный на корреляции со степенью злокачественности» . Современная патология . 20 (3): 344–51. doi : 10.1038/modpathol.3800743 . ПМИД 17277764 .
- ^ Сейгел ГМ, Хакам А.С., Гангули А., Манделл Л.М., Гонсалес-Фернандес Ф. (июнь 2007 г.). «Маркеры эмбриональных и нейрональных стволовых клеток человека при ретинобластоме» . Молекулярное видение . 13 : 823–32. ПМЦ 2768758 . ПМИД 17615543 .
- ^ Чжан Дж., Дин Л., Холмфельдт Л., Ву Г., Хитли С.Л., Пейн-Тернер Д. и др. (январь 2012 г.). «Генетическая основа раннего острого лимфобластного лейкоза-предшественника Т-клеток» . Природа . 481 (7380): 157–63. Бибкод : 2012Natur.481..157Z . дои : 10.1038/nature10725 . ПМК 3267575 . ПМИД 22237106 .
- ^ Шраувен И., Или М., Хюнтельман М.Дж., Тис М., Гомер Н., Вандерстратен К. и др. (март 2009 г.). «Полногеномный анализ выявляет генетические варианты гена RELN, связанные с отосклерозом» . Американский журнал генетики человека . 84 (3): 328–38. дои : 10.1016/j.ajhg.2009.01.023 . ПМК 2667982 . ПМИД 19230858 .
- ^ Делахайе Н.Ф., Колтель Н., Путье Д., Барбье М., Бенек П., Джоли Ф. и др. (декабрь 2007 г.). «Анализ экспрессии генов выявляет ранние изменения в нескольких молекулярных путях у мышей, восприимчивых к церебральной малярии, по сравнению с мышами, устойчивыми к церебральной малярии» . БМК Геномика . 8 : 452. дои : 10.1186/1471-2164-8-452 . ПМК 2246131 . ПМИД 18062806 .
- ^ Гаршасби М., Махмуди М., Размара Э., Вожданян М., Аслани С., Фархади Э. и др. (июнь 2020 г.). «Идентификация варианта RELN p.(Ser2486Gly) в иранской семье с болезнью Бехтерева; первая ассоциация RELN и AS» . Европейский журнал генетики человека . 28 (6): 754–762. дои : 10.1038/s41431-020-0573-4 . ПМЦ 7253431 . ПМИД 32001840 .
- ^ « 'Reelin' в новом лечении рассеянного склероза» . 12 августа 2020 г.
- ^ Jump up to: а б Смит-Ригтер Л.А., Шампанское Д.Л., ван Хоофт Дж.А. (2009). Линден Р. (ред.). «Влияние изменений в материнской заботе на протяжении всей жизни на дендритную структуру и функцию пирамидных нейронов 2/3 кортикального слоя у потомства крыс» . ПЛОС ОДИН . 4 (4): е5167. Бибкод : 2009PLoSO...4.5167S . дои : 10.1371/journal.pone.0005167 . ПМЦ 2663818 . ПМИД 19357777 .
- ^ Уивер И.С., Мини М.Дж., Шиф М. (февраль 2006 г.). «Влияние материнской заботы на транскриптом гиппокампа и тревожное поведение потомства, которое обратимо во взрослом возрасте» . Труды Национальной академии наук Соединенных Штатов Америки . 103 (9): 3480–5. Бибкод : 2006PNAS..103.3480W . дои : 10.1073/pnas.0507526103 . ПМЦ 1413873 . ПМИД 16484373 .
- ^ Люсье А.Л., Карунчо Х.Дж., Калинчук Л.Е. (август 2009 г.). «Повторное воздействие кортикостерона, но не ограничение, уменьшает количество рилин-положительных клеток в гиппокампе взрослых крыс». Письма по неврологии . 460 (2): 170–4. doi : 10.1016/j.neulet.2009.05.050 . ПМИД 19477232 . S2CID 5305922 .
- ^ Линтас С., Персико AM (январь 2010 г.). «Метилирование неокортикального промотора RELN значительно увеличивается после полового созревания». НейроОтчет . 21 (2): 114–8. дои : 10.1097/WNR.0b013e328334b343 . ПМИД 19952965 . S2CID 206137259 .
- ^ Исии К., Кубо К.И., Накадзима К. (18 октября 2016 г.). «Рилин и нервно-психические расстройства» . Границы клеточной нейронауки . 10 :229. дои : 10.3389/fncel.2016.00229 . ПМК 5067484 . ПМИД 27803648 .
- ^ Донг Э., Нельсон М., Грейсон Д.Р., Коста Э., Гуидотти А. (сентябрь 2008 г.). «Клозапин и сульпирид, но не галоперидол или оланзапин, активируют деметилирование ДНК мозга» . Труды Национальной академии наук Соединенных Штатов Америки . 105 (36): 13614–9. Бибкод : 2008PNAS..10513614D . дои : 10.1073/pnas.0805493105 . ПМЦ 2533238 . ПМИД 18757738 .
- ^ Фатеми С.Х., Ройтиман Т.Дж., Фолсом Т.Д. (июнь 2009 г.). «Хроническое лечение психотропными препаратами вызывает дифференциальную экспрессию сигнальной системы Рилин в лобной коре крыс». Исследования шизофрении . 111 (1–3): 138–52. doi : 10.1016/j.schres.2009.03.002 . ПМИД 19359144 . S2CID 37048872 .
Дальнейшее чтение
[ редактировать ]- Фатеми С.Х. (март 2005 г.). «Гликопротеин Рилин: структура, биология и роль в здоровье и болезни». Молекулярная психиатрия . 10 (3). Спрингер: 251–257. дои : 10.1038/sj.mp.4001613 . ISBN 978-0-387-76760-4 . ПМИД 15583703 . S2CID 21206951 .
- Фёрстер Э., Жоссен Ю., Чжао С., Чай Икс, Фротшер М., Гоффине А.М. (февраль 2006 г.). «Недавний прогресс в понимании роли рилина в радиальной миграции нейронов с особым упором на зубчатую извилину». Европейский журнал неврологии . 23 (4): 901–9. дои : 10.1111/j.1460-9568.2006.04612.x . ПМИД 16519655 . S2CID 25269492 .
- Бефферт У., Столт ПК, Герц Дж. (март 2004 г.). «Функции липопротеиновых рецепторов в нейронах» . Журнал исследований липидов . 45 (3): 403–9. doi : 10.1194/jlr.R300017-JLR200 . ПМИД 14657206 .
- Донг Э., Агис-Бальбоа Р.К., Симонини М.В., Грейсон Д.Р., Коста Э., Гуидотти А. (август 2005 г.). «Ремоделирование промотора декарбоксилазы 67 рилина и глутаминовой кислоты в эпигенетической мышиной модели шизофрении, индуцированной метионином» . Труды Национальной академии наук Соединенных Штатов Америки . 102 (35): 12578–83. Бибкод : 2005PNAS..10212578D . дои : 10.1073/pnas.0505394102 . ПМК 1194936 . ПМИД 16113080 .
- Магдалено С.М., Карран Т. (декабрь 2001 г.). «Развитие мозга: интегрины и путь Рилина» . Современная биология . 11 (24): Р1032-5. Бибкод : 2001CBio...11R1032M . дои : 10.1016/S0960-9822(01)00618-2 . ПМИД 11747842 . S2CID 8790079 .
- Хонг С.Э., Шугарт Ю.Ю., Хуанг Д.Т., Шахван С.А., Грант П.Е., Хурихейн Д.О. и др. (сентябрь 2000 г.). «Аутосомно-рецессивная лиссэнцефалия с гипоплазией мозжечка связана с мутациями RELN человека». Природная генетика . 26 (1): 93–6. дои : 10.1038/79246 . ПМИД 10973257 . S2CID 67748801 .
Внешние ссылки
[ редактировать ]- Обзор всей структурной информации, доступной в PDB для UniProt : Q60841 (Mouse Reelin) в PDBe-KB .
- «Габриэлла Д'Арканджело» . Университет Рутгерса. Архивировано из оригинала 25 июля 2008 года . Проверено 23 августа 2008 г.
учёный, открывший ген и белок рилин
- Человеческий RELN в WikiGenes
- «Экспрессия гена рилина у мышей» . Карта экспрессии генов мозга . Детская исследовательская больница Св. Иуды. Архивировано из оригинала 23 января 2005 года . Проверено 23 августа 2008 г.