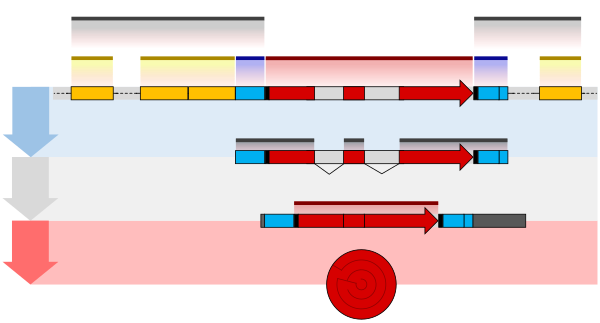
Нормативная последовательность
Изображения в этой статье могут потребовать корректировки изображений размещения , форматирования и размера . . ( февраль 2022 г. ) |
— Регуляторная последовательность это сегмент молекулы нуклеиновой кислоты , который способен увеличивать или уменьшать экспрессию определенных генов в организме. Регуляция экспрессии генов является важной особенностью всех живых организмов и вирусов.
Описание
[ редактировать ]В ДНК регуляция экспрессии генов обычно происходит на уровне биосинтеза РНК ( транскрипции ). Это достигается посредством специфического связывания белков ( факторов транскрипции ), которые активируют или ингибируют транскрипцию. Факторы транскрипции могут действовать как активаторы , репрессоры или и то, и другое. Репрессоры часто действуют, предотвращая образование продуктивного комплекса РНК-полимеразой с областью инициации транскрипции ( промотором ), тогда как активаторы способствуют образованию продуктивного комплекса. Более того, было показано, что мотивы ДНК предсказывают эпигеномные модификации, что позволяет предположить, что факторы транскрипции играют роль в регуляции эпигенома . [2]
В РНК регуляция может происходить на уровне биосинтеза белка ( трансляции ), расщепления РНК, сплайсинга РНК или терминации транскрипции. Регуляторные последовательности часто связаны с молекулами информационной РНК (мРНК), где они используются для контроля биогенеза или трансляции мРНК. Для осуществления этой регуляции с РНК могут связываться различные биологические молекулы, включая белки (например, репрессоры трансляции и факторы сплайсинга), другие молекулы РНК (например, микроРНК ) и небольшие молекулы , в случае рибопереключателей .
Активация и внедрение
[ редактировать ]Регуляторная последовательность ДНК не регулирует, пока она не активирована. Различные регуляторные последовательности активируются и затем осуществляют свою регуляцию с помощью разных механизмов.
Активация и внедрение энхансера
[ редактировать ]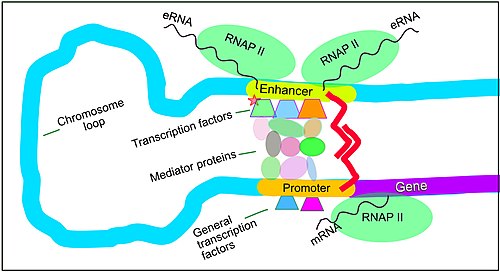
Экспрессию генов у млекопитающих можно активировать, когда сигналы передаются промоторам, связанным с генами. Цис -регуляторные последовательности ДНК , расположенные в областях ДНК, удаленных от промоторов генов, могут оказывать очень сильное влияние на экспрессию генов, при этом экспрессия некоторых генов увеличивается до 100 раз из-за такой цис -регуляторной последовательности. [3] Эти цис -регуляторные последовательности включают энхансеры , сайленсеры , инсуляторы и привязывающие элементы. [4] Среди этого созвездия последовательностей энхансеры и связанные с ними белки-факторы транскрипции играют ведущую роль в регуляции экспрессии генов. [5]
Энхансеры — это последовательности генома, являющиеся основными генно-регуляторными элементами. Энхансеры контролируют программы экспрессии генов, специфичные для определенного типа клеток, чаще всего путем прохождения больших расстояний, чтобы оказаться в физической близости с промоторами своих генов-мишеней. [6] При исследовании нейронов коры головного мозга было обнаружено 24 937 петель, подводящих энхансеры к промоторам. [3] Множественные энхансеры, каждый из которых часто находится на десятках или сотнях тысяч нуклеотидов, удаленных от генов-мишеней, соединяются с промоторами гена-мишени и координируются друг с другом, чтобы контролировать экспрессию общего гена-мишени. [6]
Схематическая иллюстрация в этом разделе показывает, как энхансер движется по кругу, чтобы вступить в тесную физическую близость к промотору целевого гена. Петля стабилизируется димером соединительного белка (например, димером CTCF или YY1 ), причем один член димера прикреплен к своему связывающему мотиву на энхансере, а другой член прикреплен к своему связывающему мотиву на промоторе (представленному красные зигзаги на иллюстрации). [7] Несколько белков-факторов транскрипции, специфичных для клеточных функций (в 2018 году Ламберт и др. указали, что в клетке человека имеется около 1600 факторов транскрипции). [8] ) обычно связываются с конкретными мотивами энхансера [9] и небольшая комбинация этих связанных с энхансером факторов транскрипции, когда они приближаются к промотору с помощью петли ДНК, регулируют уровень транскрипции целевого гена. Медиатор (коактиватор) (комплекс, обычно состоящий примерно из 26 белков во взаимодействующей структуре) передает регуляторные сигналы от энхансерных ДНК-связанных факторов транскрипции непосредственно ферменту РНК-полимеразы II (РНКП II), связанному с промотором. [10]
Энхансеры, когда они активны, обычно транскрибируются с обеих цепей ДНК с помощью РНК-полимераз, действующих в двух разных направлениях, образуя две эРНК, как показано на рисунке. [11] Неактивный энхансер может быть связан с неактивным фактором транскрипции. Фосфорилирование фактора транскрипции может активировать его, и этот активированный фактор транскрипции может затем активировать энхансер, с которым он связан (см. маленькую красную звездочку, обозначающую фосфорилирование фактора транскрипции, связанного с энхансером, на иллюстрации). [12] Активированный энхансер начинает транскрипцию своей РНК перед активацией промотора, чтобы инициировать транскрипцию информационной РНК из его целевого гена. [13]
Метилирование и деметилирование CpG-островков
[ редактировать ]
5-Метилцитозин (5-mC) представляет собой метилированную форму ДНК основания цитозина (см. рисунок). 5-mC представляет собой эпигенетический маркер, обнаруживаемый преимущественно в цитозинах в составе динуклеотидов CpG, которые состоят из цитозина, за которым следует считывание гуанина в направлении от 5' к 3' вдоль цепи ДНК ( сайты CpG ). В геноме человека встречается около 28 миллионов CpG-динуклеотидов. [14] В большинстве тканей млекопитающих в среднем от 70% до 80% цитозинов CpG метилированы (образуя 5-метил-CpG или 5-mCpG). [15] Метилированные цитозины в последовательностях CpG часто встречаются группами, называемыми CpG-островками . Около 59% последовательностей промоторов имеют островок CpG, тогда как только около 6% последовательностей энхансеров имеют островок CpG. [16] Островки CpG представляют собой регуляторные последовательности, поскольку, если островки CpG метилированы в промоторе гена, это может снизить или заглушить экспрессию гена. [17]
Метилирование ДНК регулирует экспрессию генов посредством взаимодействия с белками метилсвязывающего домена (MBD), такими как MeCP2, MBD1 и MBD2. Эти белки MBD наиболее прочно связываются с высоко метилированными CpG-островками . [18] Эти белки MBD имеют как метил-CpG-связывающий домен, так и домен репрессии транскрипции. [18] Они связываются с метилированной ДНК и направляют белковые комплексы, обладающие активностью ремоделирования хроматина и/или модификации гистонов, к метилированным CpG-островкам. Белки MBD обычно репрессируют локальный хроматин с помощью таких средств, как катализ внедрения репрессивных меток гистонов или создание общей репрессивной среды хроматина посредством ремоделирования нуклеосом и реорганизации хроматина. [18]
Факторы транскрипции — это белки, которые связываются со специфическими последовательностями ДНК, чтобы регулировать экспрессию данного гена. Последовательность связывания фактора транскрипции в ДНК обычно имеет длину около 10 или 11 нуклеотидов. В геноме человека закодировано около 1400 различных факторов транскрипции, и они составляют около 6% всех генов, кодирующих человеческие белки. [19] Около 94% сайтов связывания транскрипционных факторов, которые связаны с генами, реагирующими на сигнал, встречаются в энхансерах, тогда как только около 6% таких сайтов встречаются в промоторах. [9]
EGR1 является фактором транскрипции, важным для регуляции метилирования CpG-островков. Сайт связывания транскрипционного фактора EGR1 часто расположен в последовательностях энхансера или промотора. [20] В геноме млекопитающих имеется около 12 000 сайтов связывания EGR1, причем около половины сайтов связывания EGR1 расположены в промоторах, а половина - в энхансерах. [20] Связывание EGR1 с целевым участком связывания ДНК нечувствительно к метилированию цитозина в ДНК. [20]
Хотя в нестимулированных клетках обнаруживаются лишь небольшие количества белка EGR1, трансляция EGR1 в белок через час после стимуляции заметно увеличивается. [21] Экспрессия EGR1 в различных типах клеток может стимулироваться факторами роста, нейротрансмиттерами, гормонами, стрессом и травмой. [21] В мозге, когда нейроны активируются, активность белков EGR1 повышается, и они связываются (рекрутируют) ранее существовавшие ферменты TET1, которые высоко экспрессируются в нейронах. Ферменты ТЕТ могут катализировать деметилирование 5-метилцитозина. Когда факторы транскрипции EGR1 доставляют ферменты TET1 к сайтам связывания EGR1 в промоторах, ферменты TET могут деметилировать метилированные островки CpG на этих промоторах. После деметилирования эти промоторы могут затем инициировать транскрипцию своих генов-мишеней. Сотни генов в нейронах дифференциально экспрессируются после активации нейронов посредством рекрутирования EGR1 TET1 на метилированные регуляторные последовательности в их промоторах. [20]
Активация двух- или одноцепочечными разрывами
[ редактировать ]Около 600 регуляторных последовательностей в промоторах и около 800 регуляторных последовательностей в энхансерах, по-видимому, зависят от двухцепочечных разрывов, инициируемых топоизомеразой 2β (TOP2B), для активации. [22] [23] Индукция определенных двухцепочечных разрывов специфична в отношении индуцирующего сигнала. Когда нейроны активируются in vitro , в их геномах происходит всего 22 двухцепочечных разрыва, индуцированных TOP2B. [24] Однако когда контекстуальное формирование страха , это вызывает появление сотен связанных с генами DSB в медиальной префронтальной коре и гиппокампе, которые важны для обучения и памяти. у мышей применяется [25]

Такие двухцепочечные разрывы, индуцированные TOP2B, сопровождаются как минимум четырьмя ферментами пути репарации ДНК негомологичного соединения концов (NHEJ) (DNA-PKcs, KU70, KU80 и ДНК-ЛИГАЗА IV) (см. рисунок). Эти ферменты восстанавливают двухцепочечные разрывы в течение периода от 15 минут до 2 часов. [24] [26] Таким образом, двухцепочечные разрывы в промоторе связаны с TOP2B и, по крайней мере, с этими четырьмя ферментами репарации. Эти белки присутствуют одновременно на одной нуклеосоме-промоторе (в последовательности ДНК, обернутой вокруг одной нуклеосомы, около 147 нуклеотидов), расположенной вблизи места начала транскрипции их гена-мишени. [26]
Двухцепочечный разрыв, вызванный TOP2B, по-видимому, освобождает часть промотора в сайте начала транскрипции, связанном с РНК-полимеразой, для физического перемещения к связанному с ним энхансеру. Это позволяет энхансеру с его связанными факторами транскрипции и белками-медиаторами напрямую взаимодействовать с РНК-полимеразой, которая была приостановлена в сайте начала транскрипции, чтобы начать транскрипцию. [24] [10]
Аналогичным образом, ферменты топоизомеразы I (TOP1), по-видимому, расположены на многих энхансерах, и эти энхансеры активируются, когда TOP1 вводит одноцепочечный разрыв. [27] TOP1 вызывает одноцепочечные разрывы в определенных регуляторных последовательностях ДНК энхансера, когда сигнализируется специфическим транскрипционным фактором, связывающим энхансер. [27] Разрывы топоизомеразы I связаны с другими факторами репарации ДНК, чем те, которые окружают разрывы TOP2B. В случае TOP1 разрывы наиболее непосредственно связаны с ферментами репарации ДНК MRE11 , RAD50 и ATR . [27]
Примеры
[ редактировать ]Геномы можно систематически анализировать для выявления регуляторных областей. [28] Консервативные некодирующие последовательности часто содержат регуляторные области, поэтому они часто являются объектом такого анализа.
- коробка СААТ
- коробка CCAAT
- Оператор (биология)
- Прибновская коробка
- ТАТА коробка
- Элемент SECIS , мРНК
- Сигнал полиаденилирования , мРНК
- А-бокс
- Z-бокс
- С-бокс
- Электронный ящик
- G-бокс
Ген инсулина
[ редактировать ]Регуляторные последовательности гена инсулина : [29]
- А5
- С
- отрицательный регуляторный элемент (НРЕ) [30]
- С2
- Е2
- А3
- элемент ответа цАМФ
- А2
- Связывание энхансера CAAT (CEB)
- С1
- Е1
- Г1
См. также
[ редактировать ]- Ген-регулятор
- Регуляция экспрессии генов
- Цис- действующий элемент
- Сеть регулирования генов
- Открытая база данных нормативных аннотаций
- Оперон
- Сайт связывания ДНК
- Промоутер
- Трансдействующий фактор
- ORegYear
Ссылки
[ редактировать ]- ^ Jump up to: а б Шафи, Томас; Лоу, Рохан (2017). «Строение генов эукариот и прокариот» . Викижурнал медицины . 4 (1). дои : 10.15347/wjm/2017.002 . ISSN 2002-4436 .
- ^ Уитакер Дж.В., Чжао Чен, Вэй Ван. (2014) Предсказание эпигенома человека по мотивам ДНК. Природные методы. doi:10.1038/nmeth.3065
- ^ Jump up to: а б Биган Дж.А., Пастузин Э.Д., Фернандес Л.Р., Го М.Х., Фэн К., Титус КР и др. (июнь 2020 г.). «Трехмерная реструктуризация генома во временных рамках экспрессии генов нейронов, индуцированной активностью» . Природа Нейронауки . 23 (6): 707–717. дои : 10.1038/s41593-020-0634-6 . ПМЦ 7558717 . ПМИД 32451484 .
- ^ Верхёль Т.С., ван Хейфте Л., Перенталер Э., Баракат Т.С. (2020). «Почему YY1: механизмы регуляции транскрипции Инь Ян 1» . Границы клеточной биологии и биологии развития . 8 : 592164. дои : 10.3389/fcell.2020.592164 . ПМЦ 7554316 . ПМИД 33102493 .
- ^ Шпиц Ф, Ферлонг Э.Э. (сентябрь 2012 г.). «Факторы транскрипции: от связывания энхансера к контролю развития». Обзоры природы. Генетика . 13 (9): 613–26. дои : 10.1038/nrg3207 . ПМИД 22868264 . S2CID 205485256 .
- ^ Jump up to: а б Шенфельдер С., Фрейзер П. (август 2019 г.). «Дальние контакты энхансер-промотор в контроле экспрессии генов». Обзоры природы. Генетика . 20 (8): 437–455. дои : 10.1038/s41576-019-0128-0 . ПМИД 31086298 . S2CID 152283312 .
- ^ Вайнтрауб А.С., Ли CH, Замудио А.В., Сигова А.А., Ханнетт Н.М., Дэй Д.С. и др. (декабрь 2017 г.). «YY1 является структурным регулятором петель энхансер-промотор» . Клетка . 171 (7): 1573–1588.e28. дои : 10.1016/j.cell.2017.11.008 . ПМЦ 5785279 . ПМИД 29224777 .
- ^ Ламберт С.А., Джолма А., Кампителли Л.Ф., Дас П.К., Инь Ю., Альбу М. и др. (февраль 2018 г.). «Факторы транскрипции человека» . Клетка . 172 (4): 650–665. дои : 10.1016/j.cell.2018.01.029 . ПМИД 29425488 .
- ^ Jump up to: а б Гроссман С.Р., Энгрейтц Дж., Рэй Дж.П., Нгуен Т.Х., Хакоэн Н., Ландер Э.С. (июль 2018 г.). «Позиционная специфичность различных классов транскрипционных факторов в энхансерах» . Труды Национальной академии наук Соединенных Штатов Америки . 115 (30): Е7222–Е7230. дои : 10.1073/pnas.1804663115 . ПМК 6065035 . ПМИД 29987030 .
- ^ Jump up to: а б Аллен Б.Л., Taatjes DJ (март 2015 г.). «Медиаторный комплекс: центральный интегратор транскрипции» . Обзоры природы. Молекулярно-клеточная биология . 16 (3): 155–66. дои : 10.1038/nrm3951 . ПМЦ 4963239 . ПМИД 25693131 .
- ^ Михайличенко О., Бондаренко В., Харнетт Д., Шор И.Е., Малес М., Виалес Р.Р., Ферлонг Э.Э. (январь 2018 г.). «Степень активности энхансера или промотора отражается уровнями и направленностью транскрипции эРНК» . Гены и развитие . 32 (1): 42–57. дои : 10.1101/gad.308619.117 . ПМЦ 5828394 . ПМИД 29378788 .
- ^ Ли QJ, Ян Ш., Маэда Ю., Сладек Ф.М., Шаррокс А.Д., Мартинс-Грин М. (январь 2003 г.). «Зависимая от фосфорилирования MAP-киназы активация Elk-1 приводит к активации коактиватора p300» . Журнал ЭМБО . 22 (2): 281–91. дои : 10.1093/emboj/cdg028 . ПМК 140103 . ПМИД 12514134 .
- ^ Карулло Н.В., Филлипс III Р.А., Саймон Р.К., Сото С.А., Хиндс Дж.Э., Солсбери А.Дж. и др. (сентябрь 2020 г.). «Энхансерные РНК предсказывают регуляторные связи между энхансером и геном и имеют решающее значение для функции энхансера в нейрональных системах» . Исследования нуклеиновых кислот . 48 (17): 9550–9570. дои : 10.1093/nar/gkaa671 . ПМЦ 7515708 . ПМИД 32810208 .
- ^ Левквист С., Додд И.Б., Снеппен К., Хаертер Дж.О. (июнь 2016 г.). «Метилирование ДНК в эпигеномах человека зависит от локальной топологии сайтов CpG» . Исследования нуклеиновых кислот . 44 (11): 5123–32. дои : 10.1093/нар/gkw124 . ПМЦ 4914085 . ПМИД 26932361 .
- ^ Джаббари К., Бернарди Дж. (май 2004 г.). «Метилирование цитозина и частоты CpG, TpG (CpA) и TpA». Джин . 333 : 143–9. дои : 10.1016/j.gene.2004.02.043 . ПМИД 15177689 .
- ^ Штайнхаус Р., Гонсалес Т., Зелов Д., Робинсон П.Н. (июнь 2020 г.). «Первазивные и CpG-зависимые промотороподобные характеристики транскрибируемых энхансеров» . Исследования нуклеиновых кислот . 48 (10): 5306–5317. дои : 10.1093/nar/gkaa223 . ПМЦ 7261191 . ПМИД 32338759 .
- ^ Птица А (январь 2002 г.). «Схемы метилирования ДНК и эпигенетическая память» . Гены и развитие . 16 (1): 6–21. дои : 10.1101/gad.947102 . ПМИД 11782440 .
- ^ Jump up to: а б с Ду Кью, Луу П.Л., Стирзакер С., Кларк С.Дж. (2015). «Белки метил-CpG-связывающего домена: читатели эпигенома» . Эпигеномика . 7 (6): 1051–73. дои : 10.2217/эпи.15.39 . ПМИД 25927341 .
- ^ Вакерисас Дж.М., Куммерфельд С.К., Тейхманн С.А., Ласкомб Н.М. (апрель 2009 г.). «Перепись факторов транскрипции человека: функции, экспрессия и эволюция». Обзоры природы. Генетика . 10 (4): 252–63. дои : 10.1038/nrg2538 . ПМИД 19274049 . S2CID 3207586 .
- ^ Jump up to: а б с д Сунь З, Сюй Х, Хэ Дж, Мюррей А, Сунь М.А., Вэй Икс и др. (август 2019 г.). «EGR1 привлекает TET1 для формирования метилома мозга во время развития и при активности нейронов» . Природные коммуникации . 10 (1): 3892. Бибкод : 2019NatCo..10.3892S . дои : 10.1038/s41467-019-11905-3 . ПМЦ 6715719 . ПМИД 31467272 .
- ^ Jump up to: а б Кубосаки А., Томару Ю., Тагами М., Арнер Э., Миура Х., Сузуки Т. и др. (2009). «Полногеномное исследование сайтов связывания EGR-1 in vivo при моноцитарной дифференцировке» . Геномная биология . 10 (4): Р41. дои : 10.1186/gb-2009-10-4-r41 . ПМЦ 2688932 . ПМИД 19374776 .
- ^ Деллино Дж.И., Паллуцци Ф., Кьяриелло А.М., Пиччиони Р., Бьянко С., Фурия Л. и др. (июнь 2019 г.). «Высвобождение приостановленной РНК-полимеразы II в определенных локусах способствует образованию двухцепочечных разрывов ДНК и способствует транслокации рака» . Природная генетика . 51 (6): 1011–1023. дои : 10.1038/s41588-019-0421-z . ПМИД 31110352 . S2CID 159041612 .
- ^ Сингх С., Шлахта К., Манукян А., Раймер Х.М., Динда М., Бекиранов С., Ван Й.Х. (март 2020 г.). «Участки паузы РНК-полимеразы II на активно транскрибируемых генах обогащены двухцепочечными разрывами ДНК» . J Биол Хим . 295 (12): 3990–4000. дои : 10.1074/jbc.RA119.011665 . ПМК 7086017 . ПМИД 32029477 .
- ^ Jump up to: а б с Мадабхуши Р., Гао Ф., Пфеннинг А.Р., Пан Л., Ямакава С., Со Дж. и др. (июнь 2015 г.). «Вызванные активностью разрывы ДНК регулируют экспрессию нейрональных генов раннего ответа» . Клетка . 161 (7): 1592–605. дои : 10.1016/j.cell.2015.05.032 . ПМЦ 4886855 . ПМИД 26052046 .
- ^ Стотт РТ, Крицкий О, Цай ЛХ (2021). «Профилирование сайтов разрывов ДНК и транскрипционных изменений в ответ на контекстуальное обучение страху» . ПЛОС ОДИН . 16 (7): e0249691. Бибкод : 2021PLoSO..1649691S . дои : 10.1371/journal.pone.0249691 . ПМЦ 8248687 . ПМИД 34197463 .
- ^ Jump up to: а б Джу Б.Г., Луняк В.В., Перисси В., Гарсиа-Бассетс И., Роуз Д.В., Гласс С.К., Розенфельд М.Г. (июнь 2006 г.). «Разрыв дцДНК, опосредованный топоизомеразой IIbeta, необходимый для регулируемой транскрипции». Наука . 312 (5781): 1798–802. Бибкод : 2006Sci...312.1798J . дои : 10.1126/science.1127196 . ПМИД 16794079 . S2CID 206508330 .
- ^ Jump up to: а б с Пук Дж., Козбиал П., Ли В., Тан Ю., Лю З., Сутер Т. и др. (январь 2015 г.). «Активация лиганд-зависимого энхансера, регулируемая активностью топоизомеразы-I» . Клетка . 160 (3): 367–80. дои : 10.1016/j.cell.2014.12.023 . ПМЦ 4422651 . ПМИД 25619691 .
- ^ Степанова М, Тяжелова Т, Скоблов М, Баранова А (май 2005 г.). «Сравнительный анализ относительной встречаемости сайтов связывания транскрипционных факторов в геномах позвоночных и областях промоторов генов» . Биоинформатика . 21 (9): 1789–96. doi : 10.1093/биоинформатика/bti307 . ПМИД 15699025 .
- ^ Меллул Д., Маршак С., Сераси Э. (март 2002 г.). «Регуляция транскрипции гена инсулина» . Диабетология . 45 (3): 309–26. дои : 10.1007/s00125-001-0728-y . ПМИД 11914736 .
- ^ Чан В.Г., Ким Э.Дж., Пак К.Г., Пак Ю.Б., Чой Х.С., Ким Х.Дж. и др. (январь 2007 г.). «Опосредованная глюкокортикоидными рецепторами репрессия экспрессии гена инсулина человека регулируется PGC-1альфа». Связь с биохимическими и биофизическими исследованиями . 352 (3): 716–21. дои : 10.1016/j.bbrc.2006.11.074 . ПМИД 17150186 .