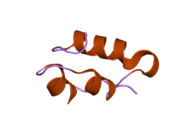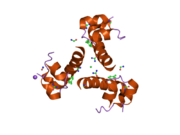Инсулин
| ИНС | ||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | INS , IDDM, IDDM1, IDDM2, ILPR, IRDN, MODY10, инсулин, PNDM4 | |||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | Опустить : 176730 ; МГИ : 96573 ; Гомологен : 173 ; Генные карты : INS ; ОМА : INS – ортологи | |||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | ||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||

Инсулин ( / ˈ ɪ n . sj ʊ . l ɪ n / , [ 5 ] [ 6 ] от латинского insula , «остров») — пептидный гормон, вырабатываемый бета-клетками островков поджелудочной железы, инсулина ( INS) кодируемый у человека геном . Это основной анаболический гормон организма. [ 7 ] Он регулирует метаболизм углеводов ткани , жиров и белков , способствуя всасыванию глюкозы из крови в клетки печени , жировой и скелетных мышц . [ 8 ] В этих тканях поглощенная глюкоза превращается либо в гликоген посредством гликогенеза , либо в жиры ( триглицериды ) посредством липогенеза ; в печени глюкоза превращается в оба. [ 8 ] глюкозы Производство и секреция печенью сильно подавляются высокими концентрациями инсулина в крови. [ 9 ] Циркулирующий инсулин также влияет на синтез белков в самых разных тканях. Таким образом, это анаболический гормон, способствующий превращению малых молекул в крови в большие молекулы в клетках. Низкий уровень инсулина в крови имеет противоположный эффект, способствуя повсеместному катаболизму , особенно резервного жира в организме .
Бета-клетки чувствительны к уровню сахара в крови, поэтому они секретируют инсулин в кровь в ответ на высокий уровень глюкозы и подавляют секрецию инсулина, когда уровень глюкозы низкий. [ 10 ] Производство инсулина также регулируется глюкозой: высокий уровень глюкозы способствует выработке инсулина, тогда как низкий уровень глюкозы приводит к снижению выработки. [ 11 ] Инсулин усиливает поглощение и метаболизм глюкозы в клетках, тем самым снижая уровень сахара в крови. Соседние с ними альфа-клетки , следуя сигналам бета-клеток, [ 10 ] секретируют глюкагон в кровь противоположным образом: секреция увеличивается при низком уровне глюкозы в крови и снижается секреция при высоких концентрациях глюкозы. Глюкагон повышает уровень глюкозы в крови, стимулируя гликогенолиз и глюконеогенез в печени. [ 8 ] [ 10 ] Секреция инсулина и глюкагона в кровь в ответ на концентрацию глюкозы в крови является основным механизмом гомеостаза глюкозы . [ 10 ]
Снижение или отсутствие активности инсулина приводит к диабету – состоянию высокого уровня сахара в крови ( гипергликемии ). Существует два типа заболевания. При диабете 1 типа бета-клетки разрушаются в результате аутоиммунной реакции , поэтому инсулин больше не может синтезироваться или секретироваться в кровь. [ 12 ] При диабете 2 типа разрушение бета-клеток менее выражено, чем при 1 типе, и не обусловлено аутоиммунным процессом. происходит накопление амилоида , что, вероятно, нарушает их анатомию и физиологию. Вместо этого в островках поджелудочной железы [ 10 ] Патогенез снижение популяции островковых бета-клеток, снижение секреторной функции островковых диабета 2 типа недостаточно изучен, но бета-клеток, которые выживают, и резистентность периферических тканей к инсулину . известно, что в этом участвуют [ 7 ] Диабет 2 типа характеризуется повышенной секрецией глюкагона, которая не зависит от концентрации глюкозы в крови и не реагирует на нее. Но инсулин по-прежнему выделяется в кровь в ответ на уровень глюкозы в крови. [ 10 ] В результате в крови накапливается глюкоза.
Белок инсулина человека состоит из 51 аминокислоты и имеет молекулярную массу 5808 Да . Это гетеродимер А -цепи и В-цепи, соединенных между собой дисульфидными связями . Структура инсулина незначительно различается у разных видов животных. инсулин из животных источников, не являющихся человеческими, несколько отличается по эффективности (влиянию на углеводный обмен Из-за этих различий ) от человеческого инсулина. Свиной инсулин особенно близок к человеческому варианту и широко использовался для лечения диабетиков 1 типа до того, как человеческий инсулин можно было производить в больших количествах с помощью технологий рекомбинантной ДНК . [ 13 ] [ 14 ] [ 15 ] [ 16 ]
Инсулин был первым открытым пептидным гормоном. [ 17 ] Фредерик Бантинг и Чарльз Бест , работавшие в лаборатории Джона Маклауда в Университете Торонто , были первыми, кто выделил инсулин из поджелудочной железы собаки в 1921 году. Фредерик Сэнгер секвенировал структуру аминокислот в 1951 году, что сделало инсулин первым белком, полностью секвенированный. [ 18 ] Кристаллическая структура инсулина в твердом состоянии была определена Дороти Ходжкин в 1969 году. Инсулин также является первым белком, который был химически синтезирован и произведен с помощью технологии рекомбинантной ДНК . [ 19 ] Он включен в Примерный список основных лекарственных средств ВОЗ – наиболее важных лекарств, необходимых в базовой системе здравоохранения . [ 20 ]
Эволюция и распространение видов
[ редактировать ]Инсулин, возможно, появился более миллиарда лет назад. [ 21 ] Молекулярное происхождение инсулина восходит, по крайней мере, к простейшим одноклеточным эукариотам . [ 22 ] Известно, что помимо животных инсулиноподобные белки существуют у грибов и простейших . [ 21 ]
Инсулин вырабатывается бета-клетками островков поджелудочной железы у большинства позвоночных и тельцами Брокмана у некоторых костистых рыб . [ 23 ] Конусные улитки : Conus geographus и Conus tulipa , ядовитые морские улитки, охотящиеся на мелкую рыбу, используют модифицированные формы инсулина в своих ядовитых коктейлях. Инсулиновый токсин, по структуре более близкий к инсулину рыб, чем к нативному инсулину улиток, замедляет добычу рыб, снижая уровень глюкозы в их крови. [ 24 ] [ 25 ]
Производство
[ редактировать ]
Инсулин вырабатывается исключительно в бета-клетках островков поджелудочной железы у млекопитающих и в тельце Брокмана у некоторых рыб. Человеческий инсулин вырабатывается из INS гена , расположенного на хромосоме 11. [ 26 ] У грызунов есть два функциональных гена инсулина; один является гомологом большинства генов млекопитающих ( Ins2 ), а другой представляет собой ретропозированную копию, которая включает последовательность промотора, но лишена интрона ( Ins1 ). [ 27 ] Транскрипция гена инсулина увеличивается в ответ на повышение уровня глюкозы в крови. [ 28 ] Это в первую очередь контролируется факторами транскрипции , которые связывают энхансерные последовательности в ~ 400 парах оснований перед сайтом начала транскрипции гена. [ 26 ] [ 28 ]
Основными факторами транскрипции, влияющими на секрецию инсулина, являются PDX1 , NeuroD1 и MafA . [ 29 ] [ 30 ] [ 31 ] [ 32 ]
Во время состояния с низким содержанием глюкозы PDX1 (гомеобоксный белок 1 поджелудочной железы и двенадцатиперстной кишки) располагается на ядерной периферии в результате взаимодействия с HDAC1 и 2 . [ 33 ] что приводит к снижению секреции инсулина. [ 34 ] Увеличение уровня глюкозы крови вызывает фосфорилирование PDX1 в , что приводит к его ядерной транслокации и связыванию элемента A3 в промоторе инсулина. [ 35 ] При транслокации он взаимодействует с коактиваторами HAT p300 и SETD7 . PDX1 влияет на модификации гистонов посредством ацетилирования и деацетилирования, а также метилирования . Также говорят, что он подавляет глюкагон . [ 36 ]
NeuroD1 , также известный как β2, регулирует экзоцитоз инсулина в β-клетках поджелудочной железы , напрямую индуцируя экспрессию генов, участвующих в экзоцитозе. [ 37 ] Он локализован в цитозоле в ответ на высокий глюкозы гликозилируется , но OGT , что вызывает транслокацию и/или фосфорилируется ERK уровень в ядро. В ядре β2 гетеродимеризуется с E47 , связывается с элементом E1 инсулинового промотора и привлекает коактиватор p300 , который ацетилирует β2. Он способен взаимодействовать с другими факторами транскрипции, а также при активации гена инсулина. [ 37 ]
MafA разлагается протеасомами при низком уровне глюкозы в крови . Повышенный уровень глюкозы делает неизвестный белок гликозилированным . действует как фактор транскрипции MafA Этот белок неизвестным образом , и MafA транспортируется из клетки. Затем MafA транслоцируется обратно в ядро, где связывается с элементом C1 промотора инсулина. [ 38 ] [ 39 ]
Эти факторы транскрипции работают синергически и в сложной схеме. Повышенный уровень глюкозы в крови может через некоторое время разрушить связывающую способность этих белков и, следовательно, снизить количество секретируемого инсулина, вызывая диабет . Снижение связывающей активности может быть опосредовано глюкозой вызванным окислительным стрессом, , и считается, что антиоксиданты предотвращают снижение секреции инсулина в глюкотоксичных β-клетках поджелудочной железы . Молекулы, передающие сигнал о стрессе, и активные формы кислорода ингибируют ген инсулина, мешая кофакторам, связывающим факторы транскрипции, и самим факторам транскрипции. [ 40 ]
Несколько регуляторных последовательностей в промоторной области гена инсулина человека связываются с факторами транскрипции . В общем, A-боксы связываются с факторами Pdx1 , E-боксы связываются с NeuroD , C-боксы связываются с MafA , а элементы ответа цАМФ с CREB . Существуют также сайленсеры , подавляющие транскрипцию.
Синтез
[ редактировать ]
Инсулин синтезируется в виде неактивной молекулы-предшественника, белка длиной в 110 аминокислот, называемого «препроинсулин». Препроинсулин транслируется непосредственно в шероховатый эндоплазматический ретикулум (RER), где его сигнальный пептид удаляется сигнальной пептидазой с образованием «проинсулина». [ 26 ] Когда проинсулин складывается , противоположные концы белка, называемые «А-цепью» и «В-цепью», соединяются вместе тремя дисульфидными связями . [ 26 ] Свернутый проинсулин затем проходит через аппарат Гольджи и упаковывается в специализированные секреторные пузырьки . [ 26 ] В грануле проинсулин расщепляется пропротеинконвертазой 1/3 и пропротеинконвертазой 2 , удаляя среднюю часть белка, называемую « С-пептидом ». [ 26 ] Наконец, карбоксипептидаза Е удаляет две пары аминокислот с концов белка, в результате чего образуется активный инсулин – А- и В-цепи инсулина, теперь соединенные двумя дисульфидными связями. [ 26 ]
Полученный зрелый инсулин упаковывается внутри зрелых гранул в ожидании метаболических сигналов (таких как лейцин, аргинин, глюкоза и манноза) и стимуляции блуждающего нерва для экзоцитоза из клетки в кровоток. [ 41 ]
Было показано, что инсулин и родственные ему белки производятся внутри мозга, а снижение уровня этих белков связано с болезнью Альцгеймера. [ 42 ] [ 43 ] [ 44 ]
Высвобождение инсулина также стимулируется стимуляцией рецептора бета-2 и ингибируется стимуляцией рецептора альфа-1. Кроме того, кортизол, глюкагон и гормон роста противодействуют действию инсулина во время стресса. Инсулин также ингибирует высвобождение жирных кислот гормон-чувствительной липазой в жировой ткани. [ 8 ]
Структура
[ редактировать ]
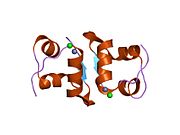
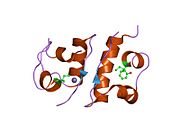
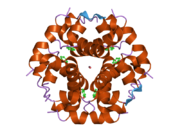
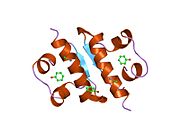
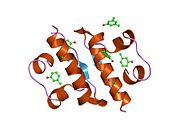
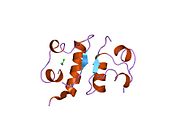
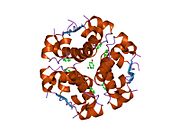
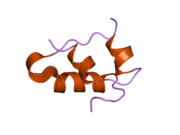
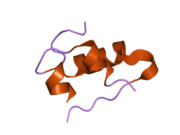
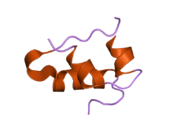
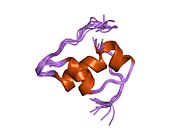
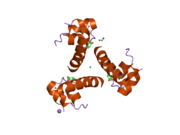
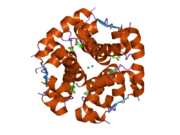
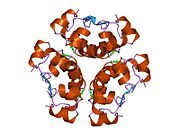
Вопреки первоначальному убеждению в том, что гормоны, как правило, будут небольшими химическими молекулами, поскольку первый пептидный гормон, известный о его структуре, было обнаружено, что инсулин довольно большой. [ 17 ] Один белок (мономер) инсулина человека состоит из 51 аминокислот и имеет молекулярную массу 5808 Да . Молекулярная формула человеческого инсулина составляет C 257 H 383 N 65 O 77 S 6 . [ 45 ] Это комбинация двух пептидных цепей ( димеров ), называемых А-цепью и В-цепью, которые соединены между собой двумя дисульфидными связями . А-цепь состоит из 21 аминокислоты, а В-цепь — из 30 остатков. Связывающие (межцепочечные) дисульфидные связи образуются по остаткам цистеина между положениями А7-В7 и А20-В19. Внутри А-цепи между остатками цистеина в положениях А6 и А11 имеется дополнительная (внутрицепочечная) дисульфидная связь. А-цепь имеет две α-спиральные области А1-А8 и А12-А19, которые антипараллельны; в то время как B-цепь имеет центральную α-спираль (покрывающую остатки B9-B19), фланкированную дисульфидной связью с обеих сторон, и два β-листа (покрывающие B7-B10 и B20-B23). [ 17 ] [ 46 ]
Аминокислотная последовательность инсулина строго консервативна и лишь незначительно различается между видами. Бычий инсулин отличается от человеческого всего тремя аминокислотными остатками, а свиной – одним. Даже инсулин некоторых видов рыб достаточно похож на человеческий, чтобы быть клинически эффективным у людей. Инсулин у некоторых беспозвоночных по последовательности очень похож на человеческий инсулин и оказывает сходное физиологическое действие. Сильная гомология, наблюдаемая в последовательности инсулина у различных видов, позволяет предположить, что она сохранялась на протяжении большей части истории эволюции животных. C-пептид проинсулина Однако гораздо сильнее различается у разных видов; это тоже гормон, но вторичный. [ 46 ]
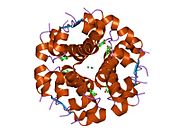
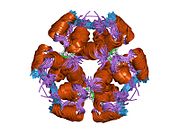
Инсулин вырабатывается и хранится в организме в виде гексамера (единица из шести молекул инсулина), при этом активной формой является мономер. Размер гексамера составляет около 36000 Да. Шесть молекул связаны вместе как три димерные единицы, образуя симметричную молекулу. Важной особенностью является наличие атомов цинка (Zn 2+ ) на оси симметрии, которые окружены тремя молекулами воды и тремя остатками гистидина в положении В10. [ 17 ] [ 46 ]
Гексамер представляет собой неактивную форму с долгосрочной стабильностью, которая позволяет защитить высокореактивный инсулин, но при этом легкодоступна. Преобразование гексамер-мономер является одним из центральных аспектов составов инсулина для инъекций. Гексамер гораздо более стабилен, чем мономер, что желательно по практическим соображениям; однако мономер является гораздо более быстро реагирующим препаратом, поскольку скорость диффузии обратно пропорциональна размеру частиц. Быстродействующий препарат означает, что инъекции инсулина не должны предшествовать приему пищи на несколько часов, что, в свою очередь, дает людям с диабетом большую гибкость в их ежедневном графике. [ 47 ] Инсулин может агрегировать и образовывать фибриллярные встречно-пальцевые бета-листы . Это может вызвать инъекционный амилоидоз и предотвратить хранение инсулина в течение длительного времени. [ 48 ]
Функция
[ редактировать ]Секреция
[ редактировать ]Бета-клетки островков Лангерганса выделяют инсулин в две фазы. Первая фаза высвобождения быстро запускается в ответ на повышение уровня глюкозы в крови и длится около 10 минут. Вторая фаза представляет собой устойчивое, медленное высвобождение вновь образованных везикул, запускаемое независимо от сахара, достигающее пика через 2–3 часа. Две фазы высвобождения инсулина предполагают, что гранулы инсулина присутствуют в различных заявленных популяциях или «пулах». Во время первой фазы экзоцитоза инсулина большая часть гранул, предрасполагающих к экзоцитозу, высвобождается после интернализации кальция. Этот пул известен как готовый к выпуску пул (RRP). Гранулы RRP составляют 0,3-0,7% от общей популяции инсулинсодержащих гранул и находятся непосредственно рядом с плазматической мембраной. Во время второй фазы экзоцитоза гранулы инсулина требуют мобилизации гранул на плазматической мембране и предыдущего препарата для их высвобождения. [ 49 ] Таким образом, вторая фаза высвобождения инсулина определяется скоростью, с которой гранулы готовятся к высвобождению. Этот пул известен как резервный пул (RP). RP высвобождается медленнее, чем RRP (RRP: 18 гранул/мин; RP: 6 гранул/мин). [ 50 ] Снижение высвобождения инсулина первой фазы может быть самым ранним обнаруживаемым дефектом бета-клеток, предсказывающим начало диабета 2 типа . [ 51 ] Первая фаза высвобождения и чувствительность к инсулину являются независимыми предикторами диабета. [ 52 ]
Описание выпуска первой фазы выглядит следующим образом:
- Глюкоза поступает в β-клетки через глюкозы транспортеры GLUT2 . При низком уровне сахара в крови в β-клетки поступает мало глюкозы; при высоких концентрациях глюкозы в крови в эти клетки поступает большое количество глюкозы. [ 53 ]
- Глюкоза, поступающая в β-клетку, фосфорилируется до глюкозо-6-фосфата (G-6-P) под действием глюкокиназы ( гексокиназы IV ), которая не ингибируется G-6-P так, как это происходит с гексокиназой в других тканях (гексокиназа IV). I – III) подвержены влиянию этого продукта. Это означает, что внутриклеточная концентрация G-6-P остается пропорциональной концентрации сахара в крови. [ 10 ] [ 53 ]
- Глюкозо-6-фосфат вступает в гликолитический путь , а затем через реакцию пируватдегидрогеназы в цикл Кребса (субстрата цикла Кребса) образуется множество высокоэнергетических молекул АТФ , где в результате окисления ацетил-КоА , что приводит к увеличению соотношение АТФ:АДФ внутри клетки. [ 54 ]
- Повышенное внутриклеточное соотношение АТФ:АДФ закрывает АТФ-чувствительный SUR1/ Kir6.2 калиевый канал (см. рецептор сульфонилмочевины ). Это предотвращает ионы калия (K + ) от выхода из клетки путем облегченной диффузии, что приводит к накоплению внутриклеточных ионов калия. В результате внутренняя часть клетки становится менее отрицательной по отношению к внешней, что приводит к деполяризации поверхностной мембраны клетки.
- При деполяризации потенциалзависимый ион кальция (Ca 2+ ) каналы открываются, позволяя ионам кальция проникать в клетку путем облегченной диффузии.
- Цитозольная концентрация ионов кальция также может быть увеличена за счет высвобождения кальция из внутриклеточных запасов посредством активации рианодиновых рецепторов. [ 55 ]
- Концентрация ионов кальция в цитозоле бета-клеток может также или дополнительно повышаться за счет активации фосфолипазы С в результате связывания внеклеточного лиганда (гормона или нейротрансмиттера) с мембранным рецептором, связанным с G-белком . Фосфолипаза С расщепляет мембранный фосфолипид, фосфатидилинозитол-4,5-бисфосфат , на инозитол-1,4,5-трифосфат и диацилглицерин . Инозитол-1,4,5-трифосфат (IP3) затем связывается с рецепторными белками плазматической мембраны эндоплазматического ретикулума (ЭР). Это позволяет высвободить Ca 2+ ионы из ЭР через IP3-зависимые каналы, что повышает цитозольную концентрацию ионов кальция независимо от влияния высокой концентрации глюкозы в крови. По этому пути действует парасимпатическая стимуляция островков поджелудочной железы, увеличивая секрецию инсулина в кровь. [ 56 ]
- Значительно увеличенное количество ионов кальция в цитоплазме клеток вызывает выброс в кровь ранее синтезированного инсулина, запасенного во внутриклеточных секреторных везикулах .
Это основной механизм высвобождения инсулина. Другие вещества, которые, как известно, стимулируют высвобождение инсулина, включают аминокислоты аргинин и лейцин, парасимпатическое высвобождение ацетилхолина ( действующее через путь фосфолипазы C), сульфонилмочевину , холецистокинин (CCK, также через фосфолипазу C), [ 57 ] и инкретины желудочно-кишечного происхождения , такие как глюкагоноподобный пептид-1 (GLP-1) и глюкозозависимый инсулинотропный пептид (GIP).
Высвобождение инсулина сильно ингибируется норадреналином (норадреналином), что приводит к повышению уровня глюкозы в крови во время стресса. Похоже, что высвобождение катехоламинов симпатической нервной системой оказывает противоречивое влияние на высвобождение инсулина бета-клетками, поскольку высвобождение инсулина ингибируется α 2 -адренергическими рецепторами. [ 58 ] и стимулируется β 2 -адренергическими рецепторами. [ 59 ] Конечным эффектом норадреналина симпатических нервов и адреналина надпочечников на высвобождение инсулина является ингибирование из-за доминирования α-адренергических рецепторов. [ 60 ]
Когда уровень глюкозы снижается до обычного физиологического значения, высвобождение инсулина из β-клеток замедляется или прекращается. Если уровень глюкозы в крови падает ниже этого значения, особенно до опасно низкого уровня, высвобождение гипергликемических гормонов (чаще всего глюкагона из островков альфа-клеток Лангерганса) вызывает высвобождение глюкозы в кровь из запасов гликогена в печени, что дополняется глюконеогенезом , если гликоген магазины опустошаются. Повышая уровень глюкозы в крови, гипергликемические гормоны предотвращают или корректируют опасную для жизни гипогликемию.
Признаки нарушения высвобождения инсулина первой фазы можно увидеть в тесте на толерантность к глюкозе , который демонстрируется существенно повышенным уровнем глюкозы в крови через 30 минут после приема дозы глюкозы (75 или 100 г глюкозы), за которой следует медленное снижение уровня глюкозы в крови. следующие 100 минут, чтобы оставаться выше 120 мг/100 мл через два часа после начала теста. У нормального человека уровень глюкозы в крови корректируется (и может быть даже несколько завышен) к концу теста. Всплеск инсулина является «первой реакцией» на повышение уровня глюкозы в крови. Эта реакция индивидуальна и зависит от дозы, хотя ранее всегда считалось, что она зависит только от типа пищи.
Колебания
[ редактировать ]
Даже во время пищеварения, как правило, через один-два часа после еды, высвобождение инсулина из поджелудочной железы не является непрерывным, а с периодом 3–6 минут, изменяясь от генерации концентрации инсулина в крови более примерно 800 пмоль колеблется /л. до менее 100 пмоль/л (у крыс). [ 61 ] Считается, что это позволяет избежать подавления рецепторов инсулина в клетках-мишенях и помогает печени экстрагировать инсулин из крови. [ 61 ] Это колебание важно учитывать при введении инсулинстимулирующих препаратов, поскольку в идеале должна достигаться колеблющаяся концентрация высвобождения инсулина в крови, а не постоянная высокая концентрация. [ 61 ] Этого можно достичь путем ритмической доставки инсулина в воротную вену , путем доставки, активируемой светом, или путем трансплантации островковых клеток в печень. [ 61 ] [ 62 ] [ 63 ]
Уровень инсулина в крови
[ редактировать ]
Уровень инсулина в крови можно измерять в международных единицах , таких как мкМЕ/мл, или в молярной концентрации , например в пмоль/л, где 1 мкМЕ/мл равен 6,945 пмоль/л. [ 64 ] Типичный уровень в крови между приемами пищи составляет 8–11 мкМЕ/мл (57–79 пмоль/л). [ 65 ]
Преобразование сигнала
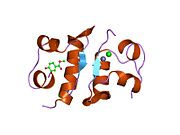
[ редактировать ]Эффекты инсулина инициируются его связыванием с рецептором инсулина (IR) , присутствующим в клеточной мембране. Молекула рецептора содержит субъединицы α- и β. Две молекулы соединяются, образуя так называемый гомодимер. Инсулин связывается с α-субъединицами гомодимера, обращенного к внеклеточной стороне клетки. Субъединицы β обладают ферментной активностью тирозинкиназы, которая запускается связыванием инсулина. Эта активность провоцирует аутофосфорилирование β-субъединиц, а затем фосфорилирование белков внутри клетки, известных как субстраты инсулиновых рецепторов (IRS). Фосфорилирование IRS активирует каскад сигнальной трансдукции, который приводит к активации других киназ, а также факторов транскрипции, которые опосредуют внутриклеточные эффекты инсулина. [ 66 ]
Каскад, приводящий к встраиванию транспортеров глюкозы GLUT4 в клеточные мембраны мышечных и жировых клеток, синтезу гликогена в печени и мышечной ткани, а также превращению глюкозы в триглицериды в печени, жировой ткани и кормящей молочной железе. ткань железы действует посредством активации IRS-1 киназы фосфоинозитол-3 ( PI3K ). Этот фермент превращает фосфолипид клеточной мембраны под названием фосфатидилинозитол-4,5-бисфосфат (PIP2) в фосфатидилинозитол-3,4,5-трифосфат (PIP3), который, в свою очередь, активирует протеинкиназу B (PKB). Активированная ПКБ облегчает слияние эндосом , содержащих GLUT4 , с клеточной мембраной, что приводит к увеличению количества транспортеров GLUT4 в плазматической мембране. [ 67 ] PKB также фосфорилирует киназу гликогенсинтазы (GSK), тем самым инактивируя этот фермент. [ 68 ] Это означает, что ее субстрат, гликогенсинтаза (GS), не может фосфорилироваться и остается дефосфорилированным и, следовательно, активным. Активный фермент гликогенсинтаза (GS) катализирует лимитирующую стадию синтеза гликогена из глюкозы. Подобные дефосфорилирования влияют на ферменты, контролирующие скорость гликолиза , приводящего к синтезу жиров посредством малонил-КоА в тканях, способных генерировать триглицериды , а также на ферменты, контролирующие скорость глюконеогенеза в печени. Общий эффект этих окончательных дефосфорилирований ферментов заключается в том, что в тканях, которые могут осуществлять эти реакции, стимулируется синтез гликогена и жира из глюкозы, а производство глюкозы печенью посредством гликогенолиза и глюконеогенеза ингибируется. [ 69 ] Распад триглицеридов жировой тканью на свободные жирные кислоты и глицерин также ингибируется. [ 69 ]
После того, как внутриклеточный сигнал, возникший в результате связывания инсулина с его рецептором, был получен, необходимо прекращение передачи сигнала. Как упомянуто ниже в разделе о деградации, эндоцитоз и деградация рецептора, связанного с инсулином, являются основным механизмом прекращения передачи сигнала. [ 41 ] Кроме того, сигнальный путь также завершается дефосфорилированием остатков тирозина в различных сигнальных путях тирозинфосфатазами. Известно также, что серин/треониновые киназы снижают активность инсулина.
установлена структура комплекса инсулин- инсулиновый рецептор Методами рентгеновской кристаллографии . [ 70 ]
Физиологические эффекты
[ редактировать ]

Действия инсулина на глобальном уровне метаболизма человека включают:
- Увеличение потребления клетками определенных веществ, особенно глюкозы в мышечной и жировой ткани (около двух третей клеток организма). [ 71 ]
- Увеличение репликации ДНК и синтеза белка за счет контроля поглощения аминокислот.
- Модификация активности многочисленных ферментов .
К действиям инсулина (косвенному и прямому) на клетки относятся:
- Стимулирует усвоение глюкозы. Инсулин снижает концентрацию глюкозы в крови, вызывая поглощение глюкозы клетками. Это возможно, поскольку инсулин вызывает внедрение транспортера GLUT4 в клеточные мембраны мышечной и жировой ткани, что позволяет глюкозе проникать в клетку. [ 66 ]
- Увеличение синтеза жиров – инсулин заставляет жировые клетки поглощать глюкозу из крови, которая превращается в триглицериды ; снижение инсулина вызывает обратный эффект. [ 71 ]
- Повышенная этерификация жирных кислот – заставляет жировую ткань вырабатывать нейтральные жиры (т. е. триглицериды ) из жирных кислот; снижение инсулина вызывает обратный эффект. [ 71 ]
- Снижение липолиза – приводит к уменьшению превращения запасов липидов жировых клеток в жирные кислоты и глицерин крови; снижение инсулина вызывает обратный эффект. [ 71 ]
- Индуцированный синтез гликогена. Когда уровень глюкозы высок, инсулин индуцирует образование гликогена путем активации фермента гексокиназы, который добавляет фосфатную группу в глюкозу, в результате чего молекула не может выйти из клетки. В то же время инсулин ингибирует фермент глюкозо-6-фосфатазу, удаляющую фосфатную группу. Эти два фермента являются ключевыми для образования гликогена. Кроме того, инсулин активирует ферменты фосфофруктокиназу и гликогенсинтазу, которые отвечают за синтез гликогена. [ 72 ]
- Снижение глюконеогенеза и гликогенолиза – снижается продукция глюкозы из неуглеводных субстратов, прежде всего в печени (подавляющее большинство эндогенного инсулина, поступающего в печень, никогда не покидает печень); снижение инсулина вызывает выработку глюкозы печенью из различных субстратов. [ 71 ]
- Снижение протеолиза – уменьшение распада белка. [ 71 ]
- Снижение аутофагии – снижение уровня деградации поврежденных органелл. Постпрандиальные уровни полностью подавляют аутофагию. [ 73 ]
- Увеличение поглощения аминокислот – заставляет клетки поглощать циркулирующие аминокислоты; снижение инсулина тормозит всасывание. [ 71 ]
- Тонус артериальных мышц – заставляет мышцы артериальной стенки расслабляться, увеличивая кровоток, особенно в микроартериях; уменьшение инсулина уменьшает поток, позволяя этим мышцам сокращаться. [ 74 ]
- Увеличение секреции соляной кислоты париетальными клетками желудка. [ нужна ссылка ]
- Повышенное поглощение калия – заставляет клетки синтезировать гликоген (очень губчатое, «влажное» вещество, которое увеличивает содержание внутриклеточной воды и сопутствующего ей калия). + ионы ) [ 75 ] усваивать калий из внеклеточной жидкости; недостаток инсулина тормозит всасывание. Увеличение инсулином поглощения калия клетками снижает уровень калия в плазме крови. Возможно, это происходит посредством индуцированной инсулином транслокации Na . + /К + -АТФаза на поверхности клеток скелетных мышц. [ 76 ] [ 77 ]
- Снижение почечной экскреции натрия. [ 78 ]
- В гепатоцитах связывание инсулина резко приводит к активации протеинфосфатазы 2А (PP2A). [ нужна ссылка ] , который дефосфорилирует бифункциональный фермент фруктозобисфосфатазу-2 (PFKB1) , [ 79 ] активация активного центра фосфофруктокиназы-2 (PFK-2). ПФК-2 увеличивает выработку фруктозо-2,6-бисфосфата. Фруктозо-2,6-бисфосфат аллостерически активирует PFK-1 , что способствует гликолизу, а не глюконеогенезу. Повышенный гликолиз увеличивает образование малонил-КоА , молекулы, которая может быть задействована в липогенезе и которая аллостерически ингибирует карнитинпальмитоилтрансферазу I (CPT1) , митохондриальный фермент, необходимый для перемещения жирных кислот в межмембранное пространство митохондрий для получения жирных кислот. метаболизм. [ 80 ]
Инсулин также влияет на другие функции организма, такие как эластичность сосудов и когнитивные функции . Когда инсулин попадает в мозг человека, он улучшает обучение и память, в частности, благотворно влияет на вербальную память. [ 81 ] Усиление передачи сигналов инсулина в головном мозге посредством интраназального введения инсулина также усиливает острую терморегуляторную и глюкорегуляционную реакцию на прием пищи, что позволяет предположить, что инсулин центральной нервной системы способствует координации широкого спектра гомеостатических или регуляторных процессов в организме человека. [ 82 ] Инсулин также оказывает стимулирующее действие на гонадотропин-рилизинг гормон , гипоталамуса тем самым способствуя фертильности . [ 83 ]
Деградация
[ редактировать ]Как только молекула инсулина прикрепится к рецептору и начнет действовать, она может быть высвобождена обратно во внеклеточную среду или же может быть разложена клеткой. Двумя основными местами клиренса инсулина являются печень и почки. [ 84 ] Расщепляется ферментом протеиндисульфидредуктазой (глутатион) . [ 85 ] который разрывает дисульфидные связи между цепями А и В. Печень выводит большую часть инсулина во время первого прохождения, тогда как почки выводят большую часть инсулина из системного кровообращения. Деградация обычно включает эндоцитоз комплекса инсулин-рецептор с последующим действием фермента, расщепляющего инсулин . По оценкам, молекула инсулина, вырабатываемая эндогенно бета-клетками, разлагается в течение примерно одного часа после ее первоначального высвобождения в кровообращение ( период полураспада инсулина ~ 4–6 минут). [ 86 ] [ 87 ]
Регулятор эндоканнабиноидного метаболизма
[ редактировать ]Инсулин является основным регулятором эндоканнабиноидов (ЭК) метаболизма , и было показано, что лечение инсулином снижает внутриклеточные ЭК, 2-арахидоноилглицерин (2-АГ) и анандамид (АЕА), что соответствует инсулиночувствительным изменениям экспрессии ферментов метаболизма ЭК. . В инсулинорезистентных адипоцитах паттерны инсулин-индуцированной экспрессии ферментов нарушаются таким образом, что это согласуется с повышенным синтезом ЭК и снижением деградации ЭК. Результаты показывают, что инсулинорезистентные адипоциты не способны регулировать метаболизм ЭК и снижают внутриклеточные уровни ЭК в ответ на стимуляцию инсулином, в результате чего страдающих ожирением, наблюдается повышенная концентрация ЭК. у людей с инсулинорезистентностью, [ 88 ] [ 89 ] Эта дисрегуляция способствует чрезмерному накоплению висцерального жира и снижению высвобождения адипонектина из брюшной жировой ткани, а также возникновению нескольких кардиометаболических факторов риска, которые связаны с ожирением и диабетом 2 типа . [ 90 ]
Гипогликемия
[ редактировать ]Гипогликемия , также известная как «низкий уровень сахара в крови», — это когда уровень сахара в крови снижается ниже нормального уровня. [ 91 ] Это может привести к различным симптомам , включая неуклюжесть, проблемы с речью, спутанность сознания, потерю сознания , судороги или смерть. [ 91 ] Также могут присутствовать чувство голода, потливость, дрожь и слабость. [ 91 ] Симптомы обычно появляются быстро. [ 91 ]
Наиболее распространенной причиной гипогликемии являются лекарства, используемые для лечения диабета, такие как инсулин и производные сульфонилмочевины . [ 92 ] [ 93 ] Риск выше у диабетиков, которые едят меньше, чем обычно, занимаются спортом больше, чем обычно, или употребляют алкоголь . [ 91 ] Другие причины гипогликемии включают почечную недостаточность , некоторые опухоли , такие как инсулинома , заболевания печени , гипотиреоз , голодание , врожденные нарушения обмена веществ , тяжелые инфекции , реактивную гипогликемию и ряд лекарств, включая алкоголь. [ 91 ] [ 93 ] Низкий уровень сахара в крови может наблюдаться у здоровых детей, которые не ели в течение нескольких часов. [ 94 ]
Болезни и синдромы
[ редактировать ]Существует несколько состояний, при которых нарушение инсулина является патологичным:
- Диабет – общий термин, обозначающий все состояния, характеризующиеся гипергликемией. Он может быть следующих видов: [ 95 ]
- Сахарный диабет 1 типа – аутоиммунное разрушение β-клеток поджелудочной железы, продуцирующих инсулин, что приводит к абсолютному дефициту инсулина.
- Диабет 2 типа – либо неадекватная выработка инсулина β-клетками, либо резистентность к инсулину , либо и то, и другое по не до конца понятным причинам.
- Существует корреляция с диетой , малоподвижным образом жизни, ожирением , возрастом и метаболическим синдромом . Причинно-следственная связь была продемонстрирована на нескольких модельных организмах, включая мышей и обезьян; Важно отметить, что люди, не страдающие ожирением, действительно заболевают диабетом 2 типа из-за диеты, малоподвижного образа жизни и неизвестных факторов риска, хотя это может и не быть причинно-следственной связью.
- вполне вероятно, что существует генетическая предрасположенность к развитию диабета 2 типа при определенных условиях окружающей среды.
- Другие виды нарушения толерантности к глюкозе (см. Диабет ).
- Инсулинома – опухоль из бета-клеток, продуцирующих избыток инсулина или реактивную гипогликемию . [ 96 ]
- Метаболический синдром – плохо изученное состояние, впервые названное Ривеном Джеральдом синдромом X. Неясно, имеет ли синдром единую поддающуюся лечению причину или является результатом изменений в организме, приводящих к диабету 2 типа. Он характеризуется повышенным артериальным давлением, дислипидемией (нарушения форм холестерина в крови и других липидов крови) и увеличением окружности талии (по крайней мере, в популяциях большей части развитого мира). Основной основной причиной может быть резистентность к инсулину, которая предшествует диабету 2 типа и представляет собой снижение способности к инсулиновому ответу в некоторых тканях (например, мышцах, жире). Часто такие заболевания, как эссенциальная гипертония , ожирение , диабет 2 типа и сердечно-сосудистые заболевания (ССЗ). развиваются [ 97 ]
- Синдром поликистозных яичников – сложный синдром у женщин репродуктивного возраста, при котором ановуляция и избыток андрогенов обычно проявляются в виде гирсутизма . Во многих случаях СПКЯ присутствует резистентность к инсулину. [ 98 ]
Медицинское использование
[ редактировать ]
Биосинтетический человеческий инсулин (рДНК инсулина человека, МНН) для клинического применения производится по технологии рекомбинантной ДНК . [ 13 ] Биосинтетический человеческий инсулин имеет повышенную чистоту по сравнению с экстрактивным животным инсулином, повышенная чистота снижает образование антител. Исследователям удалось внедрить ген человеческого инсулина в растения в качестве еще одного метода производства инсулина («биофарминг») в сафлоре . [ 99 ] Ожидается, что эта технология позволит снизить производственные затраты.
Доступно несколько аналогов человеческого инсулина. Эти аналоги инсулина тесно связаны со структурой человеческого инсулина и были разработаны для конкретных аспектов гликемического контроля с точки зрения быстрого действия (прандиальные инсулины) и длительного действия (базальные инсулины). [ 100 ] Был разработан первый биосинтетический аналог инсулина для клинического применения во время еды (прандиальный инсулин), Хумалог (инсулин лизпро), [ 101 ] он быстрее всасывается после подкожной инъекции, чем обычный инсулин, с эффектом через 15 минут после инъекции. Другими аналогами быстрого действия являются НовоРапид и Апидра со схожим профилем. [ 102 ] Все они быстро всасываются благодаря аминокислотным последовательностям, которые уменьшают образование димеров и гексамеров (мономерные инсулины всасываются быстрее). Инсулины быстрого действия не требуют интервала между инъекциями и приемом пищи, рекомендованного ранее для человеческого инсулина и инсулинов животных. Другой тип — инсулин длительного действия; первым из них был Лантус (инсулин гларгин). Они оказывают устойчивый эффект в течение длительного периода от 18 до 24 часов. Аналогично, другой аналог инсулина пролонгированного действия ( Левемир ) основан на подходе ацилирования жирных кислот. К этому аналогу присоединяется молекула миристиновой кислоты , которая связывает молекулу инсулина с обильным сывороточным альбумином, что, в свою очередь, продлевает эффект и снижает риск гипогликемии. Оба пролонгированных аналога необходимо принимать только один раз в день, и они используются у больных сахарным диабетом 1 типа в качестве базального инсулина. Также доступна комбинация инсулина быстрого и пролонгированного действия, что повышает вероятность достижения пациентами профиля инсулина, имитирующего профиль высвобождения собственного инсулина организмом. [ 103 ] [ 104 ] Инсулин также используется во многих клеточных линиях, таких как CHO-s, HEK 293 или Sf9, для производства моноклональных антител, вирусных вакцин и продуктов генной терапии. [ 105 ]
Инсулин обычно вводится подкожно с помощью одноразовых шприцев с иглами , с помощью инсулиновой помпы или с помощью инсулиновых шприц-ручек многократного использования с одноразовыми иглами. Ингаляционный инсулин также доступен на рынке США.
Игла для одноразовой ручки Dispovan от HMD [ 106 ] Это первая в Индии игла для инсулиновой ручки, упрощающая самостоятельное введение инсулина. Эти иглы-ручки с очень тонкими стенками и коническим острием с несколькими скосами обеспечивают комфорт пациента, сводя к минимуму боль и обеспечивая бесперебойную доставку лекарств. Целью продукта является предоставление доступных игл для ручек в развивающуюся часть страны через широкий канал распространения. Кроме того, универсальная конструкция этих игл гарантирует совместимость со всеми инсулиновыми ручками.
В отличие от многих лекарств, инсулин нельзя принимать внутрь, поскольку, как и почти все другие белки, попадающие в желудочно-кишечный тракт , он распадается на фрагменты, после чего теряется всякая активность. Были проведены некоторые исследования способов защиты инсулина от пищеварительного тракта, чтобы его можно было вводить перорально или сублингвально. [ 107 ] [ 108 ]
В 2021 году Всемирная организация здравоохранения добавила инсулин в свой примерный список жизненно важных лекарств . [ 109 ]
Инсулин и все другие лекарства бесплатно предоставляются людям с диабетом Национальной службой здравоохранения в странах Соединенного Королевства. [ 110 ]
История обучения
[ редактировать ]Открытие
[ редактировать ]строение поджелудочной железы В 1869 году, изучая под микроскопом , Пауль Лангерганс , студент-медик из Берлина , выявил некоторые ранее незамеченные скопления ткани, разбросанные по всей массе поджелудочной железы. [ 111 ] Функция «кучек клеток», позже известных как островки Лангерганса , первоначально оставалась неизвестной, но позже Эдуард Лагесс предположил, что они могут производить секреты, играющие регулирующую роль в пищеварении. [ 112 ] Сын Пола Лангерганса, Арчибальд, также помог понять эту регулирующую роль.
В 1889 году врач Оскар Минковски в сотрудничестве с Джозефом фон Мерингом удалил поджелудочную железу от здоровой собаки, чтобы проверить его предполагаемую роль в пищеварении. При тестировании мочи они обнаружили сахар, впервые установив связь между поджелудочной железой и диабетом. сделал еще один важный шаг В 1901 году американский врач и ученый Юджин Линдсей Опи , когда он изолировал роль поджелудочной железы на островки Лангерханс: «Сахарный диабет, когда результат поражения поджелудочной железы вызвана разрушением Острова Лангерганс и встречаются только тогда, когда эти тела частично или полностью разрушены ». [ 113 ] [ 114 ] [ 115 ]
В течение следующих двух десятилетий исследователи предприняли несколько попыток изолировать секрет островков. В 1906 году Джордж Людвиг Цульцер добился частичного успеха в лечении собак экстрактом поджелудочной железы, но продолжить свою работу он не смог. Между 1911 и 1912 годами Э. Л. Скотт из Чикагского университета попробовал водные экстракты поджелудочной железы и отметил «небольшое уменьшение глюкозурии», но не смог убедить своего директора в ценности своей работы; оно было закрыто. Исраэль Кляйнер продемонстрировал аналогичные эффекты в Университете Рокфеллера в 1915 году, но Первая мировая война прервала его работу, и он к ней не вернулся. [ 116 ]
В 1916 году Николае Паулеску разработал водный экстракт поджелудочной железы , который при введении собаке, страдающей диабетом , оказывал нормализующее действие на уровень сахара в крови . Ему пришлось прервать свои эксперименты из-за Первой мировой войны , и в 1921 году он написал четыре статьи о своей работе, проведенной в Бухаресте , и своих испытаниях на собаке, страдающей диабетом. Позже в том же году он опубликовал «Исследование роли поджелудочной железы в усвоении пищи». [ 117 ] [ 118 ]
Название «инсулин» было придумано Эдвардом Альбертом Шарпи-Шафером в 1916 году для гипотетической молекулы, вырабатываемой островками Лангерганса поджелудочной железы (от латинского insula — островок или остров), которая контролирует метаболизм глюкозы. Без ведома Шарпи-Шафера Жан де Мейер в 1909 году ввел очень похожее слово «инсулин» для той же молекулы. [ 119 ] [ 120 ]
Экстракция и очистка
[ редактировать ]В октябре 1920 года канадец Фредерик Бантинг пришел к выводу, что пищеварительные выделения, которые первоначально изучал Минковский, разрушают секрет островков, что делает невозможным успешное извлечение. Хирург по образованию, Бантинг знал, что закупорка протока поджелудочной железы приведет к атрофии большей части поджелудочной железы, в то время как островки Лангерганса останутся нетронутыми. Он предположил, что из островков можно получить относительно чистый экстракт, когда большая часть остальной части поджелудочной железы исчезнет. Он сделал для себя заметку: «Перевяжите протоки поджелудочной железы собаки. Поддерживайте собак в живых до тех пор, пока ацинусы не вырождаются, оставляя островки. Постарайтесь изолировать их внутреннюю секрецию + уменьшить гликомочевину [так в оригинале]». [ 121 ] [ 122 ]

Весной 1921 года Бантинг отправился в Торонто, чтобы объяснить свою идею Джону Маклеоду , профессору физиологии Университета Торонто . Маклеод поначалу был настроен скептически, поскольку Бантинг не имел опыта исследований и не был знаком с новейшей литературой, но он согласился предоставить Бантингу лабораторное помещение для проверки своих идей. Тем летом Маклауд также договорился о том, чтобы два студента работали лаборантами Бантинга, но Бантингу требовался только один лаборант. Чарльз Бест и Кларк Ноубл подбросили монетку; Бест выиграл жеребьевку и взял на себя первую смену. Это оказалось неудачным для Нобла, поскольку Бантинг держал Беста все лето и в конечном итоге поделился с Бестом половиной своих денег, полученных Нобелевской премией, и заслуги за открытие. [ 123 ] 30 июля 1921 года Бантинг и Бест успешно выделили экстракт («ислетин») из островков собаки с перевязанными протоками и ввели его собаке, страдающей диабетом, обнаружив, что экстракт снижает уровень сахара в крови на 40% за 1 час. [ 124 ] [ 122 ]
Бантинг и Бест представили свои результаты Маклеоду по его возвращению в Торонто осенью 1921 года, но Маклауд указал на недостатки экспериментальной схемы и предложил повторить эксперименты с большим количеством собак и лучшим оборудованием. Он перевел Бантинга и Беста в лучшую лабораторию и начал платить Бантингу зарплату из своих исследовательских грантов. Несколько недель спустя второй раунд экспериментов также увенчался успехом, и в ноябре Маклауд помог опубликовать их результаты в частном порядке в Торонто. Столкнувшись с трудоёмкой задачей по перевязыванию протоков собак и ожиданию нескольких недель для извлечения инсулина, Бантинг придумал идею экстрагировать инсулин из поджелудочной железы плода теленка, у которой ещё не развились пищеварительные железы. К декабрю им также удалось извлечь инсулин из поджелудочной железы взрослой коровы. Маклауд прекратил все остальные исследования в своей лаборатории, чтобы сосредоточиться на очистке инсулина. Он пригласил биохимика Джеймса Коллипа помочь с этой задачей, и команда почувствовала себя готовой к клиническим испытаниям в течение месяца. [ 122 ]

11 января 1922 года Леонарду Томпсону , 14-летнему диабетику, умиравшему в больнице общего профиля Торонто , сделали первую инъекцию инсулина. [ 125 ] [ 126 ] [ 127 ] [ 128 ] Однако экстракт оказался настолько нечистым, что у Томпсона возникла сильная аллергическая реакция , и дальнейшие инъекции были отменены. В течение следующих 12 дней Коллип день и ночь работал над улучшением экстракта бычьей поджелудочной железы. Вторая доза была введена 23 января, устранив глюкозурию типичную для диабета , не вызвав при этом каких-либо явных побочных эффектов. Первым американским пациентом стала Элизабет Хьюз , дочь госсекретаря США Чарльза Эванса Хьюза . [ 129 ] [ 130 ] Первым пациентом, получившим лечение в США, был будущий художник-гравёр по дереву Джеймс Д. Хэвенс ; [ 131 ] Джон Ралстон Уильямс импортировал инсулин из Торонто в Рочестер, штат Нью-Йорк , для лечения Хейвенса. [ 132 ]
Бантинг и Бест никогда не ладили с Коллипом, считая его чем-то вроде нарушителя. [ нужна ссылка ] и Коллип вскоре покинул проект. Весной 1922 года Бесту удалось усовершенствовать свои методы до такой степени, что можно было извлекать большие количества инсулина по требованию, но препарат оставался нечистым. Фармацевтическая фирма Eli Lilly and Company предложила помощь вскоре после первых публикаций в 1921 году, и они приняли предложение Лилли в апреле. В ноябре главный химик Лилли Джордж Б. Уолден обнаружил изоэлектрическое осаждение и смог производить большие количества высокоочищенного инсулина. Вскоре после этого инсулин был предложен для продажи широкой публике.
Патент
[ редактировать ]К концу января 1922 года напряженность между четырьмя «соавторами» инсулина и Коллипом на короткое время возникла угроза отдельно запатентовать свой процесс очистки. Поэтому Джон Дж. Фитцджеральд , директор некоммерческого учреждения общественного здравоохранения Connaught Laboratories , выступил в роли миротворца. В результате соглашения от 25 января 1922 г. были установлены два ключевых условия: 1) сотрудники подпишут контракт, в котором обязуются не получать патент с коммерческой фармацевтической фирмой в течение начального периода работы с Connaught; и 2) что никакие изменения в исследовательской политике не будут разрешены, если они не будут предварительно обсуждены Фитцджеральдом и четырьмя сотрудниками. [ 133 ] Это помогло сдержать разногласия и связало исследование с общественным мандатом Коннахта.
Первоначально Маклауд и Бантинг особенно неохотно патентовали свой процесс получения инсулина по соображениям медицинской этики . Однако сохранялись опасения, что частная третья сторона может перехватить и монополизировать исследование (на что Эли Лилли и Компания) . намекали [ 134 ] ), и что безопасное распространение будет трудно гарантировать без возможности контроля качества. С этой целью Эдвард Кэлвин Кендалл дал ценный совет. Он выделил тироксин в клинике Мэйо в 1914 году и запатентовал процесс по соглашению между ним, братьями Мэйо и Университетом Миннесоты , передав патент государственному университету. [ 135 ] 12 апреля Бантинг, Бест, Коллип, Маклеод и Фитцджеральд совместно написали президенту Университета Торонто , предлагая аналогичную схему с целью передачи патента Совету управляющих университета. [ 136 ] В письме подчеркивалось, что: [ 137 ]
Патент не будет использоваться ни для каких иных целей, кроме как для предотвращения изъятия патента другими лицами. Когда подробности метода приготовления будут опубликованы, любой сможет приготовить экстракт, но никто не сможет обеспечить прибыльную монополию.
Поручение Совету управляющих Университета Торонто было завершено 15 января 1923 года за символическую выплату в размере 1 доллар США. [ 138 ] Эта договоренность была отмечена в журнале The World's Work в 1923 году как «шаг вперед в медицинской этике». [ 139 ] В 2010-х годах он также привлек большое внимание средств массовой информации к вопросам здравоохранения и доступности лекарств .
После дальнейшей обеспокоенности по поводу попыток Eli Lilly запатентовать отдельные части производственного процесса, помощник директора Connaught и руководитель подразделения инсулина Роберт Дефрис разработал политику объединения патентов, которая требует от производителей свободно делиться любыми улучшениями производственного процесса без ущерба для доступности. [ 140 ]
Структурный анализ и синтез
[ редактировать ]Очищенный инсулин животного происхождения изначально был единственным типом инсулина, доступным для экспериментов и диабетиков. Джон Джейкоб Абель был первым, кто получил кристаллическую форму в 1926 году. [ 141 ] Доказательства природы белка были впервые предоставлены Майклом Сомоджи , Эдвардом А. Дойзи и Филипом А. Шаффером в 1924 году. [ 142 ] Это было полностью доказано, когда Ханс Йенсен и Эрл А. Эванс-младший выделили аминокислоты фенилаланин и пролин в 1935 году. [ 143 ]
Аминокислотная структура инсулина была впервые охарактеризована в 1951 году Фредериком Сэнгером . [ 18 ] [ 144 ] а первый синтетический инсулин был произведен одновременно в лабораториях Панайотиса Катсоянниса из Питтсбургского университета и Хельмута Зана в RWTH Ахенского университета в середине 1960-х годов. [ 145 ] [ 146 ] [ 147 ] [ 148 ] [ 149 ] Синтетический кристаллический бычий инсулин был получен китайскими исследователями в 1965 году. [ 150 ] Полная трехмерная структура инсулина была определена методом рентгеновской кристаллографии в Дороти Ходжкин в 1969 году. лаборатории [ 151 ]
Ханс Э. Вебер открыл препроинсулин, работая научным сотрудником в Калифорнийском университете в Лос-Анджелесе в 1974 году. В 1973–1974 годах Вебер изучил методы выделения, очистки и трансляции информационной РНК. Для дальнейшего исследования инсулина он получил ткани поджелудочной железы на бойне в Лос-Анджелесе, а затем из животных в Калифорнийском университете в Лос-Анджелесе. Он выделил и очистил общую информационную РНК из островковых клеток поджелудочной железы, которую затем транслировал в ооцитах Xenopus laevis и осаждал с помощью антител против инсулина. Когда общий транслированный белок анализировали с помощью электрофореза в полиакриламидном геле с ДСН и градиентом сахарозы, выделяли пики, соответствующие инсулину и проинсулину. Однако, к удивлению Вебера, был выделен третий пик, соответствующий молекуле большего размера, чем проинсулин. Повторив эксперимент несколько раз, он постоянно отмечал этот большой пик перед проинсулином, который, как он определил, должен быть более крупной молекулой-предшественником, расположенной выше проинсулина. В мае 1975 года на собрании Американской диабетической ассоциации в Нью-Йорке Вебер устно представил свою работу. [ 152 ] где он первым назвал эту молекулу-предшественник «препроинсулином». После устного выступления Вебер был приглашен на ужин, чтобы обсудить свою статью и выводы Дональда Штайнера , исследователя, который внес свой вклад в характеристику проинсулина. Год спустя, в апреле 1976 года, эта молекула была дополнительно охарактеризована и секвенирована Штайнером, ссылаясь на работу и открытие Ганса Вебера. [ 153 ] Препроинсулин стал важной молекулой для изучения процесса транскрипции и трансляции.
Первый генетически модифицированный синтетический «человеческий» инсулин был произведен с использованием кишечной палочки в 1978 году Артуром Риггсом и Кейичи Итакура в Научно-исследовательском институте Бекмана в Городе надежды в сотрудничестве с Гербертом Бойером из Genentech . [ 14 ] [ 15 ] Компания Genentech, основанная Суонсоном, Бойером и Эли Лилли и компанией , в 1982 году начала продавать первый коммерчески доступный биосинтетический человеческий инсулин под торговой маркой Humulin . [ 15 ] Подавляющее большинство инсулина, используемого во всем мире, представляет собой биосинтетический рекомбинантный «человеческий» инсулин или его аналоги. [ 16 ] Недавно группа канадских исследователей-новаторов применила другой подход: она использовала легко выращиваемое растение сафлора для производства гораздо более дешевого инсулина. [ 154 ]
Рекомбинантный инсулин вырабатывается либо в дрожжах (обычно Saccharomyces cerevisiae ), либо в кишечной палочке . [ 155 ] В дрожжах инсулин может быть сконструирован в виде одноцепочечного белка с сайтом эндопротеазы KexII (дрожжевой гомолог PCI/PCII), который отделяет А-цепь инсулина от усеченной на С-конце B-цепи инсулина. Химически синтезированный С-концевой хвост затем прививается к инсулину путем обратного протеолиза с использованием недорогой протеазы трипсина; обычно лизин на С-концевом хвосте защищен химической защитной группой для предотвращения протеолиза. Простота модульного синтеза и относительная безопасность модификаций в этой области объясняют распространенность аналогов инсулина с С-концевыми модификациями (например, лизпро, аспарт, глулизин). Синтез Genentech и полностью химический синтез, такой как синтез Брюса Меррифилда, не являются предпочтительными, поскольку эффективность рекомбинации двух цепей инсулина низка, в первую очередь из-за конкуренции с осаждением B-цепи инсулина.
Нобелевские премии
[ редактировать ]
Нобелевский комитет в 1923 году приписал практическое извлечение инсулина команде из Университета Торонто и присудил Нобелевскую премию двум мужчинам: Фредерику Бантингу и Джону Маклеоду . [ 156 ] им была присуждена Нобелевская премия по физиологии и медицине В 1923 году за открытие инсулина . Бантинг, разгневанный тем, что Бест не был упомянут, [ 157 ] поделился с ним своим призом, а Маклеод тут же поделился своим с Джеймсом Коллипом . Патент на инсулин был продан Университету Торонто за один доллар.
Две другие Нобелевские премии были присуждены за работу над инсулином. Британский молекулярный биолог Фредерик Сэнгер , определивший первичную структуру инсулина в 1955 году, был удостоен Нобелевской премии по химии 1958 года . [ 18 ] Розалин Сассман Ялоу получила Нобелевскую премию по медицине 1977 года за разработку радиоиммунного анализа инсулина.
Несколько Нобелевских премий также имеют косвенную связь с инсулином. Джордж Майнот , со-лауреат Нобелевской премии 1934 года за разработку первого эффективного лечения пернициозной анемии , страдал диабетом . Уильям Касл заметил, что открытие в 1921 году инсулина, пришедшего вовремя, чтобы сохранить Майноту жизнь, стало, таким образом, также ответственным за открытие лекарства от злокачественной анемии . [ 158 ] Дороти Ходжкин была удостоена Нобелевской премии по химии в 1964 году за разработку кристаллографии — метода, который она использовала для расшифровки полной молекулярной структуры инсулина в 1969 году. [ 151 ]
Споры
[ редактировать ]
Работа, опубликованная Бантингом, Бестом, Коллипом и Маклеодом, представляла собой получение очищенного экстракта инсулина, пригодного для использования на людях. [ 159 ] Хотя Паулеску открыл принципы лечения, его солевой экстракт нельзя было использовать на людях; он не был упомянут в Нобелевской премии 1923 года. Ян Мюррей особенно активно работал над исправлением «исторической ошибки» в отношении Николае Паулеску . Мюррей был профессором физиологии в Медицинском колледже Андерсона в Глазго , Шотландия , заведующим отделением метаболических заболеваний в ведущей больнице Глазго, вице-президентом Британской диабетической ассоциации и одним из основателей Международной диабетической федерации . . Мюррей писал:
Недостаточное признание было дано Паулеску, выдающемуся румынскому ученому, которому на момент начала своих исследований команда из Торонто уже преуспела в выделении антидиабетического гормона поджелудочной железы и доказала его эффективность в снижении гипергликемии у собак, больных диабетом. [ 160 ]
В частном общении Арне Тиселиус , бывший глава Нобелевского института, выразил личное мнение, что Паулеску был в равной степени достоин премии 1923 года. [ 161 ]
Ссылки
[ редактировать ]- ^ Перейти обратно: а б с GRCh38: Версия Ensembl 89: ENSG00000254647 – Ensembl , май 2017 г.
- ^ Перейти обратно: а б с GRCm38: Ensembl, выпуск 89: ENSMUSG00000000215 – Ensembl , май 2017 г.
- ^ «Ссылка на Human PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Ссылка на Mouse PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Инсулин | Значение инсулина по лексике» . Лексико-словари | Английский . Архивировано из оригинала 1 августа 2020 года.
- ^ «Инсулин — Английский словарь WordReference.com» . www.wordreference.com .
- ^ Перейти обратно: а б Воет Д., Воет Дж.Г. (2011). Биохимия (4-е изд.). Нью-Йорк: Уайли.
- ^ Перейти обратно: а б с д Страйер Л. (1995). Биохимия (Четвертое изд.). Нью-Йорк: WH Freeman and Company. стр. 773–74. ISBN 0-7167-2009-4 .
- ^ Сонксен П., Сонксен Дж. (июль 2000 г.). «Инсулин: понимание его действия на здоровье и болезни» . Британский журнал анестезии . 85 (1): 69–79. дои : 10.1093/бья/85.1.69 . ПМИД 10927996 .
- ^ Перейти обратно: а б с д и ж г Коэслаг Дж. Х., Сондерс П.Т., Тербланш Э. (июнь 2003 г.). «Переоценка гомеостата глюкозы в крови, которая всесторонне объясняет комплекс сахарный диабет 2 типа и синдром X» . Журнал физиологии . 549 (Часть 2) (опубликовано в 2003 г.): 333–46. дои : 10.1113/jphysicalol.2002.037895 . ПМК 2342944 . ПМИД 12717005 .
- ^ Андрали СС, Сэмпли МЛ, Вандерфорд Н.Л., Озджан С (1 октября 2008 г.). «Регуляция глюкозой экспрессии гена инсулина в бета-клетках поджелудочной железы» . Биохимический журнал . 415 (1): 1–10. дои : 10.1042/BJ20081029 . ISSN 1470-8728 . ПМИД 18778246 .
- ^ Американское общество фармацевтов системы здравоохранения (1 февраля 2009 г.). «Инъекция инсулина [» . ПабМед Здоровье . Национальный центр биотехнологической информации, Национальная медицинская библиотека США . Проверено 12 октября 2012 г.
- ^ Перейти обратно: а б Информационный портал о лекарствах NLM - Инсулин человеческий USAN Druginfo.nlm.nih.gov . Архивировано 19 ноября 2022 г. в Wayback Machine.
- ^ Перейти обратно: а б «Объявлено о первом успешном лабораторном производстве человеческого инсулина» . Выпуск новостей . Генентек. 6 сентября 1978 года. Архивировано из оригинала 27 сентября 2016 года . Проверено 26 сентября 2016 г.
- ^ Перейти обратно: а б с Тоф I (1994). «Технология рекомбинантной ДНК в синтезе человеческого инсулина» . Издательство «Маленькое дерево» . Проверено 3 ноября 2009 г.
- ^ Перейти обратно: а б Аггарвал С.Р. (декабрь 2012 г.). «Что питает биотехнологический двигатель с 2011 по 2012 год». Природная биотехнология . 30 (12): 1191–7. дои : 10.1038/nbt.2437 . ПМИД 23222785 . S2CID 8707897 .
- ^ Перейти обратно: а б с д Вайс М., Штайнер Д.Ф., Филипсон Л.Х. (2000). «Биосинтез, секреция, структура и взаимосвязь структура-активность инсулина» . В Feingold KR, Anawalt B, Boyce A, Chrousos G, Dungan K, Grossman A, et al. (ред.). Эндотекст . MDText.com, Inc. PMID 25905258 . Проверено 18 февраля 2020 г. .
- ^ Перейти обратно: а б с Стреттон АО (октябрь 2002 г.). «Первая последовательность. Фред Сэнгер и инсулин» . Генетика . 162 (2): 527–32. дои : 10.1093/генетика/162.2.527 . ПМЦ 1462286 . ПМИД 12399368 .
- ^ «Открытие и развитие инсулина как метода лечения можно отнести к 19 веку» . Диабет . 15 января 2019 года . Проверено 17 февраля 2020 г.
- ^ Девятнадцатый Примерный список основных лекарственных средств ВОЗ (апрель 2015 г.) (PDF) . ВОЗ. Апрель 2015. с. 455. HDL : 10665/189763 . ISBN 978-92-4-120994-6 . Проверено 10 мая 2015 г.
- ^ Перейти обратно: а б де Соуза А.М., Лопес Х.А. (ноябрь 2004 г.). «Инсулиновые или инсулиноподобные исследования на одноклеточных организмах: обзор» . Браз. Арх. Биол. Технол . 47 (6): 973–81. дои : 10.1590/S1516-89132004000600017 . ISSN 1516-8913 . Проверено 30 июня 2022 г.
- ^ ЛеРойт Д., Шилоах Дж., Хеффрон Р., Рубиновиц С., Таненбаум Р., Рот Дж. (август 1985 г.). «Связанный с инсулином материал у микробов: сходства и различия с инсулинами млекопитающих». Канадский журнал биохимии и клеточной биологии . 63 (8): 839–849. дои : 10.1139/o85-106 . ПМИД 3933801 .
- ^ Райт-младший, Ян Х, Хирценко О, Сюй Бая, Ю В, Похайдак Б (2014). «Обзор ксенотрансплантации рыбьих островков с использованием доноров тилапии дикого типа и производство трансгенной тилапии, экспрессирующей «гуманизированный» инсулин тилапии» . Ксенотрансплантация . 21 (6): 485–95. дои : 10.1111/xen.12115 . ПМЦ 4283710 . ПМИД 25040337 .
- ^ «Смертоносная морская улитка использует инсулин, чтобы сделать свою жертву вялой» . Хранитель . 19 января 2015 г.
- ^ Сафави-Хемами Х., Гаевяк Дж., Карант С., Робинсон С.Д., Юберхайде Б., Дуглас А.Д. и др. (февраль 2015 г.). «Специализированный инсулин используется для химического оружия конусными улитками, охотящимися за рыбой» . Труды Национальной академии наук Соединенных Штатов Америки . 112 (6): 1743–48. Бибкод : 2015PNAS..112.1743S . дои : 10.1073/pnas.1423857112 . ПМК 4330763 . ПМИД 25605914 .
- ^ Перейти обратно: а б с д и ж г Токарз В.Л., Макдональд П.Е., Клип А (июль 2018 г.). «Клеточная биология системной функции инсулина» . J Клеточная Биол . 217 (7): 2273–2289. дои : 10.1083/jcb.201802095 . ПМК 6028526 . ПМИД 29622564 .
- ^ Шиао М.С., Ляо Б.И., Лонг М., Ю Х.Т. (март 2008 г.). «Адаптивная эволюция двухгенной системы инсулина у мышей» . Генетика . 178 (3): 1683–91. doi : 10.1534/genetics.108.087023 . ПМК 2278064 . ПМИД 18245324 .
- ^ Перейти обратно: а б Фу З., Гилберт Э.Р., Лю Д. (январь 2013 г.). «Регуляция синтеза и секреции инсулина и дисфункция бета-клеток поджелудочной железы при диабете» . Карр Диабет Rev. 9 (1): 25–53. дои : 10.2174/157339913804143225 . ПМЦ 3934755 . ПМИД 22974359 .
- ^ Бернардо А.С., Хэй К.В., Дочерти К. (ноябрь 2008 г.). «Факторы транскрипции поджелудочной железы и их роль в рождении, жизни и выживании бета-клеток поджелудочной железы» (PDF) . обзор. Молекулярная и клеточная эндокринология . 294 (1–2): 1–9. дои : 10.1016/j.mce.2008.07.006 . ПМИД 18687378 . S2CID 28027796 .
- ^ Раттер Г.А., Пуллен Т.Дж., Ходсон DJ, Мартинес-Санчес А. (март 2015 г.). «Идентификация β-клеток поджелудочной железы, чувствительность к глюкозе и контроль секреции инсулина». обзор. Биохимический журнал . 466 (2): 203–18. дои : 10.1042/BJ20141384 . ПМИД 25697093 . S2CID 2193329 .
- ^ Раттер Г.А., Таваре Дж.М., Палмер Д.Г. (июнь 2000 г.). «Регуляция экспрессии генов млекопитающих с помощью глюкозы». обзор. Новости физиологических наук . 15 (3): 149–54. doi : 10.1152/физиологияонлайн.2000.15.3.149 . ПМИД 11390898 .
- ^ Пуату В., Хэгман Д., Стейн Р., Артнер И., Робертсон Р.П., Хармон Дж.С. (апрель 2006 г.). «Регуляция гена инсулина глюкозой и d-кислотами» . обзор. Журнал питания . 136 (4): 873–76. дои : 10.1093/jn/136.4.873 . ПМЦ 1853259 . ПМИД 16549443 .
- ^ Волон С., Вассер-Когнет М., Кан А. (октябрь 2000 г.). «Глюкозная регуляция транскрипции генов» . обзор. Журнал биологической химии . 275 (41): 31555–58. дои : 10.1074/jbc.R000016200 . ПМИД 10934218 .
- ^ Кристенсен Д.П., Даллёф М., Лунд М., Расмуссен Д.Н., Нильсен М.Д., Биллеструп Н. и др. (2011). «Ингибирование гистондеацетилазы (HDAC) как новое лечение сахарного диабета» . Молекулярная медицина . 17 (5–6): 378–90. дои : 10.2119/molmed.2011.00021 . ПМК 3105132 . ПМИД 21274504 .
- ^ Ван В, Ши Ц, Го Т, Ян З, Цзя З, Чен П и др. (июнь 2016 г.). «PDX1 и ISL1 по-разному координируют свои действия с эпигенетическими модификациями, регулируя экспрессию гена инсулина при различных концентрациях глюкозы» . Молекулярная и клеточная эндокринология . 428 : 38–48. дои : 10.1016/j.mce.2016.03.019 . ПМИД 26994512 .
- ^ Ван X, Вэй X, Пан Ц, И Ф (август 2012 г.). «Гистондеацетилазы и их ингибиторы: молекулярные механизмы и терапевтическое значение при сахарном диабете» . Акта Фармацевтика Синика Б. 2 (4): 387–95. дои : 10.1016/j.apsb.2012.06.005 .
- ^ Перейти обратно: а б Андрали С.С., Сэмпли М.Л., Вандерфорд Н.Л., Озджан С. (октябрь 2008 г.). «Регуляция глюкозой экспрессии гена инсулина в бета-клетках поджелудочной железы». обзор. Биохимический журнал . 415 (1): 1–10. дои : 10.1042/BJ20081029 . ПМИД 18778246 .
- ^ Кането Х., Мацуока Т.А., Кавасима С., Ямамото К., Като К., Мияцука Т. и др. (июль 2009 г.). «Роль MafA в бета-клетках поджелудочной железы». Обзоры расширенной доставки лекарств . 61 (7–8): 489–96. дои : 10.1016/j.addr.2008.12.015 . ПМИД 19393272 .
- ^ Арамата С., Хан С.И., Катаока К. (декабрь 2007 г.). «Роль и регуляция транскрипционного фактора MafA в островковых бета-клетках» . Эндокринный журнал . 54 (5): 659–66. doi : 10.1507/endocrj.KR-101 . ПМИД 17785922 .
- ^ Кането Х., Мацуока Т.А. (октябрь 2012 г.). «Участие окислительного стресса в подавлении биосинтеза инсулина при диабете» . Международный журнал молекулярных наук . 13 (10): 13680–90. дои : 10.3390/ijms131013680 . ПМЦ 3497347 . ПМИД 23202973 .
- ^ Перейти обратно: а б Наджар С. (2003). «Действие инсулина: молекулярная основа диабета». Энциклопедия наук о жизни . Джон Уайли и сыновья. doi : 10.1038/npg.els.0001402 . ISBN 978-0-470-01617-6 .
- ^ Густин Н (7 марта 2005 г.). «Исследователи обнаруживают связь между инсулином и болезнью Альцгеймера» . Эврикалерт! Полем Американская ассоциация по развитию науки . Получено 1 января 2009 года .
- ^ De La Monte SM, Wands JR (февраль 2005 г.). «Обзор инсулина и инсулиноподобного экспрессии фактора роста, передачи сигналов и неисправности в центральной нервной системе: отношение к болезни Альцгеймера» (PDF) . Журнал болезни Альцгеймера . 7 (1): 45–61. doi : 10.3233/JAD-2005-7106 . PMID 15750214 .
- ^ Стин Э., Терри Б.М., Ривера Э.Дж., Кэннон Дж.Л., Нили Т.Р., Таварес Р. и др. (февраль 2005 г.). «Нарушение экспрессии инсулина и инсулиноподобного фактора роста и сигнальных механизмов при болезни Альцгеймера — это диабет 3 типа?» (PDF) . Журнал болезни Альцгеймера . 7 (1): 63–80. дои : 10.3233/jad-2005-7107 . ПМИД 15750215 . S2CID 28173722 .
- ^ «Инсулин человеческий» . ПабХим . Проверено 26 февраля 2019 г.
- ^ Перейти обратно: а б с Фу З., Гилберт Э.Р., Лю Д. (январь 2013 г.). «Регуляция синтеза и секреции инсулина и дисфункция бета-клеток поджелудочной железы при диабете» . Текущие обзоры диабета . 9 (1): 25–53. дои : 10.2174/157339913804143225 . ПМЦ 3934755 . ПМИД 22974359 .
- ^ Данн М.Ф. (август 2005 г.). «Взаимодействия цинка и лиганда модулируют сборку и стабильность гексамера инсулина - обзор». Биометаллы . 18 (4): 295–303. дои : 10.1007/s10534-005-3685-y . ПМИД 16158220 . S2CID 8857694 .
- ^ Иванова М.И., Сиверс С.А., Савайя М.Р., Уолл Дж.С., Айзенберг Д. (ноябрь 2009 г.). «Молекулярные основы сборки инсулиновых фибрилл» . Труды Национальной академии наук Соединенных Штатов Америки . 106 (45): 18990–5. Бибкод : 2009PNAS..10618990I . дои : 10.1073/pnas.0910080106 . ПМЦ 2776439 . ПМИД 19864624 .
- ^ Омар-Хмеади М., Идевалл-Хагрен О (март 2021 г.). «Биогенез и экзоцитоз инсулиновых гранул» . Клеточные и молекулярные науки о жизни . 78 (5): 1957–1970. дои : 10.1007/s00018-020-03688-4 . ПМЦ 7966131 . ПМИД 33146746 .
- ^ Братанова-Точкова Т.К., Ченг Х., Дэниел С., Гунавардана С., Лю Ю.Дж., Малвейни-Муса Дж. и др. (февраль 2002 г.). «Механизмы запуска и увеличения, пулы гранул и двухфазная секреция инсулина» . Диабет . 51 (Приложение 1): S83–S90. doi : 10.2337/diabetes.51.2007.S83 . ПМИД 11815463 .
- ^ Герих Дж. (Февраль 2002). «Снижение первой фазной инсулина высвобождает самую раннюю обнаруживаемая аномалия у людей, предназначенных для развития диабета 2 типа?» Полем Диабет . 51 (Suppl 1): S117 - S121. doi : 10.2337/диабет.51.2007.S117 . PMID 11815469 .
- ^ Lorenzo C, Wagenknecht LE, Rewers MJ, Karter AJ, Bergman RN, Hanley AJ, et al. (Сентябрь 2010). «Индекс расположения, эффективность глюкозы и конверсия в диабет 2 типа: исследование атеросклероза с резистентностью к инсулину (IRA)» . Уход за диабетом . 33 (9): 2098–2103. doi : 10.2337/dc10-0165 . PMC 2928371 . PMID 20805282 .
- ^ Перейти обратно: а б Шуит Ф., Моенс К., Хаймберг Х., Пайпелерс Д. (ноябрь 1999 г.). «Клеточное происхождение гексокиназы в островках поджелудочной железы» . Журнал биологической химии . 274 (46) (опубликовано в 1999 г.): 32803–09. дои : 10.1074/jbc.274.46.32803 . ПМИД 10551841 .
- ^ Шуит Ф., Де Вос А., Фарфари С., Моенс К., Пайпелерс Д., Брун Т. и др. (июль 1997 г.). «Метаболическая судьба глюкозы в очищенных островковых клетках. Регулируемый глюкозой анаплероз в бета-клетках» . Журнал биологической химии . 272 (30) (опубликовано в 1997 г.): 18572–79. дои : 10.1074/jbc.272.30.18572 . ПМИД 9228023 .
- ^ Сантулли Г., Пагано Г., Сарду С., Се В., Рейкен С., Д'Асия С.Л. и др. (май 2015 г.). «Канал высвобождения кальция RyR2 регулирует высвобождение инсулина и гомеостаз глюкозы» . Журнал клинических исследований . 125 (5): 1968–78. дои : 10.1172/JCI79273 . ПМК 4463204 . ПМИД 25844899 .
- ^ Страйер Л. (1995). Биохимия (Четвертое изд.). Нью-Йорк: WH Freeman and Company. стр. 343–44. ISBN 0-7167-2009-4 .
- ^ Коустон Э.Э., Миллер Ж.Дж. (март 2010 г.). «Терапевтический потенциал новых препаратов, воздействующих на рецептор холецистокинина 1 типа» . Британский журнал фармакологии . 159 (5): 1009–21. дои : 10.1111/j.1476-5381.2009.00489.x . ПМК 2839260 . ПМИД 19922535 .
- ^ Накаки Т., Накадате Т., Като Р. (август 1980 г.). «Альфа-2-адренорецепторы, модулирующие высвобождение инсулина из изолированных островков поджелудочной железы». Архив фармакологии Наунина-Шмидеберга . 313 (2): 151–53. дои : 10.1007/BF00498572 . ПМИД 6252481 . S2CID 30091529 .
- ^ Лейден Б.Т., Дурай В., Лоу В.Л. младший (2010). «Рецепторы, связанные с G-белком, островки поджелудочной железы и диабет» . Природное образование . 3 (9): 13.
- ^ Сиркар С (2007). Медицинская физиология . Штутгарт: Издательская группа Thieme. стр. 537–38. ISBN 978-3-13-144061-7 .
- ^ Перейти обратно: а б с д и Хеллман Б., Гилф Э., Грейпенгиссер Э., Данск Х., Салехи А. (2007). «[Колебания инсулина — клинически важный ритм. Противодиабетические средства должны увеличивать пульсирующий компонент выброса инсулина]» . Лякартиднинген (на шведском языке). 104 (32–33): 2236–39. ПМИД 17822201 .
- ^ Сароде Б.Р., Ковер К., Тонг П.Ю., Чжан С., Фридман Ш.Х. (ноябрь 2016 г.). «Световой контроль высвобождения инсулина и уровня глюкозы в крови с помощью инъекционного фотоактивируемого депо» . Молекулярная фармацевтика . 13 (11): 3835–3841. doi : 10.1021/acs.molpharmaceut.6b00633 . ПМК 5101575 . ПМИД 27653828 .
- ^ Джайн П.К., Карунакаран Д., Фридман Ш. (январь 2013 г.). «Строительство депо фотоактивированного инсулина» (PDF) . Ангеванде Хеми . 52 (5): 1404–9. дои : 10.1002/anie.201207264 . ПМИД 23208858 . Архивировано из оригинала (PDF) 2 ноября 2019 года . Проверено 3 ноября 2019 г.
- ^ Роулетт Р. (13 июня 2001 г.). «Словарь единиц измерения» . Университет Северной Каролины в Чапел-Хилл. Архивировано из оригинала 28 октября 2013 года.
- ^ Ивасе Х., Кобаяши М., Накадзима М., Такатори Т. (январь 2001 г.). «Соотношение инсулина и С-пептида можно использовать для судебно-медицинской диагностики передозировки экзогенного инсулина». Международная судебно-медицинская экспертиза . 115 (1–2): 123–127. дои : 10.1016/S0379-0738(00)00298-X . ПМИД 11056282 .
- ^ Перейти обратно: а б «Справочник по диабету, 4-е издание, отрывок № 4: Нормальная физиология секреции и действия инсулина» . Диабет под контролем. Бесплатный еженедельный информационный бюллетень о диабете для медицинских работников . 28 июля 2014 года . Проверено 1 июня 2017 г.
- ^ Макманус Э.Дж., Сакамото К., Армит Л.Дж., Рональдсон Л., Шпиро Н., Маркес Р. и др. (апрель 2005 г.). «Роль, которую фосфорилирование GSK3 играет в передаче сигналов инсулина и Wnt, определяется с помощью нокинного анализа» . Журнал ЭМБО . 24 (8): 1571–83. дои : 10.1038/sj.emboj.7600633 . ПМЦ 1142569 . ПМИД 15791206 .
- ^ Фанг X, Ю SX, Лу Y, Баст Р.К., Вуджетт-младший, Миллс ГБ (октябрь 2000 г.). «Фосфорилирование и инактивация киназы гликогенсинтазы 3 протеинкиназой А» . Труды Национальной академии наук Соединенных Штатов Америки . 97 (22): 11960–75. Бибкод : 2000PNAS...9711960F . дои : 10.1073/pnas.220413597 . ПМК 17277 . ПМИД 11035810 .
- ^ Перейти обратно: а б Страйер Л. (1995). Биохимия (Четвертое изд.). Нью-Йорк: WH Freeman and Company. стр. 351–56, 494–95, 505, 605–06, 773–75. ISBN 0-7167-2009-4 .
- ^ Ментинг Дж., Уиттакер Дж., Маргеттс М.Б., Уиттакер Л.Дж., Конг Г.К., Смит Б.Дж. и др. (январь 2013 г.). «Как инсулин взаимодействует со своим основным сайтом связывания на рецепторе инсулина» . Природа . 493 (7431): 241–245. Бибкод : 2013Natur.493..241M . дои : 10.1038/nature11781 . ПМЦ 3793637 . ПМИД 23302862 .
Саймон Лаудер (9 января 2013 г.). «Австралийские исследователи взломали механизм связывания инсулина» . Австралийская комиссия по радиовещанию. - ^ Перейти обратно: а б с д и ж г Димитриадис Г., Митру П., Ламбадиари В., Марату Э., Раптис С.А. (август 2011 г.). «Эффекты инсулина в мышечной и жировой ткани». Исследования диабета и клиническая практика . 93 (Приложение 1): S52–59. дои : 10.1016/S0168-8227(11)70014-6 . ПМИД 21864752 .
- ^ «Физиологические эффекты инсулина» . www.vivo.colostate.edu . Архивировано из оригинала 7 мая 2023 года . Проверено 1 июня 2017 г.
- ^ Бергамини Э., Каваллини Дж., Донати А., Гори З. (октябрь 2007 г.). «Роль аутофагии в старении: ее существенная часть в антивозрастном механизме ограничения калорий». Анналы Нью-Йоркской академии наук . 1114 (1): 69–78. Бибкод : 2007NYASA1114...69B . дои : 10.1196/анналы.1396.020 . ПМИД 17934054 . S2CID 21011988 .
- ^ Чжэн С., Лю Цзы (июнь 2015 г.). «Сосудистая функция, действие инсулина и физические упражнения: сложное взаимодействие» . Тенденции в эндокринологии и обмене веществ . 26 (6): 297–304. дои : 10.1016/j.tem.2015.02.002 . ПМЦ 4450131 . ПМИД 25735473 .
- ^ Крейцман С.Н., Коксон А.Ю., Саз К.Ф. (июль 1992 г.). «Запасы гликогена: иллюзии легкой потери веса, чрезмерного набора веса и искажения оценок состава тела» (PDF) . Американский журнал клинического питания . 56 (Приложение 1): 292S–93S. дои : 10.1093/ajcn/56.1.292S . ПМИД 1615908 . Архивировано из оригинала (PDF) 18 октября 2012 года.
- ^ Бензиан Б., Чибалин А.В. (сентябрь 2008 г.). «Границы: регуляция натриевого насоса скелетных мышц: парадигма транслокации». Американский журнал физиологии. Эндокринология и обмен веществ . 295 (3): E553–58. дои : 10.1152/ajpendo.90261.2008 . ПМИД 18430962 . S2CID 10153197 .
- ^ Клаузен Т. (сентябрь 2008 г.). «Регуляторная роль транслокации насосов Na+-K+ в скелетных мышцах: гипотеза или реальность?». Американский журнал физиологии. Эндокринология и обмен веществ . 295 (3): E727–28, ответ автора 729. doi : 10.1152/ajpendo.90494.2008 . ПМИД 18775888 . S2CID 13410719 .
- ^ Гупта А.К., Кларк Р.В., Киршнер К.А. (январь 1992 г.). «Влияние инсулина на почечную экскрецию натрия». Гипертония . 19 (Приложение 1): I78–82. doi : 10.1161/01.HYP.19.1_Suppl.I78 . ПМИД 1730458 .
- ^ Райдер М.Х., Бертран Л., Вертоммен Д., Михельс П.А., Руссо Г.Г., Хюэ Л. (1 августа 2004 г.). «6-фосфофрукто-2-киназа/фруктозо-2,6-бисфосфатаза: борьба с бифункциональным ферментом, контролирующим гликолиз» . Биохимический журнал . 381 (3): 561–579. дои : 10.1042/BJ20040752 . ПМЦ 1133864 . ПМИД 15170386 .
- ^ Ван Ю, Юй В, Ли С, Го Д, Хэ Дж, Ван Ю (11 марта 2022 г.). «Ацетил-КоА-карбоксилазы и болезни» . Границы онкологии . 12 . дои : 10.3389/fonc.2022.836058 . ПМЦ 8963101 . ПМИД 35359351 .
- ^ Бенедикт С., Халльшмид М., Хатке А., Шультес Б., Фем Х.Л., Борн Дж. и др. (ноябрь 2004 г.). «Интраназальный инсулин улучшает память у людей» (PDF) . Психонейроэндокринология . 29 (10): 1326–1334. doi : 10.1016/j.psyneuen.2004.04.003 . ПМИД 15288712 . S2CID 20321892 .
- ^ Бенедикт С., Бреде С., Шиот Х.Б., Ленерт Х., Шультес Б., Борн Дж. и др. (январь 2011 г.). «Интраназальный инсулин усиливает постпрандиальный термогенез и снижает постпрандиальный уровень инсулина в сыворотке крови у здоровых мужчин» . Диабет . 60 (1): 114–118. дои : 10.2337/db10-0329 . ПМК 3012162 . ПМИД 20876713 .
- ^ Комнинос А.Н., Джаясена К.Н., Дхилло В.С. (2014). «Взаимосвязь между гормонами кишечника и жировой ткани и репродукцией» . Обновление репродукции человека . 20 (2): 153–174. дои : 10.1093/humupd/dmt033 . ПМИД 24173881 . S2CID 18645125 .
- ^ Ко Х.Е., Цао С., Миттендорфер Б. (январь 2022 г.). «Клиренс инсулина при ожирении и диабете 2 типа» . Международный журнал молекулярных наук . 23 (2): 596. doi : 10.3390/ijms23020596 . ПМЦ 8776220 . ПМИД 35054781 .
- ^ «ЭК 1.8.4.2» . iubmb.qmul.ac.uk . Проверено 25 июля 2022 г.
- ^ Дакворт У.К., Беннетт Р.Г., Хэмел Ф.Г. (октябрь 1998 г.). «Деградация инсулина: прогресс и потенциал» . Эндокринные обзоры . 19 (5): 608–24. дои : 10.1210/edrv.19.5.0349 . ПМИД 9793760 .
- ^ Палмер Б.Ф., Генрих В.Л. «Углеводный и инсулиновый обмен при хронической болезни почек» . UpToDate, Inc.
- ^ Д'Эон ТМ, Пирс К.А., Руа Дж.Дж., Тайлер А., Чен Х., Тейшейра С.Р. (май 2008 г.). «Роль резистентности адипоцитов к инсулину в патогенезе повышения уровня эндоканнабиноидов, связанного с ожирением» . Диабет . 57 (5): 1262–68. дои : 10.2337/db07-1186 . ПМИД 18276766 .
- ^ Гатта-Черифи Б, Кота Д (февраль 2016 г.). «Новые взгляды на роль эндоканнабиноидной системы в регуляции энергетического баланса» . Международный журнал ожирения . 40 (2): 210–19. дои : 10.1038/ijo.2015.179 . ПМИД 26374449 . S2CID 20740277 .
- ^ Ди Марзо V (август 2008 г.). «Эндоканнабиноидная система при ожирении и диабете 2 типа» . Диабетология . 51 (8): 1356–67. дои : 10.1007/s00125-008-1048-2 . ПМИД 18563385 .
- ^ Перейти обратно: а б с д и ж «Гипогликемия» . Национальный институт диабета, заболеваний органов пищеварения и почек . Октябрь 2008 г. Архивировано из оригинала 1 июля 2015 г. Проверено 28 июня 2015 г.
- ^ Янаи Х., Адачи Х., Кацуяма Х., Морияма С., Хамасаки Х., Сако А. (февраль 2015 г.). «Причинные антидиабетические препараты и основные клинические факторы гипогликемии у пациентов с диабетом» . Всемирный журнал диабета . 6 (1): 30–6. дои : 10.4239/wjd.v6.i1.30 . ПМЦ 4317315 . ПМИД 25685276 .
- ^ Перейти обратно: а б Шриер Р.В. (2007). Справочник по внутренним болезням реальные пациенты, реальные ответы (3-е изд.). Филадельфия: Липпинкотт Уильямс и Уилкинс. п. 119. ИСБН 978-0-7817-6529-9 . Архивировано из оригинала 1 июля 2015 года.
- ^ Перкин Р.М. (2008). Детская госпитальная медицина : учебник стационарного ведения (2-е изд.). Филадельфия: Wolters Kluwer Health/Lippincott Williams & Wilkins. п. 105. ИСБН 978-0-7817-7032-3 . Архивировано из оригинала 1 июля 2015 года.
- ^ Макдональд ИА (ноябрь 2016 г.). «Обзор последних данных, касающихся сахара, резистентности к инсулину и диабета» . Европейский журнал питания . 55 (Приложение 2): 17–23. дои : 10.1007/s00394-016-1340-8 . ПМК 5174139 . ПМИД 27882410 .
- ^ Геттье Дж. М., Горден П. (март 2010 г.). «Секреция инсулина и инсулинпродуцирующие опухоли» . Экспертный обзор эндокринологии и обмена веществ . 5 (2): 217–227. дои : 10.1586/eem.09.83 . ПМЦ 2853964 . ПМИД 20401170 .
- ^ Саклайен М.Г. (февраль 2018 г.). «Глобальная эпидемия метаболического синдрома» . Текущие отчеты о гипертонии . 20 (2): 12. дои : 10.1007/s11906-018-0812-z . ПМК 5866840 . ПМИД 29480368 .
- ^ Эль Хайек С., Битар Л., Хамдар Л.Х., Мирза Ф.Г., Дауд Г. (5 апреля 2016 г.). «Синдром поликистозных яичников: обновленный обзор» . Границы в физиологии . 7 : 124. doi : 10.3389/fphys.2016.00124 . ПМЦ 4820451 . ПМИД 27092084 .
- ^ Марсиал Г.Г. (13 августа 2007 г.). «От SemBiosys: новый вид инсулина» . Внутри Уолл-стрит . Архивировано из оригинала 17 ноября 2007 года.
- ^ Аналог инсулина
- ^ Веккьо И, Торнали К, Брагацци Н.Л., Мартини М (23 октября 2018 г.). «Открытие инсулина: важная веха в истории медицины» . Границы эндокринологии . 9 : 613. дои : 10.3389/fendo.2018.00613 . ПМК 6205949 . ПМИД 30405529 .
- ^ Гаст К., Шулер А., Вольф М., Тальхаммер А., Бертольд Х., Нагель Н. и др. (ноябрь 2017 г.). «Быстродействующие и человеческие инсулины: кинетика диссоциации гексамеров при разбавлении фармацевтического состава» . Фармацевтические исследования . 34 (11): 2270–2286. дои : 10.1007/s11095-017-2233-0 . ПМЦ 5643355 . ПМИД 28762200 .
- ^ Ульрих Х., Снайдер Б., Гарг С.К. (2007). «Сочетание инсулинов для оптимального контроля уровня глюкозы в крови при диабете I и 2 типа: фокус на инсулин глулизин» . Сосудистое здоровье и управление рисками . 3 (3): 245–54. ПМК 2293970 . ПМИД 17703632 .
- ^ Сильвер Б., Рамайя К., Эндрю С.Б., Фредрик О., Баджадж С., Калра С. и др. (апрель 2018 г.). «Руководство EADSG: инсулинотерапия при диабете» . Терапия диабета . 9 (2): 449–492. дои : 10.1007/s13300-018-0384-6 . ПМК 6104264 . ПМИД 29508275 .
- ^ «Человеческий инсулин для инновационных биологических препаратов» . Ново Нордиск Фарматех . 22 октября 2021 г.
- ^ «Вы больны диабетом? Если да, то вы получите одноразовую иглу для инсулиновой ручки HMD по разумной цене» . amarujala.com . Проверено 8 июля 2022 г.
- ^ Вонг Сай, Мартинес Дж., Дасс Ч.Р. (2016). «Пероральная доставка инсулина для лечения диабета: статус-кво, проблемы и возможности» . Журнал фармации и фармакологии . 68 (9): 1093–108. дои : 10.1111/jphp.12607 . ПМИД 27364922 .
- ^ Шах Р.Б., Патель М., Маахс Д.М., Шах В.Н. (2016). «Методы доставки инсулина: прошлое, настоящее и будущее» . Международный журнал фармацевтических исследований . 6 (1): 1–9. дои : 10.4103/2230-973X.176456 . ПМЦ 4787057 . ПМИД 27014614 .
- ^ Шарма, Северная Каролина (1 октября 2021 г.). «ВОЗ добавляет новые лекарства в свой список основных лекарств» . мята . Проверено 9 октября 2021 г.
- ^ «Бесплатные рецепты (Англия)» . Диабет Великобритании . Проверено 21 ноября 2022 г.
Если вы используете инсулин или лекарства для лечения диабета... вы не платите ни за какие лекарства, которые вам прописали.
- ^ Сакула А. (июль 1988 г.). «Пауль Лангерганс (1847-1888): дань столетней годовщине» . Журнал Королевского медицинского общества . 81 (7): 414–5. дои : 10.1177/014107688808100718 . ПМК 1291675 . ПМИД 3045317 .
- ^ Пети Х. «Эдуард Лагесс (1861–1927)» . Музей региональной больницы Лилля (на французском языке) . Проверено 25 июля 2018 г.
- ^ Опи Э.Л. (1901). «Сахарный диабет, связанный с гиалиновой дегенерацией островков Лангерганса поджелудочной железы». Бюллетень больницы Джонса Хопкинса . 12 (125): 263–64. hdl : 2027/coo.31924069247447 .
- ^ Опи Э.Л. (1901). «О связи хронического интерстициального панкреатита с островами Лангерганса и сахарным диабетом» . Журнал экспериментальной медицины . 5 (4): 397–428. дои : 10.1084/jem.5.4.397 . ПМК 2118050 . ПМИД 19866952 .
- ^ Опи Э.Л. (1901). «Связь сахарного диабета с поражениями поджелудочной железы. Гиалиновая дегенерация островков Лангерганса» . Журнал экспериментальной медицины . 5 (5): 527–40. дои : 10.1084/jem.5.5.527 . ПМК 2118021 . ПМИД 19866956 .
- ^ Американский институт питания (1967). «Материалы тридцать первого ежегодного собрания Американского института питания». Журнал питания . 92 (4): 509. дои : 10.1093/jn/92.4.507 .
- ^ Паулеско, Северная Каролина (31 августа 1921 г.). «Исследование роли поджелудочной железы в усвоении питательных веществ» . Международный архив физиологии . 17 :85–109.
- ^ Лестрада Х (1997). «75-летие открытия инсулина» . Диабет и обмен веществ . 23 (1): 112.
- ^ де Лейва А., Брюг Э., де Лейва-Перес А. (2011). «Открытие инсулина: продолжающиеся споры спустя девяносто лет». Эндокринология и питание (английское издание) . 58 (9): 449–456. дои : 10.1016/j.endoen.2011.10.001 .
- ^ Веккьо И, Торнали К, Брагацци Н.Л., Мартини М (23 октября 2018 г.). «Открытие инсулина: важная веха в истории медицины» . Границы эндокринологии . 9 : 613. дои : 10.3389/fendo.2018.00613 . ПМК 6205949 . ПМИД 30405529 .
- ^ Бантинг Ф.Г. (31 октября 1920 г.). «Заметка от 31/20 окт. из вкладышей тетради 1920/21 г.» . Библиотеки Университета Торонто .
- ^ Перейти обратно: а б с Розенфельд Л. (декабрь 2002 г.). «Инсулин: открытие и споры» . Клиническая химия . 48 (12): 2270–88. дои : 10.1093/клинчем/48.12.2270 . ПМИД 12446492 .
- ^ Райт-младший (декабрь 2002 г.). «Почти знаменит: Э. Кларк Ноубл, связующий звено в открытии инсулина и винбластина» . CMAJ . 167 (12): 1391–96. ПМЦ 137361 . ПМИД 12473641 .
- ^ Кришнамурти К. (2002). Пионеры научных открытий . Публикации Миттала. п. 266. ИСБН 978-81-7099-844-0 . Проверено 26 июля 2011 г.
- ^ Блисс М (июль 1993 г.). «Переписывание истории болезни: Чарльз Бест и миф о Бантинге и Бесте» (PDF) . Журнал истории медицины и смежных наук . 48 (3): 253–74. дои : 10.1093/jhmas/48.3.253 . ПМИД 8409364 .
- ^ «Работа над диабетом показывает прогресс в борьбе с болезнью» . Торонто Стар Еженедельник . Библиотеки Университета Торонто. 14 января 1922 года.
- ^ Флетчер А.А. (ноябрь 1962 г.). «Ранний клинический опыт применения инсулина» . Журнал Канадской медицинской ассоциации . 87 (20): 1052–5. ПМЦ 1849803 . ПМИД 13945508 .
- ^ Бантинг Ф.Г. (декабрь 1921 г. - январь 1922 г.). «Записи пациентов Леонарда Томпсона» . Библиотеки Университета Торонто .
- ^ Цугер А (4 октября 2010 г.). «Открытие первого чудодейственного лекарства» . Нью-Йорк Таймс . Проверено 6 октября 2010 г.
Элизабет Хьюз была веселой, симпатичной маленькой девочкой пяти футов ростом, с прямыми каштановыми волосами и непреодолимым интересом к птицам. На диете Аллена ее вес упал до 65 фунтов, затем до 52 фунтов, а затем, после приступа диареи, который чуть не убил ее весной 1922 года, до 45 фунтов. К тому времени она прожила три года, намного дольше, чем ожидалось. А потом ее мать услышала новость: в Канаде наконец-то выделили инсулин.
- ^ Бантинг Ф.Г. (16 августа 1922 г.). «Диаграмма Элизабет Хьюз» . Библиотеки Университета Торонто .
- ^ Вудбери, DO (февраль 1963 г.). «Пожалуйста, спасите моего сына!» . Библиотеки Университета Торонто .
- ^ Маркотт Б. (22 ноября 2010 г.). «Джон Уильямс из Рочестера — человек научных талантов» . Демократ и хроника . Рочестер, Нью-Йорк . Компания Ганнетт . стр. 1Б, 4Б. Архивировано из оригинала 23 ноября 2010 года . Проверено 22 ноября 2010 г.
- ^ Комитет по инсулину Совета управляющих Университета Торонто (25 января 1922 г.). «Меморандум о сотрудничестве Антитоксиновых лабораторий Коннахта в исследованиях, проводимых доктором Бантингом, мистером Бестом и доктором Коллипом под общим руководством профессора Дж. Дж. Р. Маклауда с целью получения экстракта поджелудочной железы, оказывающего специфическое воздействие на кровь. концентрация сахара» . Библиотеки Университета Торонто .
- ^ Блисс М (2007). Открытие инсулина (изд. к 25-летию). Чикаго: Издательство Чикагского университета. п. 132. ИСБН 978-0-226-05899-3 . OCLC 74987867 .
Компания «Лилли» была бы рада сотрудничать с Торонто, писал Клоуз и намекал (возможно, намеренно, а может и нет), что Торонто можно обойти: «Я до сих пор воздерживался от начала работы в наших лабораториях в области этого вопроса, поскольку я был Стремясь никоим образом не вторгаться в сферу вашей деятельности и ваших коллег до тех пор, пока вы не опубликуете свои результаты, я чувствую, однако, что сейчас этот вопрос имеет такую неотложную важность, что нам следует без промедления приступить к экспериментальной стороне вопроса. , желательно сотрудничая с вами и вашими соратниками..."
- ^ Кендалл ЕС (10 апреля 1922 г.). «Письмо доктору Дж. Дж. Р. Маклеоду от 04.10.1922» . Библиотеки Университета Торонто: открытие и раннее развитие инсулина .
- ^ Маклауд Джей-Джей (28 апреля 1924 г.). «Заявление, зачитанное Дж. Дж. Р. Маклеодом на заседании Инсулинового комитета относительно патентов и гонораров 28 апреля 1924 г.» . Библиотеки Университета Торонто: открытие и раннее развитие инсулина .
- ^ Блисс М (2007). Открытие инсулина (изд. к 25-летию). Чикаго: Издательство Чикагского университета. стр. 131–133. ISBN 978-0-226-05899-3 . OCLC 74987867 .
- ^ Бантинг Ф.Г., Лучший C, Коллип Дж.С. (15 января 1923 г.). «Поручение губернаторам Университета Торонто» . Библиотеки Университета Торонто: открытие и раннее развитие инсулина .
- ^ «Копия статьи: Шаг вперед в медицинской этике» . Библиотеки Университета Торонто: открытие и раннее развитие инсулина . Мировая работа. Февраль 1923 года.
- ^ Блисс М (2007). Открытие инсулина (изд. к 25-летию). Чикаго: Издательство Чикагского университета. п. 181. ИСБН 978-0-226-05899-3 . OCLC 74987867 .
- ^ Абель Джей-Джей (февраль 1926 г.). «Кристаллический инсулин» . Труды Национальной академии наук Соединенных Штатов Америки . 12 (2): 132–6. Бибкод : 1926ПНАС...12..132А . дои : 10.1073/pnas.12.2.132 . ПМЦ 1084434 . ПМИД 16587069 .
- ^ Сомоги М., Дойзи Э.А., Шаффер П.А. (май 1924 г.). «О приготовлении инсулина» (PDF) . Журнал биологической химии . 60 (1): 31–58. дои : 10.1016/S0021-9258(18)85220-6 .
- ^ Дженсен Х, Эванс Э.А. (1 января 1935 г.). «Исследования кристаллического инсулина Xviii. Природа свободных аминогрупп в инсулине и выделение фенилаланина и пролина из кристаллического инсулина» (PDF) . Журнал биологической химии . 108 (1): 1–9. дои : 10.1016/S0021-9258(18)75301-5 .
- ^ Сэнгер Ф., Таппи Х. (сентябрь 1951 г.). «Аминокислотная последовательность в фенилаланильной цепи инсулина. I. Идентификация низших пептидов из частичных гидролизатов» . Биохимический журнал . 49 (4): 463–81. дои : 10.1042/bj0490463 . ПМК 1197535 . ПМИД 14886310 . ; Сэнгер Ф., Таппи Х. (сентябрь 1951 г.). «Аминокислотная последовательность фенилаланильной цепи инсулина. 2. Исследование пептидов из ферментных гидролизатов» . Биохимический журнал . 49 (4): 481–90. дои : 10.1042/bj0490481 . ПМК 1197536 . ПМИД 14886311 . ; Сэнгер Ф., Томпсон Э.О. (февраль 1953 г.). «Аминокислотная последовательность в глицильной цепи инсулина. I. Идентификация низших пептидов из частичных гидролизатов» . Биохимический журнал . 53 (3): 353–66. дои : 10.1042/bj0530353 . ПМК 1198157 . ПМИД 13032078 . ; Сэнгер Ф., Томпсон Э.О. (февраль 1953 г.). «Аминокислотная последовательность в глицильной цепи инсулина. II. Исследование пептидов из ферментных гидролизатов» . Биохимический журнал . 53 (3): 366–74. дои : 10.1042/bj0530366 . ПМК 1198158 . ПМИД 13032079 .
- ^ Кацояннис П.Г., Фукуда К, Томецко А, Сузуки К, Тилак М (1964). «Инсулиновые пептиды. X. Синтез B-цепи инсулина и ее сочетание с природным или синтетическим A-Chin для генерации активности инсулина». Журнал Американского химического общества . 86 (5): 930–32. дои : 10.1021/ja01059a043 .
- ^ Кунг Ю.Т., Ду Ю.К., Хуан В.Т., Чен К.С., Кэ Л.Т. (ноябрь 1965 г.). «Тотальный синтез кристаллического бычьего инсулина». Scientia Sinica . 14 (11): 1710–6. ПМИД 5881570 .

- ^ Марглин А., Меррифилд Р.Б. (ноябрь 1966 г.). «Синтез бычьего инсулина твердофазным методом». Журнал Американского химического общества . 88 (21): 5051–2. дои : 10.1021/ja00973a068 . ПМИД 5978833 .
- ^ Костин Дж.Е. (январь 2004 г.). «В чем преимущество наличия меланина в частях центральной нервной системы (например, в черной субстанции)?» . ИУБМБ Жизнь . 56 (1). Time Inc.: 47–9. дои : 10.1080/15216540310001659029 . ПМИД 14992380 . S2CID 85423381 .
- ^ Воллмер А., Дикен М.Л., Федервиш М., Де Мейтс П. (2002). Структура инсулина и родственных белков, функции и фармакология . Бостон: Академическое издательство Kluwer. ISBN 978-1-4020-0655-5 .
- ^ Цоу CL (2015). Воспоминания о синтетическом кристаллическом бычьем инсулине [Память об исследованиях синтеза бычьего инсулина]. 生命科学 [Китайский бюллетень наук о жизни] (на упрощенном китайском языке). 27 (6): 777–79.
- ^ Перейти обратно: а б Бланделл Т.Л., Катфилд Дж.Ф., Катфилд С.М., Додсон Э.Дж., Додсон Г.Г., Ходжкин Д.С. и др. (июнь 1971 г.). «Положения атомов в ромбоэдрических кристаллах инсулина 2-цинка». Природа . 231 (5304): 506–11. Бибкод : 1971Natur.231..506B . дои : 10.1038/231506a0 . ПМИД 4932997 . S2CID 4158731 .
- ^ Вебер, HE (1975) Диабет 24, 405. (см. рисунок)
- ^ Чан С.Дж., Кейм П., Штайнер Д.Ф. Бесклеточный синтез препроинсулинов крысы: характеристика и определение частичной аминокислотной последовательности. Proc Natl Acad Sci. США 1976;73:1964-1968.
- ^ «Сафлоры могут стать новым источником инсулина | Новости CTV» . www.ctvnews.ca . Февраль 2010 года . Проверено 12 ноября 2019 г. .
- ^ Кьельдсен Т. (сентябрь 2000 г.). «Дрожжевая секреторная экспрессия предшественников инсулина» (PDF) . Прикладная микробиология и биотехнология . 54 (3): 277–86. дои : 10.1007/s002530000402 . ПМИД 11030562 . S2CID 9246671 . Архивировано из оригинала (PDF) 27 сентября 2017 года.
- ^ «Нобелевская премия по физиологии и медицине 1923 года» . Нобелевский фонд.
- ^ Фельман А (22 ноября 2018 г.). «Кто открыл инсулин?» . Медицинские новости сегодня .
- ^ Замок ВБ (1962). «Лекция Гордона Уилсона. Столетие любопытства по поводу злокачественной анемии» . Труды Американской клинической и климатологической ассоциации . 73 : 54–80. ПМК 2249021 . ПМИД 21408623 .
- ^ Бантинг Ф.Г., Лучший Чемпион, Коллип Дж.Б., Кэмпбелл В.Р., Флетчер А.А. (март 1922 г.). «Экстракты поджелудочной железы в лечении сахарного диабета» . Журнал Канадской медицинской ассоциации . 12 (3): 141–46. ПМЦ 1524425 . ПМИД 20314060 .
- ^ Друри, Мичиган (июль 1972 г.). «Золотой юбилей инсулина». Журнал Ирландской медицинской ассоциации . 65 (14): 355–63. ПМИД 4560502 .
- ^ Мюррей I (апрель 1971 г.). «Паулеско и выделение инсулина». Журнал истории медицины и смежных наук . 26 (2): 150–57. дои : 10.1093/jhmas/XXVI.2.150 . ПМИД 4930788 .
Дальнейшее чтение
[ редактировать ]- Laws GM, Reaven A (1999). Инсулинорезистентность: метаболический синдром X. Тотова, Нью-Джерси: Humana Press. ISBN 978-0-89603-588-1 .
- Лихи Дж.Л., Чефалу WT (22 марта 2002 г.). Инсулиновая терапия (1-е изд.). Нью-Йорк: Марсель Деккер. ISBN 978-0-8247-0711-8 .
- Кумар С., О'Рахилли С. (14 января 2005 г.). Инсулинорезистентность: действие инсулина и его нарушения при заболеваниях . Чичестер, Англия: Уайли. ISBN 978-0-470-85008-4 .
- Эрлих А., Шредер К.Л. (16 июня 2000 г.). Медицинская терминология для медицинских профессий (4-е изд.). Томсон Делмар Обучение. ISBN 978-0-7668-1297-0 .
- Дразнин Б. , ЛеРойт Д. (сентябрь 1994 г.). Молекулярная биология диабета: аутоиммунитет и генетика; Синтез и секреция инсулина . Тотова, Нью-Джерси: Humana Press. ISBN 978-0-89603-286-6 .
- Мисбин Р.И. (февраль 2022 г.). ИНСУЛИН — история от инсайдера FDA . Вашингтон, округ Колумбия: Издательство «Политика и проза». ISBN 978-1-62429-391-7 . Архивировано из оригинала 29 июня 2022 года . Проверено 29 июня 2022 г.
- Знаменитые канадские врачи: сэр Фредерик Бантинг из Библиотеки и архивов Канады
- Маккидж К., Гоа КЛ (2001). «Инсулин гларгин: обзор его терапевтического применения в качестве средства длительного действия для лечения сахарного диабета 1 и 2 типов». Наркотики . 61 (11): 1599–624. дои : 10.2165/00003495-200161110-00007 . ПМИД 11577797 . S2CID 46972328 .
- де Лейва А., Брюгес Э., де Лейва-Перес А. (ноябрь 2011 г.). «[Открытие инсулина: продолжающиеся споры спустя девяносто лет]». Эндокринология и питание (на испанском языке). 58 (9): 449–56. дои : 10.1016/j.endonu.2011.10.001 . ПМИД 22036099 .
- Веккио И, Торнали С, Брагацци Н.Л., Мартини М (2018). «Открытие инсулина: важная веха в истории медицины» . Границы эндокринологии . 9 : 613. дои : 10.3389/fendo.2018.00613 . ПМК 6205949 . ПМИД 30405529 .
Внешние ссылки
[ редактировать ]- Коллекция библиотек Университета Торонто: открытие и раннее развитие инсулина, 1920–1925 гг.
- Цифровые архивы CBC – Бантинг, Бест, Маклауд, Коллип: в поисках лекарства от диабета
- Анимации действия инсулина в организме на сайте AboutKidsHealth.ca (архивировано 9 марта 2011 г.)
- Обзор всей структурной информации, доступной в PDB для UniProt : P01308 (Инсулин) в PDBe-KB .






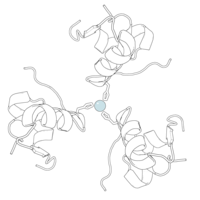





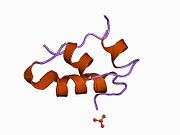

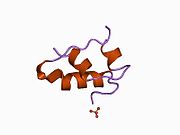
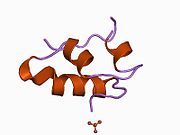

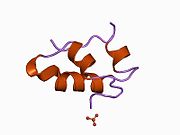

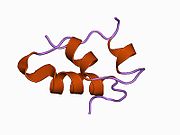


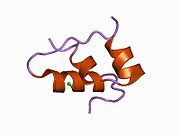
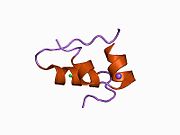
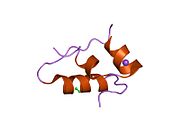


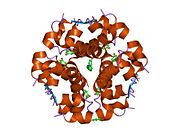






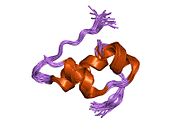



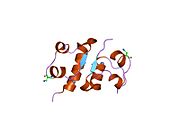

![1jco: Solution structure of the monomeric [Thr(B27)->Pro,Pro(B28)->Thr] insulin mutant (PT insulin)](http://upload.wikimedia.org/wikipedia/commons/thumb/9/9a/PDB_1jco_EBI.jpg/180px-PDB_1jco_EBI.jpg)

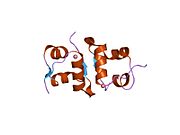
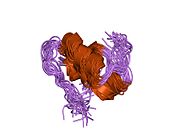
![1mhj: SOLUTION STRUCTURE OF THE SUPERACTIVE MONOMERIC DES-[PHE(B25)] HUMAN INSULIN MUTANT. ELUCIDATION OF THE STRUCTURAL BASIS FOR THE MONOMERIZATION OF THE DES-[PHE(B25)] INSULIN AND THE DIMERIZATION OF NATIVE INSULIN](http://upload.wikimedia.org/wikipedia/commons/thumb/e/e8/PDB_1mhj_EBI.jpg/180px-PDB_1mhj_EBI.jpg)