Проинсулин
| инсулин | |||
|---|---|---|---|
 Инсулин подвергается обширной посттрансляционной модификации на пути продукции. Производство и секреция в значительной степени независимы; подготовленный инсулин хранится в ожидании секреции. И С-пептид, и зрелый инсулин биологически активны. Клеточные компоненты и белки на этом изображении не в масштабе. | |||
| Идентификаторы | |||
| Символ | ИНС | ||
| ген NCBI | 3630 | ||
| HGNC | 6081 | ||
| МОЙ БОГ | 176730 | ||
| RefSeq | НМ_000207 | ||
| ЮниПрот | P01308 | ||
| Другие данные | |||
| Локус | Хр. 11 п15.5 | ||
| |||
Проинсулин является прогормона предшественником инсулина, вырабатываемого бета-клетками островков поджелудочной железы , специализированных областей поджелудочной железы . У человека проинсулин кодируется INS геном . [1] [2] Островки поджелудочной железы секретируют только от 1% до 3% интактного проинсулина. [3] Однако, поскольку проинсулин имеет более длительный период полураспада, чем инсулин, он может составлять от 5 до 30% инсулиноподобных структур, циркулирующих в крови. [3] Концентрация проинсулина выше после еды и ниже, когда человек голодает. [3] Кроме того, хотя проинсулин и инсулин имеют структурные различия, проинсулин все же демонстрирует некоторое сродство к рецептору инсулина . Из-за относительного сходства структуры проинсулин может производить от 5% до 10% метаболической активности, аналогично индуцируемой инсулином. [3]
Проинсулин представляет собой окончательную одноцепочечную белковую структуру, секретируемую клетками перед расщеплением на зрелый инсулин. [4] Проинсулин был открыт профессором Дональдом Ф. Штайнером из Чикагского университета в 1967 году. [5]
Структура
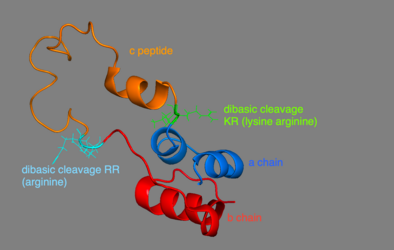
[ редактировать ]У человека проинсулин состоит из 86 остатков (у коров — 81), [6] и образован тремя отдельными цепочками. [7] Цепь А, цепь В и область, соединяющая их, называется С. пептидом [7] Правильная структура проинсулина имеет решающее значение для правильного сворачивания зрелого инсулина, поскольку размещение пептида C заставляет молекулу создавать правильно расположенные дисульфидные связи внутри и между цепями A и B. [7] [8] Есть три дисульфидные связи, которые необходимы для того, чтобы зрелый инсулин имел правильную структуру. Две из этих дисульфидных связей находятся между цепями А и В, а одна представляет собой связь внутри А-цепи. [7] Дисульфидные связи возникают между седьмыми остатками А- и В-цепей, 20-м остатком А-цепи и 19-м остатком В-цепи, а также 6-м и 11-м остатками А-цепи. [9]
Пептид C находится между цепями A и B проинсулина. [7] Соединение между A-цепью и C-пептидом гораздо более стабильно, чем соединение между C-пептидом и B-цепью, при этом вблизи соединения C-пептида и A-цепи проявляются признаки альфа-спирали. [10] Соединение цепи C-пептида-А происходит между остатками 64 и 65 проинсулина. Это молекулы лизина и аргинина соответственно. [10] Соединение C-пептид-B-цепь находится между двумя остатками аргинина в положениях 31 и 32 проинсулина. [10]
Среди видов млекопитающих сохраняется значительная часть структуры проинсулина, при этом большая часть изменений остатков наблюдается от одного вида к другому, присутствующих в C-пептиде. [8] [11] Тем не менее, остатки пептида C, консервативные у разных видов, взаимодействуют с аналогично консервативными остатками в цепях A и B. [8] Таким образом, предполагается, что эти консервативные остатки важны для функциональности зрелого инсулина. [8]
- 3D-модель проинсулина: цепь A обозначена синим цветом, цепь b — красным, пептид c — оранжевым. Двухосновное расщепление c-пептида и цепи находится в зеленом KR (лизин и аргинин), а для c-пептида и b-цепи - в голубом RR (аргинин).
Синтез и посттрансляционная модификация
[ редактировать ]Проинсулин синтезируется на мембраносвязанных рибосомах, расположенных на шероховатой эндоплазматической сети , где он сворачивается и его дисульфидные связи окисляются. Затем он транспортируется в аппарат Гольджи , где упаковывается в секреторные пузырьки и обрабатывается рядом протеаз с образованием зрелого инсулина . Зрелый инсулин содержит на 35 аминокислот меньше; 4 удаляются вообще, а оставшийся 31 образует С-пептид . С-пептид отделяется от центра последовательности проинсулина; два других конца (цепь B и цепь A) остаются соединенными дисульфидными связями. [ нужна ссылка ]
Посттрансляционная модификация проинсулина в зрелый инсулин происходит только в бета-клетках островков поджелудочной железы. [12] Когда проинсулин транспортируется через аппарат Гольджи, С-пептид расщепляется. [9] Это расщепление происходит с помощью двух эндопротеаз. [13] типа I Эндопротеазы , PC1 и PC3, разрушают соединение цепи C-пептида с цепью B. [13] PC2, эндопротеаза типа II, расщепляет связь C-пептид-А-цепь. [13] Образовавшаяся молекула, теперь уже зрелый инсулин, хранится в виде гексамера в секреторных пузырьках и стабилизируется с помощью ионы до тех пор, пока они не будут секретированы. [9]
Иммуногенность
[ редактировать ]Когда инсулин первоначально очищали из поджелудочной железы крупного рогатого скота или свиньи , весь проинсулин не был полностью удален. [14] [15] Когда некоторые люди использовали эти инсулины, проинсулин мог вызывать реакцию организма сыпью, сопротивление инсулину или даже образование вмятин или шишек на коже в месте инъекции инсулина. Это можно охарактеризовать как ятрогенное повреждение из-за небольших различий между проинсулинами разных видов. С конца 1970-х годов, когда был внедрен высокоочищенный свиной инсулин, а уровень чистоты инсулина достиг 99%, это перестало быть значимой клинической проблемой. [16] Что касается их влияния на фармакокинетику инсулина, умеренные концентрации определенных антител к инсулину могут иметь положительное преимущество для всех диабетиков без эндогенной секреции инсулина (например, людей с диабетом 1 типа ), поскольку антитела, связывающие инсулин, эффективно увеличивают скорость выведения инсулина и пространство его распределения, а также помогают продлить его фармакологический и биологический период полураспада. [17] [ нужны разъяснения ]
Медицинская значимость
[ редактировать ]Исторически сложилось так, что многие метаболические заболевания, связанные с инсулином, были сосредоточены на зрелом инсулине. Однако в последние годы возросла важность изучения структуры и функции проинсулина или соотношения проинсулин:инсулин. [18] в отношении этих заболеваний становится все более ясным.
Повышенный уровень проинсулина в системе кровообращения по сравнению с концентрациями зрелого инсулина может указывать на надвигающуюся резистентность к инсулину и развитие диабета 2 типа . [19] Дополнительные проблемы с проинсулином, которые могут привести к диабету, включают мутации в количестве присутствующих цистеинов, которые могут повлиять на правильное сворачивание. [9] Если мутация вызывает лишь незначительное изменение, она может просто вызвать стресс у способности эндоплазматического ретикулума правильно сворачивать белок. [9] Этот стресс через некоторое время приведет к уменьшению количества β-клеток, вырабатывающих зрелый инсулин, а затем приведет к сахарному диабету. [9]
Постнатальный проинсулин имеет решающее значение для регуляции обмена веществ. Однако проинсулин у новорожденных важен для нормального развития глазных нервов, развития сердца и общего выживания эмбриональных клеток. [20] Регулирование концентрации проинсулина во время эмбрионального развития имеет решающее значение, поскольку слишком много или слишком мало пептида может вызвать дефекты и смерть плода. [20] До сих пор при изучении неонатального сахарного диабета к заболеванию приводили только мутации, связанные с изменением аминокислот, обнаруженные в домене B. [9]
См. также
[ редактировать ]- инсулин
- препроинсулин
- сигнальный пептид
- сигнальный пептид пептидаза
- пропротеинконвертаза 1 (PC1)
- пропротеинконвертаза 2 (PC2)
Ссылки
[ редактировать ]- ^ «Энтрез Ген: Инсулин INS» .
- ^ Белл Дж.И., Пикте Р.Л., Раттер В.Дж., Корделл Б., Тишер Э., Гудман Х.М. (март 1980 г.). «Последовательность гена человеческого инсулина». Природа . 284 (5751): 26–32. Бибкод : 1980Natur.284...26B . дои : 10.1038/284026a0 . ПМИД 6243748 . S2CID 4363706 .
- ^ Jump up to: а б с д «Интерпретация 80908 Проинсулин плазма» . www.mayomedicallaboratories.com . Архивировано из оригинала 4 октября 2017 г. Проверено 9 марта 2017 г.
- ^ Ассали Н.С., Кларк К.Е., Зугайб М., Бринкман Ч.Р., Нувайхид Б. (1995). «Влияние эстрогенных гормонов на маточно-плацентарную гемодинамику и выработку прогестерона у овец» . Международный журнал фертильности . 23 (3): 219–23. ПМЦ 8333766 . ПМИД 40897 .
- ^ Филипсон Л.Х., Белл Г., Полонский К.С. (январь 2015 г.). «Дональд Ф. Штайнер, доктор медицинских наук, 1930–2014: первооткрыватель проинсулина» . Труды Национальной академии наук Соединенных Штатов Америки . 112 (4): 940–1. Бибкод : 2015PNAS..112..940P . дои : 10.1073/pnas.1423774112 . ПМЦ 4313841 . ПМИД 25561547 .
- ^ Учетный номер универсального белкового ресурса P01308 для «INS_HUMAN» на UniProt .
- ^ Jump up to: а б с д и Нолан С., Марголиаш Э., Петерсон Дж.Д., Штайнер Д.Ф. (май 1971 г.). «Строение бычьего проинсулина» . Журнал биологической химии . 246 (9): 2780–95. дои : 10.1016/S0021-9258(18)62252-5 . ПМИД 4928892 .
- ^ Jump up to: а б с д Снелл Ч.Р., Смит Д.Г. (август 1975 г.). «Проинсулин: предлагаемая трехмерная структура» . Журнал биологической химии . 250 (16): 6291–5. дои : 10.1016/S0021-9258(19)41065-X . ПМИД 808541 .
- ^ Jump up to: а б с д и ж г Вайс М.А. (июль 2009 г.). «Проинсулин и генетика сахарного диабета» . Журнал биологической химии . 284 (29): 19159–63. дои : 10.1074/jbc.R109.009936 . ПМК 2740536 . ПМИД 19395706 .
- ^ Jump up to: а б с Ян Ю, Хуа QX, Лю Дж, Симидзу Э.Х., Чокетт М.Х., Маккин Р.Б., Вайс М.А. (март 2010 г.). «Структура раствора проинсулина: гибкость соединяющего домена и обработка прогормонов» . Журнал биологической химии . 285 (11): 7847–51. дои : 10.1074/jbc.c109.084921 . ПМЦ 2832934 . ПМИД 20106974 .
- ^ Белл Дж.И., Пикте Р.Л., Раттер В.Дж., Корделл Б., Тишер Э., Гудман Х.М. (март 1980 г.). «Последовательность гена человеческого инсулина». Природа . 284 (5751): 26–32. Бибкод : 1980Natur.284...26B . дои : 10.1038/284026a0 . ПМИД 6243748 . S2CID 4363706 .
- ^ Гроскрейц DJ, Сливковски MX, Горман CM (февраль 1994 г.). «Генетически модифицированный проинсулин, конститутивно процессирующийся и секретируемый в виде зрелого активного инсулина» (PDF) . Журнал биологической химии . 269 (8): 6241–5. дои : 10.1016/S0021-9258(17)37593-2 . ПМИД 8119968 .
- ^ Jump up to: а б с Кауфманн Дж. Э., Ирмингер Дж. К., Халбан П. А. (сентябрь 1995 г.). «Требования к последовательности для обработки проинсулина на стыке B-цепи/C-пептида» . Биохимический журнал . 310 (3): 869–74. дои : 10.1042/bj3100869 . ПМК 1135976 . ПМИД 7575420 .
- ^ Уилсон Р.М., Дуглас К.А., Таттерсолл Р.Б., Ривз В.Г. (сентябрь 1985 г.). «Иммуногенность высокоочищенного бычьего инсулина: сравнение с обычным бычьим и высокоочищенным человеческим инсулином» . Диабетология . 28 (9): 667–70. дои : 10.1007/BF00291973 . ПМИД 3905477 .
- ^ Таниолак С., Голдфайн И.Д., Крун Л. «Фармакология инсулина, типы режимов и корректировки» . Эндотекст.com. Архивировано из оригинала 25 июля 2011 г. Проверено 18 марта 2011 г.
- ^ Домашний PD, Альберти К.Г. (ноябрь 1982 г.). «Новые инсулины. Их характеристики и клинические показания» . Наркотики . 24 (5): 401–13. дои : 10.2165/00003495-198224050-00003 . ПМИД 6756879 . S2CID 28616749 .
- ^ Грей Р.С., Коуэн П., ди Марио Ю, Элтон Р.А., Кларк Б.Ф., Дункан Л.Дж. (июнь 1985 г.). «Влияние антител к инсулину на фармакокинетику и биодоступность рекомбинантного человеческого и высокоочищенного говяжьего инсулина у инсулинозависимых диабетиков» . Британский медицинский журнал . 290 (6483): 1687–91. дои : 10.1136/bmj.290.6483.1687 . ПМК 1416075 . ПМИД 3924216 .
- ^ Мецца Т., Ферраро П.М., Сан В.А., Моффа С., Чефало С.М., Куеро Г. и др. (ноябрь 2018 г.). «Повышенная рабочая нагрузка β-клеток модулирует соотношение проинсулина к инсулину у людей». Диабет . 67 (11): 2389–2396. дои : 10.2337/db18-0279 . hdl : 2434/587996 . ПМИД 30131390 . S2CID 52058695 .
- ^ Микканен Л., Хаффнер С.М., Хейлз К.Н., Рённемаа Т., Лааксо М. (декабрь 1997 г.). «Взаимосвязь проинсулина, инсулина и соотношения проинсулина к инсулину с чувствительностью к инсулину и острой реакцией на инсулин у субъектов с нормогликемией». Диабет . 46 (12): 1990–5. дои : 10.2337/диаб.46.12.1990 . ПМИД 9392485 . S2CID 44874023 .
- ^ Jump up to: а б Эрнандес-Санчес К., Мансилья А., де ла Роса Э.Дж., де Пабло Ф. (июнь 2006 г.). «Проинсулин в развитии: новые роли древнего прогормона» . Диабетология . 49 (6): 1142–50. дои : 10.1007/s00125-006-0232-5 . hdl : 10261/72608 . ПМИД 16596360 .