Изоцитрат-лиаза
| Изоцитрат-лиаза | |||
|---|---|---|---|
 Гомотетрамерная структура изоцитратлиазы E. coli . На основе PDB 1IGW. [ 1 ] | |||
| Идентификаторы | |||
| Номер ЕС. | 4.1.3.1 | ||
| Номер CAS. | 9045-78-7 | ||
| Базы данных | |||
| ИнтЭнк | вид IntEnz | ||
| БРЕНДА | БРЕНДА запись | ||
| Экспаси | Просмотр NiceZyme | ||
| КЕГГ | КЕГГ запись | ||
| МетаЦик | метаболический путь | ||
| ПРЯМОЙ | профиль | ||
| PDB Структуры | RCSB PDB PDBe PDBsum | ||
| Генная онтология | АмиГО / QuickGO | ||
| |||
| Семейство изоцитрат-лиаз | |||
|---|---|---|---|
| Идентификаторы | |||
| Символ | ICL | ||
| Пфам | PF00463 | ||
| ИнтерПро | IPR000918 | ||
| PROSITE | PDOC00145 | ||
| ОБЛАСТЬ ПРИМЕНЕНИЯ 2 | 1ф8м / СКОПе / СУПФАМ | ||
| |||
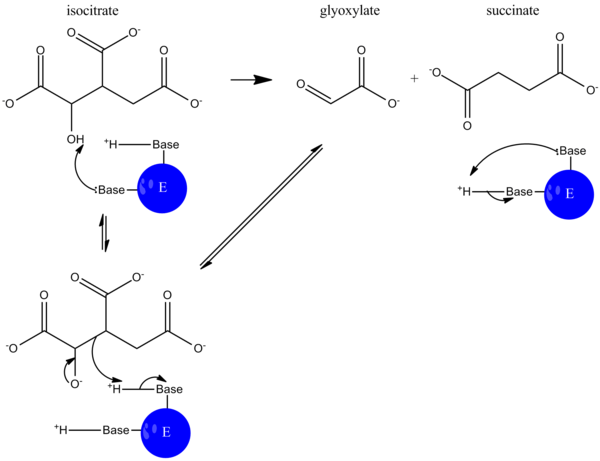
Изоцитратлиаза ( EC 4.1.3.1 ), или ICL , представляет собой фермент глиоксилатного цикла , который катализирует расщепление изоцитрата на сукцинат и глиоксилат . [ 2 ] [ 3 ] Вместе с малатсинтазой он обходит две стадии декарбоксилирования цикла трикарбоновых кислот (цикл ТСА) и используется бактериями, грибами и растениями. [ 4 ]
Систематическое название этого класса ферментов — изоцитратглиоксилатлиаза (сукцинатобразующая) . Другие широко используемые названия включают изоцитразу , изоцитритазу , изоцитратазу , трео-Ds-изоцитрат-глиоксилат-лиазу и изоцитрат-глиоксилат-лиазу . Этот фермент участвует в метаболизме глиоксилатов и дикарбоксилатов .
Механизм
[ редактировать ]Этот фермент принадлежит к семейству лиаз , в частности оксокислотлиаз, которые расщепляют углерод-углеродные связи. К этому семейству также принадлежат и другие ферменты, в том числе карбоксивинилкарбоксифосфонатфосфорилмутаза ( EC 2.7.8.23 ), которая катализирует превращение 1-карбоксивинилкарбоксифосфоната в 3-(гидрогидроксифосфорил)пируватдиоксид углерода, и фосфоенолпируватмутаза ( EC 5.4.2.9 ), которая участвует в биосинтезе трипептидных антибиотиков фосфинотрицина .
В ходе катализа изоцитрат депротонируется , а альдольное расщепление приводит к высвобождению сукцината и глиоксилата. Этот механизм реакции во многом аналогичен механизму реакции альдолазы при гликолизе , при котором разрывается связь углерод-углерод и высвобождается альдегид. [ 5 ]
В глиоксилатном цикле малатсинтаза затем катализирует конденсацию глиоксилата и ацетил-СоА с образованием малата, поэтому цикл может продолжаться.
ICL конкурирует с изоцитратдегидрогеназой , ферментом, присутствующим в цикле ТСА, за переработку изоцитрата. Поток через эти ферменты контролируется фосфорилированием изоцитратдегидрогеназы, которая имеет гораздо более высокое сродство к изоцитрату по сравнению с ICL. [ 6 ] Таким образом, дезактивация изоцитратдегидрогеназы путем фосфорилирования приводит к увеличению каналов изоцитрата через ICL, как это видно, когда бактерии выращиваются на ацетате , двухуглеродном соединении. [ 6 ]
Структура фермента
[ редактировать ]несколько структур По состоянию на 2023 год решено ICL. К ним относятся одна структура из Pseudomonas aeruginosa ( PDB код доступа 6G1O ), одна структура из Fusarium graminearum ( 5E9H ), одна структура из гриба Aspergillus nidulans ( 1DQU ), одна структура из Yersinia pestis ( 3LG3 ), одна структура из Burkholderia pseudomallei ( 3I4E ). , одна структура из Escherichia coli ( 1IGW ), две структуры из Magnaporthe oryzae ( 5E9F и 5E9G ), четыре структуры из Brucella melitensis ( 3P0X , 3OQ8 , 3EOL и 3E5B ) и одиннадцать структур из Mycobacterium Tuberculosis ( 1F61 , 1F8I , 1F8M , 6C4A , 6C4C , 5DQL , 6EDW , 6EDZ , 6EE1 , 6XPP и 8G8K ).
ICL состоит из четырех идентичных цепей и требует наличия магния. 2+ или Мн 2+ и тиол для активности. [ 4 ] Считается, что в Escherichia coli Lys-193, Lys-194, Cys-195, His-197 и His-356 являются каталитическими остатками, тогда как His-184, как полагают, участвует в сборке тетрамерного фермента. [ 7 ]
Между прокариотами и эукариотами разница в структуре ICL заключается в добавлении примерно 100 аминокислот вблизи центра эукариотического фермента. Считается, что у эукариот дополнительные аминокислоты участвуют в локализации ICL в одномембранных органеллах , называемых глиоксисомами . [ 4 ] [ 8 ] Эти дополнительные аминокислоты обуславливают разницу в молекулярной массе: прокариотическая ICL составляет 48 кДа, а эукариотическая ICL составляет 67 кДа. [ 4 ] Между последовательностями грибных, растительных и бактериальных ферментов консервативен только один остаток цистеина; он расположен в середине консервативного гексапептида.
Большинство ICL, охарактеризованных на сегодняшний день, содержат только один домен (каталитический домен). Однако в изоформе 2 ICL M.tuberculosis были обнаружены два домена. [ 9 ] С помощью структурных и кинетических исследований было обнаружено, что С-концевой домен является регуляторным доменом, который димеризуется с соответствующим С-концевым доменом из другой субъединицы (тетрамера ICL2) при связывании ацетил-коэнзима А, чтобы активировать каталитическую активность фермент. [ 9 ]
В M.tuberculosis H37Rv (обычно используемый лабораторный штамм) ген, кодирующий ICL2, был разделен на две открытые рамки считывания ( rv1915 и rv1916 ), таким образом кодируя Rv1915 (ICL2a) и Rv1916 (ICL2b) соответственно. Биологические функции Rv1915 (ICL2a) и Rv1916 (ICL2b) изучены плохо. Rv1915 и rv1916 первоначально были охарактеризованы как псевдогены. [ 10 ] Исследование in silico , проведенное в 2019 году, предсказало, что Rv1916 (ICL2b) может участвовать в синтезе вторичных метаболитов. [ 11 ] Исследования in vitro показали, что как Rv1915 (ICL2a), так и Rv1916 (ICL2b) могут катализировать превращение изоцитрата в образование сукцината и глиоксилата. [ 11 ] [ 12 ] Однако недавнее структурное и биохимическое исследование показало, что Rv1916 (ICL2b) не обладает активностью ICL. [ 13 ] Вместо этого исследование показало, что Rv1916 (ICL2b) представляет собой ацетил-КоА-связывающий белок с неизвестной биологической функцией. [ 13 ]
Анализы
[ редактировать ]несколько анализов Было разработано для изучения кинетики ферментов и ингибирования ICL. Наиболее часто используемые анализы включали использование химической или ферментативной ультрафиолетовой-видимой (УФ/видимой) спектроскопии для измерения количества образующегося глиоксилата. Например, глиоксилат может вступать в реакцию с фенилгидразином с образованием гидразона, который можно анализировать с помощью УФ/видимой спектроскопии. [ 14 ] Альтернативно, лактатдегидрогеназа может использоваться для катализа восстановления глиоксилата до гликолата в присутствии никотинамидадениндинуклеотида (НАДН), который является косубстратом лактатдегидрогеназы. В ходе реакции НАДН окисляется до НАД. + . Уменьшение концентрации НАДН затем можно измерить с помощью УФ/видимой спектроскопии с использованием красителя. [ 10 ] Помимо спектроскопических методов, биофизические методы, включая нативную неденатурирующую масс-спектрометрию и спектроскопию ядерного магнитного резонанса (ЯМР). для изучения ICL также применялись [ 15 ] [ 16 ]
Биологическая функция
[ редактировать ]Фермент ICL оказался функциональным у различных архей , бактерий , простейших , растений , грибов и нематод . [ 17 ] Хотя ген обнаружен в геномах нематод и книдарий, он не обнаружен в геномах плацентарных млекопитающих. [ 17 ]
Отводя изоцитрат из цикла ТСА, действие ICL и малатсинтазы в глиоксилатном цикле приводит к чистой ассимиляции углерода из двухуглеродных соединений. [ 18 ] Таким образом, хотя цикл ТСА не приводит к чистой ассимиляции углерода, глиоксилатный цикл генерирует промежуточные продукты, которые можно использовать для синтеза глюкозы (посредством глюконеогенеза ), а также других продуктов биосинтеза. В результате организмы, использующие ICL и малатсинтазу, способны синтезировать глюкозу и промежуточные продукты ее метаболизма из ацетил-КоА, полученного из ацетата, или в результате деградации этанола, жирных кислот или поли-β-гидроксибутирата. [ 4 ] Эта функция особенно важна для высших растений при использовании масел семян. В прорастающих семенах при расщеплении масел образуется ацетил-КоА. Это служит субстратом для глиоксилатного цикла, в ходе которого образуются промежуточные продукты, которые служат основным источником питательных веществ до начала производства сахаров посредством фотосинтеза . [ 8 ]
У M.tuberculosis изоформы ICL 1 и 2 также играют роль метилизоцитратлиазы , превращая метилизоцитрат в сукцинат и пируват. [ 9 ] [ 19 ] Это важно, поскольку метилцитратный цикл является ключевым для выживания бактерий, питающихся жирными кислотами с нечетной цепью . [ 20 ]
Актуальность заболевания
[ редактировать ]Было обнаружено, что ICL играет важную роль в патогенезе человека, животных и растений. [ 4 ] Для некоторых сельскохозяйственных культур, включая зерновые, огурцы и дыни, повышенная экспрессия гена, кодирующего ICL, важна для вирулентности грибов. [ 4 ] Например, повышенная экспрессия гена icl1 наблюдалась у гриба Leptosphaeria maculans при заражении канолы . Инактивация гена icl1 приводит к снижению патогенности гриба, что, как полагают, является результатом неспособности гриба использовать источники углерода, предоставляемые растением. [ 21 ]
Кроме того, активация глиоксилатного цикла наблюдалась у патогенов, поражающих человека. Так обстоит дело с такими грибами, как Candida albicans , которые обитают на коже, ротовой полости, желудочно-кишечном тракте, кишечнике и влагалище млекопитающих и могут приводить к системным инфекциям у пациентов с ослабленным иммунитетом; а также для бактерии Mycobacterium Tuberculosis , основного возбудителя туберкулеза . [ 22 ] [ 23 ] В последнем случае было обнаружено, что ICL необходим для выживания в организме хозяина. [ 24 ] Таким образом, ICL в настоящее время является мишенью ингибирования при терапевтическом лечении туберкулеза. [ 25 ]
Из-за его использования патогенными грибами и бактериями ведется поиск специфических ингибиторов ICL и малатсинтазы. [ 4 ] Хотя некоторые ингибиторы уже идентифицированы, в том числе итаконат , итаконовый ангидрид, бромпируват , нитропропионат, оксалат и малат , они неспецифичны и также могут ингибировать другие ферменты, необходимые для функционирования хозяина. [ 4 ] [ 26 ] [ 27 ] Необходимы дополнительные исследования для выявления ингибиторов, избирательно воздействующих на ферменты глиоксилатного цикла.
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Бриттон К.Л., Абейсингхе И.С., Бейкер П.Дж., Барынин В., Диль П., Лэнгридж С.Дж. и др. (сентябрь 2001 г.). «Структура и доменная организация изоцитратлиазы Escherichia coli». Акта Кристаллографика. Раздел D. Биологическая кристаллография . 57 (Часть 9): 1209–18. дои : 10.1107/S0907444901008642 . ПМИД 11526312 .
- ^ Бичинг-младший (декабрь 1989 г.). «Высокая консервативность последовательности изоцитрат-лиазы из Escherichia coli и Ricinus communis». Белковые последовательности и анализ данных . 2 (6): 463–6. ПМИД 2696959 .
- ^ Атоми Х., Уэда М., Хикида М., Хишида Т., Тераниши Ю., Танака А. (февраль 1990 г.). «Пероксисомальная изоцитратлиаза н-алканассимилирующих дрожжей Candidatropicis: анализ и характеристика генов». Журнал биохимии . 107 (2): 262–6. doi : 10.1093/oxfordjournals.jbchem.a123036 . ПМИД 2361956 .
- ^ Jump up to: а б с д и ж г час я Данн М.Ф., Рамирес-Трухильо Х.А., Эрнандес-Лукас I (октябрь 2009 г.). «Основная роль изоцитратлиазы и малатсинтазы в бактериальном и грибковом патогенезе» . Микробиология . 155 (Часть 10): 3166–75. дои : 10.1099/mic.0.030858-0 . ПМИД 19684068 .
- ^ Гарретт Р., Гришэм К.Н. (2008). Биохимия . Брукс Коул. стр. 588 . ISBN 978-0-495-10935-8 .
- ^ Jump up to: а б Коззоне Эй Джей (1998). «Регуляция метаболизма ацетата путем фосфорилирования белков у кишечных бактерий». Ежегодный обзор микробиологии . 52 : 127–64. дои : 10.1146/аннурев.микро.52.1.127 . ПМИД 9891796 .
- ^ Рехман А., Макфадден Б.А. (июль 1997 г.). «Лизин 194 функционален в изоцитратлиазе Escherichia coli». Современная микробиология . 35 (1): 14–7. дои : 10.1007/s002849900203 . ПМИД 9175553 . S2CID 23972776 .
- ^ Jump up to: а б Истмонд П.Дж., Грэм И.А. (февраль 2001 г.). «Пересмотр роли глиоксилатного цикла в масличных семенах». Тенденции в науке о растениях . 6 (2): 72–8. дои : 10.1016/S1360-1385(00)01835-5 . ПМИД 11173291 .
- ^ Jump up to: а б с Бхусал, РП; Цзяо, В.; Квай, BXC; Рейниссон, Дж.; Коллинз, Эй Джей; Сперри, Дж.; Башири, Г.; Люнг, IKH (октябрь 2019 г.). «Ацетил-КоА-опосредованная активация изоцитратлиазы 2 микобактерий туберкулеза» . Природные коммуникации . 10 (1): 4639. Бибкод : 2019NatCo..10.4639B . дои : 10.1038/s41467-019-12614-7 . ПМК 6788997 . ПМИД 31604954 .
- ^ Jump up to: а б Хёнер Зу Бентруп К., Мичак А., Свенсон Д.Л., Рассел Д.Г. (декабрь 1999 г.). «Характеристика активности и экспрессии изоцитратлиазы в Mycobacterium avium и Mycobacterium Tuberculosis» . Журнал бактериологии . 181 (23): 7161–7. дои : 10.1128/JB.181.23.7161-7167.1999 . ПМК 103675 . ПМИД 10572116 .
- ^ Jump up to: а б Антил М., Шарма Дж., Бриссонне Ю., Чоудхари М., Гуэн С., Гупта В. (сентябрь 2019 г.). «Понимание структурных функций неуловимого белка Rv1916 микобактерии туберкулеза» (PDF) . Международный журнал биологических макромолекул . 141 : 927–936. doi : 10.1016/j.ijbiomac.2019.09.038 . ПМИД 31505209 . S2CID 202556684 .
- ^ Антил М, Гупта В (июнь 2022 г.). «Rv1915 и Rv1916 из микобактерии туберкулеза H37Rv образуют in vitro белок-белковый комплекс». Biochimica et Biophysical Acta (BBA) – Общие предметы . 1866 (6): 130130. doi : 10.1016/j.bbagen.2022.130130 . ПМИД 35307510 .
- ^ Jump up to: а б Хуанг Э.Ю., Квай Б.Х., Бхусал Р.П., Башири Г., Люнг, И.К. (май 2023 г.). «Микобактерия туберкулеза Rv1916 представляет собой ацетил-КоА-связывающий белок» . ХимБиоХим . 24 (14): e202300162. дои : 10.1002/cbic.202300162 . ПМИД 37211532 .
- ^ «Труды Биохимического общества» . Биохимический журнал . 72 (1): 1П–13П. Май 1959 г. doi : 10.1042/bj0720001P . ПМК 1196904 . ПМИД 16748793 .
- ^ Фам ТВ, Муркин А.С., Мойнихан М.М., Харрис Л., Тайлер П.С., Шетти Н. и др. (июль 2017 г.). «Микобактерия туберкулеза» . Труды Национальной академии наук Соединенных Штатов Америки . 114 (29): 7617–7622. дои : 10.1073/pnas.1706134114 . ПМЦ 5530696 . ПМИД 28679637 .
- ^ Бхусал Р.П., Патель К., Квай Б.Х., Сварджес А., Башири Г., Рейниссон Дж. и др. (ноябрь 2017 г.). «Ингибиторы изоцитратлиазы микобактерий туберкулеза» . МедХимКомм . 8 (11): 2155–2163. дои : 10.1039/C7MD00456G . ПМК 6072051 . ПМИД 30108733 .
- ^ Jump up to: а б Кондрашов Ф.А., Кунин Е.В., Моргунов И.Г., Финогенова Т.В., Кондрашова М.Н. (октябрь 2006 г.). «Эволюция ферментов глиоксилатного цикла у Metazoa: свидетельства множественных событий горизонтального переноса и образования псевдогенов» . Биология Директ . 1 (31): 31. дои : 10.1186/1745-6150-1-31 . ПМК 1630690 . ПМИД 17059607 .
- ^ Корнберг Х.Л., Кребс Х.А. (май 1957 г.). «Синтез компонентов клетки из C2-единиц с помощью модифицированного цикла трикарбоновых кислот». Природа . 179 (4568): 988–91. Бибкод : 1957Natur.179..988K . дои : 10.1038/179988a0 . ПМИД 13430766 . S2CID 40858130 .
- ^ Гулд Т.А., ван де Лангемхин Х., Муньос-Элиас Э.Дж., МакКинни Дж.Д., Сакчеттини Дж.К. (август 2006 г.). «Двойная роль изоцитратлиазы 1 в глиоксилатном и метилцитратном циклах у микобактерий туберкулеза» . Молекулярная микробиология . 61 (4): 940–7. дои : 10.1111/j.1365-2958.2006.05297.x . ПМИД 16879647 . S2CID 26099043 .
- ^ Эо Х, Ри К.Ю. (апрель 2014 г.). «Метилцитратный цикл определяет бактерицидную значимость изоцитратлиазы для выживания микобактерий туберкулеза на жирных кислотах» . Труды Национальной академии наук Соединенных Штатов Америки . 111 (13): 4976–81. Бибкод : 2014PNAS..111.4976E . дои : 10.1073/pnas.1400390111 . ПМЦ 3977286 . ПМИД 24639517 .
- ^ Иднурм А., Хоулетт Б.Дж. (октябрь 2002 г.). «Изоцитратлиаза необходима для патогенности гриба Leptosphaeria maculans для канолы (Brassica napus)» . Эукариотическая клетка . 1 (5): 719–24. doi : 10.1128/EC.1.5.719-724.2002 . ПМК 126752 . ПМИД 12455691 .
- ^ Лоренц М.К., Бендер Я.А., Финк Г.Р. (октябрь 2004 г.). «Транкрипционный ответ Candida albicans при интернализации макрофагами» . Эукариотическая клетка . 3 (5): 1076–87. doi : 10.1128/EC.3.5.1076-1087.2004 . ПМК 522606 . ПМИД 15470236 .
- ^ Шривастава В., Джайн А., Шривастава Б.С., Шривастава Р. (май 2008 г.). «Отбор генов микобактерий туберкулеза, активируемых при проживании в легких инфицированных мышей». Туберкулез . 88 (3): 171–7. дои : 10.1016/j.tube.2007.10.002 . ПМИД 18054522 .
- ^ Муньос-Элиас Э.Дж., МакКинни Джей.Д. (июнь 2005 г.). «Изоцитрат-лиазы 1 и 2 микобактерии туберкулеза совместно необходимы для роста и вирулентности in vivo» . Природная медицина . 11 (6): 638–44. дои : 10.1038/nm1252 . ПМЦ 1464426 . ПМИД 15895072 .
- ^ Бхусал Р.П., Башири Дж., Квай Б.С., Сперри Дж., Люнг И.К. (июль 2017 г.). «Нацеливание изоцитратлиазы на лечение латентного туберкулеза». Открытие наркотиков сегодня . 22 (7): 1008–1016. дои : 10.1016/j.drudis.2017.04.012 . ПМИД 28458043 .
- ^ Кратки М., Виншова Ю. (декабрь 2012 г.). «Достижения в области нацеливания и ингибиторов микобактериальной изоцитратлиазы». Современная медицинская химия . 19 (36): 6126–37. дои : 10.2174/0929867311209066126 . ПМИД 23092127 .
- ^ Ли Й.В., Вахаб Х.А., Чунг Й.С. (2015). «Потенциальные ингибиторы изоцитратлиазы микобактерий туберкулеза и не-M.tuberculosis: краткое содержание» . БиоМед Исследования Интернэшнл . 2015 : 895453. doi : 10.1155/2015/895453 . ПМК 4306415 . ПМИД 25649791 .
Дальнейшее чтение
[ редактировать ]- Макфадден Б.А., Хоуз В.В. (1963). «Кристаллизация и некоторые свойства изоцитратлиазы Pseudomonas indigofera» . Ж. Биол. Хим . 238 (5): 1737–1742. дои : 10.1016/S0021-9258(18)81129-2 .
- Шиио И, Шио Т., Макфадден Б.А. (январь 1965 г.). «Изоцитратлиаза Pseudomonas indigofera I. Получение, аминокислотный состав и молекулярная масса». Biochimica et Biophysical Acta (BBA) - Нуклеиновые кислоты и синтез белка . 96 : 114–22. дои : 10.1016/0005-2787(65)90615-5 . ПМИД 14285253 .
- Викери Х.Б. (июнь 1962 г.). «Предлагаемая новая номенклатура изомеров изолимонной кислоты» . Журнал биологической химии . 237 (6): 1739–41. дои : 10.1016/S0021-9258(19)73928-3 . ПМИД 13925783 .