Фосфоенолпируватмутаза
| фосфоенолпируватмутаза | |||
|---|---|---|---|
| Идентификаторы | |||
| Номер ЕС. | 5.4.2.9 | ||
| Номер CAS. | 115756-49-5 | ||
| Базы данных | |||
| ИнтЭнк | вид IntEnz | ||
| БРЕНДА | БРЕНДА запись | ||
| Экспаси | Просмотр NiceZyme | ||
| КЕГГ | КЕГГ запись | ||
| МетаЦик | метаболический путь | ||
| ПРЯМОЙ | профиль | ||
| PDB Структуры | RCSB PDB PDBe PDBsum | ||
| Генная онтология | АмиГО / QuickGO | ||
| |||
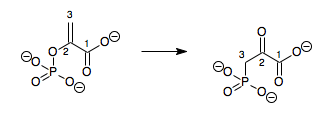
В энзимологии фосфоенолпируватмутаза КФ ( фермент 5.4.2.9 ) представляет собой , химическую катализирующий реакцию .
- фосфоенолпируват 3-фосфонопируват
Следовательно, этот фермент имеет один субстрат — фосфоенолпируват (PEP) и один продукт — 3-фосфонопируват (PPR), которые являются структурными изомерами .
Этот фермент принадлежит к семейству изомераз , а именно фосфотрансфераз (фосфомутаз), которые переносят фосфатные группы внутри молекулы. Систематическое название этого класса ферментов — фосфоенолпируват-2,3-фосфономутаза . Другие широко используемые названия включают фосфоенолпируват-фосфонопируватфосфомутазу , PEP-фосфомутазу , фосфоенолпируват-фосфомутазу , PEPPM и PEP-фосфомутазу . Этот фермент участвует в метаболизме аминофосфонатов .
Фосфоенолпируватмутаза была открыта в 1988 году. [ 1 ] [ 2 ]
Структурные исследования
[ редактировать ]По состоянию на конец 2007 года для этого класса ферментов было решено 6 структур , все — группой Герцберга [1] из Университета Мэриленда с использованием PEPPM из голубой мидии edulis Mytilus . Первая структура ( PDB код доступа 1PYM ) была решена в 1999 году и содержала ингибитор оксалата магния. [ 3 ] Эта структура идентифицировала фермент как состоящий из идентичных субъединиц бета-цилиндра (демонстрирующих складку TIM-цилиндра , которая состоит из восьми параллельных бета-цепей ). Наблюдалась димеризация, при которой спираль каждой субъединицы взаимодействует со стволом другой субъединицы; авторы назвали эту особенность «заменой спирали». Димеры также могут димеризоваться с образованием гомотетрамерного фермента. На основе этого исследования был предложен механизм двойного переноса фосфорила: он будет включать разрыв фосфорно-кислородной связи PEP с образованием промежуточного фосфофермента с последующим переносом фосфорильной группы от фермента к углероду-3 с образованием PPR.
Однако совсем недавно была решена структура с сульфопируватным ингибитором, который является более близким аналогом субстрата ( 1M1B ); [ 4 ] вместо этого это исследование подтвердило диссоциативный механизм . Примечательной особенностью этих структур была защита активного центра от растворителя; Было высказано предположение, что значительное конформационное изменение , переводящее белок из «открытого» состояния в «закрытое», и это было подтверждено несколькими кристаллическими структурами в открытом состоянии. при связывании происходит [ 5 ] Три из них были дикого типа : апофермент в 1S2T , фермент плюс его кофактор иона магния в 1S2V и фермент с высокой ионной силой в 1S2W . Мутант (D58A, в одной из петель активного центра) также кристаллизовался в виде апофермента ( 1S2U ). На основе этих структур была идентифицирована «воротниковая» петля активного центра (остатки 115–133), которая защищает подложку от растворителя в закрытой конформации.
Две конформации, взятые из кристаллических структур 1M1B (закрытая) и 1S2T (открытая), состыкованы друг с другом на изображениях ниже; они различаются незначительно, за исключением воротной петли, которая окрашена в фиолетовый цвет для закрытой конформации и синий для открытой конформации. На крупном плане активного центра (слева) также включены несколько боковых цепей (голубой), которые были идентифицированы как важные для катализа; обзор (справа) иллюстрирует характерную складку, меняющую спираль. Изображения представляют собой кадры из ленточных киноизображений . Обе эти структуры кристаллизовались в виде димеров. В цепи А (используемой для крупного плана активного сайта) спирали красные, петли (кроме воротной петли) белые, а бета-цепи зеленые; в цепи Б спирали желтые, бета-тяжи оливковые, петли серые; эти цвета одинаковы для закрытых и открытых конструкций. Ионы магния серые, сульфопируватные лиганды розовые; оба имеют закрытую структуру (хотя фермент также кристаллизовался только со связанным магнием и принял открытую конформацию).
Структура PEPPM очень похожа на структуру метилизоцитратлиазы - фермента, участвующего в метаболизме пропаноата , субстратом которого также является низкомолекулярная карбоновая кислота - структура бета-цилиндра, а также расположение активного центра и геометрия мультимеризации такие же. Изоцитратлиаза также очень похожа, хотя каждая субъединица имеет второй, меньший по размеру бета-домен в дополнение к основному бета-цилиндру.
Механизм
[ редактировать ]Считается, что фосфоенолпируватмутаза обладает диссоциативным механизмом. [ 4 ] Ион магния участвует в качестве кофактора. Фосфорильная/фосфатная группа также, по-видимому, ионно взаимодействует с Arg159 и His190, стабилизируя реакционноспособное промежуточное соединение. Образование промежуточного фосфофермента маловероятно, поскольку наиболее возможные остатки ковалентного аддукта могут быть мутированы лишь с частичной потерей функции. Реакция включает диссоциацию фосфора от кислорода 2 и последующую нуклеофильную атаку углерода 3 на фосфор. Примечательно, что конфигурация фосфора сохраняется, т.е. углерод 3 PPR присоединяется к той же поверхности фосфора, из которой был удален кислород 2 PEP; это было бы маловероятно для неферментативно-катализируемого диссоциативного механизма, но поскольку реакционноспособное промежуточное соединение сильно взаимодействует с аминокислотами и ионами магния активного центра, этого следует ожидать в присутствии ферментативного катализа.
Остатки в воротной петле активного центра, особенно Lys120, Asn122 и Leu124, также, по-видимому, взаимодействуют с субстратом и реактивным промежуточным продуктом; эти взаимодействия объясняют, почему петля переходит в закрытую конформацию при связывании субстрата.
Биологическая функция
[ редактировать ]Поскольку фосфоенолпируватмутаза обладает необычной способностью образовывать новую углерод-фосфорную связь, она важна для синтеза фосфонатов , таких как фосфонолипиды и антибиотики фосфомицин и биалафос . Образование этой связи совершенно термодинамически невыгодно; даже несмотря на то, что PEP представляет собой очень высокоэнергетическое фосфатное соединение, равновесие при взаимном превращении PEP-PPR по-прежнему благоприятствует PEP. [ 1 ] Фермент фосфонопируватдекарбоксилаза представляет собой решение этой проблемы: он катализирует очень термодинамически выгодное декарбоксилирование PPR, и образующийся 2-фосфоноацетальдегид затем превращается в биологически полезные фосфонаты. Это позволяет реакции фосфонеолпирувата идти в прямом направлении в соответствии с принципом Ле Шателье . Декарбоксилирование быстро удаляет продукт, и, таким образом, реакция продвигается вперед, хотя реагента было бы гораздо больше, чем продукта, если бы системе позволили достичь равновесия самостоятельно.
Фермент карбоксифосфоенолпируватфосфономутаза выполняет аналогичную реакцию, превращая P-карбоксифосфоенолпируват в фосфинопируват и углекислый газ . [2] [ 6 ]
Ссылки
[ редактировать ]- ^ Jump up to: а б Боуман Э., Маккуини М., Барри Р.Дж., Данауэй-Мариано Д. (1988). «Катализ и термодинамика фосфоенолпируватной фосфонопируватной перегруппировки - вхождение в фосфонатный класс природных фосфорорганических соединений». Дж. Ам. хим. Соц . 110 (16): 5575–5576. дои : 10.1021/ja00224a054 .
- ^ Зайдель Х.М., Фриман С., Сето Х., Ноулз-младший (1988). «Биосинтез фосфонатов: выделение фермента, ответственного за образование углерод-фосфорной связи». Природа . 335 (6189): 457–458. Бибкод : 1988Natur.335..457S . дои : 10.1038/335457a0 . ПМИД 3138545 . S2CID 4310660 .
- ^ Хуан К., Ли З., Цзя Ю., Данауэй-Мариано Д., Херцберг О. (1999). «Обмен спиралей между двумя альфа-/бета-цилиндрами: кристаллическая структура фосфоенолпируватмутазы со связанным Mg(2+)-оксалатом» . Структура. Складывать. Дес . 7 (5): 539–48. дои : 10.1016/S0969-2126(99)80070-7 . ПМИД 10378273 .
- ^ Jump up to: а б Лю С., Лу З., Цзя Ю., Данауэй-Мариано Д., Херцберг О. (2002). «Диссоциативный перенос фосфорила в катализе мутазы PEP: структура комплекса фермент/сульфопируват и кинетические свойства мутантов». Биохимия . 41 (32): 10270–10276. CiteSeerX 10.1.1.321.6707 . дои : 10.1021/bi026024v . ПМИД 12162742 .
- ^ Лю С., Лу З., Хан Ю., Цзя Ю., Ховард А., Данауэй-Мариано Д., Херцберг О. (2004). «Конформационная гибкость мутазы PEP». Биохимия . 43 (15): 4447–4453. CiteSeerX 10.1.1.432.6514 . дои : 10.1021/bi036255h . ПМИД 15078090 .
- ^ Хидака Т, Имаи С, Хара О, Анзай Х, Мураками Т, Нагаока К, Сето Х (1990). «Карбоксифосфоноенолпируватфосфономутаза, новый фермент, катализирующий образование CP-связи» . Дж. Бактериол . 172 (6): 3066–72. дои : 10.1128/jb.172.6.3066-3072.1990 . ПМК 209109 . ПМИД 2160937 .