Ланостеролсинтаза
| ланостеринсинтаза | |||
|---|---|---|---|
| Идентификаторы | |||
| Номер ЕС. | 5.4.99.7 | ||
| Номер CAS. | 9032-71-7 | ||
| Базы данных | |||
| ИнтЭнк | вид IntEnz | ||
| БРЕНДА | БРЕНДА запись | ||
| Экспаси | Просмотр NiceZyme | ||
| КЕГГ | КЕГГ запись | ||
| МетаЦик | метаболический путь | ||
| ПРЯМОЙ | профиль | ||
| PDB Структуры | RCSB PDB PDBe PDBsum | ||
| Генная онтология | АмиГО / QuickGO | ||
| |||
| СЖО | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | LSS , OSC, CTRCT44, ланостеролсинтаза (2,3-оксидосквален-ланостеролциклаза), ланостеролсинтаза, HYPT14, APMR4 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | ОМИМ : 600909 ; МГИ : 1336155 ; Гомологен : 37408 ; GeneCards : LSS ; ОМА : LSS — ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Ланостеролсинтаза ( EC 5.4.99.7 ) представляет собой оксидоскваленциклазы (OSC) фермент , который превращает ( S )-2,3-оксидосквален в катион протостерола и, наконец, в ланостерин . [5] Ланостерин является ключевым четырехкольцевым промежуточным продуктом биосинтеза холестерина . [6] [7] У человека ланостеролсинтаза кодируется LSS геном . [8] [9]
У эукариот ланостеролсинтаза — интегральный монотопный белок, ассоциированный с цитозольной стороной эндоплазматической сети . [10] Некоторые данные свидетельствуют о том, что фермент представляет собой растворимый, не связанный с мембраной белок у тех немногих прокариот , которые его производят. [11]
Из-за роли фермента в биосинтезе холестерина существует интерес к ингибиторам ланостеринсинтазы как к потенциальным препаратам, снижающим уровень холестерина, в дополнение к существующим статинам . [12]
Механизм
[ редактировать ]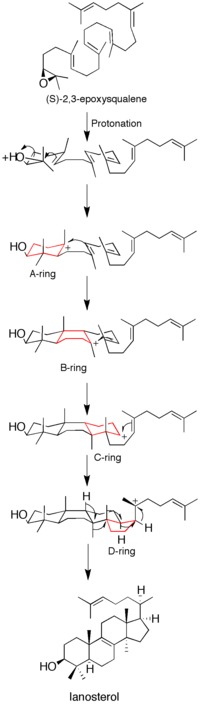
Хотя некоторые данные о механизме были получены с помощью ингибиторов суицида , исследований мутагенеза и моделирования гомологии , до сих пор не до конца понятно, как фермент катализирует образование ланостерола . [12]
Начальное протонирование эпоксида и раскрытие кольца
[ редактировать ]Перед получением рентгеновской кристаллической структуры белка был использован сайт-направленный мутагенез для определения остатков, ключевых для каталитической активности фермента. Было установлено, что остаток аспарагиновой кислоты (D455) и два остатка гистидина (H146 и H234) необходимы для функционирования фермента. Кори и др. кольца субстрата выдвинули гипотезу, что аспарагиновая кислота действует путем протонирования эпоксидного , тем самым увеличивая его восприимчивость к внутримолекулярной атаке ближайшей двойной связью , при этом H146, возможно, усиливает способность аспарагиновой кислоты донора протонов за счет водородных связей . [13] После получения рентгеновской кристаллической структуры фермента роль D455 как донора протонов эпоксида субстрата была подтверждена, хотя было обнаружено, что D455, скорее всего, стабилизируется за счет водородных связей из двух остатков цистеина (C456 и C533). чем от ранее предложенного гистидина. [12]
Каскад образования колец
[ редактировать ]Протонирование эпоксида активирует субстрат, запуская каскад реакций образования кольца. Всего образуются четыре кольца (от A до D), образующие холестериновый остов. [12] Хотя идея согласованного образования всех четырех колец выдвигалась в прошлом, кинетические исследования с аналогами ( S )-2,3-оксидосквалена показали, что образование продуктов достигается за счет дискретных карбокатионов промежуточных (см. Рисунок 1 ). Выделение моноциклических и бициклических продуктов из мутантов ланостеролсинтазы еще больше ослабило гипотезу согласованного механизма. [14] [15] Однако данные свидетельствуют о том, что раскрытие эпоксидного кольца и образование А-кольца согласованы. [16]
Структура
[ редактировать ]Ланостеролсинтаза представляет собой двухдоменный мономерный белок. [10] состоит из двух связанных (α/α) бочкообразных доменов и трех меньших β-структур . фермента Активный центр находится в центре белка и закрыт суженным каналом. Прохождение ( S )-2,3-эпоксискваленового субстрата через канал требует изменения конформации белка . У эукариот гидрофобная (см . поверхность (6% от общей площади поверхности фермента) представляет собой ЭР область связывания мембраны Рисунок 2 ). [12]
Фермент содержит пять областей отпечатков пальцев, содержащих мотивы Gln - Trp , которые также присутствуют в очень аналогичном бактериальном ферменте сквален-гопенциклазе . [12] Остатки этих областей «отпечатков пальцев» содержат сложенные боковые цепи, которые, как полагают, способствуют стабильности фермента во время высокоэкзергонических реакций циклизации, катализируемых ферментом. [17]
Функция
[ редактировать ]Катализ образования ланостерола
[ редактировать ]Ланостеролсинтаза катализирует превращение ( S )-2,3-эпоксисквалена в ланостерол , ключевой четырехкольцевой промежуточный продукт в биосинтезе холестерина . [6] [7] Таким образом, он, в свою очередь, является предшественником эстрогенов , андрогенов , прогестагенов , глюкокортикоидов , минералокортикоидов и нейростероидов . У эукариот фермент связан с цитозольной стороной мембраны эндоплазматического ретикулума . [10] Хотя синтез холестерина в основном связан с эукариотами , было обнаружено, что лишь немногие прокариоты экспрессируют ланостеролсинтазу; он был обнаружен в виде растворимого белка у Mmethylococcus capsulatus . [11]
Катализ образования эпоксиланостерина
[ редактировать ]Ланостеролсинтаза также катализирует циклизацию 2,3;22,23-диэпоксисквалена в 24( S ),25-эпоксиланостерин, [18] который позже превращается в 24( S ),25-эпоксихолестерин. [19] Поскольку сродство фермента к этому второму субстрату больше, чем к моноэпокси( S )-2,3-эпоксисквалену, при частичном ингибировании превращения 2,3;22,23-диэпоксисквалена в 24( S ) 25-эпоксиланостерин предпочтительнее. синтез ланостерола . [20] Это имеет значение для профилактики и лечения заболеваний.
Клиническое значение
[ редактировать ]Ингибиторы ферментов как препараты, снижающие уровень холестерина
[ редактировать ]Возрос интерес к ингибиторам ланостеролсинтазы как препаратам для снижения уровня холестерина в крови и лечения атеросклероза . Широко популярные статины в настоящее время используются для снижения функции холестерина ЛПНП (липопротеинов низкой плотности) путем ингибирования активности ГМГ-КоА-редуктазы . [6] Поскольку этот фермент катализирует образование предшественников, находящихся далеко впереди ( S )-2,3-эпоксисквалена и холестерина, статины могут отрицательно влиять на количество промежуточных продуктов, необходимых для других путей биосинтеза (например, синтеза изопреноидов , кофермента Q ). Таким образом, ланостеролсинтаза, которая более тесно связана с биосинтезом холестерина, чем ГМГ-КоА-редуктаза , является привлекательной мишенью для лекарств. [21]
Считается, что ингибиторы ланостеролсинтазы снижают уровень холестерина ЛПНП и ЛПОНП посредством двойного механизма контроля. Исследования, в которых ланостеролсинтаза частично ингибируется, показали как прямое снижение образования ланостерола , так и снижение активности ГМГ-КоА-редуктазы . 24 ответственен оксистерин ( S ),25-эпоксиланостерин, который преимущественно образуется по сравнению с ланостерином во время частичного ингибирования ланостеролсинтазы. HMG-CoA-редуктазы Считается, что за это ингибирование активности [22]
Эволюция
[ редактировать ]Считается, что оксидоскваленциклазы (OSC, класс, к которому относится ланостеролциклаза) произошли от бактериальной сквален-гопенциклазы (SHC), которая участвует в образовании гопаноидов . Филогенетические деревья, построенные на основе аминокислотных последовательностей OSC у разных организмов, предполагают наличие одного общего предка и то, что путь синтеза развивался только один раз. [23] Открытие стеранов , включая холестан, в сланцах возрастом 2,7 миллиарда лет из кратона Пилбара , Австралия , предполагает, что эукариоты с OSC и сложным стероидным механизмом присутствовали на ранних этапах истории Земли. [24]
Ссылки
[ редактировать ]- ^ Перейти обратно: а б с ENSG00000281289 GRCh38: выпуск Ensembl 89: ENSG00000160285, ENSG00000281289 — Ensembl , май 2017 г.
- ^ Перейти обратно: а б с GRCm38: выпуск Ensembl 89: ENSMUSG00000033105 – Ensembl , май 2017 г.
- ^ «Ссылка на Human PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Ссылка на Mouse PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ Дин П.Д., Ортис де Монтеллано П.Р., Блох К., Кори Э.Дж. (июнь 1967 г.). «Растворимая 2,3-оксидоскваленстеролциклаза» . Журнал биологической химии . 242 (12): 3014–5. дои : 10.1016/S0021-9258(18)99606-7 . ПМИД 6027261 .
- ^ Перейти обратно: а б с Хафф М.В., Телфорд, Д.Э. (июль 2005 г.). «Властелин колец: механизм действия оксидосквален:ланостеринциклазы становится кристально ясным» . Тенденции в фармакологических науках . 26 (7): 335–340. дои : 10.1016/j.tips.2005.05.004 . ПМИД 15951028 .
- ^ Перейти обратно: а б Ямамото С., Лин К., Блох К. (май 1969 г.). «Некоторые свойства микросомальной 2,3-оксидоскваленстеролциклазы» . Труды Национальной академии наук Соединенных Штатов Америки . 63 (1): 110–7. Бибкод : 1969ПНАС...63..110Y . дои : 10.1073/pnas.63.1.110 . ПМК 534008 . ПМИД 5257956 .
- ^ Бейкер Ч., Мацуда С.П., Лю Д.Р., Кори Э.Дж. (август 1995 г.). «Молекулярное клонирование человеческого гена, кодирующего ланостеролсинтазу, из библиотеки кДНК печени». Связь с биохимическими и биофизическими исследованиями . 213 (1): 154–160. дои : 10.1006/bbrc.1995.2110 . ПМИД 7639730 .
- ^ Янг М., Чен Х., Лалиоти, доктор медицинских наук, Антонаракис С.Е. (май 1996 г.). «Ген ланостеролсинтазы человека картирован на хромосоме 21q22.3». Генетика человека . 97 (5): 620–624. дои : 10.1007/BF02281872 . ПМИД 8655142 . S2CID 21051816 .
- ^ Перейти обратно: а б с Руф А., Мюллер Ф., Д'Арси Б., Стил М., Кушнир Э., Хандшин С., Моран О.Г., Тома Р. (март 2004 г.). «Монотопный мембранный белок человека оксидоскваленциклаза активен как мономер». Связь с биохимическими и биофизическими исследованиями . 315 (2): 247–254. дои : 10.1016/j.bbrc.2004.01.052 . ПМИД 14766201 .
- ^ Перейти обратно: а б Лэмб, округ Колумбия, Джексон С.Дж., Варрилоу А.Г., Мэннинг, Нью-Джерси, Келли Д.Е., Келли С.Л. (август 2007 г.). «Биосинтез ланостерола у прокариот Mmethylococcus capsulatus: понимание эволюции биосинтеза стеринов» . Молекулярная биология и эволюция . 24 (8): 1714–1721. дои : 10.1093/molbev/msm090 . ПМИД 17567593 .
- ^ Перейти обратно: а б с д и ж Тома Р., Шульц-Гаш Т., Д'Арси Б., Бенц Дж., Эби Дж., Демлоу Х., Хенниг М., Штиль М., Руф А. (ноябрь 2004 г.). «Понимание формирования стероидного каркаса на основе структуры оксидоскваленциклазы человека». Природа . 432 (7013): 118–122. Бибкод : 2004Natur.432..118T . дои : 10.1038/nature02993 . ПМИД 15525992 . S2CID 364281 .
- ^ Кори Э.Дж., Ченг СН, Бейкер СН, Мацуда СП, Ли Д., Сонг Икс (февраль 1997 г.). «Исследование субстратсвязывающих сегментов и каталитического действия ланостеролсинтазы. Аффинное мечение карбокатионами, полученными из аналогов 2, 3-оксидосквалена, основанных на механизме, и зондов направленного мутагенеза». Дж. Ам. хим. Соц . 119 (6): 1289–96. дои : 10.1021/ja963228o .
- ^ Ву Т.К., Ван Т.Т., Чанг Ч., Лю Ю.Т., Ши В.С. (ноябрь 2008 г.). «Значение остатка тирозина 707 оксидосквален-ланостерилциклазы Saccharomyces cerevisiae для образования бициклического кольца стул-лодочка и реакций депротонирования». Органические письма . 10 (21): 4959–62. дои : 10.1021/ol802036c . ПМИД 18842050 .
- ^ Жубер Б.М., Хуа Л., Мацуда С.П. (февраль 2000 г.). «Стерическая масса в положении 454 ланостеролсинтазы Saccharomyces cerevisiae влияет на образование B-кольца, но не на депротонирование». Органические письма . 2 (3): 339–41. дои : 10.1021/ol9912940 . ПМИД 10814317 .
- ^ Кори Э.Дж., Ченг СН, Бейкер СН, Мацуда СП, Ли Д., Сонг Икс (февраль 1997 г.). «Методология получения чистой рекомбинантной ланостеринсинтазы S. cerevisiae с использованием системы экспрессии бакуловируса. Доказательства того, что расщепление оксирана и образование А-кольца согласованы в биосинтезе ланостерола из 2,3-оксидосквалена». Дж. Ам. хим. Соц . 119 (6): 1277–88. дои : 10.1021/ja963227w .
- ^ Вендт К.У., Поралла К., Шульц Г.Е. (сентябрь 1997 г.). «Структура и функция скваленциклазы». Наука . 277 (5333): 1811–15. дои : 10.1126/science.277.5333.1811 . ПМИД 9295270 .
- ^ Кори Э.Дж., Гросс СК (август 1967 г.). «Образование стеринов действием 2,3-оксидосквален-стеролциклазы на искусственные субстраты 2,3:22,23-диоксидосквален и 2,3-оксидо-22,23-дигидросквален». Журнал Американского химического общества . 89 (17): 4561–2. дои : 10.1021/ja00993a079 . ПМИД 6046552 .
- ^ Нельсон Дж. А., Штекбек С.Р., Спенсер Т.А. (февраль 1981 г.). «Биосинтез 24,25-эпоксихолестерина из сквалена 2,3;22,23-диоксида» . Журнал биологической химии . 256 (3): 1067–8. дои : 10.1016/S0021-9258(19)69921-7 . ПМИД 7451488 .
- ^ Буто О., Долис Д., Шубер Ф. (октябрь 1992 г.). «Преимущественная циклизация 2,3 (S): 22 (S), 23-диоксидосквалена 2,3-оксидосквален-ланостеринциклазой млекопитающих». Связь с биохимическими и биофизическими исследованиями . 188 (2): 898–904. дои : 10.1016/0006-291X(92)91140-L . ПМИД 1445330 .
- ^ Телфорд Д.Э., Липсон С.М., Барретт П.Х., Сазерленд Б.Г., Эдвардс Дж.Ю., Эби Дж.Д., Демлоу Х., Моран О.Х., Хафф М.В. (декабрь 2005 г.). «Новый ингибитор оксидосквален:ланостеролциклазы ингибирует выработку аполипопротеина B100 липопротеинов очень низкой плотности (apoB100) и усиливает катаболизм липопротеинов низкой плотности apoB100 за счет заметного снижения содержания холестерина в печени» . Атеросклероз, тромбоз и сосудистая биология . 25 (12): 2608–14. дои : 10.1161/01.ATV.0000189158.28455.94 . ПМИД 16210564 .
- ^ Панини С.Р., Гупта А., Секстон Р.К., Пэриш Э.Дж., Радни Х. (октябрь 1987 г.). «Регуляция биосинтеза стеринов и активности 3-гидрокси-3-метилглутарил-кофермента А редуктазы в культивируемых клетках с помощью прогестерона» . Журнал биологической химии . 262 (30): 14435–40. дои : 10.1016/S0021-9258(18)47813-1 . ПМИД 3667583 .
- ^ Пирсон А., Будин М., Брокс Дж.Дж. (декабрь 2003 г.). «Филогенетические и биохимические доказательства синтеза стеринов у бактерии Gemmata obscuriglobus» . Труды Национальной академии наук Соединенных Штатов Америки . 100 (26): 15352–7. Бибкод : 2003PNAS..10015352P . дои : 10.1073/pnas.2536559100 . ПМК 307571 . ПМИД 14660793 .
- ^ Брокс Джей-Джей, Логан Г.А., Бьюик Р., Summons RE (август 1999 г.). «Архейские молекулярные окаменелости и раннее появление эукариотов». Наука . 285 (5430): 1033–6. Бибкод : 1999Sci...285.1033B . CiteSeerX 10.1.1.516.9123 . дои : 10.1126/science.285.5430.1033 . ПМИД 10446042 .
Дальнейшее чтение
[ редактировать ]- Росслер Э., Миттаз Л., Ду Ю., Скотт Х.С., Чанг Дж., Россье С., Гуиппони М., Мацуда С.П., Мюнке М., Антонаракис С.Е. (ноябрь 1999 г.). «Структура гена ланостеролсинтазы человека и его анализ как кандидата на голопрозэнцефалию (HPE1)» . Генетика человека . 105 (5): 489–95. doi : 10.1007/s004390051135 (неактивен 3 апреля 2024 г.). ПМИД 10598817 .
{{cite journal}}: CS1 maint: DOI неактивен по состоянию на апрель 2024 г. ( ссылка ) - Ма Дж., Демпси А.А., Стаматиу Д., Маршалл К.В., Лью CC (март 2007 г.). «Идентификация закономерностей экспрессии генов лейкоцитов, связанных с уровнями липидов в плазме у людей». Атеросклероз . 191 (1): 63–72. doi : 10.1016/j.atherosclerosis.2006.05.032 . ПМИД 16806233 .
- Бейеа М.М., Хеслоп К.Л., Савьес К.Г., Эдвардс Дж.Ю., Маркл Дж.Г., Хегеле Р.А., Хафф М.В. (февраль 2007 г.). «Селективное усиление регулируемых LXR генов ABCA1, ABCG1 и APOE в макрофагах посредством увеличения эндогенного синтеза 24 (S), 25-эпоксихолестерина» . Журнал биологической химии . 282 (8): 5207–16. дои : 10.1074/jbc.M611063200 . ПМИД 17186944 .
- Данг Х, Лю Ю, Пан В, Ли С, Ван Н, Шай Цзюй, Чжу Ю (март 2009 г.). «Подавление 2,3-оксидоскваленциклазы диетой с высоким содержанием жиров способствует опосредованному альфа-рецептором X печени улучшению липидного профиля печени» . Журнал биологической химии . 284 (10): 6218–26. дои : 10.1074/jbc.M803702200 . ПМК 2649084 . ПМИД 19119143 .
- Кимура К, Вакамацу А, Судзуки Ю, Ота Т, Нисикава Т, Ямашита Р, Ямамото Дж, Секине М, Цуритани К, Вакагури Х, Исии С, Сугияма Т, Сайто К, Исоно Ю, Ириэ Р, Кушида Н, Ёнеяма Т , Оцука Р, Канда К, Ёкой Т, Кондо Х, Вагацума М, Муракава К, Исида С, Исибаши Т, Такахаси-Фудзи А, Танасе Т, Нагай К, Кикучи Х, Накаи К, Исогай Т, Сугано С (январь 2006 г.) : крупномасштабная идентификация и характеристика предполагаемых альтернативных промоторов генов человека» ( /gr.4039406 PMID 1 ): 55–65 « 10.1101 16 . . . . Диверсификация транскрипционной модуляции : 16344560 doi
- Сунг С.К., Сибуя М., Санкава У., Эбизука Ю. (октябрь 1995 г.). «Молекулярное клонирование кДНК, кодирующей ланостеролсинтазу человека» . Биологический и фармацевтический вестник . 18 (10): 1459–61. дои : 10.1248/bpb.18.1459 . ПМИД 8593458 .
- Янг М., Чен Х., Лалиоти, доктор медицинских наук, Антонаракис С.Е. (май 1996 г.). «Ген ланостеролсинтазы человека картирован на хромосоме 21q22.3». Генетика человека . 97 (5): 620–4. дои : 10.1007/BF02281872 . ПМИД 8655142 . S2CID 21051816 .
- Пеффли Д.М., Гайен А.К., Моран О.Г. (август 1998 г.). «Понижение уровня и синтеза мРНК 3-гидрокси-3-метилглутарил-коэнзима А-редуктазы в клетках сирийского хомячка C100 с помощью ингибитора оксидоскваленциклазы [4'-(6-аллил-этил-амино-гексилокси)-2'-фтор- фенил]-(4-бромфенил)метанон (Ro 48-8071): сравнение с симвастатином». Биохимическая фармакология . 56 (4): 439–49. дои : 10.1016/S0006-2952(98)00083-5 . ПМИД 9763219 .
- Лу Й, Долле М.Э., Имхольц С., Ван 'т Слот Р., Вершурен В.М., Вейменга С., Фескенс Э.Дж., Бур Дж.М. (декабрь 2008 г.). «Множественные генетические варианты на путях-кандидатах влияют на концентрацию холестерина липопротеинов высокой плотности в плазме» . Журнал исследований липидов . 49 (12): 2582–9. doi : 10.1194/jlr.M800232-JLR200 . ПМИД 18660489 .
- Ченг Дж., Капранов П., Дренков Дж., Дике С., Брубейкер С., Патель С., Лонг Дж., Стерн Д., Таммана Х., Хелт Г., Семенченко В., Пикколбони А., Бекиранов С., Бэйли Д.К., Ганеш М., Гош С., Белл И. , Герхард Д.С., Гингерас Т.Р. (май 2005 г.). «Транскрипционные карты 10 хромосом человека с разрешением 5 нуклеотидов». Наука . 308 (5725): 1149–54. Бибкод : 2005Sci...308.1149C . дои : 10.1126/science.1108625 . ПМИД 15790807 . S2CID 13047538 .
- Пира И.Т., Калиновски А., Джексон Д., Дэвис В., Дэвис С., Олдридж А., Гривз П. (2001). «Токсикологические поражения, связанные с двумя родственными ингибиторами оксидоскваленциклазы у собак и мышей». Токсикологическая патология . 29 (2): 174–9. дои : 10.1080/019262301317052440 . ПМИД 11421484 . S2CID 38721319 .
- Бональдо М.Ф., Леннон Дж., Соарес М.Б. (сентябрь 1996 г.). «Нормализация и вычитание: два подхода к открытию генов» . Геномные исследования . 6 (9): 791–806. дои : 10.1101/гр.6.9.791 . ПМИД 8889548 .
- Руф А., Мюллер Ф., Д'Арси Б., Стил М., Кушнир Э., Хандшин С., Моран О.Г., Тома Р. (март 2004 г.). «Монотопный мембранный белок человека оксидоскваленциклаза активен как мономер». Связь с биохимическими и биофизическими исследованиями . 315 (2): 247–54. дои : 10.1016/j.bbrc.2004.01.052 . ПМИД 14766201 .
- Марк М., Мюллер П., Майер Р., Эйзель Б. (январь 1996 г.). «Влияние нового ингибитора 2,3-оксидоскваленциклазы на регуляцию биосинтеза холестерина в клетках HepG2» . Журнал исследований липидов . 37 (1): 148–58. дои : 10.1016/S0022-2275(20)37643-4 . ПМИД 8820110 .
Внешние ссылки
[ редактировать ]- Ланостерин + синтаза Национальной медицинской библиотеки США по медицинским предметным рубрикам (MeSH)