Фарнезилдифосфат фарнезилтрансфераза
| Скваленсинтаза | |||
|---|---|---|---|
 | |||
| Идентификаторы | |||
| Номер ЕС. | 2.5.1.21 | ||
| Номер CAS. | 9077-14-9 | ||
| Базы данных | |||
| ИнтЭнк | вид IntEnz | ||
| БРЕНДА | БРЕНДА запись | ||
| Экспаси | Просмотр NiceZyme | ||
| КЕГГ | КЕГГ запись | ||
| МетаЦик | метаболический путь | ||
| ПРЯМОЙ | профиль | ||
| PDB Структуры | RCSB PDB PDBe PDBsum | ||
| Генная онтология | АмиГО / QuickGO | ||
| |||
| фарнезилдифосфат фарнезилтрансфераза 1 | |||
|---|---|---|---|
| Идентификаторы | |||
| Символ | ФДФТ1 | ||
| ген NCBI | 2222 | ||
| HGNC | 3629 | ||
| МОЙ БОГ | 184420 | ||
| RefSeq | НМ_004462 | ||
| ЮниПрот | P37268 | ||
| Другие данные | |||
| Номер ЕС | 2.5.1.21 | ||
| Локус | Хр. 8 п23.1-п22 | ||
| |||
Скваленсинтаза ( SQS ) или фарнезилдифосфат:фарнезилдифосфатфарнезилтрансфераза — фермент, локализованный на мембране эндоплазматической сети . SQS участвует в пути биосинтеза изопреноидов , катализируя двухэтапную реакцию, в которой две идентичные молекулы фарнезилпирофосфата ( FPP) превращаются в сквален с потреблением НАДФН . [2] Катализ с помощью SQS является первым важным шагом в синтезе стеринов , поскольку образующийся сквален превращается исключительно в различные стерины, такие как холестерин , посредством сложного, многоэтапного пути. SQS принадлежит к сквален/фитоенсинтазы семейству белков .
Разнообразие
[ редактировать ]Скваленсинтаза была охарактеризована у животных, растений и дрожжей. [3] По структуре и механике скваленсинтаза очень похожа на фитоенсинтазу (PHS), другую пренилтрансферазу . PHS выполняет аналогичную роль SQS у растений и бактерий, катализируя синтез фитоина , предшественника каротиноидных соединений. [4]
Структура
[ редактировать ]Скваленсинтаза (SQS) локализуется исключительно на мембране эндоплазматического ретикулума (ЭР). [5] SQS прикреплен к мембране коротким С-концевым трансмембранным доменом. [6] N -концевой каталитический домен фермента выступает в цитозоль растворимые субстраты . , где связываются [2] Формы SQS млекопитающих имеют массу примерно 47 кДа и состоят из ~416 аминокислот . Кристаллическая структура человеческого SQS была определена в 2000 году и показала, что белок полностью состоит из α-спиралей . Фермент сложен в один домен , характеризующийся большим центральным каналом. Активные центры обеих полуреакций, катализируемых SQS, расположены внутри этого канала. Один конец канала открыт для цитозоля, тогда как другой конец образует гидрофобный карман. [5] SQS содержит две консервативные последовательности, богатые аспартатом , которые, как полагают, непосредственно участвуют в каталитическом механизме. [7] Эти богатые аспартатом мотивы являются одной из нескольких консервативных структурных особенностей ферментов биосинтеза изопреноидов класса I, хотя эти ферменты не имеют гомологичных последовательностей . [5]

Механизм
[ редактировать ]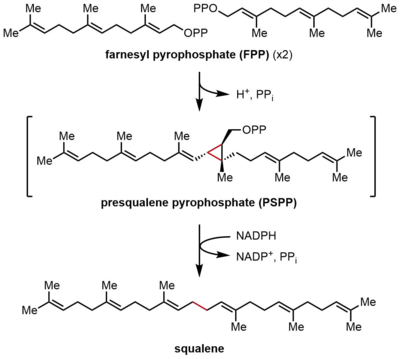
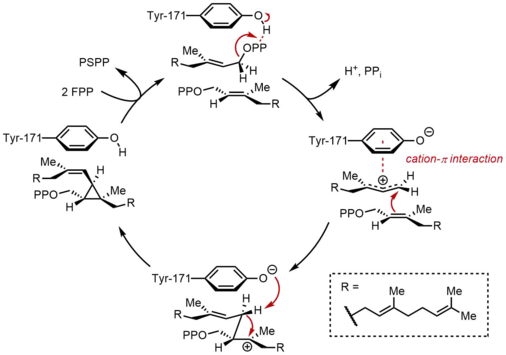
Скваленсинтаза (SQS) катализирует восстановительную димеризацию фарнезилпирофосфата (FPP), при которой две идентичные молекулы FPP превращаются в одну молекулу сквалена. Реакция протекает в две стадии, протекая через промежуточный прескваленпирофосфат (PSPP). FPP представляет собой растворимое аллильное соединение, содержащее 15 атомов углерода (C 15 ), тогда как сквален представляет собой нерастворимый изопреноид C 30 . [2] [4] Эта реакция представляет собой прямой синтез терпенов , поскольку обе молекулы FPP соединены в положении C4 и образуют связь 1-1'. Это контрастирует со связями 1'-4', которые гораздо чаще встречаются в биосинтезе изопрена, чем связи 4-4'. [8] [9] Механизм реакции SQS требует двухвалентного катиона , часто Mg. 2+ , чтобы облегчить связывание пирофосфатных групп на FPP. [10]
Конденсация ФПП
[ редактировать ]В первой полуреакции две идентичные молекулы фарнезилпирофосфата (FPP) последовательно связываются со скваленсинтазой (SQS). Молекулы FPP связываются с разными областями фермента и обладают разной аффинностью связывания. [11] Начиная с вершины каталитического цикла ниже, реакция начинается с ионизации FPP с образованием аллильного карбокатиона . Остаток тирозина (Tyr-171) играет решающую роль на этом этапе, служа донором протонов, облегчая отщепление пирофосфата. Более того, образующийся фенолят-анион может стабилизировать образующийся карбокатион посредством катион-π-взаимодействий , которые будут особенно сильными из-за очень богатой электронами природы фенолят-аниона. Образовавшийся аллильный катион затем подвергается атаке олефина второй молекулы FPP, образуя третичный карбокатион. Образовавшийся ранее фенолят-анион затем служит основанием для отрыва протона от этого аддукта с образованием циклопропанового продукта, прескваленпирофосфата (PSPP). Созданный PSPP остается связанным с SQS для второй реакции. [5] [10] Важность остатка тирозина в этом процессе была продемонстрирована исследованиями мутагенеза крысиного SQS (rSQS). [7] и тем фактом, что Tyr-171 сохраняется во всех известных SQS (и PHS ). [2] В rSQS Tyr-171 конвертировался в ароматические остатки Phe и Trp , а также гидроксилсодержащий остаток Ser . Ни один из этих мутантов не был способен конвертировать FPP в PSPP или сквален, что демонстрирует, что одних только ароматических колец или спиртов недостаточно для преобразования FPP в PSPP.
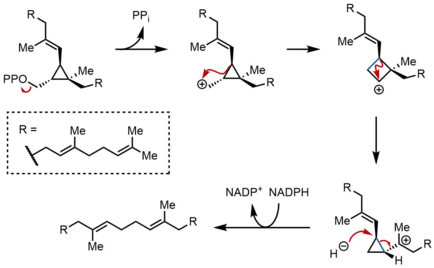
Перегруппировка и сокращение ПСПП
[ редактировать ]Во второй полуреакции SQS прескваленпирофосфат (PSPP) перемещается во второе место реакции внутри SQS. Считается, что сохранение PSPP в центральном канале SQS защищает реакционноспособный промежуточный продукт от реакции с водой. [5] Из PSPP сквален образуется в результате серии карбокатионных перегруппировок. [12] [13] Процесс начинается с ионизации пирофосфата с образованием циклопропилкарбинильного катиона. Катион перегруппировывается в результате 1,2-миграции циклопропановой связи C–C к карбокатиону, образуя связь, показанную синим цветом, с образованием циклобутилкарбокатиона. Впоследствии происходит вторая 1,2-миграция с образованием другого циклопропилкарбинильного катиона, при этом катион опирается на третичный углерод. Образующийся карбокатион затем размыкает кольцо гидридом, доставляемым НАДФН , образуя сквален, который затем высвобождается SQS в мембрану эндоплазматического ретикулума . [2]
Хотя циклопропилкарбинил-циклопропилкарбинильные перегруппировки могут протекать через дискретные промежуточные циклобутильные катионы, предполагаемый циклобутильный катион не удалось уловить в модельных исследованиях. Таким образом, циклобутильный катион может фактически быть переходным состоянием между двумя циклопропилкарбинильными катионами, а не отдельным промежуточным соединением. Стереохимия промежуточных продуктов и геометрия олефинов в конечном продукте продиктованы супрафациальной природой 1,2-сдвигов и стереоэлектронными требованиями . Хотя были предложены и другие механизмы, показанный выше механизм подтверждается выделением риллингола, который представляет собой спирт, образующийся в результате захвата второго циклопропилкарбинильного катиона водой.
Регулирование
[ редактировать ]
FPP является важным метаболическим промежуточным продуктом мевалонатного пути , который представляет собой основную точку ветвления терпеноидного пути. [2] [14] FPP используется для образования нескольких важных классов соединений помимо стеринов ( через сквален), включая убихинон. [15] и долихолы . [16] SQS катализирует первый обязательный этап биосинтеза стеринов из FPP и, следовательно, важен для контроля потока к стериновым и нестериновым продуктам. Активность SQS тесно связана с активностью ГМГ-КоА-редуктазы , которая катализирует лимитирующую стадию мевалонатного пути. Высокие уровни ЛПНП, , полученного из холестерина значительно ингибируют активность ГМГ-КоА-редуктазы, поскольку мевалонат больше не требуется для производства стеринов. Однако остаточная активность HMG-CoA-редуктазы наблюдается даже при очень высоких уровнях ЛПНП, так что FPP может образовывать нестериновые продукты, необходимые для роста клеток. [17] Чтобы предотвратить использование этого остаточного FPP для синтеза стеринов, когда стеринов много, активность SQS значительно снижается при высоких уровнях ЛПНП. [18] Такое подавление активности SQS лучше рассматривать как механизм контроля потока, а не как способ регулирования уровня холестерина. Это связано с тем, что ГМГ-КоА-редуктаза является более значимым фактором контроля регуляции синтеза холестерина (ее активность подавляется на 98% при высоких уровнях ЛПНП). [17]
Регулирование стеролами
[ редактировать ]Регуляция SQS происходит преимущественно на уровне гена транскрипции SQS . [2] Класс белка, связывающего регуляторный элемент стерола (SREBP), транскрипционных факторов занимает центральное место в регуляции генов, участвующих в гомеостазе холестерина , и важен для контроля уровней транскрипции SQS. Когда уровни стеринов низкие, неактивная форма SREBP расщепляется с образованием активного транскрипционного фактора, который перемещается в ядро, чтобы вызвать транскрипцию гена SQS. Из трех известных факторов транскрипции SREBP только SREBP-1a и SREBP-2 активируют транскрипцию гена SQS в печени трансгенных мышей. [19] [20] В культивируемых клетках HepG2 SQS SREBP-1a оказывается более важным, чем SREBP-2, в контроле активации промотора . [21] Однако было показано, что промоторы SQS по-разному реагируют на SREBP-1a и SREBP-2 в разных экспериментальных системах.
Помимо SREBP, для максимальной активации промотора SQS необходимы дополнительные факторы транскрипции. Исследования промоторов с использованием люциферазы репортерного гена анализов показали, что факторы транскрипции Sp1 и NF-Y и/или CREB также важны для активации промотора SQS. NF-Y и/или CREB необходимы для того, чтобы SREBP-1a полностью активировал промотор SQS, хотя для этого SREBP-2 также необходим Sp1.
Интерактивная карта маршрутов
[ редактировать ]Нажмите на гены, белки и метаболиты ниже, чтобы перейти к соответствующим статьям. [§ 1]
- ^ Интерактивную карту маршрутов можно редактировать на WikiPathways: «Statin_Pathway_WP430» .
Биологическая функция
[ редактировать ]Скваленсинтаза (SQS) представляет собой фермент, участвующий в пути биосинтеза изопреноидов. SQS-синтаза катализирует точку разветвления между биосинтезом стеринов и нестеринов и направляет фарнезилпирофосфат (FPP) исключительно на производство стеринов. [2] Важным стеролом, вырабатываемым этим путем, является холестерин , который используется в клеточных мембранах и для синтеза гормонов . [22] SQS конкурирует с несколькими другими ферментами за использование FPP, поскольку он является предшественником различных терпеноидов. Снижение активности SQS ограничивает поток FPP по стериновому пути и увеличивает продукцию нестериновых продуктов. Важные нестериновые продукты включают убихинон , долихолы , гем А и фарнезилированные белки. [23]
скваленсинтазы Разработка мышей с нокаутом продемонстрировала, что потеря скваленсинтазы смертельна и что этот фермент необходим для развития центральной нервной системы . [24]
Актуальность заболевания
[ редактировать ]Скваленсинтаза является мишенью регуляции уровня холестерина. повышенная экспрессия SQS повышает уровень холестерина у мышей. Было показано, что [24] Поэтому ингибиторы SQS представляют большой интерес для лечения гиперхолестеринемии и профилактики ишемической болезни сердца (ИБС) . [25] Было также высказано предположение, что варианты этого фермента могут быть частью генетической связи с гиперхолестеринемией. [26]
Ингибиторы скваленсинтазы
[ редактировать ]Было показано, что ингибиторы скваленсинтазы снижают синтез холестерина, а также уровень триглицеридов в плазме . [22] [27] Ингибиторы SQS могут стать альтернативой ингибиторам ГМГ-КоА-редуктазы (статинам), которые имеют серьезные побочные эффекты у некоторых пациентов. [28] Ингибиторы скваленсинтазы, которые исследовались на предмет использования для профилактики сердечно-сосудистых заболеваний, включают лапаквистат (ТАК-475), зарагозовую кислоту и RPR 107393. [29] [30] Несмотря на достижение II фазы клинических испытаний , лапаквистат был снят с производства в 2008 году. [31] [32]
Ингибирование гомолога скваленсинтазы у Staphylococcus aureus в настоящее время исследуется в качестве антибактериальной терапии на основе фактора вирулентности. [33]
Ссылки
[ редактировать ]- ^ Итикава М., Ёкомизо А., Ито М., Сугита К., Усуи Х., Симидзу Х., Сузуки М., Тераяма К., Канда А. (март 2011 г.). «Открытие новой матрицы 2-аминобензгидрола для высокоэффективных ингибиторов скваленсинтазы». Биоорг. Мед. Хим . 19 (6): 1930–49. дои : 10.1016/j.bmc.2011.01.065 . ПМИД 21353782 .
- ^ Jump up to: а б с д и ж г час Тэнси Т.Р., Шехтер I (декабрь 2000 г.). «Структура и регуляция скваленсинтазы млекопитающих». Биохим. Биофиз. Акта . 1529 (1–3): 49–62. дои : 10.1016/S1388-1981(00)00137-2 . ПМИД 11111077 .
- ^ Накашима Т., Иноуэ Т., Ока А., Нишино Т., Осуми Т., Хата С. (март 1995 г.). «Клонирование, экспрессия и характеристика кДНК, кодирующих скваленсинтазу Arabidopsis thaliana» . Учеб. Натл. акад. наук. США . 92 (6): 2328–32. Бибкод : 1995PNAS...92.2328N . дои : 10.1073/pnas.92.6.2328 . ПМК 42476 . ПМИД 7892265 .
- ^ Jump up to: а б Тэнси Т.Р., Шехтер I (2001). «Скваленсинтаза: структура и регуляция». Прог. Нуклеиновая кислота Рез. Мол. Биол . Прогресс в исследованиях нуклеиновых кислот и молекулярной биологии. 65 : 157–95. дои : 10.1016/S0079-6603(00)65005-5 . ISBN 9780125400657 . ПМИД 11008488 .
- ^ Jump up to: а б с д и Пандит Дж., Дэнли Д.Э., Шульте Г.К., Маццалупо С., Поли Т.А., Хейворд К.М., Хаманака Э.С., Томпсон Дж.Ф., Харвуд Х.Дж. (сентябрь 2000 г.). «Кристаллическая структура скваленсинтазы человека. Ключевой фермент биосинтеза холестерина» . Ж. Биол. Хим . 275 (39): 30610–7. дои : 10.1074/jbc.M004132200 . ПМИД 10896663 .
- ^ Дженнингс С.М., Цай Ю.Х., Фиш Т.М., Робинсон Г.В. (июль 1991 г.). «Молекулярное клонирование и характеристика дрожжевого гена скваленсинтетазы» . Учеб. Натл. акад. наук. США . 88 (14): 6038–42. Бибкод : 1991PNAS...88.6038J . дои : 10.1073/pnas.88.14.6038 . ПМК 52017 . ПМИД 2068081 .
- ^ Jump up to: а б Гу П., Исии Ю., Спенсер Т.А., Шехтер И. (май 1998 г.). «Исследование функциональной структуры и идентификация трех ферментных доменов, участвующих в каталитической активности скваленсинтазы печени крысы» . Ж. Биол. Хим . 273 (20): 12515–25. дои : 10.1074/jbc.273.20.12515 . ПМИД 9575210 .
- ^ Компакт-диск Поултера (1990). «Биосинтез терпенов без головы к хвосту. Формирование связей 1'-1 и 1'-3». Отчеты о химических исследованиях . 23 (3): 70–77. дои : 10.1021/ar00171a003 .
- ^ Линь Ф.Ю., Лю С.И., Лю Ю.Л., Чжан Ю., Ван К., Дженг В.Ю., Ко Т.П., Цао Р., Ван А.Х., Олдфилд Э. (декабрь 2010 г.). «Механизм действия и ингибирование дегидроскваленсинтазы» . Учеб. Натл. акад. наук. США . 107 (50): 21337–42. Бибкод : 2010PNAS..10721337L . дои : 10.1073/pnas.1010907107 . ПМК 3003041 . ПМИД 21098670 .
- ^ Jump up to: а б Бейтиа Э., Куреши А.А., Портер Дж.В. (март 1973 г.). «Скваленсинтетаза. 3. Механизм реакции» . Ж. Биол. Хим . 248 (5): 1856–67. дои : 10.1016/S0021-9258(19)44269-5 . ПМИД 4348553 .
- ^ Мухтиар К.А., Калиновский С.С., Чжан Д., Поултер К.Д. (апрель 1994 г.). «Дрожжевая скваленсинтаза. Механизм добавления субстратов и активации НАДФН» . Ж. Биол. Хим . 269 (15): 11201–7. дои : 10.1016/S0021-9258(19)78111-3 . ПМИД 8157649 .
- ^ Блэгг, Брайан С.Дж.; Ярстфер, Майкл Б.; Роджерс, Дэниел Х.; Поултер, К. Дейл (4 июля 2002 г.). «Рекомбинантная скваленсинтаза. Механизм перегруппировки пресквалендифосфата в сквален». Журнал Американского химического общества . 124 (30): 8846–8853. дои : 10.1021/ja020411a . ПМИД 12137537 .
- ^ Ярстфер, Майкл Б.; Блэгг, Брайан С.Дж.; Роджерс, Дэниел Х.; Поултер, К. Дейл (25 декабря 1996 г.). «Биосинтез сквалена. Доказательства существования третичного циклопропилкарбинильного катионного промежуточного продукта при перегруппировке пресквалендифосфата в сквален». Журнал Американского химического общества . 118 (51): 13089–13090. дои : 10.1021/ja963308s .
- ^ Браун, Майкл С.; Гольдштейн, Джозеф Л. (1980). «Мультивалентная регуляция HMG-CoA-редуктазы по обратной связи, механизм контроля, координирующий синтез изопреноидов и рост клеток» . Дж. Липид Рес . 21 (5): 505–517. дои : 10.1016/S0022-2275(20)42221-7 . ПМИД 6995544 .
- ^ Олсон, Роберт Э. (1 января 1967 г.). Роберт С. Харрис; Ира Г. Вул; Джон А. Лорейн; Г. Ф. Марриан; Кеннет В. Тиманн (ред.). «Биосинтез убихинонов у животных*». Витамины и гормоны . 24 : 551–574. дои : 10.1016/s0083-6729(08)60221-6 . ISBN 9780127098241 . ПМИД 5340877 .
- ^ Гоф, Дорин П.; Хемминг, ФРВ (1 июня 1970 г.). «Характеристика и стереохимия биосинтеза долихолов в печени крыс» . Биохимический журнал . 118 (1): 163–166. дои : 10.1042/bj1180163 . ISSN 0264-6021 . ПМК 1179092 . ПМИД 4319540 .
- ^ Jump up to: а б Фауст, Джерри Р.; Гольдштейн, Джозеф Л.; Браун, Майкл С. (1 января 1979 г.). «Синтез убихинона и холестерина в фибробластах человека: регуляция разветвленного пути». Архив биохимии и биофизики . 192 (1): 86–99. дои : 10.1016/0003-9861(79)90074-2 . ПМИД 219777 .
- ^ Фауст, Джерри Р.; Гольдштейн, Джозеф Л.; Браун, Майкл С. (1 октября 1979 г.). «Активность скваленсинтетазы в фибробластах человека: регуляция через рецептор липопротеина низкой плотности» . Труды Национальной академии наук Соединенных Штатов Америки . 76 (10): 5018–5022. Бибкод : 1979PNAS...76.5018F . дои : 10.1073/pnas.76.10.5018 . ISSN 0027-8424 . ПМК 413070 . ПМИД 228272 .
- ^ Гуань, Г.; Цзян, Г.; Кох, Р.Л.; Шехтер, И. (15 сентября 1995 г.). «Молекулярное клонирование и функциональный анализ промотора гена скваленсинтазы человека» . Журнал биологической химии . 270 (37): 21958–21965. дои : 10.1074/jbc.270.37.21958 . ISSN 0021-9258 . ПМИД 7665618 .
- ^ Гуань, Гуйминь; Дай, Пей-Хуа; Осборн, Тимоти Ф.; Ким, Джэ Б.; Шехтер, Ишайяху (11 апреля 1997 г.). «Множественные элементы последовательности участвуют в регуляции транскрипции гена скваленсинтазы человека» . Журнал биологической химии . 272 (15): 10295–10302. дои : 10.1074/jbc.272.15.10295 . ISSN 0021-9258 . ПМИД 9092581 .
- ^ Гуань, Г.; Дай, П.; Шехтер, И. (15 мая 1998 г.). «Дифференциальная регуляция транскрипции гена скваленсинтазы человека с помощью белков, связывающих регуляторные элементы стерола (SREBP) 1a и 2, и участие в регуляции элементов 5'-последовательности ДНК» . Журнал биологической химии . 273 (20): 12526–12535. дои : 10.1074/jbc.273.20.12526 . ISSN 0021-9258 . ПМИД 9575211 .
- ^ Jump up to: а б Курунакис А.П., Кацелу М.Г., Матралис А.Н., Ладопулу Э.М., Бававеа Э. (2011). «Ингибиторы скваленсинтазы: обновленная информация о поиске новых антигиперлипидемических и антиатеросклеротических средств». Курс. Мед. Хим . 18 (29): 4418–39. дои : 10.2174/092986711797287557 . ПМИД 21864285 .
- ^ Парадайз Э.М., Кирби Дж., Чан Р., Кислинг Дж.Д. (июнь 2008 г.). «Перенаправление потока через точку ветвления FPP в Saccharomyces cerevisiae за счет снижения регуляции скваленсинтазы». Биотехнология. Биоинж . 100 (2): 371–8. дои : 10.1002/бит.21766 . ПМИД 18175359 . S2CID 23878922 .
- ^ Jump up to: а б Оказаки Х, Тазоэ Ф, Окадзаки С, Исо Н, Цукамото К, Секия М, Яхаги Н, Иидзука Ю, Охаси К, Китамин Т, Тозава Р, Инаба Т, Ягю Х, Окадзаки М, Шимано Х, Сибата Н, Араи Х , Нагай Р.З., Кадоваки Т., Осуга Дж., Исибаши С. (сентябрь 2006 г.). «Повышение биосинтеза холестерина и гиперхолестеринемия у мышей со сверхэкспрессией скваленсинтазы в печени» . Дж. Липид Рес . 47 (9): 1950–8. doi : 10.1194/jlr.M600224-JLR200 . ПМИД 16741291 .
- ^ Дэвидсон М.Х. (январь 2007 г.). «Ингибирование скваленсинтазы: новая мишень для лечения дислипидемии». Представитель Curr Atheroscler . 9 (1): 78–80. дои : 10.1007/BF02693932 . ПМИД 17169251 . S2CID 28176904 .
- ^ До Р., Кисс РС, Годе Д., Энгерт Дж. К. (январь 2009 г.). «Скваленсинтаза: критический фермент в пути биосинтеза холестерина». Клин. Жене . 75 (1): 19–29. дои : 10.1111/j.1399-0004.2008.01099.x . ПМИД 19054015 . S2CID 205406994 .
- ^ Хиёси Х, Янагимачи М, Ито М, Саэки Т, Ёсида И, Окада Т, Икута Х, Синмё Д, Танака К, Курусу Н, Танака Х (ноябрь 2001 г.). «Ингибиторы скваленсинтазы снижают уровень триглицеридов в плазме посредством механизма, независимого от рецептора липопротеинов низкой плотности». Евро. Дж. Фармакол . 431 (3): 345–52. дои : 10.1016/S0014-2999(01)01450-9 . ПМИД 11730728 .
- ^ Сейки С., Фришман WH (2009). «Фармакологическое ингибирование скваленсинтазы и других последующих ферментов пути синтеза холестерина: новый терапевтический подход к лечению гиперхолестеринемии». Кардиол Рев . 17 (2): 70–6. дои : 10.1097/CRD.0b013e3181885905 . ПМИД 19367148 . S2CID 33130333 .
- ^ Чарльтон-Менис В., Даррингтон П.Н. (2007). «Ингибиторы скваленсинтазы: клиническая фармакология и потенциал снижения уровня холестерина». Наркотики . 67 (1): 11–6. дои : 10.2165/00003495-200767010-00002 . ПМИД 17209661 . S2CID 45715717 .
- ^ Амин Д., Ратледж Р.З., Нидл С.Н., Гальценски Х.Ф., Нойеншвандер К., Скотезе А.К., Магуайр М.П., Буш Р.К., Хеле DJ, Бильдер Г.Е., Перроне М.Х. (май 1997 г.). «RPR 107393, мощный ингибитор скваленсинтазы и эффективное средство для снижения уровня холестерина при пероральном приеме: сравнение с ингибиторами HMG-CoA-редуктазы». Дж. Фармакол. Эксп. Там . 281 (2): 746–52. ПМИД 9152381 .
- ^ Гиббс, Эдвина (29 октября 2007 г.). «ОБНОВЛЕНИЕ 2: FDA США велит компании Takeda прекратить некоторые испытания TAK-475» . Рейтер . Проверено 5 марта 2013 г.
- ^ «Прекращение разработки ТАК-475, соединения для лечения гиперхолестеринемии» . Такеда Фармасьютикал Компани Лимитед. 28 марта 2008 года . Проверено 5 марта 2013 г.
- ^ Лю Ци, Лю Джи, Сун Ю, Инь Ф, Хенслер М.Э., Дженг Вай, Низет В., Ван А.Х., Олдфилд Э. (март 2008 г.). «Ингибитор биосинтеза холестерина блокирует вирулентность золотистого стафилококка» (PDF) . Наука . 319 (5868): 1391–4. Бибкод : 2008Sci...319.1391L . дои : 10.1126/science.1153018 . ПМК 2747771 . ПМИД 18276850 .
Внешние ссылки
[ редактировать ]- Фарнезил-дифосфат + фарнезилтрансфераза в Национальной медицинской библиотеке США по медицинским предметным рубрикам (MeSH)