Субъединица I цитохром с-оксидазы
| ЦОГ1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | COX1 , митохондриально кодируемая цитохром с оксидаза I, COI, MTCO1, основная субъединица цитохром с оксидазы, CO I, субъединица I цитохром с оксидазы | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | Опустить : 516030 ; МГИ : 102504 ; Гомологен : 5016 ; Генные карты : COX1 ; ОМА : ЦОГ1 – ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Субъединица I цитохром с-оксидазы | |||
|---|---|---|---|
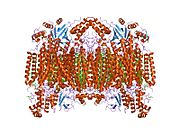
 Структура 13-субъединичной окисленной цитохром-с-оксидазы. [5] | |||
| Идентификаторы | |||
| Символ | ЦОГ1 или ИСП | ||
| Пфам | PF00115 | ||
| ИнтерПро | ИПР000883 | ||
| PROSITE | PDOC00074 | ||
| СКОП2 | 1occ / SCOPe / СУПФАМ | ||
| TCDB | 3.Д.4 | ||
| Суперсемейство OPM | 4 | ||
| белок OPM | 1v55 | ||
| CDD | cd01663 | ||
| |||

Цитохром с оксидаза I ( COX1 ), также известная как митохондриально кодируемая цитохром с оксидаза I ( MT-CO1 ), представляет собой белок , который кодируется MT-CO1 геном у эукариот . [6] Ген также называется COX1 , CO1 или COI . [7] Цитохром с оксидаза I является основной субъединицей комплекса цитохром с оксидазы . У людей мутации в MT-CO1 были связаны с наследственной оптической нейропатией Лебера (LHON), приобретенной идиопатической сидеробластной анемией , дефицитом комплекса IV , колоректальным раком , нейросенсорной глухотой и рецидивирующей миоглобинурией . [8] [9] [10]
Структура
[ редактировать ]У человека ген MT-CO1 расположен от пар нуклеотидов с 5904 по 7444 на богатом гуанином тяжелом (H) участке мтДНК . Продукт гена представляет собой белок массой 57 кДа, состоящий из 513 аминокислот . [11] [12]
Функция
[ редактировать ]Субъединица I цитохром с-оксидазы (CO1 или MT-CO1) является одной из трех кодируемых митохондриальной ДНК (мтДНК) субъединиц (MT-CO1, MT-CO2 , MT-CO3 ) цитохром с-оксидазы , также известной как комплекс IV . Цитохром с-оксидаза ( EC 1.9.3.1 ) является ключевым ферментом аэробного метаболизма. Это третий и последний фермент цепи переноса электронов митохондриального окислительного фосфорилирования . [6]
Гем-медные оксидазы, перекачивающие протоны, представляют собой концевые ферменты переноса энергии дыхательных цепей у прокариот и эукариот . Биядерный центр CuB-гема а3 (или гема о), связанный с крупнейшей субъединицей I цитохрома с и убихинолоксидаз ( EC 1.10.3.10 ), непосредственно участвует в сочетании между восстановлением дикислорода и протонной накачкой. [13] [14] Некоторые терминальные оксидазы генерируют трансмембранный протонный градиент через плазматическую мембрану (прокариоты) или внутреннюю мембрану митохондрий (эукариоты).
Ферментный комплекс состоит из 3-4 субъединиц (прокариоты) до 13 полипептидов (млекопитающие), из которых только каталитическая субъединица (эквивалентная субъединице I млекопитающих (COI)) обнаружена во всех гем-медных респираторных оксидазах. Присутствие биметаллического центра (образованного высокоспиновым гемом и медью B), а также низкоспинового гема, оба лигированы с шестью консервативными остатками гистидина вблизи внешней стороны четырех трансмембранных участков внутри COI, является общим для всех членов семьи. . [15] [16] [17] В отличие от эукариот дыхательная цепь прокариот разветвлена и образует множество концевых оксидаз. Ферментные комплексы различаются по составу гема и меди, типу субстрата и сродству к субстрату. Различные респираторные оксидазы позволяют клеткам настраивать свою дыхательную систему в соответствии с различными условиями роста окружающей среды. [13]
Показано, что эубактериальная хинолоксидаза произошла от цитохром -с -оксидазы грамположительных бактерий, а архебактериальная хинолоксидаза имеет независимое происхождение. Значительное количество данных свидетельствует о том, что Pseudomonadota (также известные как протеобактерии или пурпурные бактерии) приобрели хинолоксидазу посредством латерального переноса генов от грамположительных бактерий . [13]
Родственная редуктаза оксида азота ( EC 1.7.99.7 ) существует у денитрифицирующих видов архей и эубактерий и представляет собой гетеродимер цитохромов b и c. Акцептором может выступать феназинметосульфат. Было высказано предположение, что каталитические субъединицы цитохром -с -оксидазы произошли от древних редуктаз оксида азота, которые могли восстанавливать как азот, так и кислород. [18] [19]
Клиническое значение
[ редактировать ]Мутации в этом гене у людей связаны с наследственной оптической нейропатией Лебера (LHON), приобретенной идиопатической сидеробластной анемией , комплекса IV дефицитом , колоректальным раком , нейросенсорной глухотой и рецидивирующей миоглобинурией . [8] [9] [10]
Наследственная оптическая нейропатия Лебера (LHON)
[ редактировать ]LHON, коррелирующий с мутациями в MT-CO1 , характеризуется дисфункцией зрительного нерва , вызывающей подострую или острую потерю центрального зрения . У некоторых пациентов могут наблюдаться неврологические нарушения или нарушения сердечной проводимости . Поскольку это заболевание является результатом мутаций митохондриальной ДНК, затрагивающих комплексы дыхательной цепи , оно передается по материнской линии . [20] [9] [10]
Приобретенная идиопатическая сидеробластная анемия
[ редактировать ]MT-CO1 может быть вовлечен в развитие приобретенной идиопатической сидеробластной анемии. ДНК могут вызывать дисфункцию дыхательной цепи, предотвращая восстановление трехвалентного железа железа до двухвалентного , которое необходимо для заключительного этапа митохондриального биосинтеза гема Мутации в митохондриальной . Результатом является накопление железа в митохондриях и недостаточное производство гема. [21] [22] [9] [10]
Дефицит митохондриального комплекса IV (MT-C4D)
[ редактировать ]Мутации в этом гене могут вызывать дефицит митохондриального комплекса IV — заболевание дыхательной цепи митохондрий, проявляющееся широким спектром клинических проявлений — от изолированной миопатии до тяжелого мультисистемного заболевания, поражающего множество органов и тканей. Симптомы могут включать дисфункцию печени и гепатомегалию , гипотонию , мышечную слабость , непереносимость физической нагрузки , задержку моторного развития , умственную отсталость , задержку развития и гипертрофическую кардиомиопатию . У некоторых больных гипертрофическая кардиомиопатия приводит к летальному исходу на неонатальном этапе. У других больных может проявиться болезнь Ли . [23] [24] [9] [10]
Колоректальный рак (КРР)
[ редактировать ]Мутации MT-CO1 играют роль в колоректальном раке, очень сложном заболевании, проявляющемся злокачественными поражениями внутренних стенок толстой и прямой кишки . Многочисленные такие генетические изменения часто связаны с прогрессированием аденомы или предраковых поражений в инвазивную аденокарциному . Длительный язвенный колит , полипы толстой кишки и семейный анамнез являются факторами риска колоректального рака. [25] [26] [9] [10]
Рецидивирующая миоглобинурия митохондриальная (РМ-МТ)
[ редактировать ]РМ-МТ — заболевание, характеризующееся повторяющимися приступами рабдомиолиза (некроза или распада скелетных мышц), сопровождающегося мышечной болью и слабостью, непереносимостью физических упражнений, низкой способностью мышц к окислительному фосфорилированию и сопровождающееся экскрецией миоглобина с мочой. Это связано с митохондриальной миопатией. Мутация G5920A и гетероплазматическая нонсенс-мутация G6708A были связаны с дефицитом ЦОГ и RM-MT. [27] [28] [9] [10]
Глухота, нейросенсорная, митохондриальная (DFNM)
[ редактировать ]ДФНМ — это форма несиндромальной глухоты, передающаяся по материнской линии . У больных наблюдается прогрессирующая постлингвальная нейросенсорная потеря слуха, затрагивающая высокие частоты. Мутация A1555G связана с этим заболеванием. [29] [9] [10]
Подсемейства
[ редактировать ]- Цитохром с-оксидаза cbb3-типа, субъединица I InterPro : IPR004677
- Цитохром-о-убихинолоксидаза, субъединица I InterPro : IPR014207
- Цитохромаа3-хинолоксидаза, субъединица I InterPro : IPR014233
- Цитохром с-оксидаза, субъединица I бактериального типа InterPro : IPR014241
Использование в штрих-кодировании ДНК
[ редактировать ]MT-CO1 — это ген, который часто используется в качестве штрих-кода ДНК для идентификации видов животных. Последовательность гена MT-CO1 подходит для этой роли, поскольку скорость ее мутаций обычно достаточно высока, чтобы различать близкородственные виды , а также потому, что ее последовательность консервативна среди сородичей. Вопреки основному возражению, выдвинутому скептиками, о том, что различия в последовательностях MT-CO1 слишком малы, чтобы их можно было обнаружить между близкородственными видами, между близкородственными видами животных обычно обнаруживается расхождение более чем на 2%. [30] предполагая, что штрих-код эффективен для большинства животных. Однако у большинства, если не у всех , семенных растений скорость эволюции MT-CO1 очень медленная. Также было высказано предположение, что MT-CO1 может быть лучшим геном для штрих-кодирования ДНК почвенных грибов , чем ITS (ген, наиболее часто используемый для микологического штрих-кодирования). [31]
MT-COI (= CCOI) в криптах толстой кишки
[ редактировать ]
Белок MT-COI, также известный как CCOI, обычно экспрессируется на высоком уровне в цитоплазме крипт толстой человека кишки (толстой кишки). Однако MT-COI часто теряется в криптах толстой кишки с возрастом у людей, а также часто отсутствует в дефектах полей, которые приводят к раку толстой кишки, а также в некоторых частях рака толстой кишки. [32]
Эпителиальная внутренняя поверхность толстой кишки испещрена инвагинациями — криптами толстой кишки. Крипты толстой кишки имеют форму микроскопических толстостенных пробирок с центральным отверстием по всей длине трубки ( просвет крипты ). На изображении в этом срезе показаны четыре среза ткани: два — поперек длинных осей крипт, а два — параллельно длинным осям.
Большинство крипт толстой кишки человека на изображениях имеют высокую экспрессию окрашенного в коричнево-оранжевый цвет MT-COI. Однако в некоторых криптах толстой кишки все клетки лишены MT-COI и выглядят в основном белыми, а их основной цвет представляет собой сине-серое окрашивание ядер на внешних стенках крипт. Гривз и др. [33] показали, что дефицит MT-COI в криптах толстой кишки обусловлен мутациями гена MT-COI. Как видно на панели B, часть стволовых клеток трех крипт имеет мутацию в MT-COI, так что от 40% до 50% клеток, возникающих из этих стволовых клеток, образуют белый сегмент в области поперечного разреза. .
У людей процент крипт толстой кишки, дефицитных по MT-COI, составляет менее 1% до 40 лет, но затем линейно увеличивается с возрастом. [32] В среднем к 80–84 годам процент крипт толстой кишки, дефицитных по MT-COI, достигает 18% у женщин и 23% у мужчин. [32] Опухоли толстой кишки часто возникают в области крипт, содержащих большое скопление (до 410) крипт с дефицитом MT-COI. При раке толстой кишки до 80% опухолевых клеток могут иметь дефицит MT-COI. [32]
Как видно на панелях C и D, длина крипт составляет от примерно 75 до примерно 110 клеток. Средняя окружность крипты составляет 23 ячейки. [34] Судя по этим измерениям, в криптах содержится от 1725 до 2530 ячеек. В другом отчете указан диапазон от 1500 до 4900 клеток в крипте толстой кишки. [35]
Появление частых крипт с почти полной утратой MT-COI в их количестве от 1700 до 5000 клеток предполагает процесс естественного отбора. Однако также было показано, что дефицит в конкретной крипте из-за первоначальной мутации митохондриальной ДНК может иногда возникать в результате стохастического процесса. [36] [37] Тем не менее, частое возникновение дефицита MT-COI во многих криптах эпителия толстой кишки указывает на то, что отсутствие MT-COI, вероятно, обеспечивает селективное преимущество.
MT-COI кодируется митохондриальной хромосомой . В большинстве митохондрий имеется несколько копий хромосомы, обычно от 2 до 6 на митохондрию. [38] [39] [40] Если мутация MT-COI происходит в одной хромосоме митохондрии, может произойти случайное расслоение хромосом во время деления митохондрий с образованием новых митохондрий. Это может привести к образованию митохондрии с преимущественно или исключительно MT-COI-мутированными хромосомами.
Митохондрия с хромосомами, в значительной степени мутированными по MT-COI, должна будет иметь положительную ошибку отбора , чтобы часто становиться основным типом митохондрий в клетке (клетке с гомоплазмией с дефицитом MT-COI ). В каждой клетке содержится от 100 до 700 митохондрий, в зависимости от типа клеток. [39] [40] Более того, происходит довольно быстрый оборот митохондрий, так что митохондрия с хромосомами, мутированными по MT-COI, и положительным смещением отбора может вскоре стать основным типом митохондрий в клетке. Средний период полураспада митохондрий у крыс в зависимости от типа клеток составляет от 9 до 24 дней. [41] а у мышей – около 2 дней. [42] У человека период полураспада митохондрий, вероятно, также составляет от нескольких дней до недель.
Стволовая клетка в основании крипт толстой кишки, которая в значительной степени дефицитна по MT-COI, может конкурировать с другими 4 или 5 стволовыми клетками за занятие ниши стволовых клеток. Если это произойдет, то в криптах толстой кишки будет дефицит MT-COI во всех 1700–5000 клетках, как показано для некоторых крипт на панелях A, B и D изображения.
Крипты толстой кишки могут размножаться путем деления, как видно на панели C, где крипта делится с образованием двух крипт, и на панели B, где по крайней мере одна крипта делится. Большинство крипт с дефицитом MT-COI представляют собой кластеры крипт (клоны крипт) с двумя или более криптами с дефицитом MT-COI, расположенными рядом друг с другом (см. панель D). [32] Это показывает, что часто возникают клоны дефицитных крипт и, таким образом, вероятно, существует положительная селективная предвзятость, которая позволила им распространиться в эпителии толстой кишки человека.
Неясно, почему дефицит MT-COI должен иметь положительную селективную ошибку. Одно предложение [32] заключается в том, что дефицит MT-COI в митохондриях приводит к снижению выработки реактивного кислорода (и меньшему окислительному повреждению), и это обеспечивает селективное преимущество в конкуренции с другими митохондриями внутри той же клетки за генерирование гомоплазмии при дефиците MT-COI. Другое предположение заключалось в том, что клетки с дефицитом цитохром-с-оксидазы устойчивы к апоптозу и, следовательно, с большей вероятностью выживут. Связь MT-COI с апоптозом возникает потому, что активная цитохром с-оксидаза окисляет цитохром с, который затем активирует прокаспазу 9, что приводит к апоптозу. [43] Эти два фактора могут способствовать частому возникновению крипт толстой кишки с дефицитом MT-COI с возрастом или во время канцерогенеза в толстой кишке человека.
Взаимодействия
[ редактировать ]MITRAC (промежуточное соединение сборки регуляции митохондриальной трансляции цитохром с оксидазы) В комплексе кодируемый белок взаимодействует с COA3 и SMIM20 / MITRAC7 . Это взаимодействие с SMIM20 стабилизирует вновь синтезированный MT-CO1 и предотвращает его преждевременный оборот . [44] Кроме того, он взаимодействует с TMEM177 -зависимым образом COX20 . [45] [9] [10]
Ссылки
[ редактировать ]- ^ Jump up to: а б с GRCh38: Версия Ensembl 89: ENSG00000198804 – Ensembl , май 2017 г.
- ^ Jump up to: а б с GRCm38: выпуск Ensembl 89: ENSMUSG00000064351 – Ensembl , май 2017 г.
- ^ «Ссылка на Human PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Ссылка на Mouse PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ Цукихара Т., Аояма Х., Ямасита Э., Томизаки Т., Ямагути Х., Синдзава-Ито К. и др. (май 1996 г.). «Вся структура 13-субъединичной окисленной цитохром с оксидазы при 2,8 А». Наука . 272 (5265): 1136–1144. Бибкод : 1996Sci...272.1136T . дои : 10.1126/science.272.5265.1136 . ПМИД 8638158 . S2CID 20860573 .
- ^ Jump up to: а б «Ген Энтрез: субъединица I цитохром с-оксидазы» .
- ^ Косакян А., Хегер Т.Дж., Леандер Б.С., Тодоров М., Митчелл Э.А., Лара Э. (май 2012 г.). «Штрих-кодирование COI раковинных амеб Nebelid (Amoebozoa: Arcellinida): обширное загадочное разнообразие и новое определение Hyalospheniidae Schultze» (PDF) . Протист . 163 (3): 415–434. дои : 10.1016/j.protis.2011.10.003 . ПМИД 22130576 .
- ^ Jump up to: а б Онлайн-менделевское наследование у человека (OMIM): 516030
- ^ Jump up to: а б с д и ж г час я «MT-CO1 - субъединица 1 цитохром с-оксидазы - Homo sapiens (человек) - ген и белок MT-CO1» . www.uniprot.org . Проверено 13 августа 2018 г.
 В эту статью включен текст, доступный по лицензии CC BY 4.0 .
В эту статью включен текст, доступный по лицензии CC BY 4.0 . - ^ Jump up to: а б с д и ж г час я «UniProt: универсальная база знаний о белках» . Исследования нуклеиновых кислот . 45 (Д1): Д158–Д169. Январь 2017 г. doi : 10.1093/nar/gkw1099 . ПМК 5210571 . ПМИД 27899622 .
- ^ Зонг Н.К., Ли Х., Ли Х., Лам М.П., Хименес Р.К., Ким К.С. и др. (октябрь 2013 г.). «Интеграция биологии и медицины сердечного протеома с помощью специализированной базы знаний» . Исследование кровообращения . 113 (9): 1043–1053. дои : 10.1161/CIRCRESAHA.113.301151 . ПМК 4076475 . ПМИД 23965338 .
- ^ «MT-CO1 - субъединица 1 цитохром с-оксидазы» . База знаний Атласа органических белков сердца (COPaKB) . [ постоянная мертвая ссылка ]
- ^ Jump up to: а б с Гарсия-Хорсман Х.А., Баркера Б., Рамбли Дж., Ма Дж., Геннис Р.Б. (сентябрь 1994 г.). «Суперсемейство гемомедных респираторных оксидаз» . Журнал бактериологии . 176 (18): 5587–5600. дои : 10.1128/jb.176.18.5587-5600.1994 . ЧВК 196760 . ПМИД 8083153 .
- ^ Папа С., Капитанио Н., Глейзер П., Виллани Дж. (май 1994 г.). «Протонный насос гем-медных оксидаз». Международная клеточная биология . 18 (5): 345–355. дои : 10.1006/cbir.1994.1084 . ПМИД 8049679 . S2CID 36428993 .
- ^ Кастресана Дж., Люббен М., Сарасте М., Хиггинс Д.Г. (июнь 1994 г.). «Эволюция цитохромоксидазы, фермента старше атмосферного кислорода» . Журнал ЭМБО . 13 (11): 2516–2525. дои : 10.1002/j.1460-2075.1994.tb06541.x . ПМК 395125 . ПМИД 8013452 .
- ^ Капальди Р.А., Малатеста Ф., Дарли-Усмар В.М. (июль 1983 г.). «Структура цитохром с оксидазы». Biochimica et Biophysica Acta (BBA) - Обзоры по биоэнергетике . 726 (2): 135–148. дои : 10.1016/0304-4173(83)90003-4 . ПМИД 6307356 .
- ^ Холм Л., Сарасте М., Викстрем М. (сентябрь 1987 г.). «Структурные модели окислительно-восстановительных центров цитохромоксидазы» . Журнал ЭМБО . 6 (9): 2819–2823. дои : 10.1002/j.1460-2075.1987.tb02578.x . ПМК 553708 . ПМИД 2824194 .
- ^ Сарасте М., Кастресана Дж. (март 1994 г.). «Цитохромоксидаза возникла в результате работы с ферментами денитрификации» . Письма ФЭБС . 341 (1): 1–4. дои : 10.1016/0014-5793(94)80228-9 . ПМИД 8137905 . S2CID 1248917 .
- ^ Чен Дж., Строус М. (февраль 2013 г.). «Денитрификация и аэробное дыхание, гибридные цепи переноса электронов и коэволюция» . Biochimica et Biophysica Acta (BBA) — Биоэнергетика . 1827 (2): 136–144. дои : 10.1016/j.bbabio.2012.10.002 . ПМИД 23044391 .
- ^ Браун, доктор медицинских наук, Ян CC, Траунс I, Торрони А., Лотт М.Т., Уоллес, округ Колумбия (август 1992 г.). «Вариант митохондриальной ДНК, выявленный у пациентов с наследственной оптической невропатией Лебера, который удлиняет аминокислотную последовательность субъединицы I цитохром с-оксидазы» . Американский журнал генетики человека . 51 (2): 378–385. ПМК 1682694 . ПМИД 1322638 .
- ^ Гаттерманн Н., Рецлафф С., Ван Й.Л., Хофхаус Г., Хайниш Дж., Аул С., Шнайдер В. (декабрь 1997 г.). «Гетероплазматические точечные мутации митохондриальной ДНК, затрагивающие субъединицу I цитохром с-оксидазы у двух пациентов с приобретенной идиопатической сидеробластной анемией» . Кровь . 90 (12): 4961–4972. дои : 10.1182/blood.V90.12.4961 . ПМИД 9389715 .
- ^ Брокер С., Менье Б., Рич П., Гаттерманн Н., Хофхаус Г. (ноябрь 1998 г.). «Мутации мтДНК, связанные с сидеробластной анемией, вызывают дефект митохондриальной цитохром-с-оксидазы». Европейский журнал биохимии . 258 (1): 132–138. дои : 10.1046/j.1432-1327.1998.2580132.x . ПМИД 9851701 .
- ^ Варламов Д.А., Кудин А.П., Вильхабер С., Шредер Р., Сассен Р., Беккер А. и др. (август 2002 г.). «Метаболические последствия новой миссенс-мутации гена CO I мтДНК» . Молекулярная генетика человека . 11 (16): 1797–1805. дои : 10.1093/hmg/16.11.1797 . ПМИД 12140182 .
- ^ Лучиоли С., Хоффмайер К., Карроццо Р., Тесса А., Людвиг Б., Санторелли Ф.М. (март 2006 г.). «Внедрение новой мутации мтДНК человека в ген COX I Paracoccus denitrificans объясняет функциональные нарушения у пациента». Нейрогенетика . 7 (1): 51–57. дои : 10.1007/s10048-005-0015-z . ПМИД 16284789 . S2CID 21304246 .
- ^ Гривз Л.С., Престон С.Л., Тадроус П.Дж., Тейлор Р.В., Бэррон М.Дж., Укриф Д. и др. (январь 2006 г.). «Мутации митохондриальной ДНК возникают в стволовых клетках толстой кишки человека, а мутировавшие клоны размножаются за счет деления крипт» . Труды Национальной академии наук Соединенных Штатов Америки . 103 (3): 714–719. Бибкод : 2006PNAS..103..714G . дои : 10.1073/pnas.0505903103 . ПМЦ 1325106 . ПМИД 16407113 .
- ^ Намслауер И., Бжезинский П. (март 2009 г.). «Мутация митохондриальной ДНК, связанная с раком толстой кишки, приводит к утечке протонов в цитохром-с-оксидазе» . Труды Национальной академии наук Соединенных Штатов Америки . 106 (9): 3402–3407. Бибкод : 2009PNAS..106.3402N . дои : 10.1073/pnas.0811450106 . ПМЦ 2651238 . ПМИД 19218458 .
- ^ Карадимас К.Л., Гринштейн П., Сью К.М., Джозеф Дж.Т., Танджи К., Халлер Р.Г. и др. (сентябрь 2000 г.). «Рецидивирующая миоглобинурия из-за нонсенс-мутации в гене COX I митохондриальной ДНК». Неврология . 55 (5): 644–649. дои : 10.1212/wnl.55.5.644 . ПМИД 10980727 . S2CID 26776388 .
- ^ Коллберг Г., Мослеми А.Р., Линдберг С., Холм Э., Олдфорс А. (февраль 2005 г.). «Митохондриальная миопатия и рабдомиолиз, связанные с новой нонсенс-мутацией в гене, кодирующем субъединицу I цитохром с-оксидазы» . Журнал невропатологии и экспериментальной неврологии . 64 (2): 123–128. дои : 10.1093/jnen/64.2.123 . ПМИД 15751226 .
- ^ Пандия А., Ся XJ, Эрденетунгалаг Р., Амендола М., Ланда Б., Раднаабазар Дж. и др. (декабрь 1999 г.). «Гетерогенные точковые мутации в предшественнике митохондриальной тРНК Ser(UCN), сосуществующие с мутацией A1555G у глухих студентов из Монголии» . Американский журнал генетики человека . 65 (6): 1803–1806. дои : 10.1086/302658 . ПМЦ 1288397 . ПМИД 10577941 .
- ^ Хеберт П.Д., Ратнасингем С., деВаард-младший (август 2003 г.). «Штрих-кодирование жизни животных: различия субъединицы 1 цитохром с-оксидазы среди близкородственных видов» . Слушания. Биологические науки . 270 (Приложение 1): S96–S99. дои : 10.1098/rsbl.2003.0025 . ПМК 1698023 . ПМИД 12952648 .
- ^ Молитор С, Интавонг Б, Сейдж Л, Джеремия Р.А., Мухамаду Б (январь 2010 г.). «Потенциал гена cox1 в таксономическом разрешении почвенных грибов» . Письма FEMS по микробиологии . 302 (1): 76–84. дои : 10.1111/j.1574-6968.2009.01839.x . ПМИД 19909345 .
- ^ Jump up to: а б с д и ж г Бернштейн С., Фациста А., Нгуен Х., Зайтлин Б., Хассуна Н., Лустаунау С. и др. (декабрь 2010 г.). «Рак и возрастная недостаточность цитохром с-оксидазы I в криптах толстой кишки» . Всемирный журнал желудочно-кишечной онкологии . 2 (12): 429–442. дои : 10.4251/wjgo.v2.i12.429 . ПМК 3011097 . ПМИД 21191537 .
- ^ Гривз Л.С., Престон С.Л., Тадроус П.Дж., Тейлор Р.В., Бэррон М.Дж., Укриф Д. и др. (январь 2006 г.). «Мутации митохондриальной ДНК возникают в стволовых клетках толстой кишки человека, а мутировавшие клоны размножаются за счет деления крипт» . Труды Национальной академии наук Соединенных Штатов Америки . 103 (3): 714–719. Бибкод : 2006PNAS..103..714G . дои : 10.1073/pnas.0505903103 . ПМЦ 1325106 . ПМИД 16407113 .
- ^ Бейкер А.М., Серезер Б., Мелтон С., Флетчер А.Г., Родригес-Хусто М., Тадроус П.Дж. и др. (август 2014 г.). «Количественная оценка эволюции крипт и стволовых клеток в нормальной и неопластической толстой кишке человека» . Отчеты по ячейкам . 8 (4): 940–947. дои : 10.1016/j.celrep.2014.07.019 . ПМЦ 4471679 . ПМИД 25127143 .
- ^ Нутебум М., Джонсон Р., Тейлор Р.В., Райт Н.А., Лайтоулерс Р.Н., Кирквуд Т.Б. и др. (февраль 2010 г.). «Возрастные мутации митохондриальной ДНК приводят к небольшим, но значительным изменениям в пролиферации клеток и апоптозе в криптах толстой кишки человека» . Стареющая клетка . 9 (1): 96–99. дои : 10.1111/j.1474-9726.2009.00531.x . ПМК 2816353 . ПМИД 19878146 .
- ^ Коллер Х.А., Бодяк Н.Д., Храпко К. (апрель 2002 г.). «Частые внутриклеточные клональные расширения соматических мутаций мтДНК: значение и механизмы». Анналы Нью-Йоркской академии наук . 959 (1): 434–447. Бибкод : 2002NYASA.959..434C . дои : 10.1111/j.1749-6632.2002.tb02113.x . ПМИД 11976216 . S2CID 40639679 .
- ^ Нехаева Е., Бодяк Н.Д., Крайцберг Ю., МакГрат С.Б., Ван Орсоу Н.Дж., Плужников А. и др. (апрель 2002 г.). «Клонально расширенные точечные мутации мтДНК широко распространены в отдельных клетках тканей человека» . Труды Национальной академии наук Соединенных Штатов Америки . 99 (8): 5521–5526. Бибкод : 2002PNAS...99.5521N . дои : 10.1073/pnas.072670199 . ПМЦ 122802 . ПМИД 11943860 .
- ^ Легро Ф., Малка Ф., Фрашон П., Ломбес А., Рохо М. (июнь 2004 г.). «Организация и динамика митохондриальной ДНК человека». Журнал клеточной науки . 117 (Часть 13): 2653–2662. дои : 10.1242/jcs.01134 . ПМИД 15138283 . S2CID 14335558 .
- ^ Jump up to: а б Робин ЭД, Вонг Р. (сентябрь 1988 г.). «Молекулы митохондриальной ДНК и виртуальное количество митохондрий на клетку в клетках млекопитающих». Журнал клеточной физиологии . 136 (3): 507–513. дои : 10.1002/jcp.1041360316 . ПМИД 3170646 . S2CID 2841036 .
- ^ Jump up to: а б Сато М., Куроива Т. (сентябрь 1991 г.). «Организация множества нуклеоидов и молекул ДНК в митохондриях клетки человека». Экспериментальные исследования клеток . 196 (1): 137–140. дои : 10.1016/0014-4827(91)90467-9 . ПМИД 1715276 .
- ^ Мензис Р.А., Золотой PH (апрель 1971 г.). «Обмен митохондрий в различных тканях молодых взрослых и старых крыс» . Журнал биологической химии . 246 (8): 2425–2429. дои : 10.1016/S0021-9258(18)62305-1 . ПМИД 5553400 .
- ^ Мива С., Лоулесс С., фон Зглиницки Т. (декабрь 2008 г.). «Обмен митохондрий в печени происходит быстро in vivo и ускоряется при ограничении питания: применение простой динамической модели» . Стареющая клетка . 7 (6): 920–923. дои : 10.1111/j.1474-9726.2008.00426.x . ПМЦ 2659384 . ПМИД 18691181 .
- ^ Браун Г.К., Борутайте В. (2008). «Регуляция апоптоза окислительно-восстановительным состоянием цитохрома с» . Biochimica et Biophysica Acta (BBA) — Биоэнергетика . 1777 (7–8): 877–881. дои : 10.1016/j.bbabio.2008.03.024 . ПМИД 18439415 .
- ^ Деннерляйн С., Ольеклаус С., Янс Д., Хеллвиг С., Барет Б., Якобс С. и др. (сентябрь 2015 г.). «MITRAC7 действует как COX1-специфичный шаперон и обнаруживает контрольную точку во время сборки цитохрома c-оксидазы» . Отчеты по ячейкам . 12 (10): 1644–1655. дои : 10.1016/j.celrep.2015.08.009 . hdl : 11858/00-001M-0000-0028-466E-C . ПМИД 26321642 .
- ^ Лоренци И., Ольеклаус С., Айх А., Ронсёр С., Каллегари С., Дудек Дж. и др. (февраль 2018 г.). «Митохондриальный TMEM177 связывается с COX20 во время биогенеза COX2» . Биохимия и биофизика Acta (BBA) - Исследования молекулярных клеток . 1865 (2): 323–333. дои : 10.1016/j.bbamcr.2017.11.010 . ПМЦ 5764226 . ПМИД 29154948 .
Дальнейшее чтение
[ редактировать ]- Торрони А., Ахилли А., Маколей В., Ричардс М., Бандельт Х.Дж. (июнь 2006 г.). «Сбор плодов дерева мтДНК человека». Тенденции в генетике . 22 (6): 339–345. дои : 10.1016/j.tig.2006.04.001 . PMID 16678300 .
- Бодентейх А., Митчелл Л.Г., Полимеропулос М.Х., Меррил Ч.Р. (май 1992 г.). «Динуклеотидный повтор в D-петле митохондрий человека». Молекулярная генетика человека . 1 (2): 140. doi : 10.1093/hmg/1.2.140-a . ПМИД 1301157 .
- Браун, доктор медицинских наук, Ян CC, Траунс I, Торрони А., Лотт М.Т., Уоллес, округ Колумбия (август 1992 г.). «Вариант митохондриальной ДНК, выявленный у пациентов с наследственной оптической невропатией Лебера, который удлиняет аминокислотную последовательность субъединицы I цитохром с-оксидазы» . Американский журнал генетики человека . 51 (2): 378–385. ПМК 1682694 . ПМИД 1322638 .
- Лу X, Уокер Т., Макманус Дж.П., Селиги В.Л. (июль 1992 г.). «Дифференциация клеток аденокарциномы толстой кишки человека HT-29 коррелирует с повышенной экспрессией митохондриальной РНК: влияние трегалозы на рост и созревание клеток». Исследования рака . 52 (13): 3718–3725. ПМИД 1377597 .
- Марзуки С., Ноер А.С., Лертрит П., Тьягараджан Д., Капса Р., Уттанафол П., Бирн Э. (декабрь 1991 г.). «Нормальные варианты митохондриальной ДНК человека и продукты трансляции: построение справочной базы данных». Генетика человека . 88 (2): 139–145. дои : 10.1007/bf00206061 . ПМИД 1757091 . S2CID 28048453 .
- Мораес К.Т., Андреетта Ф., Бонилья Э., Шанске С., ДиМауро С., Шон Э.А. (март 1991 г.). «Репликационно-компетентная митохондриальная ДНК человека, лишенная промоторной области тяжелой цепи» . Молекулярная и клеточная биология . 11 (3): 1631–1637. дои : 10.1128/MCB.11.3.1631 . ПМК 369459 . ПМИД 1996112 .
- Аттарди Г., Чомин А., Дулиттл Р.Ф., Мариоттини П., Раган С.И. (1987). «Семь неопознанных рамок считывания митохондриальной ДНК человека кодируют субъединицы НАДН-дегидрогеназы дыхательной цепи». Симпозиумы Колд-Спринг-Харбор по количественной биологии . 51 Пт 1 (1): 103–114. дои : 10.1101/sqb.1986.051.01.013 . ПМИД 3472707 .
- Чомин А., Клитер М.В., Рэган С.И., Райли М., Дулиттл Р.Ф., Аттарди Дж. (октябрь 1986 г.). «URF6, последняя неопознанная рамка считывания мтДНК человека, кодирует субъединицу НАДН-дегидрогеназы». Наука . 234 (4776): 614–618. Бибкод : 1986Sci...234..614C . дои : 10.1126/science.3764430 . ПМИД 3764430 .
- Чомин А., Мариоттини П., Клитер М.В., Раган С.И., Мацуно-Яги А., Хатефи Ю. и др. (1985). «Шесть неопознанных рамок считывания митохондриальной ДНК человека кодируют компоненты НАДН-дегидрогеназы дыхательной цепи». Природа . 314 (6012): 592–597. Бибкод : 1985Natur.314..592C . дои : 10.1038/314592a0 . ПМИД 3921850 . S2CID 32964006 .
- Сэнгер Ф., Коулсон А.Р., Баррелл Б.Г., Смит А.Дж., Роу Б.А. (октябрь 1980 г.). «Клонирование одноцепочечного бактериофага как средство быстрого секвенирования ДНК». Журнал молекулярной биологии . 143 (2): 161–178. дои : 10.1016/0022-2836(80)90196-5 . ПМИД 6260957 .
- Монтойя Дж., Охала Д., Аттарди Дж. (апрель 1981 г.). «Отличительные особенности 5'-концевых последовательностей мРНК митохондрий человека». Природа . 290 (5806): 465–470. Бибкод : 1981Natur.290..465M . дои : 10.1038/290465a0 . ПМИД 7219535 . S2CID 4358928 .
- Хорай С., Хаясака К., Кондо Р., Цугане К., Такахата Н. (январь 1995 г.). «Недавнее африканское происхождение современных людей, выявленное с помощью полных последовательностей митохондриальных ДНК человекообразных» . Труды Национальной академии наук Соединенных Штатов Америки . 92 (2): 532–536. Бибкод : 1995PNAS...92..532H . дои : 10.1073/pnas.92.2.532 . ПМК 42775 . ПМИД 7530363 .
- Эндрюс Р.М., Кубака И., Чиннери П.Ф., Лайтоулерс Р.Н., Тернбулл Д.М., Хауэлл Н. (октябрь 1999 г.). «Повторный анализ и пересмотр Кембриджской эталонной последовательности митохондриальной ДНК человека» . Природная генетика . 23 (2): 147. дои : 10.1038/13779 . ПМИД 10508508 . S2CID 32212178 .
- Ингман М., Кассманн Х., Паабо С., Гилленстен У. (декабрь 2000 г.). «Вариации митохондриального генома и происхождение современного человека». Природа . 408 (6813): 708–713. Бибкод : 2000Natur.408..708I . дои : 10.1038/35047064 . ПМИД 11130070 . S2CID 52850476 .
- Финниля С., Лехтонен М.С., Маямаа К. (июнь 2001 г.). «Филогенетическая сеть европейской мтДНК» . Американский журнал генетики человека . 68 (6): 1475–1484. дои : 10.1086/320591 . ПМК 1226134 . ПМИД 11349229 .
- Мака-Мейер Н., Гонсалес А.М., Ларруга Х.М., Флорес С., Кабрера В.М. (2003). «Основные геномные митохондриальные линии определяют раннюю экспансию человека» . БМК Генетика . 2:13 . дои : 10.1186/1471-2156-2-13 . ПМК 55343 . ПМИД 11553319 .
Эта статья включает текст из Национальной медицинской библиотеки США , который находится в свободном доступе .