МТ-АТФ6
| АТФ6 | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | АТФ6 , АТФаза6, субъединица 6 Fo синтазы МТАТР | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | Опустить : 516060 ; МГИ : 99927 ; Гомологен : 5012 ; Генные карты : ATP6 ; ОМА : АТФ6 – ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
MT-ATP6 (или ATP6 ) представляет собой митохондриальный ген с полным названием «митохондриально кодируемая мембранная субъединица 6 АТФ-синтазы», который кодирует АТФ-синтазы F o субъединицу 6 (или субъединицу/цепь А) . Эта субъединица принадлежит к комплексу F o большой трансмембранной АТФ-синтазы F-типа . [5] Этот фермент, также известный как комплекс V, отвечает за заключительный этап окислительного фосфорилирования в цепи переноса электронов . В частности, один сегмент АТФ-синтазы позволяет положительно заряженным ионам , называемым протонами , проходить через специализированную мембрану внутри митохондрий. Другой сегмент фермента использует энергию, создаваемую этим потоком протонов, для преобразования молекулы, называемой аденозиндифосфатом (АДФ), в АТФ . Мутации в гене MT-ATP6 обнаруживаются примерно у 10–20 процентов людей с синдромом Ли . [6]
Структура
[ редактировать ]
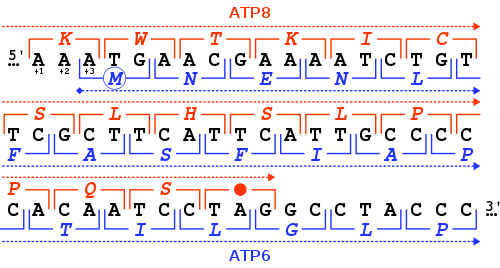
Ген MT-ATP6 предоставляет информацию для создания белка, необходимого для нормальной функции митохондрий. Ген человека MT-ATP6 , расположенный в митохондриальной ДНК 681 пару оснований . , имеет длину [7] Необычной особенностью MT-ATP6 является 46- нуклеотидное перекрытие его первых кодонов с концом гена MT-ATP8 . Что касается рамки считывания MT-ATP6 (+3), ген MT-ATP8 заканчивается в рамке считывания +1 стоп-кодоном TAG .
Белок MT-ATP6 весит 24,8 кДа и состоит из 226 аминокислот . [8] [9] Белок является субъединицей F 1 F o АТФазы, также известной как Комплекс V , который состоит из 14 ядерно- и 2 митохондриально-кодируемых субъединиц. В качестве субъединицы А MT-ATP6 содержится в некаталитической трансмембранной части F o комплекса. [7]
Номенклатура . фермента имеет давнюю историю Фракция F 1 получила свое название от термина «Фракция 1», а F o (записанная как буква «о», а не «ноль») получила свое название от того, что она является связывающей фракцией для олигомицина , типа антибиотика природного происхождения. который способен ингибировать единицу F o АТФ-синтазы. [10] [11] Область F o АТФ-синтазы представляет собой протонную пору, встроенную в мембрану митохондрий. Он состоит из трех основных субъединиц A, B и C и (у человека) шести дополнительных субъединиц d , e , f , g , F6 и 8 (или A6L). 3D-структуру гомолога этой субъединицы E. coli смоделировали На основе данных электронной микроскопии (цепь М PDB : 1c17 ). Он образует трансмембранный 4-α-пучок.
Функция
[ редактировать ]Эта субъединица является ключевым компонентом протонного канала и может играть непосредственную роль в транспортировке протонов через мембрану. Катализ в комплексе F 1 зависит от вращения центрального стебля и Foc - кольца, которое, в свою очередь, приводится в движение потоком протонов через мембрану через интерфейс между c-кольцом F0 и субъединицей А. Периферический стебель связывает субъединицу A с внешней поверхностью домена F 1 и, как полагают, действует как статор, противодействуя тенденции субъединицы A и каталитической части F 1 альфа 3 бета 3 вращаться вместе с центральным вращающимся элементом. [12]
Клиническое значение
[ редактировать ]Мутации MT-ATP6 и других генов, влияющих на окислительное фосфорилирование в митохондриях, связаны с различными нейродегенеративными и сердечно-сосудистыми заболеваниями, включая дефицит митохондриального комплекса V, наследственную оптическую нейропатию Лебера (LHON), митохондриальную энцефаломиопатию с инсультоподобными эпизодами ( MELAS ). и синдром Лея синдром НАРП . Большинство клеток организма содержат тысячи митохондрий, каждая из которых содержит одну или несколько копий митохондриальной ДНК . Тяжесть некоторых митохондриальных нарушений связана с процентом митохондрий в каждой клетке, имеющих определенное генетическое изменение. Люди с синдромом Ли из-за мутации гена MT-ATP6, как правило, имеют очень высокий процент митохондрий с мутацией (от более 90 до 95 процентов). Менее тяжелые проявления NARP обусловлены меньшим процентом митохондрий с мутацией, обычно от 70 до 90 процентов. Поскольку эти два состояния являются результатом одних и тех же генетических изменений и могут возникать у разных членов одной семьи, исследователи полагают, что они могут представлять собой спектр перекрывающихся признаков, а не два отдельных синдрома. [6]
Дефицит митохондриального комплекса V
[ редактировать ]Дефицит митохондриального комплекса V — это недостаток (дефицит) или потеря функции комплекса V цепи переноса электронов , который может вызывать широкий спектр признаков и симптомов, затрагивающих многие органы и системы организма, особенно нервную систему и сердце . Расстройство может быть опасным для жизни в младенчестве или раннем детстве. У больных могут возникнуть проблемы с питанием, медленный рост, низкий мышечный тонус ( гипотония ), сильная утомляемость ( вялость ) и задержка развития . У них наблюдается тенденция к повышению уровня молочной кислоты в крови ( лактоацидоз ), что может вызывать тошноту, рвоту, слабость и учащенное дыхание. Высокий уровень аммиака в крови ( гипераммониемия ) также может наблюдаться у больных людей и в некоторых случаях приводит к нарушению функции мозга ( энцефалопатии ) и повреждению других органов. [13] Атаксия , микроцефалия , задержка развития и умственная отсталость наблюдались у пациентов с мутацией сдвига рамки считывания в MT-ATP6. Это вызывает вставку C в положении 8612, что приводит к укороченному белку длиной всего 36 аминокислот, и два однонуклеотидных полиморфизма T > C в положениях 8610 и 8614, которые приводят к гомополимерному растяжению цитозина . [14]
Другой распространенной особенностью дефицита митохондриального комплекса V является гипертрофическая кардиомиопатия . Это состояние характеризуется утолщением ( гипертрофией ) сердечной мышцы , что может привести к сердечной недостаточности . [13] Мутация m.8528T>C возникает в перекрывающейся области генов MT-ATP6 и MT-ATP8 и была описана у многих пациентов с детской кардиомиопатией. Эта мутация изменяет инициирующий кодон в MT-ATP6 на треонин, а также заменяет триптофан на аргинин в положении 55 MT-ATP8 . [15] [16] Лица с дефицитом митохондриального комплекса V также могут иметь характерные черты лица, включая высокий лоб, изогнутые брови, направленные вниз внешние уголки глаз (наклонные глазные щели ), выступающую переносицу, низко посаженные уши, тонкие губы и маленький подбородок ( микрогнатия ). [13]
синдром Ли
[ редактировать ]Известно, что патогенные варианты митохондриального гена MT-ATP6 вызывают синдром Лея , связанный с мтДНК , — прогрессирующее заболевание головного мозга, которое обычно появляется в младенчестве или раннем детстве. У больных детей может наблюдаться задержка развития , мышечная слабость, проблемы с движением или затрудненное дыхание. [6] Другие варианты, которые, как известно, вызывают синдром Лея, связанный с мтДНК, включают MT-TL1 , MT-TK , MT-TW , MT-TV , MT-ND1 , MT-ND2 , MT-ND3 , MT-ND4 , MT-ND5 , MT-ND6. и МТ-СО3 . Нарушения выработки митохондриальной энергии приводят к нейродегенеративным расстройствам, таким как синдром Ли , который характеризуется появлением симптомов в возрасте от 12 месяцев до трех лет. Симптомы часто проявляются после вирусной инфекции и включают двигательные расстройства и периферическую нейропатию , а также гипотонию , спастичность и мозжечковую атаксию . Примерно половина заболевших пациентов умирают от дыхательной или сердечной недостаточности к трем годам. Синдром Ли является заболеванием, наследуемым по материнской линии, и его диагноз устанавливается посредством генетического тестирования вышеупомянутых митохондриальных генов, включая MT-ATP6. [17] Мутации гена MT-ATP6, связанные с синдромом Лея, изменяют один строительный блок ДНК ( нуклеотид ) в гене MT-ATP6. Наиболее распространенное генетическое изменение заменяет нуклеотид тимин на гуанин в положении 8993 (обозначается как T8993G). Мутации, вызывающие синдром Лея, нарушают функцию или стабильность АТФ-синтазного комплекса, подавляя выработку АТФ и нарушая окислительное фосфорилирование . Хотя точный механизм неясен, исследователи полагают, что нарушение окислительного фосфорилирования может привести к гибели клеток из-за уменьшения количества энергии, доступной в клетке. Определенные ткани, которым требуется большое количество энергии, такие как мозг, мышцы и сердце, кажутся особенно чувствительными к снижению клеточной энергии. Гибель клеток головного мозга, вероятно, вызывает характерные изменения в мозге, наблюдаемые при синдроме Ли, которые способствуют появлению признаков и симптомов этого заболевания. Гибель клеток в других чувствительных тканях также может способствовать развитию синдрома Лея. Гетероплазматическая мутация T→C MT - ATP6 в положении 9185 приводит к замене высококонсервативного лейцин в пролин в кодоне 220, а гетероплазматическая T→C миссенс-мутация в положении 9191 превращает высококонсервативный лейцин в пролин в положении 222 полипептида , типа Ли что приводит к фенотипу . Мутация T9185C привела к легкому и обратимому фенотипу : 97% образцов мышц и крови пациента отражают мутацию. Мутация T9191C представляла собой гораздо более тяжелый фенотип, который привел к смерти пациента в возрасте 2 лет. [18]
НАРП-синдром
[ редактировать ]Некоторые мутации гена ATP6, вызывающие синдром Ли, также ответственны за похожее, но менее тяжелое состояние, называемое невропатией, атаксией и пигментным ретинитом (NARP). [19] У людей с НАРП выявлено небольшое количество мутаций в гене MT-ATP6. Каждая из этих мутаций меняет один нуклеотид в гене MT-ATP6. Как и при синдроме Ли, наиболее частым генетическим изменением, связанным с NARP, является замена нуклеотида тимина на гуанин в положении 8993 (обозначается как T8993G). Мутации, вызывающие NARP, изменяют структуру или функцию АТФ-синтазы , снижая способность митохондрий вырабатывать АТФ. Хотя точные последствия этих мутаций неясны, исследователи продолжают исследовать, как изменения в гене MT-ATP6 влияют на выработку АТФ и приводят к мышечной слабости, потере зрения и другим особенностям NARP. [6]
Семейный двусторонний полосатый некроз
[ редактировать ]Состояние, называемое семейным двусторонним стриарным некрозом, похожее на синдром Ли, также может быть результатом изменений в гене MT-ATP6. В немногих зарегистрированных случаях этих мутаций у пораженных детей наблюдалась задержка развития, проблемы с движением и координацией, слабый мышечный тонус ( гипотония ) и необычно маленький размер головы ( микроцефалия ). Исследователи не определили, почему мутации MT-ATP6 приводят к такому сочетанию признаков и симптомов у детей с двусторонним некрозом полосатого тела. [6]
Взаимодействия
[ редактировать ]Было показано, что MT-ATP6 имеет 20 бинарных белок-белковых взаимодействий, включая 17 кокомплексных взаимодействий. MT-ATP6, по-видимому, взаимодействует с SP1 . [20]
Исследовать
[ редактировать ]опубликовал Исследовательский фонд SENS статью, в которой подробно описывается успешная аллотопическая экспрессия замещающей ДНК гена MT-ATP6 в ядерной ДНК клетки. [21]
Ссылки
[ редактировать ]- ^ Jump up to: а б с GRCh38: Версия Ensembl 89: ENSG00000198899 – Ensembl , май 2017 г.
- ^ Jump up to: а б с GRCm38: выпуск Ensembl 89: ENSMUSG00000064357 – Ensembl , май 2017 г.
- ^ «Ссылка на Human PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Ссылка на Mouse PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ Андерсон С., Банкир А.Т., Баррелл Б.Г., де Брёйн М.Х., Коулсон А.Р., Друэн Дж., Эперон И.С., Нирлих Д.П., Роу Б.А., Сэнгер Ф., Шрайер П.Х., Смит А.Дж., Стаден Р., Янг И.Г. (апрель 1981 г.). «Последовательность и организация митохондриального генома человека». Природа . 290 (5806): 457–65. Бибкод : 1981Natur.290..457A . дои : 10.1038/290457a0 . ПМИД 7219534 . S2CID 4355527 .
- ^ Jump up to: а б с д и «МТ-АТП6» . Домашний справочник по генетике . НКБИ.
- ^ Jump up to: а б «Ген Энтрез: MT-ATP6, митохондриально кодируемая АТФ-синтазой 6» .
- ^ Зонг NC, Ли Х, Ли Х, Лам МП, Хименес Р.К., Ким С.С., Денг Н., Ким АК, Чой Дж.Х., Селайя И., Лием Д., Мейер Д., Одеберг Дж., Фанг С., Лу Х.Дж., Сюй Т., Вайс Дж. , Дуан Х., Улен М., Йейтс-младший, Апвейлер Р., Ге Дж., Хермякоб Х., Пинг П. (октябрь 2013 г.). «Интеграция биологии и медицины сердечного протеома с помощью специализированной базы знаний» . Исследование кровообращения . 113 (9): 1043–53. дои : 10.1161/CIRCRESAHA.113.301151 . ПМК 4076475 . ПМИД 23965338 .
- ^ «Субъединица А АТФ-синтазы, митохондриальная» . База знаний Атласа органических белков сердца (COPaKB) .
- ^ Кагава Ю., Рэкер Э. (май 1966 г.). «Частичное разрешение ферментов, катализирующих окислительное фосфорилирование. 8. Свойства фактора, придающего чувствительность к олигомицинам митохондриальной аденозинтрифосфатазы» . Журнал биологической химии . 241 (10): 2461–6. дои : 10.1016/S0021-9258(18)96640-8 . ПМИД 4223640 .
- ^ Маккарти RE (ноябрь 1992 г.). «ВЗГЛЯД РАСТИТЕЛЬНОГО БИОХИМИКА НА H+-АТФАЗЫ И АТФ-СИНТАЗЫ» . Журнал экспериментальной биологии . 172 (Часть 1): 431–441. дои : 10.1242/jeb.172.1.431 . ПМИД 9874753 .
- ^ Карбахо Р.Дж., Келлас Ф.А., Рансуик М.Дж., Монтгомери М.Г., Уокер Дж.Э., Нойхаус Д. (август 2005 г.). «Структура F1-связывающего домена статора бычьей F1Fo-АТФазы и то, как он связывает альфа-субъединицу». Журнал молекулярной биологии . 351 (4): 824–38. дои : 10.1016/j.jmb.2005.06.012 . ПМИД 16045926 .
- ^ Jump up to: а б с «Дефицит митохондриального комплекса V» . Домашний справочник по генетике . НКБИ . Проверено 3 августа 2018 г.
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе . - ^ Джексон С.Б., Хан Д., Шретер Б., Рихтер У., Баттерсби Б.Дж., Шмитт-Мехельке Т., Мартинен П., Нуоффер Дж.М., Шаллер А. (июнь 2017 г.). «Новая мутация сдвига рамки митохондриального ATP6, вызывающая изолированный дефицит комплекса V, атаксию и энцефаломиопатию». Европейский журнал медицинской генетики . 60 (6): 345–351. дои : 10.1016/j.ejmg.2017.04.006 . hdl : 10138/237062 . ПМИД 28412374 .
- ^ Имаи А, Фудзита С, Кишита Й, Кода М, Токудзава Й, Хирата Т, Мизуно Й, Харашима Х, Накая А, Саката Й, Такеда А, Мори М, Мураяма К, Отаке А, Окадзаки Й (март 2016 г.). «Быстро прогрессирующая детская кардиомиопатия с дефицитом комплекса V митохондриальной дыхательной цепи из-за потери белков АТФазы 6 и 8». Международный журнал кардиологии . 207 : 203–5. дои : 10.1016/j.ijcard.2016.01.026 . ПМИД 26803244 .
- ^ Уэр С.М., Эль-Хасан Н., Калер С.Г., Чжан К., Ма Ю.В., Миллер Э., Вонг Б., Спайсер Р.Л., Крейген В.Дж., Козел Б.А., Грейндж Д.К., Вонг Л.Дж. (май 2009 г.). «Детская кардиомиопатия, вызванная мутацией в перекрывающейся области генов митохондриальной АТФазы 6 и 8». Журнал медицинской генетики . 46 (5): 308–14. дои : 10.1136/jmg.2008.063149 . ПМИД 19188198 . S2CID 25354118 .
- ^ Торберн Д.Р., Рахман С. (1993–2015). «Синдром Ли, связанный с митохондриальной ДНК, и НАРП» . В Пагон Р.А., Адам М.П., Ардингер Х.Х., Уоллес С.Е., Амемия А., Бин Л.Дж., Берд Т.Д., Долан Ч.Р., Фонг К.Т., Смит Р.Дж., Стивенс К. (ред.). GeneReviews [Интернет] . Сиэтл (Вашингтон): Вашингтонский университет, Сиэтл.
- ^ Мослеми А.Р., Дарин Н., Тулиниус М., Олдфорс А., Холм Э. (октябрь 2005 г.). «Две новые мутации в гене MTATP6, связанные с синдромом Ли». Нейропедиатрия . 36 (5): 314–8. дои : 10.1055/s-2005-872845 . ПМИД 16217706 .
- ^ Баракка А., Сгарби Г., Маттиацци М., Казалена Г., Паньотта Е., Валентино М.Л., Моджио М., Леназ Г., Карелли В., Солайни Г. (июль 2007 г.). «Биохимические фенотипы, связанные с мутациями митохондриального гена ATP6 в nt8993» . Biochimica et Biophysica Acta (BBA) — Биоэнергетика . 1767 (7): 913–9. дои : 10.1016/j.bbabio.2007.05.005 . ПМИД 17568559 .
- ^ «По поисковому запросу MT-ATP6 найдено 20 бинарных взаимодействий» . База данных молекулярных взаимодействий IntAct . ЭМБЛ-ЭБИ . Проверено 24 августа 2018 г.
- ^ Буминатан А., Ванхузер С., Басисти Н., Пауэрс К., Крэмптон А.Л., Ван Х, Фридрикс Н., Шиллинг Б., Брэнд, доктор медицинских наук, О'Коннор М.С. (ноябрь 2016 г.). «Стабильная ядерная экспрессия генов ATP8 и ATP6 спасает нулевой мутант комплекса V мтДНК» . Исследования нуклеиновых кислот . 44 (19): 9342–9357. дои : 10.1093/nar/gkw756 . ПМК 5100594 . ПМИД 27596602 .
Дальнейшее чтение
[ редактировать ]- Холм Э., Гретер Дж., Джейкобсон С.Э., Ларссон Н.Г., Линдстедт С., Нильссон К.О., Олдфорс А., Тулиниус М. (декабрь 1992 г.). «Митохондриальная АТФ-синтазная недостаточность у ребенка с 3-метилглутаконовой ацидурией» . Педиатрические исследования . 32 (6): 731–5. дои : 10.1203/00006450-199212000-00022 . ПМИД 1287564 .
- Торрони А., Ахилли А., Маколей В., Ричардс М., Бандельт Х.Дж. (июнь 2006 г.). «Сбор плодов дерева мтДНК человека». Тенденции в генетике . 22 (6): 339–45. дои : 10.1016/j.tig.2006.04.001 . PMID 16678300 .
- Ингман М., Кассманн Х., Паабо С., Гилленстен У. (декабрь 2000 г.). «Вариации митохондриального генома и происхождение современного человека». Природа . 408 (6813): 708–13. Бибкод : 2000Natur.408..708I . дои : 10.1038/35047064 . ПМИД 11130070 . S2CID 52850476 .
- Манфреди Дж., Фу Дж., Охайми Дж., Сэдлок Дж.Э., Квонг Дж.К., Гай Дж., Шон Э.А. (апрель 2002 г.). «Восстановление дефицита синтеза АТФ путем переноса MTATP6, гена, кодируемого митохондриальной ДНК, в ядро». Природная генетика . 30 (4): 394–9. дои : 10.1038/ng851 . ПМИД 11925565 . S2CID 30012532 .
- Торигоэ Т., Идзуми Х., Исигучи Х., Урамото Х., Мураками Т., Исэ Т., Ёсида Ю., Танабэ М., Номото М., Ито Х., Коно К. (сентябрь 2002 г.). «Усиленная экспрессия гена субъединицы вакуолярной H+-АТФазы c человека (ATP6L) в ответ на противораковые агенты» . Журнал биологической химии . 277 (39): 36534–43. дои : 10.1074/jbc.M202605200 . ПМИД 12133827 .
- Мишмар Д., Руис-Песини Е., Голик П., Маколей В., Кларк А.Г., Хоссейни С., Брэндон М., Исли К., Чен Э., Браун, доктор медицинских наук, Сукерник Р.И., Олкерс А., Уоллес, округ Колумбия (январь 2003 г.). «Естественный отбор сформировал региональные вариации мтДНК у людей» . Труды Национальной академии наук Соединенных Штатов Америки . 100 (1): 171–6. Бибкод : 2003PNAS..100..171M . дои : 10.1073/pnas.0136972100 . ПМК 140917 . ПМИД 12509511 .
- Ингман М., Гилленстен У (июль 2003 г.). «Вариации митохондриального генома и история эволюции аборигенов Австралии и Новой Гвинеи» . Геномные исследования . 13 (7): 1600–6. дои : 10.1101/гр.686603 . ПМК 403733 . ПМИД 12840039 .
- Конг К.П., Яо Ю.Г., Сунь С., Бандельт Х.Дж., Чжу К.Л., Чжан Ю.П. (сентябрь 2003 г.). «Филогения восточноазиатских линий митохондриальной ДНК, выведенная на основе полных последовательностей» . Американский журнал генетики человека . 73 (3): 671–6. дои : 10.1086/377718 . ПМЦ 1180693 . ПМИД 12870132 .
- Темперли Р.Дж., Сенека С.Х., Тонска К., Бартник Э., Биндофф Л.А., Лайтаулерс Р.Н., Хшановска-Лайтаулерс З.М. (сентябрь 2003 г.). «Исследование патогенной микроделеции мтДНК выявило зависимый от трансляции путь деаденилирования в митохондриях человека» . Молекулярная генетика человека . 12 (18): 2341–8. дои : 10.1093/hmg/ddg238 . ПМИД 12915481 .
- Рейтер Т.Я., Медхерст А.Л., Вайсфис К., Чжи Ю., Хертерих С., Хен Х., Гросс Х.Дж., Йоэндже Х., Хоатлин М.Э., Мэтью К.Г., Хубер П.А. (октябрь 2003 г.). «Двугибридные дрожжевые скрининги подразумевают участие белков анемии Фанкони в регуляции транскрипции, передаче сигналов в клетках, окислительном метаболизме и клеточном транспорте». Экспериментальные исследования клеток . 289 (2): 211–21. дои : 10.1016/S0014-4827(03)00261-1 . ПМИД 14499622 .
- Дюбо А., Годино С., Дюмур В., Саблоньер Б., Стойкович Т., Кюиссе Ж.М., Войтишкова А., Печина П., Йесина П., Хустек Дж. (январь 2004 г.). «GUG является эффективным инициирующим кодоном для трансляции митохондриального гена ATP6 человека». Связь с биохимическими и биофизическими исследованиями . 313 (3): 687–93. дои : 10.1016/j.bbrc.2003.12.013 . ПМИД 14697245 .
- Кобл, доктор медицинских наук, Джаст Р.С., О'Каллаган Дж.Э., Летмани И.Х., Петерсон К.Т., Ирвин Дж.А., Парсонс Т.Дж. (июнь 2004 г.). «Однонуклеотидные полиморфизмы по всему геному мтДНК, которые увеличивают эффективность судебно-медицинской экспертизы у представителей европеоидной расы». Международный журнал юридической медицины . 118 (3): 137–46. дои : 10.1007/s00414-004-0427-6 . ПМИД 14760490 . S2CID 8413730 .
- Карроццо Р., Рицца Т., Стрингаро А., Пьерини Р., Мормоне Е., Санторелли Ф.М., Малорни В., Матаррезе П. (июль 2004 г.). «Передаваемые по материнской линии мутации, связанные с синдромом Ли, усиливают митохондриально-опосредованный апоптоз» . Журнал нейрохимии . 90 (2): 490–501. дои : 10.1111/j.1471-4159.2004.02505.x . ПМИД 15228605 . S2CID 33013529 .
Внешние ссылки
[ редактировать ]- Запись GeneReviews/NCBI/NIH/UW о синдроме Ли, связанном с митохондриальной ДНК, и NARP
- MT-ATP6+белок+человек Национальной медицинской библиотеки США по медицинским предметным рубрикам (MeSH)
Эта статья включает текст из Национальной медицинской библиотеки США , который находится в свободном доступе .

