Никотинамидадениндинуклеотид
| |

| |
| Имена | |
|---|---|
| Другие имена
Дифосфопиридиновый нуклеотид (ДПН + ), Коэнзим I
| |
| Идентификаторы | |
3D model ( JSmol )
|
|
| КЭБ | |
| ХЭМБЛ | |
| ХимическийПаук | |
| Лекарственный Банк | |
| Информационная карта ECHA | 100.000.169 |
| КЕГГ | |
ПабХим CID
|
|
| номер РТЭКС |
|
| НЕКОТОРЫЙ |
|
| Характеристики | |
| С 21 Ч 28 Н 7 О 14 П 2 [ 1 ] [ 2 ] | |
| Молярная масса | 663.43 g/mol |
| Появление | Белый порошок |
| Температура плавления | 160 ° С (320 ° F; 433 К) |
| Опасности | |
| Безопасность и гигиена труда (OHS/OSH): | |
Основные опасности
|
Не опасно |
| NFPA 704 (огненный алмаз) | |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |
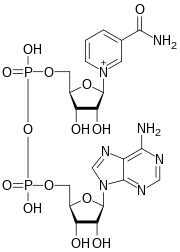
Никотинамидадениндинуклеотид ( НАД ) является коферментом центральным метаболизма . [ 3 ] НАД , обнаруженный во всех живых клетках , называется динуклеотидом, поскольку он состоит из двух нуклеотидов, соединенных фосфатными группами. Один нуклеотид содержит аденина азотистое основание , а другой — никотинамид . НАД существует в двух формах: окисленной и восстановленной форме, сокращенно НАД. + и НАДН (H для водорода ) соответственно.
В клеточном метаболизме НАД участвует в окислительно-восстановительных реакциях, перенося электроны от одной реакции к другой, поэтому он встречается в двух формах: НАД. + является окислителем , принимающим электроны от других молекул и восстанавливающимся; с Н + В результате этой реакции образуется НАДН, который можно использовать в качестве восстановителя для отдачи электронов. Эти реакции переноса электрона являются основной функцией НАД. Он также используется в других клеточных процессах, особенно в качестве субстрата ферментов модификациях при добавлении или удалении химических групп или из к белкам них , в посттрансляционных . Из-за важности этих функций ферменты, участвующие в метаболизме НАД, являются мишенью для открытия лекарств .
В организмах НАД может быть синтезирован из простых строительных блоков ( de novo ) из триптофана или аспарагиновой кислоты , каждый из которых представляет собой аминокислоту . Альтернативно, более сложные компоненты коферментов поглощаются из пищевых соединений, таких как ниацин ; подобные соединения производятся в результате реакций, которые разрушают структуру НАД, обеспечивая путь спасения , который возвращает их обратно в соответствующую активную форму.
Некоторое количество НАД превращается в кофермент никотинамидадениндинуклеотидфосфат (НАДФ), химический состав которого во многом аналогичен химическому составу НАД, хотя его основная роль заключается в качестве кофермента в анаболическом метаболизме.
об имени НАД + Надстрочный знак плюс указывает на положительный формальный заряд одного из атомов азота.
Физические и химические свойства
[ редактировать ]Никотинамидадениндинуклеотид состоит из двух нуклеозидов, соединенных пирофосфатом . Каждый нуклеозид содержит рибозное кольцо: одно с аденином, присоединенным к первому атому углерода ( положение 1' ) ( аденозиндифосфатрибоза ), а другое с никотинамидом в этом положении. [ 4 ] [ 5 ]

Соединение принимает или отдает эквивалент H − . [ 6 ] Такие реакции (суммированные в формуле ниже) включают удаление двух атомов водорода из реагента (R) в форме гидрид-иона (H − ) и протон (H + ). Протон переходит в раствор, а восстановитель RH 2 окисляется и НАД + восстанавливается до НАДН путем переноса гидрида на никотинамидное кольцо.
- РХ 2 + НАД + → НАДН + Н + + Р;
Из электронной пары гидрида один электрон притягивается к чуть более электроотрицательному атому никотинамидного кольца НАД. + , становясь частью никотинамидного фрагмента. Второй электрон и протон атома передаются атому углерода, соседнему с атомом N. Средний потенциал НАД + Окислительно-восстановительная пара /НАДН составляет -0,32 В , что делает НАДН умеренно сильным восстановителем . [ 7 ] Реакция легко обратима, когда НАДН восстанавливает другую молекулу и повторно окисляется до НАД. + . Это означает, что кофермент может непрерывно циклически переключаться между НАД и + и НАДН образуется без потребления. [ 5 ]
По внешнему виду все формы этого кофермента представляют собой белые аморфные порошки, гигроскопичные и хорошо растворимые в воде. [ 8 ] Твердые вещества стабильны, если хранить их в сухом месте и в темноте. Решения НАД + бесцветны и стабильны около недели при температуре 4 °C и нейтральном pH , но быстро разлагаются в кислых или щелочных растворах. При разложении они образуют продукты, являющиеся ингибиторами ферментов . [ 9 ]

Оба НАД + и НАДН сильно поглощают ультрафиолетовый свет из-за аденина. Например, пик поглощения НАД + имеет длину волны 259 нанометров (нм) и коэффициент экстинкции 16 900 М. −1 см −1 . НАДН также поглощает волны более высокой длины, со вторым пиком УФ-поглощения при 339 нм с коэффициентом экстинкции 6220 М. −1 см −1 . [ 10 ] Эта разница в спектрах ультрафиолетового поглощения между окисленной и восстановленной формами коферментов при более высоких длинах волн упрощает измерение превращения одного в другой в ферментных анализах - путем измерения количества УФ-поглощения при 340 нм с помощью спектрофотометра . [ 10 ]
ОНИ + и НАДН также различаются по флуоресценции . Свободно диффундирующий НАДН в водном растворе при возбуждении при поглощении никотинамида ~335 нм (ближний УФ) флуоресцирует при 445–460 нм (от фиолетового до синего) со временем жизни флуоресценции 0,4 наносекунды , в то время как НАД + не флуоресцирует. [ 11 ] [ 12 ] Свойства сигнала флуоресценции изменяются, когда НАДН связывается с белками , поэтому эти изменения можно использовать для измерения констант диссоциации , которые полезны при изучении кинетики ферментов . [ 12 ] [ 13 ] Эти изменения флуоресценции также используются для измерения изменений окислительно-восстановительного состояния живых клеток с помощью флуоресцентной микроскопии . [ 14 ]
НАДН может быть преобразован в НАД+ в реакции, катализируемой медью, для которой требуется перекись водорода. Таким образом, для снабжения клеток НАД+ необходима митохондриальная медь(II). [ 15 ] [ 16 ]
Концентрация и состояние в клетках
[ редактировать ]В печени крыс общее количество НАД + и НАДН составляет примерно 1 мкмоль на грамм сырой массы, что примерно в 10 раз превышает концентрацию НАДФ. + и НАДФН в тех же клетках. [ 17 ] Фактическая концентрация НАД + в клеточном цитозоле измерить труднее: недавние оценки в клетках животных составляют около 0,3 мМ . [ 18 ] [ 19 ] и примерно от 1,0 до 2,0 мМ в дрожжах . [ 20 ] Однако более 80% флуоресценции НАДН в митохондриях находится в связанной форме, поэтому концентрация в растворе значительно ниже. [ 21 ]
ОНИ + концентрации самые высокие в митохондриях, составляя от 40% до 70% общего клеточного НАД. + . [ 22 ] ОНИ + в цитозоле переносится в митохондрии специфическим мембранным транспортным белком , поскольку кофермент не может диффундировать через мембраны. [ 23 ] Внутриклеточный период полувыведения НАД + в одном обзоре было заявлено, что оно составляет от 1 до 2 часов, [ 24 ] тогда как в другом обзоре были даны разные оценки в зависимости от компартмента: внутриклеточный 1–4 часа, цитоплазматический 2 часа и митохондриальный 4–6 часов. [ 25 ]
Баланс между окисленной и восстановленной формами никотинамидадениндинуклеотида называется НАД. + /НАДН соотношение. Это соотношение является важным компонентом так называемого окислительно-восстановительного состояния клетки, измерения, которое отражает как метаболическую активность, так и здоровье клеток. [ 26 ] Эффекты НАД + Соотношения /НАДН сложны и контролируют активность нескольких ключевых ферментов, включая глицеральдегид-3-фосфатдегидрогеназу и пируватдегидрогеназу . В тканях здоровых млекопитающих оценки соотношения свободного НАД + соотношение НАДН в цитоплазме обычно составляет около 700:1; таким образом, это соотношение благоприятно для окислительных реакций. [ 27 ] [ 28 ] Соотношение общего НАД + /НАДН намного ниже: у млекопитающих его оценки варьируются от 3 до 10. [ 29 ] Напротив, НАДП + Соотношение /НАДФН обычно составляет около 0,005, поэтому НАДФН является доминирующей формой этого кофермента. [ 30 ] Эти разные соотношения являются ключом к различной метаболической роли НАДН и НАДФН.
Биосинтез
[ редактировать ]ОНИ + синтезируется двумя метаболическими путями. Он производится либо de novo из аминокислот, либо путями утилизации путем переработки предварительно сформированных компонентов, таких как никотинамид, обратно в НАД. + . Хотя большинство тканей синтезируют НАД + По пути спасения у млекопитающих гораздо больше синтеза de novo происходит в печени из триптофана, а в почках и макрофагах из никотиновой кислоты . [ 31 ]
И снова производство
[ редактировать ]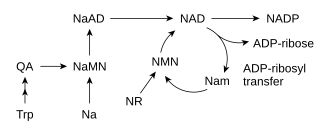
Большинство организмов синтезируют НАД. + из простых компонентов. [ 6 ] Конкретный набор реакций различается у разных организмов, но общей чертой является образование хинолиновой кислоты (QA) из аминокислоты — либо триптофана (Trp) у животных и некоторых бактерий, либо аспарагиновой кислоты (Asp) у некоторых бактерий и растений. [ 32 ] [ 33 ] Хинолиновая кислота превращается в мононуклеотид никотиновой кислоты (NaMN) путем переноса фосфорибозного фрагмента. Затем аденилатный фрагмент переносится с образованием адениндинуклеотида никотиновой кислоты (NaAD). Наконец, фрагмент никотиновой кислоты в NaAD амидируется до фрагмента никотинамида (Nam), образуя никотинамидадениндинуклеотид. [ 6 ]
На следующем этапе некоторое количество НАД + превращается в НАДФ + от НАД + киназа , фосфорилирующая НАД + . [ 34 ] У большинства организмов этот фермент использует аденозинтрифосфат (АТФ) в качестве источника фосфатной группы, хотя некоторые бактерии, такие как Mycobacterium Tuberculosis и гипертермофильная архея Pyrococcus horikoshii , используют неорганический полифосфат в качестве альтернативного донора фосфорила. [ 35 ] [ 36 ]
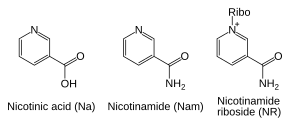
Пути спасения
[ редактировать ]Несмотря на наличие пути de novo , реакции спасения важны для человека; недостаток ниацина в рационе вызывает авитаминозную болезнь пеллагру . [ 37 ] Такая высокая потребность в НАД + возникает в результате постоянного потребления кофермента в таких реакциях, как посттрансляционные модификации, поскольку цикл НАД + Между окисленной и восстановленной формами в окислительно-восстановительных реакциях не изменяется общий уровень кофермента. [ 6 ] Основной источник НАД + у млекопитающих это путь спасения, который перерабатывает никотинамид, вырабатываемый ферментами, использующими НАД. + . [ 38 ] Первым шагом и ферментом, ограничивающим скорость на пути спасения, является никотинамидфосфорибозилтрансфераза (NAMPT), которая производит никотинамидмононуклеотид (NMN). [ 38 ] NMN является непосредственным предшественником НАД+ на пути спасения. [ 39 ]
Помимо сборки NAD + de novo из простых предшественников аминокислот клетки также восстанавливают предварительно сформированные соединения, содержащие пиридиновое основание. Тремя предшественниками витаминов, используемыми в этих метаболических путях спасения, являются никотиновая кислота (NA), никотинамид (Nam) и никотинамидрибозид (NR). [ 6 ] Эти соединения могут поступать с пищей и называются витамином B3 или ниацином . Однако эти соединения также производятся внутри клеток и путем расщепления клеточного НАД. + . Некоторые из ферментов, участвующих в этих путях спасения, по-видимому, сконцентрированы в ядре клетки , что может компенсировать высокий уровень реакций, требующих НАД. + в этой органелле . [ 40 ] Есть сообщения о том, что клетки млекопитающих могут поглощать внеклеточный НАД. + из своего окружения, [ 41 ] и никотинамид, и никотинамирибозид могут всасываться из кишечника. [ 42 ]
Пути спасения, используемые у микроорганизмов, отличаются от путей спасения у млекопитающих . [ 43 ] Некоторые патогены, такие как дрожжи Candida glabrata и бактерия Haemophilus influenzae, являются НАД. + ауксотрофы – они не могут синтезировать НАД + – но обладают путями спасения и, таким образом, зависят от внешних источников НАД. + или его предшественники. [ 44 ] [ 45 ] Еще более удивительным является внутриклеточный патоген Chlamydia trachomatis , у которого отсутствуют узнаваемые кандидаты на какие-либо гены, участвующие в биосинтезе или спасении обоих НАД. + и НАДП + и должен получить эти коферменты от своего хозяина . [ 46 ]
Функции
[ редактировать ]
Никотинамидадениндинуклеотид играет несколько важных ролей в обмене веществ . Он действует как кофермент в окислительно-восстановительных реакциях, как донор фрагментов АДФ-рибозы в реакциях АДФ-рибозилирования , как предшественник вторичного мессенджера молекулы циклической АДФ-рибозы , а также действует как субстрат для бактериальных ДНК-лигаз и группы ферментов, называемых сиртуинами , которые используют НАД + для удаления ацетильных групп из белков. Помимо этих метаболических функций, НАД + возникает как адениннуклеотид, который может высвобождаться из клеток спонтанно и посредством регулируемых механизмов. [ 48 ] [ 49 ] и, следовательно, могут играть важную внеклеточную роль. [ 49 ]
Оксидоредуктазное связывание НАД
[ редактировать ]Основная роль НАД + В обмене веществ происходит перенос электронов от одной молекулы к другой. Реакции этого типа катализируются большой группой ферментов, называемых оксидоредуктазами . Правильные названия этих ферментов содержат названия обоих их субстратов: например, НАДН-убихинон оксидоредуктаза катализирует окисление НАДН Q. коферментом [ 50 ] Однако эти ферменты также называют дегидрогеназами или редуктазами , причем НАДН-убихинон-оксидоредуктаза обычно называется НАДН-дегидрогеназой или иногда коферментом Q-редуктазой . [ 51 ]
Существует множество различных суперсемейств ферментов, связывающих НАД. + / НАДХ. Одно из наиболее распространенных суперсемейств включает структурный мотив, известный как складка Россмана . [ 52 ] [ 53 ] Мотив назван в честь Майкла Россмана , который был первым учёным, заметившим, насколько распространена эта структура в нуклеотидсвязывающих белках. [ 54 ]
Пример НАД-связывающего бактериального фермента, участвующего в метаболизме аминокислот и не имеющего складки Россмана, обнаружен у Pseudomonas syringae pv. помидор ( PDB : 2CWH ; InterPro : IPR003767 ). [ 55 ]

При связывании с активным центром оксидоредуктазы никотинамидное кольцо кофермента располагается так, что оно может принимать гидрид от другого субстрата. В зависимости от фермента донор гидрида расположен либо «над», либо «под» плоскостью плоского углерода C4, как показано на рисунке. Оксидоредуктазы класса А переносят атом сверху; ферменты класса B переносят его снизу. Поскольку углерод C4, который принимает водород, является прохиральным , это можно использовать в кинетике ферментов, чтобы получить информацию о механизме фермента. Это делается путем смешивания фермента с субстратом, в котором атомы водорода заменены атомами дейтерия , поэтому фермент восстанавливает НАД. + путем переноса дейтерия, а не водорода. В этом случае фермент может продуцировать один из двух стереоизомеров НАДН. [ 56 ]
Несмотря на сходство в том, как белки связывают два кофермента, ферменты почти всегда демонстрируют высокий уровень специфичности к любому НАД. + или НАДФ + . [ 57 ] Эта специфичность отражает различные метаболические роли соответствующих коферментов и является результатом различных наборов аминокислотных остатков в двух типах коферментсвязывающего кармана. Например, в активном центре НАДФ-зависимых ферментов ионная связь образуется между боковой цепью основной аминокислоты и кислой фосфатной группой НАДФ. + . Напротив, у НАД-зависимых ферментов заряд в этом кармане меняется на противоположный, что предотвращает НАДФ. + от привязки. Однако из этого общего правила есть несколько исключений, и такие ферменты, как альдозоредуктаза , глюкозо-6-фосфатдегидрогеназа и метилентетрагидрофолатредуктаза , у некоторых видов могут использовать оба кофермента. [ 58 ]
Роль в окислительно-восстановительном метаболизме
[ редактировать ]
Окислительно-восстановительные реакции, катализируемые оксидоредуктазами, жизненно важны во всех частях метаболизма, но одной особенно важной областью, где происходят эти реакции, является высвобождение энергии из питательных веществ. Здесь восстанавливаемые соединения, такие как глюкоза и жирные кислоты, окисляются, тем самым высвобождая энергию. Эта энергия передается НАД. + путем восстановления до НАДН в рамках бета-окисления , гликолиза и цикла лимонной кислоты . У эукариот электроны, переносимые НАДН, образующимся в цитоплазме, передаются в митохондрии (для восстановления митохондриального НАД + ) с помощью митохондриальных челноков , таких как малат-аспартатный челнок . [ 59 ] Митохондриальный НАДН затем, в свою очередь, окисляется цепью переноса электронов , которая перекачивает протоны через мембрану и генерирует АТФ посредством окислительного фосфорилирования . [ 60 ] Эти челночные системы также выполняют такую же транспортную функцию в хлоропластах . [ 61 ]
Поскольку в этих связанных наборах реакций используются как окисленная, так и восстановленная формы никотинамидадениндинуклеотида, в клетке поддерживаются значительные концентрации обоих НАД. + и НАДН с высоким содержанием НАД + Соотношение /НАДН позволяет этому коферменту действовать как окислитель и восстановитель. [ 62 ] Напротив, основная функция НАДФН – это восстановительный агент при анаболизме , при этом этот кофермент участвует в таких путях, как синтез жирных кислот и фотосинтез . Поскольку НАДФН необходим для проведения окислительно-восстановительных реакций в качестве сильного восстановителя, НАДФ + Отношение /НАДФН поддерживается на очень низком уровне. [ 62 ]
Хотя НАДН важен для катаболизма, он также используется в анаболических реакциях, таких как глюконеогенез . [ 63 ] Эта потребность в НАДН в анаболизме представляет собой проблему для прокариот, растущих на питательных веществах, которые выделяют лишь небольшое количество энергии. Например, нитрифицирующие бактерии, такие как Nitrobacter, окисляют нитрит до нитрата, который выделяет достаточно энергии для перекачки протонов и генерации АТФ, но недостаточно для непосредственного производства НАДН. [ 64 ] Поскольку НАДН по-прежнему необходим для анаболических реакций, эти бактерии используют нитрит-оксидоредуктазу для производства достаточной протондвижущей силы , чтобы запустить часть цепи переноса электронов в обратном направлении, генерируя НАДН. [ 65 ]
Неокислительно-восстановительные роли
[ редактировать ]Коэнзим НАД + также расходуется в реакциях переноса АДФ-рибозы. Например, ферменты, называемые АДФ-рибозилтрансферазами, добавляют АДФ-рибозную часть этой молекулы к белкам в посттрансляционной модификации, называемой АДФ-рибозилированием . [ 66 ] АДФ-рибозилирование включает либо добавление одного фрагмента АДФ-рибозы при моно-АДФ-рибозилировании , либо перенос АДФ-рибозы к белкам в длинных разветвленных цепях, что называется поли(АДФ-рибозилированием) . [ 67 ] Моно-АДФ-рибозилирование было впервые идентифицировано как механизм действия группы бактериальных токсинов , в частности холерного токсина , но оно также участвует в передаче сигналов в нормальных клетках . [ 68 ] [ 69 ] Поли(АДФ-рибозил)ирование осуществляется поли (АДФ-рибозо)-полимеразами . [ 67 ] [ 70 ] Структура поли(АДФ-рибозы) участвует в регуляции ряда клеточных процессов и наиболее важна в ядре клетки , в таких процессах, как восстановление ДНК и поддержание теломер . [ 70 ] Помимо этих функций внутри клетки, группа внеклеточных АДФ-рибозилтрансфераз, но их функции остаются неясными. недавно была открыта [ 71 ] ОНИ + также может быть добавлен к клеточной РНК в виде 5'-концевой модификации. [ 72 ]

Другая функция этого кофермента в передаче сигналов в клетках заключается в том, что он является предшественником циклической АДФ-рибозы , которая вырабатывается из НАД. + АДФ-рибозилциклазой как часть системы вторичного мессенджера . [ 73 ] Эта молекула участвует в передаче сигналов кальция , высвобождая кальций из внутриклеточных запасов. [ 74 ] Он делает это путем связывания и открытия класса кальциевых каналов, называемых рианодиновыми рецепторами , которые расположены в мембранах органелл , таких как эндоплазматический ретикулум , и индуцируя активацию транскрипционного фактора NAFC3. [ 75 ]
ОНИ + также потребляется различными ферментами, потребляющими НАД+, такими как CD38 , CD157 , PARP и НАД-зависимыми деацетилазами ( сиртуинами , такими как Sir2 . [ 76 ] ). [ 77 ] Эти ферменты действуют путем переноса ацетильной группы с белка-субстрата на АДФ-рибозный фрагмент НАД. + ; это расщепляет кофермент и высвобождает никотинамид и О-ацетил-АДФ-рибозу. Сиртуины, по-видимому, в основном участвуют в регуляции транскрипции посредством деацетилирования гистонов и изменения структуры нуклеосом . [ 78 ] Однако негистоновые белки также могут быть деацетилированы сиртуинами. Эта деятельность сиртуинов особенно интересна из-за их важности в регуляции старения . [ 79 ] [ 80 ]
Другие НАД-зависимые ферменты включают бактериальные ДНК-лигазы , которые соединяют два конца ДНК с помощью НАД. + в качестве субстрата для передачи фрагмента аденозинмонофосфата (АМФ) к 5'-фосфату одного конца ДНК. Это промежуточное соединение затем подвергается атаке 3'-гидроксильной группы другого конца ДНК, образуя новую фосфодиэфирную связь . [ 81 ] Это контрастирует с эукариотическими ДНК-лигазами, которые используют АТФ для образования промежуточного соединения ДНК-АМФ. [ 82 ]
Ли и др. обнаружили, что НАД + непосредственно регулирует белок-белковые взаимодействия. [ 83 ] Они также показывают, что одной из причин возрастного снижения репарации ДНК может быть повышенное связывание белка DBC1 (удаленного при раке молочной железы 1) с PARP1 (поли[АДФ-рибоза]-полимеразой 1) в виде НАД. + уровень снижается с возрастом. [ 83 ] Снижение клеточной концентрации НАД + во время старения, вероятно, способствует процессу старения и патогенезу хронических заболеваний старения. [ 84 ] Таким образом, модуляция НАД + может защитить от рака, радиации и старения. [ 83 ]
Внеклеточное действие НАД +
[ редактировать ]В последние годы НАД + также был признан внеклеточной сигнальной молекулой, участвующей в межклеточной коммуникации. [ 49 ] [ 85 ] [ 86 ] ОНИ + высвобождается из нейронов кровеносных сосудов , [ 48 ] мочевой пузырь , [ 48 ] [ 87 ] толстый кишечник , [ 88 ] [ 89 ] из нейросекреторных клеток, [ 90 ] и из синаптосом мозга , [ 91 ] и предполагается, что это новый нейромедиатор , который передает информацию от нервов к эффекторным клеткам гладкомышечных органов. [ 88 ] [ 89 ] У растений внеклеточный никотинамидадениндинуклеотид индуцирует устойчивость к инфекции патогена, и был идентифицирован первый внеклеточный рецептор НАД. [ 92 ] Необходимы дальнейшие исследования для определения основных механизмов его внеклеточного действия и их значения для здоровья человека и жизненных процессов в других организмах.
Клиническое значение
[ редактировать ]Ферменты, которые производят и используют НАД + и НАДН важны как в фармакологии , так и в исследованиях будущих методов лечения заболеваний. [ 93 ] Дизайн лекарств и разработка лекарств используют НАД + тремя способами: как прямая мишень лекарств, создавая на основе их структуры ингибиторы или активаторы ферментов, изменяющие активность НАД-зависимых ферментов, и пытаясь ингибировать НАД. + биосинтез. [ 94 ]
Поскольку раковые клетки используют усиленный гликолиз , а НАД усиливает гликолиз, никотинамидфосфорибозилтрансфераза (путь спасения НАД) часто усиливается в раковых клетках. [ 95 ] [ 96 ]
Его изучали на предмет его потенциального использования в терапии нейродегенеративных заболеваний, таких как болезнь Альцгеймера и Паркинсона, а также рассеянный склероз . [ 6 ] [ 80 ] [ 97 ] [ 77 ] Плацебо-контролируемое клиническое исследование НАДН (из которого исключались предшественники НАДН) на людях с болезнью Паркинсона не выявило никакого эффекта. [ 98 ]
ОНИ + является также непосредственной мишенью препарата изониазид , который используется при лечении туберкулеза , инфекции, вызываемой микобактерией туберкулеза . Изониазид является пролекарством , и как только он попадает в бактерии, он активируется ферментом пероксидазой , который окисляет соединение в форму свободных радикалов . [ 99 ] Затем этот радикал реагирует с НАДН с образованием аддуктов, которые являются очень мощными ингибиторами фермента еноилацил-протеин-редуктазы-переносчика . [ 100 ] и дигидрофолатредуктаза . [ 101 ]
Поскольку многие оксидоредуктазы используют НАД + и НАДН в качестве субстратов и связывают их, используя высококонсервативный структурный мотив. Идея о том, что ингибиторы на основе НАД + может быть специфичным для одного фермента, это удивительно. [ 102 ] Однако такое возможно: например, ингибиторы на основе соединений микофеноловой кислоты и тиазофурина ингибируют дегидрогеназу ИМП на НАД. + сайт связывания. Из-за важности этого фермента в метаболизме пуринов эти соединения могут быть полезны в качестве противораковых, противовирусных или иммунодепрессивных препаратов . [ 102 ] [ 103 ] Другие препараты не являются ингибиторами ферментов, а активируют ферменты, участвующие в НАД. + метаболизм. Сиртуины являются особенно интересной мишенью для таких препаратов, поскольку активация этих НАД-зависимых деацетилаз продлевает продолжительность жизни на некоторых моделях животных. [ 104 ] Такие соединения, как ресвератрол, повышают активность этих ферментов, что может иметь важное значение с точки зрения их способности задерживать старение как у позвоночных, так и у позвоночных. [ 105 ] и модельные организмы беспозвоночных . [ 106 ] [ 107 ] В одном эксперименте у мышей, получавших НАД в течение одной недели, улучшилась ядерно-митохондриальная связь. [ 108 ]
Из-за различий в метаболических путях НАД + биосинтез между организмами, например, между бактериями и человеком, эта область метаболизма является многообещающей областью для разработки новых антибиотиков . [ 109 ] [ 110 ] Например, фермент никотинамидаза , превращающий никотинамид в никотиновую кислоту, является целью разработки лекарств, поскольку этот фермент отсутствует у людей, но присутствует у дрожжей и бактерий. [ 43 ]
В бактериологии НАД, иногда называемый фактором V, используется в качестве добавки к питательной среде для некоторых требовательных бактерий. [ 111 ]
История
[ редактировать ]
Коэнзим НАД + Впервые был открыт британскими биохимиками Артуром Харденом и Уильямом Джоном Янгом в 1906 году. [ 112 ] Они заметили, что добавление кипяченого и профильтрованного дрожжевого экстракта значительно ускоряло алкогольное брожение в некипяченных дрожжевых экстрактах. Неизвестный фактор, ответственный за этот эффект, они назвали коферментом . В результате долгой и трудной очистки дрожжевых экстрактов этот термостабильный фактор был идентифицирован как нуклеотидный сахарофосфат Гансом фон Эйлером-Хельпином . [ 113 ] В 1936 году немецкий учёный Отто Генрих Варбург показал функцию нуклеотидного кофермента в переносе гидрида и определил никотинамидную часть как место окислительно-восстановительных реакций. [ 114 ]
Витамины-предшественники НАД + были впервые идентифицированы в 1938 году, когда Конрад Эльвехем показал, что печень обладает активностью «против черного языка» в форме никотинамида. [ 115 ] Затем, в 1939 году, он предоставил первые убедительные доказательства того, что ниацин используется для синтеза НАД. + . [ 116 ] В начале 1940-х годов Артур Корнберг первым обнаружил фермент в пути биосинтеза. [ 117 ] В 1949 году американские биохимики Моррис Фридкин и Альберт Л. Ленинджер доказали, что НАДН связывает метаболические пути, такие как цикл лимонной кислоты , с синтезом АТФ при окислительном фосфорилировании. [ 118 ] В 1958 году Джек Прейсс и Филип Хэндлер открыли промежуточные соединения и ферменты, участвующие в биосинтезе НАД. + ; [ 119 ] [ 120 ] Синтез спасения из никотиновой кислоты называется путем Прейсса-Хандлера. В 2004 году Чарльз Бреннер и его коллеги открыли путь никотинамид-рибозидкиназы к НАД. + . [ 121 ]
Неокислительно-восстановительная роль НАД(П) была обнаружена позже. [ 5 ] Первым было выявлено использование НАД. + в качестве донора АДФ-рибозы в реакциях АДФ-рибозилирования, наблюдавшихся в начале 1960-х годов. [ 122 ] Исследования 1980-х и 1990-х годов выявили активность НАД. + и НАДП + метаболиты в клеточной передаче сигналов – например, действие циклической АДФ-рибозы , которое было обнаружено в 1987 году. [ 123 ]
Метаболизм НАД + оставался областью интенсивных исследований в 21 веке, интерес к которым возрос после открытия НАД. + -зависимые белковые деацетилазы, названные сиртуинами в 2000 году Син-итиро Имаи и его коллегами в лаборатории Леонарда П. Гуаренте . [ 124 ] В 2009 году Имаи предложил гипотезу «Мира НАД», согласно которой ключевыми регуляторами старения и долголетия у млекопитающих являются сиртуин 1 и основной НАД. + синтезирующий фермент никотинамидфосфорибозилтрансферазу (NAMPT). [ 125 ] В 2016 году Имаи расширил свою гипотезу до «NAD World 2.0», согласно которой внеклеточный NAMPT из жировой ткани поддерживает НАД. + в гипоталамусе (центр управления) совместно с миокинами из скелетных мышц . клеток [ 126 ] В 2018 году была создана компания Napa Therapeutics для разработки лекарств против новой цели, связанной со старением, на основе исследований метаболизма НАД, проведенных в лаборатории Эрика Вердина . [ 127 ]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ «НАД+ | C21H28N7O14P2 | ChemSpider» . www.chemspider.com .
- ^ «Никотинамид-аденин-динуклеотид» . pubchem.ncbi.nlm.nih.gov .
- ^ Нельсон, Дэвид Л.; Кокс, Майкл М. (2005). Принципы биохимии (4-е изд.). Нью-Йорк: WH Freeman. ISBN 0-7167-4339-6 .
- ^ Никотинамидная группа может быть присоединена к аномерному атому углерода рибозы в двух ориентациях. Благодаря этим двум возможным структурам НАД может существовать в виде любого из двух диастереомеров . Это диастереомер β-никотинамида НАД. + то, что встречается в природе.
- ^ Jump up to: а б с Поллак Н., Дёлле С., Циглер М. (2007). «Сила восстановления: пиридиновые нуклеотиды – небольшие молекулы с множеством функций» . Биохим. Дж . 402 (2): 205–218. дои : 10.1042/BJ20061638 . ПМК 1798440 . ПМИД 17295611 .
- ^ Jump up to: а б с д и ж Беленький, Петр; Боган, Катрина Л.; Бреннер, Чарльз (январь 2007 г.). «Метаболизм НАД+ в здоровье и болезни». Тенденции биохимических наук . 32 (1): 12–19. дои : 10.1016/j.tibs.2006.11.006 . ПМИД 17161604 .
- ^ Унден Дж., Бонгертс Дж. (1997). «Альтернативные дыхательные пути Escherichia coli : энергетика и регуляция транскрипции в ответ на акцепторы электронов» . Биохим. Биофиз. Акта . 1320 (3): 217–234. дои : 10.1016/S0005-2728(97)00034-0 . ПМИД 9230919 .
- ^ Виндхольц, Марта (1983). Индекс Merck: энциклопедия химических веществ, лекарств и биологических препаратов (10-е изд.). Рэуэй, Нью-Джерси: Мерк. п. 909 . ISBN 978-0-911910-27-8 .
- ^ Бильманн Дж. Ф., Лапинте С., Хайд Э., Вейманн Г. (1979). «Структура ингибитора лактатдегидрогеназы, полученного из кофермента». Биохимия . 18 (7): 1212–1217. дои : 10.1021/bi00574a015 . ПМИД 218616 .
- ^ Jump up to: а б Доусон, Р. Бен (1985). Данные для биохимических исследований (3-е изд.). Оксфорд: Кларендон Пресс. п. 122. ИСБН 978-0-19-855358-8 .
- ^ Блэкер, Томас С.; Манн, Зои Ф.; Гейл, Джонатан Э.; Зиглер, Матиас; Бэйн, Ангус Дж.; Сабадкай, Дьёрдь; Дюшен, Майкл Р. (29 мая 2014 г.). «Разделение флуоресценции НАДН и НАДФН в живых клетках и тканях с помощью FLIM» . Природные коммуникации . 5 (1). Springer Science and Business Media LLC: 3936. Бибкод : 2014NatCo...5.3936B . дои : 10.1038/ncomms4936 . ISSN 2041-1723 . ПМК 4046109 . ПМИД 24874098 .
- ^ Jump up to: а б Лакович-младший, Шмацински Х, Новачик К, Джонсон МЛ (1992). «Визуализация времени жизни флуоресценции свободного и связанного с белком НАДН» . Учеб. Натл. акад. наук. США . 89 (4): 1271–1275. Бибкод : 1992PNAS...89.1271L . дои : 10.1073/pnas.89.4.1271 . ПМЦ 48431 . ПМИД 1741380 .
- ^ Джеймсон Д.М., Томас В., Чжоу Д.М. (1989). «Исследования флуоресценции с разрешением по времени НАДН, связанного с митохондриальной малатдегидрогеназой». Биохим. Биофиз. Акта . 994 (2): 187–190. дои : 10.1016/0167-4838(89)90159-3 . ПМИД 2910350 .
- ^ Касимова М.Р., Григиен Дж., Краб К., Хагедорн П.Х., Фливбьерг Х., Андерсен П.Е., Мёллер И.М. (2006). «Концентрация свободного НАДН поддерживается постоянной в митохондриях растений при различных метаболических условиях» . Растительная клетка . 18 (3): 688–698. дои : 10.1105/tpc.105.039354 . ПМЦ 1383643 . ПМИД 16461578 .
- ^ Чан, ПК; Кеснер, Л. (сентябрь 1980 г.). «Окисление НАДН, катализируемое комплексом меди (II), перекисью водорода». Биол Трейс Элем Рес . 2 (3): 159–174. дои : 10.1007/BF02785352 . ПМИД 24271266 . S2CID 24264851 .
- ^ Солье, Стефани; Мюллер, Себастьян; Татьяна, Канеке; Антуан, Версини; Арно, Мансар; Фабьен, Синдикубвабо; Лирой, барон; Лейла, Эмам; Пьер, Гестрауд; Г. Дан, Пантош; Винсент, Гандон; Кристина, Гайе; Тинг-Ди, Ву; Флоран, Дингли; Дамарис, Лоу; Сильвен, Бауланд; Сильвер, Дюран; Валентин, Сенсио; Сирил, Робиль; Франсуа, Троттен; Давид, Перикат; Эммануэль, Нэсер; Селин, Кугул; Этьен, Менье; Анн-Лор, Бег; Элен, Лосось; Николя, Манель; Ален, Пюизье; Сара, Ватсон; Марк А., Доусон; Николас, слуга; Гвидо, Кремер; Джиллали, Аннан; Рафаэль, Родригес (2023). «Лекарственный сигнальный путь меди, вызывающий воспаление» . Природы . 617 (7960): 386–394. Бибкод : 2023Natur.617..386S . дои : 10.1038/s41586-023-06017-4 . ПМЦ 10131557 . ПМИД 37100912 . S2CID 258353949 .
- ^ Рейсс П.Д., Зуурендонк П.Ф., Вич Р.Л. (1984). «Измерение тканевого пурина, пиримидина и других нуклеотидов методом радиальной компрессионной высокоэффективной жидкостной хроматографии». Анальный. Биохим . 140 (1): 162–71. дои : 10.1016/0003-2697(84)90148-9 . ПМИД 6486402 .
- ^ Ямада К., Хара Н., Шибата Т., Осаго Х., Цучия М. (2006). «Одновременное измерение никотинамидадениндинуклеотида и родственных соединений методом жидкостной хроматографии/тандемной масс-спектрометрии с ионизацией электрораспылением». Анальный. Биохим . 352 (2): 282–5. дои : 10.1016/j.ab.2006.02.017 . ПМИД 16574057 .
- ^ Ян Х., Ян Т., Баур Дж.А., Перес Э., Мацуи Т., Кармона Дж.Дж., Ламминг Д.В., Соуза-Пинто Н.К., Бор В.А., Розенцвейг А., де Кабо Р., Сове А.А., Синклер Д.А. (2007). «Чувствительные к питательным веществам митохондриальные НАД + Уровни диктуют выживание клеток» . Cell . 130 (6): 1095–107. doi : 10.1016/ . PMC 3366687. . PMID 17889652 j.cell.2007.07.035
- ^ Беленький П., Расетт Ф.Г., Боган К.Л., МакКлюр Дж.М., Смит Дж.С., Бреннер С. (2007). «Никотинамидрибозид способствует подавлению Sir2 и продлевает продолжительность жизни через пути Nrk и Urh1/Pnp1/Meu1 к НАД. + " . Cell . 129 (3): 473–84. doi : 10.1016/j.cell.2007.03.024 . PMID 17482543 . S2CID 4661723 .
- ^ Блинова К., Кэрролл С., Бозе С., Смирнов А.В., Харви Дж.Дж., Натсон Дж.Р., Балабан Р.С. (2005). «Распределение времени жизни флуоресценции митохондрий НАДН: стационарная кинетика матричных взаимодействий НАДН». Биохимия . 44 (7): 2585–94. дои : 10.1021/bi0485124 . ПМИД 15709771 .
- ^ Хопп А., Грютер П., Хоттигер М.О. (2019). «Регуляция метаболизма глюкозы посредством НАД+ и АДФ-рибозилирования» . Клетки . 8 (8): 890. doi : 10.3390/cells8080890 . ПМК 6721828 . ПМИД 31412683 .
- ^ Тодиско С., Агрими Г., Кастенья А., Палмьери Ф. (2006). «Идентификация митохондриального НАД + транспортер в Saccharomyces cerevisiae » . J. Biol. Chem . 281 (3): 1524–31. doi : 10.1074/jbc.M510425200 . PMID 16291748 .
- ^ Шривастава С (2016). «Новая терапевтическая роль метаболизма НАД (+) при митохондриальных и возрастных заболеваниях» . Клиническая и трансляционная медицина . 5 (1): 25. дои : 10.1186/s40169-016-0104-7 . ПМЦ 4963347 . ПМИД 27465020 .
- ^ Чжан, Нин; Сове, Энтони А. (2018). «Регуляторное влияние метаболических путей НАД + на активность сиртуина». Сиртуины в здоровье и болезни . Прогресс молекулярной биологии и трансляционной науки. Том. 154. стр. 71–104. дои : 10.1016/bs.pmbts.2017.11.012 . ISBN 9780128122617 . ПМИД 29413178 .
- ^ Шафер FQ, Бюттнер Г.Р. (2001). «Окислительно-восстановительная среда клетки, если смотреть через окислительно-восстановительное состояние пары дисульфид глутатиона/глутатион». Свободный Радик Биол Мед . 30 (11): 1191–212. дои : 10.1016/S0891-5849(01)00480-4 . ПМИД 11368918 .
- ^ Уильямсон Д.Х., Лунд П., Кребс Х.А. (1967). «Окислительно-восстановительное состояние свободного никотинамидадениндинуклеотида в цитоплазме и митохондриях печени крыс» . Биохим. Дж . 103 (2): 514–27. дои : 10.1042/bj1030514 . ПМК 1270436 . ПМИД 4291787 .
- ^ Чжан Ц, Поршень Д.В., Гудман Р.Х. (2002). «Регуляция корепрессорной функции ядерным НАДН» . Наука . 295 (5561): 1895–7. дои : 10.1126/science.1069300 . ПМИД 11847309 . S2CID 31268989 .
- ^ Лин С.Дж., Гуаренте Л. (апрель 2003 г.). «Никотинамидадениндинуклеотид, метаболический регулятор транскрипции, долголетия и болезней». Курс. Мнение. Клеточная Биол . 15 (2): 241–6. дои : 10.1016/S0955-0674(03)00006-1 . ПМИД 12648681 .
- ^ Вич Р.Л., Эгглстон Л.В., Кребс Х.А. (1969). «Окислительно-восстановительное состояние свободного никотинамид-адениндинуклеотидфосфата в цитоплазме печени крыс» . Биохим. Дж . 115 (4): 609–19. дои : 10.1042/bj1150609a . ПМЦ 1185185 . ПМИД 4391039 .
- ^ Макрейнольдс М.Р., Челлаппа К., Баур Дж.А. (2020). «Возрастное снижение НАД+» . Экспериментальная геронтология . 134 : 110888. doi : 10.1016/j.exger.2020.110888 . ПМЦ 7442590 . ПМИД 32097708 .
- ^ Като А., Уэнохара К., Акита М., Хашимото Т. (2006). «Ранние этапы биосинтеза НАД у Arabidopsis начинаются с аспартата и происходят в пластиде» . Физиол растений . 141 (3): 851–857. дои : 10.1104/стр.106.081091 . ПМЦ 1489895 . ПМИД 16698895 .
- ^ Фостер Дж.В., Moat AG (1 марта 1980 г.). «Биосинтез никотинамидадениндинуклеотида и метаболизм цикла пиридиннуклеотидов в микробных системах» . Микробиол. Преподобный . 44 (1): 83–105. дои : 10.1128/ММБР.44.1.83-105.1980 . ПМЦ 373235 . ПМИД 6997723 .
- ^ Магни Дж., Орсомандо Дж., Рафаэлли Н. (2006). «Структурные и функциональные свойства НАД-киназы, ключевого фермента биосинтеза НАДФ». Мини-обзоры по медицинской химии . 6 (7): 739–746. дои : 10.2174/138955706777698688 . ПМИД 16842123 .
- ^ Сакураба Х., Каваками Р., Осима Т. (2005). «Первая архейная неорганическая полифосфат/АТФ-зависимая НАД-киназа из гипертермофильной археи Pyrococcus horikoshii: клонирование, экспрессия и характеристика» . Прил. Окружающая среда. Микробиол . 71 (8): 4352–4358. Бибкод : 2005ApEnM..71.4352S . дои : 10.1128/АЕМ.71.8.4352-4358.2005 . ПМЦ 1183369 . PMID 16085824 .
- ^ Рафаэлли Н., Финаурини Л., Маццола Ф., Пуччи Л., Сорчи Л., Амичи А., Магни Дж. (2004). «Характеристика НАД-киназы микобактерий туберкулеза: функциональный анализ полноразмерного фермента методом направленного мутагенеза». Биохимия . 43 (23): 7610–7617. дои : 10.1021/bi049650w . ПМИД 15182203 .
- ^ Хендерсон Л.М. (1983). «Ниацин». Анну. Преподобный Нутр . 3 : 289–307. дои : 10.1146/annurev.nu.03.070183.001445 . ПМИД 6357238 .
- ^ Jump up to: а б Раджман Л., Чвалек К., Синклер Д.А. (2018). «Терапевтический потенциал молекул, усиливающих НАД: данные in vivo» . Клеточный метаболизм . 27 (3): 529–547. дои : 10.1016/j.cmet.2018.02.011 . ПМК 6342515 . ПМИД 29514064 .
- ^ «Что такое НМН?» . www.nmn.com . Проверено 8 января 2021 г.
- ^ Андерсон Р.М., Биттерман К.Дж., Вуд Дж.Г., Медведик О., Коэн Х., Лин С.С., Манчестер Дж.К., Гордон Дж.И., Синклер Д.А. (2002). «Манипулирование ядерным НАД + Путь спасения задерживает старение, не изменяя НАД в устойчивом состоянии + уровни» . J. Biol. Chem . 277 (21): 18881–18890. : 10.1074 /jbc.M111773200 . PMC 3745358. . PMID 11884393 doi
- ^ Биллингтон Р.А., Травелли С., Эрколано Э., Галли У., Роман С.Б., Гролла А.А., Канонико П.Л., Кондорелли Ф., Дженаццани А.А. (2008). «Характеристика поглощения НАД в клетках млекопитающих» . Ж. Биол. Хим . 283 (10): 6367–6374. дои : 10.1074/jbc.M706204200 . ПМИД 18180302 .
- ^ Траммелл С.А., Шмидт М.С., Вайдеманн Б.Дж., Редпат П., Якш Ф., Деллинджер Р.В., Ли З., Абель Э.Д., Миго М.Е., Бреннер С. (2016). «Никотинамидрибозид уникально биодоступен при пероральном приеме у мышей и людей» . Природные коммуникации . 7 : 12948. Бибкод : 2016NatCo...712948T . дои : 10.1038/ncomms12948 . ПМК 5062546 . ПМИД 27721479 .
- ^ Jump up to: а б Ронгво А., Андрис Ф., Ван Гул Ф., Лео О. (2003). «Реконструкция метаболизма НАД у эукариот». Биоэссе . 25 (7): 683–690. дои : 10.1002/bies.10297 . ПМИД 12815723 .
- ^ Ма Б., Пан С.Дж., Зупанчич М.Л., Кормак Б.П. (2007). «Ассимиляция НАД + предшественники Candida glabrata » . Mol. Microbiol . 66 (1): 14–25. : 10.1111 /j.1365-2958.2007.05886.x . PMID 17725566. doi S2CID 22282128 .
- ^ Рейдл Дж., Шлер С., Крайсс А., Шмидт-Браунс Дж., Кеммер Г., Солева Е. (2000). «Утилизация НАДФ и НАД у Haemophilus influenzae ». Мол. Микробиол . 35 (6): 1573–1581. дои : 10.1046/j.1365-2958.2000.01829.x . ПМИД 10760156 . S2CID 29776509 .
- ^ Гердес С.Ю., Шолле М.Д., Д'Суза М., Бернал А., Баев М.В., Фаррелл М., Курнасов О.В., Догерти М.Д., Мси Ф., Полануйер Б.М., Кэмпбелл Дж.В., Ананта С., Шаталин К.Ю., Чоудхури С.А., Фонстейн М.Ю., Остерман А.Л. ( 2002). «От генетического следа к мишеням противомикробных препаратов: примеры путей биосинтеза кофакторов» . Дж. Бактериол . 184 (16): 4555–4572. дои : 10.1128/JB.184.16.4555-4572.2002 . ПМЦ 135229 . ПМИД 12142426 .
- ^ Сенкович О., Спид Х., Григорян А. и др. (2005). «Кристаллизация трех ключевых гликолитических ферментов условно-патогенного возбудителя Cryptosporidium parvum ». Биохим. Биофиз. Акта . 1750 (2): 166–72. дои : 10.1016/j.bbapap.2005.04.009 . ПМИД 15953771 .
- ^ Jump up to: а б с Смит Л.М., Бобалова Дж., Мендоса М.Г., Лью С., Мутафова-Ямболиева В.Н. (2004). «Высвобождение бета-никотинамидадениндинуклеотида при стимуляции постганглионарных нервных окончаний кровеносных сосудов и мочевого пузыря» . J Биол Хим . 279 (47): 48893–903. дои : 10.1074/jbc.M407266200 . ПМИД 15364945 .
- ^ Jump up to: а б с Биллингтон Р.А., Бруззоне С., Де Флора А., Генаццани А.А., Кох-Нолте Ф., Зиглер М., Зокки Е (2006). «Новые функции внеклеточных пиридиннуклеотидов» . Мол. Мед . 12 (11–12): 324–7. doi : 10.2119/2006-00075.Биллингтон . ПМК 1829198 . ПМИД 17380199 .
- ^ «Номенклатура ферментов, Рекомендации по названиям ферментов Номенклатурного комитета Международного союза биохимии и молекулярной биологии» . Архивировано из оригинала 5 декабря 2007 года . Проверено 6 декабря 2007 г.
- ^ «Вид ENZYME на NiceZyme: EC 1.6.5.3» . Экспаси . Проверено 16 декабря 2007 г.
- ^ Ханукоглу I (2015). «Протеопедия: складка Россмана: бета-альфа-бета-складка в сайтах связывания динуклеотидов» . Биохим Мол Биол Образование . 43 (3): 206–209. дои : 10.1002/bmb.20849 . ПМИД 25704928 . S2CID 11857160 .
- ^ Леск А.М. (1995). «НАД-связывающие домены дегидрогеназ». Курс. Мнение. Структура. Биол . 5 (6): 775–83. дои : 10.1016/0959-440X(95)80010-7 . ПМИД 8749365 .
- ^ Рао С.Т., Россманн М.Г. (1973). «Сравнение супервторичных структур белков». Дж Мол Биол . 76 (2): 241–56. дои : 10.1016/0022-2836(73)90388-4 . ПМИД 4737475 .
- ^ Гото М, Мурамацу Х, Михара Х, Курихара Т, Эсаки Н, Оми Р, Мияхара И, Хироцу К (2005). «Кристаллические структуры Дельта1-пиперидин-2-карбоксилат/Дельта1-пирролин-2-карбоксилатредуктазы, принадлежащей к новому семейству НАД(Ф)Н-зависимых оксидоредуктаз: конформационные изменения, распознавание субстрата и стереохимия реакции» . Ж. Биол. Хим . 280 (49): 40875–84. дои : 10.1074/jbc.M507399200 . ПМИД 16192274 .
- ^ Jump up to: а б Белламачина CR (1 сентября 1996 г.). «Мотив связывания никотинамиддинуклеотида: сравнение белков, связывающих нуклеотиды» . ФАСЕБ Дж . 10 (11): 1257–69. дои : 10.1096/fasebj.10.11.8836039 . ПМИД 8836039 . S2CID 24189316 .
- ^ Каруго О, Аргос П (1997). «НАДФ-зависимые ферменты. I: Консервативная стереохимия связывания кофакторов». Белки . 28 (1): 10–28. doi : 10.1002/(SICI)1097-0134(199705)28:1<10::AID-PROT2>3.0.CO;2-N . ПМИД 9144787 . S2CID 23969986 .
- ^ Викерс Т.Дж., Орсомандо Дж., де ла Гарза Р.Д., Скотт Д.А., Канг СО, Хэнсон А.Д., Беверли С.М. (2006). «Биохимический и генетический анализ метилентетрагидрофолатредуктазы в метаболизме и вирулентности Leishmania» . Ж. Биол. Хим . 281 (50): 38150–8. дои : 10.1074/jbc.M608387200 . ПМИД 17032644 .
- ^ Баккер Б.М., Оверкамп К.М., Кёттер П., Люттик М.А., Пронк Дж.Т. (2001). «Стехиометрия и компартментация метаболизма НАДН у Saccharomyces cerevisiae » . ФЭМС Микробиол. Преподобный . 25 (1): 15–37. дои : 10.1111/j.1574-6976.2001.tb00570.x . ПМИД 11152939 .
- ^ Рич, PR (1 декабря 2003 г.). «Молекулярный механизм дыхательной цепи Кейлина». Труды Биохимического общества . 31 (6): 1095–1105. дои : 10.1042/bst0311095 . ПМИД 14641005 . S2CID 32361233 .
- ^ Хайнеке Д., Риенс Б., Гросс Х., Хоферихтер П., Петер У., Флюгге У.И., Хелдт Х.В. (1991). «Окислительно-восстановительный перенос через мембрану внутренней оболочки хлоропласта» . Физиол растений . 95 (4): 1131–1137. дои : 10.1104/стр.95.4.1131 . ПМЦ 1077662 . ПМИД 16668101 .
- ^ Jump up to: а б Николлс Д.Г.; Фергюсон С.Дж. (2002). Биоэнергетика 3 (1-е изд.). Академическая пресса. ISBN 978-0-12-518121-1 .
- ^ Систаре, Флорида; Хейнс, Р.К. (октябрь 1985 г.). «Взаимодействие между цитозольным окислительно-восстановительным потенциалом пиридиннуклеотидов и глюконеогенезом лактата/пирувата в изолированных гепатоцитах крысы. Значение для исследования действия гормонов» . Журнал биологической химии . 260 (23): 12748–12753. дои : 10.1016/S0021-9258(17)38940-8 . ПМИД 4044607 .
- ^ Фрайтаг А, Бок Э (1990). «Энергосбережение в Nitrobacter » . Письма FEMS по микробиологии . 66 (1–3): 157–62. дои : 10.1111/j.1574-6968.1990.tb03989.x .
- ^ Старкенбург С.Р., Чейн П.С., Саяведра-Сото Л.А., Хаузер Л., Лэнд М.Л., Лаример Ф.В., Малфатти С.А., Клотц М.Г., Боттомли П.Дж., Арп DJ, Хики У.Дж. (2006). «Геномная последовательность хемолитоавтотрофной нитрит-окисляющей бактерии Nitrobacter winogradskyi Nb-255» . Прил. Окружающая среда. Микробиол . 72 (3): 2050–63. Бибкод : 2006ApEnM..72.2050S . дои : 10.1128/АЕМ.72.3.2050-2063.2006 . ПМЦ 1393235 . ПМИД 16517654 .
- ^ Зиглер М (2000). «Новые функции давно известной молекулы. Новая роль НАД в клеточной передаче сигналов» . Евро. Дж. Биохим . 267 (6): 1550–64. дои : 10.1046/j.1432-1327.2000.01187.x . ПМИД 10712584 .
- ^ Jump up to: а б Дифенбах Дж., Бюркле А. (2005). «Введение в метаболизм поли(АДФ-рибозы)». Клетка. Мол. Наука о жизни . 62 (7–8): 721–30. дои : 10.1007/s00018-004-4503-3 . ПМИД 15868397 .
- ^ Бергер Ф., Рамирес-Эрнандес М.Х., Зиглер М. (2004). «Новая жизнь долгожителя: сигнальные функции НАД(Ф)». Тенденции биохимии. Наука . 29 (3): 111–8. дои : 10.1016/j.tibs.2004.01.007 . ПМИД 15003268 . S2CID 8820773 .
- ^ Корда Д., Ди Джироламо М. (2003). «Обзор нового члена Embo: функциональные аспекты моно-АДФ-рибозилирования белка» . ЭМБО Дж . 22 (9): 1953–8. дои : 10.1093/emboj/cdg209 . ПМК 156081 . ПМИД 12727863 .
- ^ Jump up to: а б Бюркле А (2005). «Поли(АДФ-рибоза). Самый сложный метаболит НАД. + FEBS j.1742-4658.2005.04864.x J. (18 ) 272 : 4576–89. : 10.1111 / . PMID 16156780. . S2CID 22975714 doi
- ^ Семан М., Адриуш С., Хааг Ф., Кох-Нолте Ф. (2004). «Экто-АДФ-рибозилтрансферазы (АРТ): новые участники клеточной коммуникации и передачи сигналов». Курс. Мед. Хим . 11 (7): 857–72. дои : 10.2174/0929867043455611 . ПМИД 15078170 .
- ^ Чен Ю.Г., Ковтонюк В.Е., Агарвал И., Шен Ю., Лю Д.Р. (декабрь 2009 г.). «ЖХ/МС-анализ клеточной РНК обнаруживает НАД-связанную РНК» . Nat Chem Biol . 5 (12): 879–881. дои : 10.1038/nchembio.235 . ПМЦ 2842606 . ПМИД 19820715 .
- ^ Гусе АХ (2004). «Биохимия, биология и фармакология циклической аденозиндифосфорибозы (cADPR)». Курс. Мед. Хим . 11 (7): 847–55. дои : 10.2174/0929867043455602 . ПМИД 15078169 .
- ^ Гусе АХ (2004). «Регуляция передачи сигналов кальция с помощью вторичного мессенджера циклической аденозиндифосфорибозы (cADPR)». Курс. Мол. Мед . 4 (3): 239–48. дои : 10.2174/1566524043360771 . ПМИД 15101682 .
- ^ Гусе АХ (2005). «Функция вторичного мессенджера и взаимосвязь структура-активность циклической аденозиндифосфорибозы (cADPR)» . ФЕБС Дж . 272 (18): 4590–7. дои : 10.1111/j.1742-4658.2005.04863.x . ПМИД 16156781 . S2CID 21509962 .
- ^ Норт Б.Дж., Вердин Э. (2004). «Сиртуины: Sir2-родственные НАД-зависимые протеиндеацетилазы» . Геном Биол . 5 (5): 224. doi : 10.1186/gb-2004-5-5-224 . ПМК 416462 . ПМИД 15128440 .
- ^ Jump up to: а б Вердин, Эрик (4 декабря 2015 г.). «НАД⁺ в старении, метаболизме и нейродегенерации» . Наука . 350 (6265): 1208–1213. Бибкод : 2015Sci...350.1208V . дои : 10.1126/science.aac4854 . ISSN 1095-9203 . ПМИД 26785480 . S2CID 27313960 .
- ^ Бландер, Гил; Гуаренте, Леонард (июнь 2004 г.). «Семейство протеиндеацетилаз Sir2». Ежегодный обзор биохимии . 73 (1): 417–435. doi : 10.1146/annurev.biochem.73.011303.073651 . ПМИД 15189148 . S2CID 27494475 .
- ^ Трапп Дж., Юнг М. (2006). «Роль НАД+-зависимых деацетилаз гистонов (сиртуинов) в старении». Цели Curr по борьбе с наркотиками . 7 (11): 1553–60. дои : 10.2174/1389450110607011553 . ПМИД 17100594 .
- ^ Jump up to: а б Мейер, Том; Шимон, Дор; Юсеф, Саусан; Янковиц, Гал; Тесслер, Ади; Чернобыльский, Том; Гаони-Йогев, Анат; Перельройзен, Рита; Будик-Хармелин, Нога; Штейнман, Лоуренс; Мэйо, Лиор (30 августа 2022 г.). «Метаболизм НАД+ стимулирует провоспалительное перепрограммирование астроцитов при аутоиммунитете центральной нервной системы» . Труды Национальной академии наук Соединенных Штатов Америки . 119 (35): e2211310119. Бибкод : 2022PNAS..11911310M . дои : 10.1073/pnas.2211310119 . ISSN 1091-6490 . ПМЦ 9436380 . ПМИД 35994674 .
- ^ Уилкинсон А., Дэй Дж., Боуотер Р. (2001). «Бактериальные ДНК-лигазы» . Мол. Микробиол . 40 (6): 1241–8. дои : 10.1046/j.1365-2958.2001.02479.x . ПМИД 11442824 . S2CID 19909818 .
- ^ Шер П., Херрманн Г., Дейли Г., Линдал Т. (1997). «Недавно идентифицированная ДНК-лигаза Saccharomyces cerevisiae , участвующая в RAD52-независимой репарации двухцепочечных разрывов ДНК» . Гены и развитие . 11 (15): 1912–24. дои : 10.1101/гад.15.11.1912 . ПМК 316416 . ПМИД 9271115 .
- ^ Jump up to: а б с Ли, Цзюнь; Бонковски, Майкл С.; Монио, Себастьен; Чжан, Дапэн; Хаббард, Бэзил П.; Линг, Элвин Дж. Ю.; Раджман, Луис А.; Цинь, Бо; Лу, Женкунь; Горбунова Вера; Аравинд, Л.; Стигборн, Клеменс; Синклер, Дэвид А. (23 марта 2017 г.). «Консервативный карман связывания НАД, который регулирует белок-белковые взаимодействия во время старения» . Наука . 355 (6331): 1312–1317. Бибкод : 2017Sci...355.1312L . дои : 10.1126/science.aad8242 . ПМК 5456119 . ПМИД 28336669 .
- ^ Вердин Э. НАД⁺ при старении, метаболизме и нейродегенерации. Наука. 4 декабря 2015 г.; 350 (6265): 1208-13. doi: 10.1126/science.aac4854. ПМИД 26785480
- ^ Зиглер М., Ньер М. (2004). "НАД + снова поверхности» . Biochem. J. 382 ( Pt 3): e5–6. : 10.1042 /BJ20041217 . PMC 1133982. . PMID 15352307 doi
- ^ Кох-Нолте Ф., Фишер С., Хааг Ф., Зиглер М. (2011). «Компартментация НАД + -зависимая передача сигналов» . FEBS Lett . 585 (11): 1651–6. : 10.1016 /j.febslet.2011.03.045 . PMID 21443875. S2CID doi 4333147 .
- ^ Брин, Лиэнн Т.; Смит, Лиза М.; Ямболиев Илья А.; Мутафова-Ямболиева, Виолета Н. (февраль 2006 г.). «β-НАД представляет собой новый нуклеотид, высвобождаемый при стимуляции нервных окончаний в мышце детрузора мочевого пузыря человека». Американский журнал физиологии. Почечная физиология . 290 (2): Ф486–Ф495. дои : 10.1152/ajprenal.00314.2005 . ПМИД 16189287 . S2CID 11400206 .
- ^ Jump up to: а б Мутафова-Ямболиева В.Н., Хван С.Дж., Хао X, Чен Х, Чжу М.Х., Вуд Дж.Д., Уорд С.М., Сандерс К.М. (2007). «Бета-никотинамидадениндинуклеотид является тормозным нейромедиатором в висцеральных гладких мышцах» . Учеб. Натл. акад. наук. США . 104 (41): 16359–64. Бибкод : 2007PNAS..10416359M . дои : 10.1073/pnas.0705510104 . ПМК 2042211 . ПМИД 17913880 .
- ^ Jump up to: а б Хван С.Дж., Дурнин Л., Дуайер Л., Ри П.Л., Уорд С.М., Ко С.Д., Сандерс К.М., Мутафова-Ямболиева В.Н. (2011). «β-никотинамидадениндинуклеотид является кишечным ингибирующим нейромедиатором в толстой кишке человека и приматов» . Гастроэнтерология . 140 (2): 608–617.e6. дои : 10.1053/j.gastro.2010.09.039 . ПМК 3031738 . ПМИД 20875415 .
- ^ Ямболиев И.А., Смит Л.М., Дурнин Л., Дай Ю., Мутафова-Ямболиева В.Н. (2009). «Хранение и секреция бета-НАД, АТФ и дофамина в NGF-дифференцированных клетках феохромоцитомы крысы PC12» . Евро. Дж. Нейроски . 30 (5): 756–68. дои : 10.1111/j.1460-9568.2009.06869.x . ПМЦ 2774892 . ПМИД 19712094 .
- ^ Дурнин Л., Дай Ю., Айба И., Шаттлворт К.В., Ямболиев И.А., Мутафова-Ямболиева В.Н. (2012). «Высвобождение, нейрональные эффекты и удаление внеклеточного β-никотинамидадениндинуклеотида (β-НАД + ) в мозге крысы» Eur . J. Neurosci . 35 (3): 423–35. doi : 10.1111/j.1460-9568.2011.07957.x . PMC 3270379. . PMID 22276961 .
- ^ Ван С, Чжоу М, Чжан X, Яо Дж, Чжан Ю, Моу Z (2017). «Киназа лектинового рецептора как потенциальный сенсор внеклеточного никотинамидадениндинуклеотида у Arabidopsis thaliana» . электронная жизнь . 6 : e25474. дои : 10.7554/eLife.25474 . ПМК 5560858 . ПМИД 28722654 .
- ^ Спасение АА (март 2008 г.). «НАД + и витамин B3: от метаболизма к терапии». Журнал фармакологии и экспериментальной терапии . 324 (3): 883–893. : 10.1124 /jpet.107.120758 . PMID 18165311. . S2CID 875753 doi
- ^ Хан Дж.А., Форухар Ф., Тао X, Тонг Л. (2007). «Метаболизм никотинамидадениндинуклеотида как привлекательная цель для открытия лекарств». Экспертное мнение. Там. Цели . 11 (5): 695–705. дои : 10.1517/14728222.11.5.695 . ПМИД 17465726 . S2CID 6490887 .
- ^ Яку К., Окабе К., Хикосака К., Накагава Т. (2018). «Метаболизм НАД в терапии рака» . Границы микробиологии . 8 : 622. doi : 10.3389/fonc.2018.00622 . ПМК 6315198 . ПМИД 30631755 .
- ^ Прамоно А.А., Ратер ГМ, Герман Х (2020). «Ферменты, способствующие НАД и НАДФН, как терапевтические мишени при раке: обзор» . Биомолекулы . 10 (3): 358. doi : 10.3390/biom10030358 . ПМЦ 7175141 . ПМИД 32111066 .
- ^ Пенберти, В. Тодд; Цунода, Икуо (2009). «Важность НАД при рассеянном склерозе» . Текущий фармацевтический дизайн . 15 (1): 64–99. дои : 10.2174/138161209787185751 . ISSN 1873-4286 . ПМЦ 2651433 . ПМИД 19149604 .
- ^ Свердлов Р.Х. (1998). «Эффективен ли НАДН при лечении болезни Паркинсона?». Наркотическое старение . 13 (4): 263–268. дои : 10.2165/00002512-199813040-00002 . ПМИД 9805207 . S2CID 10683162 .
- ^ Тимминс Г.С., Деретик В. (2006). «Механизмы действия изониазида» . Мол. Микробиол . 62 (5): 1220–1227. дои : 10.1111/j.1365-2958.2006.05467.x . ПМИД 17074073 . S2CID 43379861 .
- ^ Рават Р., Уитти А., Тонге П.Дж. (2003). «Аддукт изониазид-НАД представляет собой медленный, прочно связывающийся ингибитор InhA, еноилредуктазы микобактерий туберкулеза: сродство к аддукту и устойчивость к лекарствам» . Учеб. Натл. акад. наук. США . 100 (24): 13881–13886. Бибкод : 2003PNAS..10013881R . дои : 10.1073/pnas.2235848100 . ПМЦ 283515 . ПМИД 14623976 .
- ^ Аргиру А., Веттинг М.В., Аладегбами Б., Бланшар Дж.С. (2006). «Дигидрофолатредуктаза микобактерии туберкулеза является мишенью для изониазида». Нат. Структура. Мол. Биол . 13 (5): 408–413. дои : 10.1038/nsmb1089 . ПМИД 16648861 . S2CID 7721666 .
- ^ Jump up to: а б Панкевич К.В., Паттерсон С.Е., Блэк П.Л., Джаярам Х.Н., Рисал Д., Гольдштейн Б.М., Стуйвер Л.Дж., Шинази РФ (2004). «Кофактор имитирует селективные ингибиторы НАД-зависимой инозинмонофосфатдегидрогеназы (ИМФДГ) – основной терапевтической мишени». Курс. Мед. Хим . 11 (7): 887–900. дои : 10.2174/0929867043455648 . ПМИД 15083807 .
- ^ Франкетти П., Грифантини М (1999). «Нуклеозидные и ненуклеозидные ингибиторы дегидрогеназы ИМФ как противоопухолевые и противовирусные средства». Курс. Мед. Хим . 6 (7): 599–614. дои : 10.2174/092986730607220401123801 . ПМИД 10390603 . S2CID 247868867 .
- ^ Ким Э.Дж., Ум С.Дж. (2008). «SIRT1: роль в старении и раке» . Представитель БМБ . 41 (11): 751–756. дои : 10.5483/BMBRep.2008.41.11.751 . ПМИД 19017485 .
- ^ Валенцано Д.Р., Терзибаси Э., Генаде Т., Каттанео А., Доменичи Л., Челлерино А. (2006). «Ресвератрол продлевает продолжительность жизни и замедляет появление возрастных маркеров у недолговечных позвоночных» . Курс. Биол . 16 (3): 296–300. Бибкод : 2006CBio...16..296В . дои : 10.1016/j.cub.2005.12.038 . hdl : 11384/14713 . ПМИД 16461283 . S2CID 1662390 .
- ^ Ховитц К.Т., Биттерман К.Дж., Коэн Х.И., Ламминг Д.В., Лаву С., Вуд Дж.Г., Зипкин Р.Е., Чунг П., Киселевски А., Чжан Л.Л., Шерер Б., Синклер Д.А. (2003). «Маленькие молекулы-активаторы сиртуинов продлевают продолжительность жизни Saccharomyces cerevisiae ». Природа . 425 (6954): 191–196. Бибкод : 2003Natur.425..191H . дои : 10.1038/nature01960 . ПМИД 12939617 . S2CID 4395572 .
- ^ Вуд Дж.Г., Рогина Б., Лаву С., Ховитц К., Хелфанд С.Л., Татар М., Синклер Д. (2004). «Активаторы сиртуина имитируют ограничение калорий и задерживают старение у многоклеточных животных». Природа . 430 (7000): 686–689. Бибкод : 2004Natur.430..686W . дои : 10.1038/nature02789 . ПМИД 15254550 . S2CID 52851999 .
- ^ Гомес А.П., Прайс Н.Л., Линг А.Дж., Мослехи Дж.Дж., Монтгомери М.К., Раджман Л., Уайт Дж.П., Теодоро Дж.С., Вранн К.Д., Хаббард Б.П., Меркен Э.М., Палмейра К.М., де Кабо Р., Роло А.П., Тернер Н., Белл Э.Л., Синклер ДА (19 декабря 2013 г.). «Снижение НАД+ вызывает псевдогипоксическое состояние, нарушающее ядерно-митохондриальную связь во время старения» . Клетка . 155 (7): 1624–1638. дои : 10.1016/j.cell.2013.11.037 . ПМК 4076149 . ПМИД 24360282 .
- ^ Рицци М., Шинделин Х (2002). «Структурная биология ферментов, участвующих в биосинтезе НАД и кофактора молибдена». Курс. Мнение. Структура. Биол . 12 (6): 709–720. дои : 10.1016/S0959-440X(02)00385-8 . ПМИД 12504674 .
- ^ Бегли, Тадг П.; Кинсленд, Синтия; Мел, Райан А.; Остерман, Андрей; Доррестейн, Питер (2001). «Биосинтез никотинамидадениндинуклеотидов в бактериях». Биосинтез кофактора . Витамины и гормоны. Том. 61. С. 103–119. дои : 10.1016/S0083-6729(01)61003-3 . ISBN 9780127098616 . ПМИД 11153263 .
- ^ «Руководство по лабораторному исследованию менингита: выявление и характеристика Hib | CDC» . www.cdc.gov . 30 марта 2021 г.
- ^ Харден, А; Янг, WJ (24 октября 1906 г.). «Алкогольная закваска дрожжевого сока. Часть II. - Закваска дрожжевого сока» . Труды Лондонского королевского общества . Серия Б, содержащая статьи биологического характера. 78 (526): 369–375. дои : 10.1098/rspb.1906.0070 . JSTOR 80144 .
- ^ «Ферментация сахаров и ферментативные ферменты» (PDF) . Нобелевская лекция, 23 мая 1930 г. Нобелевский фонд. Архивировано из оригинала (PDF) 27 сентября 2007 года . Проверено 30 сентября 2007 г.
- ^ Варбург О., Кристиан В. (1936). «Пиридин, переносящий водород компонент ферментов ферментации (пиридиновый нуклеотид)». Биохимический журнал (на немецком языке). 287 : 291. дои : 10.1002/hlca.193601901199 .
- ^ Эльвехем Калифорния, Мэдден Р.Дж., Стронг FM, Вулли Д.В. (1938). «Выделение и идентификация фактора античерного языка» . Ж. Биол. Хим . 123 (1): 137–49. дои : 10.1016/S0021-9258(18)74164-1 .
- ^ Аксельрод А.Е., Мэдден Р.Дж., Эльвехем, Калифорния (1939). «Влияние дефицита никотиновой кислоты на содержание кофермента I в тканях животных» . Ж. Биол. Хим . 131 (1): 85–93. дои : 10.1016/S0021-9258(18)73482-0 .
- ^ Корнберг А (1948). «Участие неорганического пирофосфата в обратимом ферментативном синтезе дифосфопиридиннуклеотида» . Ж. Биол. Хим . 176 (3): 1475–76. дои : 10.1016/S0021-9258(18)57167-2 . ПМИД 18098602 .
- ^ Фридкин М., Ленингер А.Л. (1 апреля 1949 г.). «Этерификация неорганического фосфата, связанная с транспортом электронов между дигидродифосфопиридиновым нуклеотидом и кислородом» . Ж. Биол. Хим . 178 (2): 611–23. дои : 10.1016/S0021-9258(18)56879-4 . ПМИД 18116985 .
- ^ Прейсс Дж., Хэндлер П. (1958). «Биосинтез дифосфопиридинового нуклеотида. I. Идентификация промежуточных продуктов» . Ж. Биол. Хим . 233 (2): 488–92. дои : 10.1016/S0021-9258(18)64789-1 . ПМИД 13563526 .
- ^ Прейсс Дж., Хэндлер П. (1958). «Биосинтез дифосфопиридиннуклеотида. II. Ферментативные аспекты» . Ж. Биол. Хим . 233 (2): 493–500. дои : 10.1016/S0021-9258(18)64790-8 . ПМИД 13563527 .
- ^ Бегановский, П; Бреннер, К. (2004). «Открытие никотинамидрибозида в качестве питательного вещества и консервативных генов NRK устанавливает независимый от Прейсса-Хэндлера путь к НАД+ у грибов и людей» . Клетка . 117 (4): 495–502. дои : 10.1016/S0092-8674(04)00416-7 . ПМИД 15137942 . S2CID 4642295 .
- ^ Шамбон П., Вейл Дж.Д., Мандель П. (1963). «Активация никотинамидмононуклеотида новой ДНК-зависимой полиадениловой кислоты, синтезирующей ядерный фермент». Биохим. Биофиз. Рез. Коммун . 11 : 39–43. дои : 10.1016/0006-291X(63)90024-X . ПМИД 14019961 .
- ^ Клэппер Д.Л., Уолсет Т.Ф., Дарджи П.Дж., Ли ХК (15 июля 1987 г.). «Метаболиты пиридиннуклеотидов стимулируют высвобождение кальция из микросом яиц морского ежа, десенсибилизированных к инозитолтрифосфату» . Ж. Биол. Хим . 262 (20): 9561–8. дои : 10.1016/S0021-9258(18)47970-7 . ПМИД 3496336 .
- ^ Имаи С., Армстронг К.М., Каберлейн М., Гуаренте Л. (2000). «Белок молчания транскрипции и долголетия Sir2 представляет собой НАД-зависимую гистондеацетилазу». Природа . 403 (6771): 795–800. Бибкод : 2000Natur.403..795I . дои : 10.1038/35001622 . ПМИД 10693811 . S2CID 2967911 .
- ^ Имаи С. (2009). «Мир НАД: новая системная регуляторная сеть метаболизма и старения - Sirt1, системный биосинтез НАД и их важность» . Клеточная биохимия и биофизика . 53 (2): 65–74. дои : 10.1007/s12013-008-9041-4 . ПМЦ 2734380 . ПМИД 19130305 .
- ^ Имаи С (2016). «Мир НАД 2.0: важность межтканевой коммуникации, опосредованной NAMPT/NAD +/SIRT1, в контроле старения млекопитающих и долголетия» . npj Системная биология и приложения . 2 : 16018. дои : 10.1038/npjsba.2016.18 . ПМК 5516857 . ПМИД 28725474 .
- ^ «Napa Therapeutics создана для разработки лекарств, влияющих на метаболизм НАД» . Борьба со старением! . 17 августа 2018 г. Проверено 29 ноября 2023 г.
Дальнейшее чтение
[ редактировать ]Функция
[ редактировать ]- Нельсон Д.Л.; Кокс ММ (2004). Ленингерские принципы биохимии (4-е изд.). У. Х. Фриман. ISBN 978-0-7167-4339-2 .
- Багг Т. (2004). Введение в химию ферментов и коферментов (2-е изд.). Блэквелл Паблишинг Лимитед. ISBN 978-1-4051-1452-3 .
- Ли ХК (2002). Циклическая АДФ-рибоза и НААДФ: структура, метаболизм и функции . Академическое издательство Клувер. ISBN 978-1-4020-7281-9 .
- Левин О.С., Шучат А., Шварц Б., Венгер Дж.Д., Эллиот Дж. (1997). «Общий протокол популяционного эпиднадзора за Haemophilus influenzae типа B» (PDF) . Всемирная организация здравоохранения. Центры по контролю заболеваний. п. 13. ВОЗ/VRD/GEN/95.05. Архивировано из оригинала (PDF) 1 июля 2004 года.
- Ким, Джинхён; Ли, Сан Ха; Тивес, Флориан; Пол, Кэролайн Э.; Холлманн, Франк; Пак, Чан Бом (5 июля 2019 г.). «Никотинамидадениндинуклеотид как фотокатализатор» . Достижения науки . 5 (7): eaax0501. Бибкод : 2019SciA....5..501K . doi : 10.1126/sciadv.aax0501 . ПМК 6641943 . ПМИД 31334353 .
История
[ редактировать ]- Корниш-Боуден, Атель (1997). Новое пиво в старой бутылке. Эдуард Бюхнер и рост биохимических знаний . Валенсия: Университет Валенсии. ISBN 978-84-370-3328-0 . Архивировано из оригинала 13 декабря 2010 года . Проверено 8 декабря 2007 г. , История ранней энзимологии.
- Уильямс, Генри Смит (1904). Современное развитие химических и биологических наук . История науки: в пяти томах. Том. IV. Нью-Йорк: Харпер и братья. , учебник 19 века.
Внешние ссылки
[ редактировать ]- НАД, связанный с белками, в Банке данных белков
- Анимация NAD (требуется Flash)
- β-никотинамидадениндинуклеотид (НАД + , окисленный) и НАДН (восстановленный). Технический паспорт от Sigma-Aldrich.
- ОНИ + , НАДН и путь синтеза НАД в MetaCyc базе данных
- Список оксидоредуктаз. Архивировано 30 ноября 2010 г. на Wayback Machine в SWISS-PROT. базе данных
- ОНИ +
- ОНИ + Молекула молодости
