Альдозоредуктаза
| Альдозоредуктаза | |||
|---|---|---|---|
 | |||
| Идентификаторы | |||
| Номер ЕС. | 1.1.1.21 | ||
| Номер CAS. | 9028-31-3 | ||
| Базы данных | |||
| ИнтЭнк | вид IntEnz | ||
| БРЕНДА | БРЕНДА запись | ||
| Экспаси | Просмотр NiceZyme | ||
| КЕГГ | КЕГГ запись | ||
| МетаЦик | метаболический путь | ||
| ПРЯМОЙ | профиль | ||
| PDB Структуры | RCSB PDB PDBe PDBsum | ||
| |||
В энзимологии зависимую альдозоредуктаза (или альдегидредуктаза ) ( EC 1.1.1.21 ) представляет собой цитозольную НАДФН- оксидоредуктазу , которая катализирует восстановление множества альдегидов и карбонилов, включая моносахариды. Прежде всего он известен тем, что катализирует восстановление глюкозы до сорбита , первого этапа полиолового пути метаболизма глюкозы. [1]
Реакции
[ редактировать ]Альдозоредуктаза катализирует НАДФН-зависимое превращение глюкозы в сорбит , первый этап полиольного пути метаболизма глюкозы. Второй и последний этап пути катализируется сорбитдегидрогеназой , которая катализирует НАД-связанное окисление сорбита до фруктозы. Таким образом, полиоловый путь приводит к превращению глюкозы во фруктозу со стехиометрическим использованием НАДФН и образованием НАДН. [1]
Галактоза также является субстратом полиольного пути, но соответствующий кетосахар не образуется, поскольку сорбитдегидрогеназа не способна окислять галактит. [2] Тем не менее, альдозоредуктаза может катализировать восстановление галактозы до галактитола.
- галактоза + НАДФН + Н + галактитол + НАДФ +
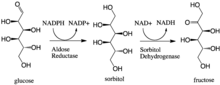
Функция
[ редактировать ]Реакция альдозоредуктазы, в частности вырабатываемый сорбит, важна для функционирования различных органов организма. Например, его обычно используют на первом этапе синтеза фруктозы из глюкозы; второй этап — окисление сорбита во фруктозу, катализируемое сорбитдегидрогеназой . Основной путь от глюкозы до фруктозы ( гликолиз ) включает фосфорилирование глюкозы гексокиназой с образованием глюкозо-6-фосфата с последующей изомеризацией во фруктозо-6-фосфат и гидролизом фосфата, но сорбитоловый путь полезен, поскольку не требует участия энергии в виде АТФ :
- Семенные пузырьки : фруктоза, вырабатываемая из сорбита, используется сперматозоидами .
- Печень : Фруктоза, полученная из сорбита, может использоваться в качестве источника энергии для гликолиза и гликонеогенеза .
Альдозоредуктаза также присутствует в хрусталике , сетчатке , шванновских клетках периферических нервов, плаценте и эритроцитах . [ нужна ссылка ]
У дрозофилы CG6084 кодирует высококонсервативный белок человеческой альдокеторедуктазы 1B. dAKR1B в гемоцитах необходим и достаточен для повышения уровня сахарных спиртов в плазме после кишечной инфекции. Повышенное содержание сорбита впоследствии активирует металлопротеазу 2, которая расщепляет PGRP-LC и активирует системный иммунный ответ в жировых телах. Таким образом, альдозоредуктаза обеспечивает критическую метаболическую контрольную точку в глобальной воспалительной реакции. [3]
Структура фермента
[ редактировать ]Альдозоредуктазу можно считать прототипом фермента суперсемейства ферментов альдокеторедуктазы. Фермент состоит из 315 аминокислотных остатков и складывается в структурный мотив β/α-цилиндра, состоящий из восьми параллельных β-цепей. [4] Соседние нити соединены восемью периферийными α-спиральными сегментами, идущими антипараллельно β-листу. [5] Каталитический активный центр расположен в ядре ствола. [5] [6] Кофактор НАДФН расположен в верхней части β/α-цилиндра, при этом никотинамидное кольцо выступает вниз в центре цилиндра, а пирофосфат находится между краями цилиндра. [1]
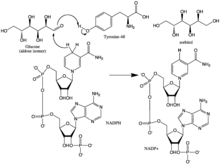



Ферментативный механизм
[ редактировать ]Механизм реакции альдозоредуктазы в направлении восстановления альдегида следует последовательному упорядоченному пути, где связывается НАДФН, а затем субстрат. Связывание НАДФН вызывает конформационное изменение (Фермент•НАДФН → Фермент*•НАДФН), которое включает шарнирное движение поверхностной петли (остатки 213–217) таким образом, чтобы покрыть часть НАДФН способом, аналогичным тому, который происходит у НАДФН. ремень безопасности. Спиртовой продукт образуется путем переноса про-R-гидрида НАДФН на поверхность карбонильного углерода субстрата. После выпуска алкогольного продукта происходит еще одно конформационное изменение (E*•NADP + → E•NADP + ) для высвобождения НАДФ + . [8] Кинетические исследования показали, что переориентация этой петли для обеспечения высвобождения НАДФ + по-видимому, представляет собой ограничивающий скорость шаг в направлении восстановления альдегидов. [9] [10] [11] Поскольку скорость высвобождения кофермента ограничивает каталитическую скорость, можно видеть, что нарушение взаимодействий, которые стабилизируют связывание кофермента, может иметь драматические эффекты на максимальную скорость (Vmax). [11]
Гидрид, который передается от НАДФ + глюкоза поступает из С-4 никотинамидного кольца в основании гидрофобной полости. Таким образом, положение этого углерода определяет активный центр фермента. В ферменте на подходящем расстоянии от C-4 существуют три остатка, которые могут быть потенциальными донорами протонов: Tyr-48, His-110 и Cys-298. Данные эволюционного, термодинамического и молекулярного моделирования предсказали, что Tyr-48 является донором протонов. Это предсказание подтвердилось результатами мутагенеза исследований. [5] [12] [13] Таким образом, считается, что взаимодействие [водородных связей] между фенольной гидроксильной группой Tyr-48 и аммониевой боковой цепью Lys-77 помогает облегчить перенос гидрида. [5]
Роль при диабете
[ редактировать ]Сахарный диабет признан основной причиной новых случаев слепоты и связан с повышенным риском болезненной нейропатии, заболеваний сердца и почечной недостаточности. Было выдвинуто множество теорий, объясняющих механизмы, приводящие к диабетическим осложнениям, включая стимуляцию метаболизма глюкозы полиольным путем. Кроме того, фермент находится в глазах ( роговице , сетчатке , хрусталике ), почках и миелиновой оболочке – тканях, которые часто участвуют в осложнениях диабета. [14] При нормальных гликемических условиях лишь небольшая часть глюкозы метаболизируется по полиольному пути, так как большая часть глюкозы фосфорилируется гексокиназой, а образующийся продукт, глюкозо-6-фосфат, используется в качестве субстрата для гликолиза или метаболизма пентозофосфата. [15] [16] Однако в ответ на хроническую гипергликемию , обнаруженную у диабетиков, поток глюкозы через полиоловый путь значительно увеличивается. До 33% общего использования глюкозы в некоторых тканях может происходить полиоловым путем. [17] Концентрация глюкозы часто повышается у диабетиков , и долгое время считалось, что альдозоредуктаза ответственна за диабетические осложнения, затрагивающие ряд органов. Многие ингибиторы альдозоредуктазы были разработаны в качестве потенциальных лекарств, но практически все они оказались безуспешными, хотя некоторые из них, такие как Эпалрестат, коммерчески доступны в нескольких странах. Дополнительные ингибиторы редуктазы, такие как альрестатин , экзисулинд , имирестат , зопольрестат , толрестат , зенарестат , кафикрестат , фидарестат , говорестат , ранирестат , поналрестат , ризарестат , сорбинил и берберин , полиумозид , ганодеровая кислота. [18] в настоящее время проходят клинические испытания. [19]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Перейти обратно: а б с Петраш Дж. М. (апрель 2004 г.). «Все в семье: альдозоредуктаза и близкородственные альдокеторедуктазы» . Клетка. Мол. Наука о жизни . 61 (7–8): 737–49. дои : 10.1007/s00018-003-3402-3 . ПМЦ 11138595 . ПМИД 15094999 . S2CID 25983505 .
- ^ Едзиняк Дж. А., Йейтс Э. М., Киношита Дж. Х. (июнь 1973 г.). «Хрусталик-полиолдегидрогеназа». Эксп. Глаз Рез. 16 (2): 95–104. дои : 10.1016/0014-4835(73)90304-7 . ПМИД 4352688 .
- ^ Ян С., Чжао Ю, Ю Дж, Фань З, Гун С.Т., Тан Х, Пан Л. (август 2019 г.). «Сахарные спирты полиольного пути служат аларминами, опосредующими локально-системную коммуникацию врожденного иммунитета у дрозофилы» . Клетка-хозяин и микроб . 26 (2): 240–251. дои : 10.1016/j.chom.2019.07.001 . ПМИД 31350199 .
- ^ Барский О.А., Габбай К.Х., Борен К.М. (сентябрь 1999 г.). «Характеристика гена и промотора альдегидредуктазы человека». Геномика . 60 (2): 188–98. дои : 10.1006/geno.1999.5915 . ПМИД 10486210 .
- ^ Перейти обратно: а б с д Уилсон Д.К., Борен К.М., Габбай К.Х., Киочо Ф.А. (июль 1992 г.). «Маловероятный участок сахарного субстрата в структуре 1,65 А голофермента альдозоредуктазы человека, вовлеченный в осложнения диабета». Наука . 257 (5066): 81–4. дои : 10.1126/science.1621098 . ПМИД 1621098 .
- ^ Рондо Ж.М., Тет-Фавье Ф., Поджарный А. и др. (январь 1992 г.). «Новый НАДФН-связывающий домен, обнаруженный в кристаллической структуре альдозоредуктазы». Природа . 355 (6359): 469–72. Бибкод : 1992Natur.355..469R . дои : 10.1038/355469a0 . ПМИД 1734286 . S2CID 4260654 .
- ^ Перейти обратно: а б Рисунок 11-4 в: Род Цветок; Хамфри П. Ранг; Морин М. Дейл; Риттер, Джеймс М. (2007). Фармакология Ранг и Дейл . Эдинбург: Черчилль Ливингстон. ISBN 978-0-443-06911-6 .
- ^ Накано Т., Петраш Дж. М. (август 1996 г.). «Кинетические и спектроскопические доказательства ингибирования активного центра альдозоредуктазы человека». Биохимия . 35 (34): 11196–202. дои : 10.1021/bi9608121 . ПМИД 8780524 .
- ^ Гримшоу С.Э., Шахбаз М., Путни К.Г. (октябрь 1990 г.). «Механистические основы нелинейной кинетики восстановления альдегидов, катализируемого альдозоредуктазой». Биохимия . 29 (42): 9947–55. дои : 10.1021/bi00494a027 . ПМИД 2125486 .
- ^ Кубишески Т.Дж., Гайндман DJ, Морьяна Н.А., Флинн Т.Г. (апрель 1992 г.). «Исследования альдозоредуктазы мышц свиньи. Кинетический механизм и доказательства медленных конформационных изменений при связывании кофермента» . Ж. Биол. хим. 267 (10): 6510–7. дои : 10.1016/S0021-9258(19)50457-4 . ПМИД 1551865 . Проверено 18 мая 2010 г.
- ^ Перейти обратно: а б Гримшоу С.Э., Борен К.М., Лай С.Дж., Габбай К.Х. (ноябрь 1995 г.). «Альдозоредуктаза человека: константы скорости механизма, включая взаимное преобразование тройных комплексов рекомбинантным ферментом дикого типа». Биохимия . 34 (44): 14356–65. дои : 10.1021/bi00044a012 . ПМИД 7578039 .
- ^ Тарле И., Борхани Д.В., Уилсон Д.К., Киочо Ф.А., Петраш Дж.М. (декабрь 1993 г.). «Зондирование активного сайта альдозоредуктазы человека. Сайт-направленный мутагенез Asp-43, Tyr-48, Lys-77 и His-110» . Ж. Биол. хим. 268 (34): 25687–93. дои : 10.1016/S0021-9258(19)74444-5 . ПМИД 8245005 . Проверено 18 мая 2010 г.
- ^ Борен К.М., Гримшоу С.Э., Лай С.Дж. и др. (март 1994 г.). «Тирозин-48 является донором протонов, а гистидин-110 управляет стереохимической селективностью субстрата в реакции восстановления альдозоредуктазы человека: кинетика фермента и кристаллическая структура мутантного фермента Y48H». Биохимия . 33 (8): 2021–32. дои : 10.1021/bi00174a007 . ПМИД 8117659 .
- ^ Шрийверс Б.Ф., Де Вризе А.С., Фливбьерг А. (декабрь 2004 г.). «От гипергликемии к диабетической болезни почек: роль метаболических, гемодинамических, внутриклеточных факторов и факторов роста/цитокинов» . Эндокр. Откр. 25 (6): 971–1010. дои : 10.1210/er.2003-0018 . ПМИД 15583025 . Проверено 18 мая 2010 г.
- ^ Габбай К.Х., Мерола Л.О., Филд Р.А. (январь 1966 г.). «Путь сорбита: присутствие в нервах и канатиках с накоплением субстрата при диабете». Наука . 151 (3707): 209–10. Бибкод : 1966Sci...151..209G . дои : 10.1126/science.151.3707.209 . ПМИД 5907911 . S2CID 31291584 .
- ^ Линдстад Р.И., МакКинли-Макки Дж.С. (сентябрь 1993 г.). «Метилглиоксаль и полиоловый путь. Трехуглеродные соединения являются субстратами сорбитдегидрогеназы печени овцы» . ФЭБС Летт. 330 (1): 31–5. дои : 10.1016/0014-5793(93)80913-F . ПМИД 8370454 . S2CID 39393722 .
- ^ Ченг Х.М., Гонсалес Р.Г. (апрель 1986 г.). «Влияние высокого уровня глюкозы и окислительного стресса на метаболизм хрусталика, альдозоредуктазу и старческий катарактогенез». Метаб. Клин. Эксп. 35 (4 Приложение 1): 10–4. дои : 10.1016/0026-0495(86)90180-0 . ПМИД 3083198 .
- ^ У Л., Ма ЗМ, Фань XL, Чжао Т, Лю ЧЖ, Хуан Х, Ли ММ, Сюн Л, Чжан К, Чжу ЛЛ, Фань М (ноябрь 2009 г.). «Антинекрозная роль гипоксического прекондиционирования после острой аноксии опосредована путем альдозоредуктазы и сорбита в клетках PC12» . Клеточные стрессы и шапероны . 15 (4): 387–94. дои : 10.1007/s12192-009-0153-6 . ПМК 3082650 . ПМИД 19902381 .
- ^ Шеммель К.Э., Падияра Р.С., Д'Суза Дж.Дж. (сентябрь 2009 г.). «Ингибиторы альдозоредуктазы в лечении диабетической периферической нейропатии: обзор». J. Осложнение диабета . 24 (5): 354–60. дои : 10.1016/j.jdiacomp.2009.07.005 . ПМИД 19748287 .
Дальнейшее чтение
[ редактировать ]- Дениз Р., доктор философии. Ферье (2005). Иллюстрированные обзоры Липпинкотта: биохимия (Иллюстрированные обзоры Липпинкотта) . Хагерстаун, Мэриленд: Липпинкотт Уильямс и Уилкинс. п. 319. ИСБН 0-7817-2265-9 .
- Эттвуд, Массачусетс, Даути CC (декабрь 1974 г.). «Очистка и свойства альдозоредуктазы печени теленка». Биохим. Биофиз. Акта . 370 (2): 358–68. дои : 10.1016/0005-2744(74)90097-7 . ПМИД 4216364 .
- Богосян Р.А., МакГиннесс Е.Т. (апрель 1979 г.). «Аффинная очистка и свойства альдозоредуктазы мозга свиньи». Биохим. Биофиз. Акта . 567 (2): 278–86. дои : 10.1016/0005-2744(79)90113-x . ПМИД 36151 .
- ^ Биби, Джейн А.; Фрей, Перри А. (1 октября 1998 г.). «Галактозомутаротаза: очистка, характеристика и исследование двух важных остатков гистидина» . Биохимия . 37 (42): 14989–14997. дои : 10.1021/bi9816047 . ISSN 0006-2960 .
