Глюкозооксидаза
| Глюкозооксидаза | |||
|---|---|---|---|
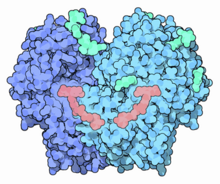 Структура димера глюкозооксидазы (темно-голубой) в комплексе с FAD (лосось) и гликанами (аквамарин) из Penicillium amagasakiense . [1] | |||
| Идентификаторы | |||
| Номер ЕС. | 1.1.3.4 | ||
| Номер CAS. | 9001-37-0 | ||
| Базы данных | |||
| ИнтЭнк | вид IntEnz | ||
| БРЕНДА | БРЕНДА запись | ||
| Экспаси | Просмотр NiceZyme | ||
| КЕГГ | КЕГГ запись | ||
| МетаЦик | метаболический путь | ||
| ПРЯМОЙ | профиль | ||
| PDB Структуры | RCSB PDB PDBe PDBsum | ||
| Генная онтология | АмиГО / QuickGO | ||
| |||
 | |
| Имена | |
|---|---|
| Другие имена Оксидаза, глюкоза | |
| Идентификаторы | |
| ХимическийПаук |
|
| Информационная карта ECHA | 100.029.625 |
| Номер ЕС |
|
| номер Е | E1102 (дополнительные химикаты) |
| КЕГГ | |
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA ) | |
| Характеристики | |
| (С 6 Н 10 О 5 ) н | |
| Молярная масса | переменная |
| Появление | белый или желтый порошок |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Фермент глюкозооксидазы ( GOx или GOD ), также известный как нотатин (номер ЕС 1.1.3.4), представляет собой оксидоредуктазу , которая катализирует окисление глюкозы до перекиси водорода и D-глюконо-δ-лактона . Этот фермент вырабатывается некоторыми видами грибов и насекомых и проявляет антибактериальную активность в присутствии кислорода и глюкозы. [2]

Глюкозооксидаза широко используется для определения свободной глюкозы в жидкостях организма ( медицинские исследования ), в растительном сырье и в пищевой промышленности. Он также имеет множество применений в биотехнологиях , обычно это ферментные анализы в биохимии, включая биосенсоры в нанотехнологиях . [3] [4] Впервые он был выделен Детлевым Мюллером в 1928 году из Aspergillus niger . [5]
Функция
[ редактировать ]Некоторые виды грибов и насекомых синтезируют глюкозооксидазу, которая производит перекись водорода, убивающую бактерии. [2]
Нотатин , выделенный из антибактериальных культур Penicillium notatum , первоначально назывался Пенициллином А , но был переименован во избежание путаницы с пенициллином . [6] Было показано, что нотатин идентичен пенициллину B и глюкозооксидазе, ферментам, извлеченным из других плесеней, помимо P. notatum ; [7] теперь он широко известен как глюкозооксидаза. [8]
Ранние эксперименты показали, что нотатин проявляет антибактериальную активность in vitro (в присутствии глюкозы) за счет образования перекиси водорода. [6] [9] Испытания in vivo показали, что нотатин не эффективен в защите грызунов от Streptococcus haemolyticus , Staphylococcus aureus или сальмонеллы и вызывает серьезные повреждения тканей в некоторых дозах. [9]
Глюкозооксидаза также вырабатывается гипофарингеальными железами рабочих пчел и откладывается в меде, где действует как естественный консервант. GOx на поверхности меда восстанавливает атмосферный O 2 до перекиси водорода (H 2 O 2 ), которая действует как противомикробный барьер. [10]
Структура
[ редактировать ]
GOx представляет собой димерный белок, трехмерная структура которого выяснена. Активный центр связывания глюкозы находится в глубоком кармане. Фермент, как и многие белки, действующие вне клеток, покрыт углеводными цепями. GOx представляет собой фермент, окисляющий глюкозу, с молекулярной массой 160 кДа. Это димерный гликопротеин, состоящий из двух субъединиц массой 80 кДа каждая. Флавинадениндинуклеотид (ФАД) в активном центре скрыт примерно на 1,5 нм внутри белковой оболочки и действует как начальный акцептор электронов. [11]
Механизм
[ редактировать ]При pH 7 глюкоза существует в растворе в циклической полуацетальной форме в виде 63,6% β-D-глюкопиранозы и 36,4% α-D-глюкопиранозы, при этом доля линейной и фуранозной форм незначительна. Глюкозооксидаза специфически связывается с β-D-глюкопиранозой и не действует на α-D-глюкозу. Он окисляет всю глюкозу в растворе, поскольку равновесие между α- и β-аномерами смещается в сторону β-стороны по мере ее расходования в реакции. [3]
Глюкозооксидаза катализирует окисление β-D-глюкозы в D-глюконо-1,5-лактон , который затем гидролизуется до глюконовой кислоты .
Для работы в качестве катализатора GOx необходим кофермент флавинадениндинуклеотид ( FAD ). ФАД является распространенным компонентом биологических окислительно-восстановительных ( окислительно-восстановительных ) реакций. Окислительно-восстановительные реакции включают приобретение или потерю электронов молекулой. В окислительно-восстановительной реакции, катализируемой GOx, FAD действует как начальный акцептор электронов и восстанавливается до FADH. − . [12] Тогда ФАДХ − окисляется конечным акцептором электронов, молекулярным кислородом (O 2 ), который может сделать это, поскольку имеет более высокий потенциал восстановления. Затем O 2 восстанавливается до перекиси водорода (H 2 O 2 ).
Приложения
[ редактировать ]Мониторинг глюкозы
[ редактировать ]Глюкозооксидаза широко используется в сочетании с пероксидазной реакцией, которая колориметрически визуализирует образовавшуюся H 2 O 2 , для определения свободной глюкозы в сыворотке или плазме крови для диагностики, с использованием спектрометрических анализов вручную или с помощью автоматизированных процедур и даже экспресс-методов на месте использования. анализы. [3] [8]
Подобные анализы позволяют контролировать уровень глюкозы в ферментационных, биореакторах, контролировать уровень глюкозы в растительном сырье и пищевых продуктах. [ нужна ссылка ] В анализе глюкозооксидазы глюкоза сначала окисляется, катализируемая глюкозооксидазой, с образованием глюконата и перекиси водорода. Затем перекись водорода окислительно связывается с хромогеном с образованием окрашенного соединения, которое можно измерить спектроскопически. Например, перекись водорода вместе с 4-аминоантипиреном (4-ААР) и фенолом в присутствии пероксидазы дает красный хиноэиминовый краситель, который можно измерить при 505 нм. Поглощение при 505 нм пропорционально концентрации глюкозы в образце.
Ферментативные биосенсоры глюкозы используют электрод вместо O 2 для захвата электронов, необходимых для окисления глюкозы, и создания электронного тока, пропорционального концентрации глюкозы. [13] Эта технология лежит в основе одноразовых сенсорных полосок для измерения уровня глюкозы, используемых диабетиками для контроля уровня глюкозы в сыворотке крови. [14]
Консервация продуктов питания
[ редактировать ]В производстве GOx используется в качестве добавки благодаря своему окислительному эффекту: он способствует получению более прочного теста при выпечке , заменяя окислители, такие как бромат. [15] Он также используется в качестве пищевого консерванта, чтобы помочь удалить кислород и глюкозу из пищевых продуктов при упаковке, таких как сухой яичный порошок, чтобы предотвратить нежелательное потемнение и нежелательный вкус. [16]
Лечение ран
[ редактировать ]В средствах для ухода за ранами, таких как «Фламинал Гидро», в качестве окислителя используется альгинатный гидрогель, содержащий глюкозооксидазу и другие компоненты.
Клинические испытания
[ редактировать ]Назальный спрей из устройства «мешок на клапане» , смешивающий глюкозооксидазу с глюкозой, прошел клинические испытания в 2016 году для профилактики и лечения простуды . [17] [18] [19]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ PDB : 1gpe ; Гудселл Д. (май 2006 г.). «Молекула месяца: глюкозооксидаза» . Банк данных белков RCSB . дои : 10.2210/rcsb_pdb/mom_2006_5 .
- ^ Jump up to: а б Вонг CM, Вонг К.Х., Чен XD (апрель 2008 г.). «Глюкозооксидаза: естественное возникновение, функции, свойства и промышленное применение». Прикладная микробиология и биотехнология . 78 (6): 927–938. дои : 10.1007/s00253-008-1407-4 . ПМИД 18330562 . S2CID 2246466 .
- ^ Jump up to: а б с «Технический паспорт глюкозооксидазы» (PDF) . Интерхим . [ постоянная мертвая ссылка ]
- ^ Гошдастидер У, Сюй Р, Тшасковский Б, Млинарчик К, Мишта П, Вишванатан С, Ренугопалакришнан В, Филипек С (2015). «Молекулярные эффекты инкапсуляции димера глюкозооксидазы графеном». РСК Прогресс . 5 (18): 13570–8. Бибкод : 2015RSCAd...513570G . дои : 10.1039/C4RA16852F .
- ^ «Детлев Мюллер открывает глюкозооксидазу» . Такомед.com . Архивировано из оригинала 18 апреля 2018 года . Проверено 13 июня 2017 г.
{{cite web}}: CS1 maint: неподходящий URL ( ссылка ) - ^ Jump up to: а б Култхард CE, Михаэлис Р., Шорт В.Ф., Сайкс Дж. (1945). «Нотатин: антибактериальная глюкозоаэродегидрогеназа из Penicillium notatum Westling и Penicillium resticulosum sp. nov» . Биохимический журнал . 39 (1): 24–36. дои : 10.1042/bj0390024 . ПМЦ 1258144 . ПМИД 16747849 .
- ^ Кейлин Д., Хартри Э.Ф. (январь 1952 г.). «Специфика глюкозооксидазы (нотатина)» . Биохимический журнал . 50 (3): 331–41. дои : 10.1042/bj0500331 . ПМЦ 1197657 . ПМИД 14915954 .
- ^ Jump up to: а б Раба Дж., Моттола Х.А. (1995). «Глюкозооксидаза как аналитический реагент» (PDF) . Критические обзоры по аналитической химии . 25 (1): 1–42. дои : 10.1080/10408349508050556 . Архивировано из оригинала (PDF) 10 января 2021 г. Проверено 8 января 2009 г.
- ^ Jump up to: а б Брум В.А., Култхард С.Э., Гурд М.Р., Шарп М.Э. (декабрь 1946 г.). «Некоторые фармакологические и химиотерапевтические свойства нотатина» . Британский журнал фармакологии и химиотерапии . 1 (4): 225–233. дои : 10.1111/j.1476-5381.1946.tb00041.x . ПМК 1509745 . ПМИД 19108091 .
- ^ Бучекова М., Валахова И., Кохутова Л., Прохазка Е., Клаудины Дж., Майтан Дж. (август 2014 г.). «Глюкозооксидаза медоносных пчел - ее экспрессия у рабочих пчел и сравнительный анализ ее содержания и H 2 O 2 -опосредованной антибактериальной активности в натуральных медах». Die Naturwissenschaften . 101 (8): 661–670. Бибкод : 2014NW....101..661B . дои : 10.1007/s00114-014-1205-z . ПМИД 24969731 . S2CID 16338921 .
- ^ Мано, Николас (2019). «Инженерия глюкозооксидазы для биоэлектрохимических применений». Биоэлектрохимия . 128 : 218–240.
- ^ Саннер, Кристоф; и др. (март 1991 г.). «15N- и 13C-ЯМР-исследования глюкозооксидазы Aspergillus niger» . Европейский журнал биохимии . 196 (3): 663–672. дои : 10.1111/j.1432-1033.1991.tb15863.x . ПМИД 2013289 .
- ^ Бланфорд (декабрь 2013 г.). «Рождение электрохимии белков». Химические коммуникации . 49 (95). Королевское химическое общество: 11130–11132. дои : 10.1039/C3CC46060F . ПМИД 24153438 .
- ^ Касс А.Е., Дэвис Дж., Фрэнсис Г.Д., Хилл Х.А., Астон В.Дж., Хиггинс И.Дж., Плоткин Е.В., Скотт Л.Д., Тернер А.П. (апрель 1984 г.). «Ферроцен-опосредованный ферментный электрод для амперометрического определения глюкозы». Аналитическая химия . 56 (4). Американское химическое общество: 667–671. дои : 10.1021/ac00268a018 . ПМИД 6721151 .
- ^ Вонг CM, Вонг К.Х., Чен XD (апрель 2008 г.). «Глюкозооксидаза: естественное возникновение, функции, свойства и промышленное применение». Прикладная микробиология и биотехнология . 78 (6): 927–38. дои : 10.1007/s00253-008-1407-4 . ПМИД 18330562 . S2CID 2246466 .
- ^ Дубей М.К., Зехра А., Аамир М., Мина М., Ахивал Л., Сингх С. и др. (2017). «Стратегии улучшения, экономически эффективное производство и потенциальное применение грибковой глюкозооксидазы (GOD): текущие обновления» . Границы микробиологии . 8 : 1032. дои : 10.3389/fmicb.2017.01032 . ПМЦ 5468390 . ПМИД 28659876 .
- ^ Номер клинического исследования NCT01883427 «Назальный спрей с глюкозооксидазой, предотвращающий простуду у детей дошкольного возраста» на сайте ClinicalTrials.gov.
- ^ Номер клинического исследования NCT01883440 «Глюкозооксидаза как средство лечения простуды» на сайте ClinicalTrials.gov.
- ^ Номер клинического исследования NCT01883453 «Назальный спрей с глюкозооксидазой для лечения простуды» на сайте ClinicalTrials.gov.
Внешние ссылки
[ редактировать ]- «Глюкозооксидаза: широко используемый и очень любимый фермент в биосенсорах» в Университете Пейсли.
- Глюкоза + Оксидаза в Национальной медицинской библиотеке США по медицинским предметным рубрикам (MeSH)