Эпоксидредуктаза витамина К
| Эпоксидредуктаза витамина К (чувствительная к варфарину) | |||
|---|---|---|---|
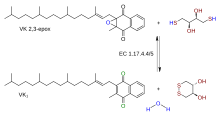 Реакция | |||
| Идентификаторы | |||
| Номер ЕС. | 1.17.4.4 | ||
| Базы данных | |||
| ИнтЭнк | вид IntEnz | ||
| БРЕНДА | БРЕНДА запись | ||
| Экспаси | Просмотр NiceZyme | ||
| КЕГГ | КЕГГ запись | ||
| МетаЦик | метаболический путь | ||
| ПРЯМОЙ | профиль | ||
| PDB Структуры | RCSB PDB PDBe PDBsum | ||
| Генная онтология | АмиГО / QuickGO | ||
| |||
| Эпоксидредуктаза витамина К | |||
|---|---|---|---|
 | |||
| Идентификаторы | |||
| Символ | ВКОР | ||
| Пфам | PF07884 | ||
| ИнтерПро | ИПР012932 | ||
| КАТ | 3кп9 | ||
| TCDB | 9.Б.265 | ||
| Суперсемейство OPM | 18 | ||
| белок OPM | 3кп9 | ||
| |||
Эпоксидредуктаза витамина К ( ВКОР ) представляет собой фермент ( EC 1.17.4.4 ), который восстанавливает витамин К после его окисления при карбоксилировании остатков глутаминовой кислоты в ферментах свертывания крови . ВКОР является членом большого семейства предсказанных ферментов, которые присутствуют у позвоночных, дрозофилы , растений, бактерий и архей . [1] У некоторых растительных и бактериальных гомологов VKOR- слит с доменами тиоредоксинового домен семейства оксидоредуктаз . [1]
Четыре остатка цистеина и один остаток, который представляет собой серин или треонин, идентифицированы как вероятные остатки активного центра . [1] Раскрытие бактериальных структур VKOR позволило лучше понять каталитический механизм. Все VKOR представляют собой трансмембранные белки, имеющие как минимум три ТМ-спирали в каталитическом ядре. Восстанавливаемый хинон связан редокс-активным мотивом CXXC в С-концевых спиралях, подобно активному сайту DsbB . Два других цистеина на N-конце расположены в виде петли за пределами трансмембранной области; они передают электроны с окислительно-восстановительным белком (или, в случае бактериального гомолога, с его собственным слитым доменом). [2] [3]
Человеческий ген VKOR называется VKORC1 (субъединица 1 комплекса VKOR). Это цель антикоагулянта варфарина . Его партнером является окислительно-восстановительный белок неизвестной природы. [4] [5] вероятно, тиоредоксин-подобный белок, расположенный в просвете ЭР, такой как TMX1 . [6]
Существует также похожий ген под названием VKORC1L1 . Образуемый им комплекс VKORL1 гораздо менее эффективен в восстановлении эпоксида, но он обладает способностью восстанавливать хиноновую форму витамина К до диольной формы (KH 2 ). Хотя в EC 1.17.4.4 отмечается, что оба паралога обладают обеими видами деятельности, точное разделение труда in vitro является спорным. [7]
Ссылки
[ редактировать ]- ^ Перейти обратно: а б с Гудштадт Л., Понтинг К.П. (июнь 2004 г.). «Эпоксидредуктаза витамина К: гомология, активный центр и каталитический механизм». Тенденции биохимических наук . 29 (6): 289–92. дои : 10.1016/j.tibs.2004.04.004 . ПМИД 15276181 .
- ^ Ли В., Шульман С., Даттон Р.Дж., Бойд Д., Беквит Дж., Рапопорт Т.А. (январь 2010 г.). «Структура бактериального гомолога эпоксидредуктазы витамина К» . Природа . 463 (7280): 507–12. Бибкод : 2010Natur.463..507L . дои : 10.1038/nature08720 . ПМЦ 2919313 . ПМИД 20110994 .
- ^ Ришави М.А., Усубалиева А, Халлгрен К.В., Беркнер К.Л. (март 2011 г.). «Новое понимание механизма оксидоредуктазы витамина К (VKOR): передача электронов через Cys43 и Cys51 снижает VKOR, обеспечивая снижение уровня витамина K и облегчая витамин K-зависимое карбоксилирование белка» . Журнал биологической химии . 286 (9): 7267–78. дои : 10.1074/jbc.M110.172213 . ПМК 3044983 . ПМИД 20978134 .
- ^ Ли Т., Чанг С.И., Джин Д.И., Лин П.Дж., Хворова А., Стаффорд Д.В. (февраль 2004 г.). «Идентификация гена эпоксидредуктазы витамина К». Природа . 427 (6974): 541–4. Бибкод : 2004Natur.427..541L . дои : 10.1038/nature02254 . ПМИД 14765195 . S2CID 4424554 .
- ^ Рост С., Фрегин А., Ивашкевичус В., Конзельманн Е., Хёртнагель К., Пельц Х.Дж., Лаппегард К., Зейфрид Э., Шаррер И., Тадденхэм Э.Г., Мюллер Ч.Р., Стром Т.М., Ольденбург Дж. (февраль 2004 г.). «Мутации в VKORC1 вызывают резистентность к варфарину и множественный дефицит факторов свертывания крови 2 типа». Природа . 427 (6974): 537–41. Бибкод : 2004Natur.427..537R . дои : 10.1038/nature02214 . ПМИД 14765194 . S2CID 4424197 .
- ^ Шульман, Сол; Ван, Белинда; Ли, Вэйкай; Рапопорт, Том А. (24 августа 2010 г.). «Эпоксидредуктаза витамина К предпочитает тиоредоксин-подобные окислительно-восстановительные партнеры, закрепленные на мембране ЭР» . Труды Национальной академии наук . 107 (34): 15027–15032. Бибкод : 2010PNAS..10715027S . дои : 10.1073/pnas.1009972107 . ПМЦ 2930587 . ПМИД 20696932 .
- ^ Ширер М.Дж., Ньюман П. (март 2014 г.). «Последние тенденции в метаболизме и клеточной биологии витамина К с особым упором на круговорот витамина К и биосинтез МК-4» . Журнал исследований липидов . 55 (3): 345–362. дои : 10.1194/jlr.R045559 . ПМЦ 3934721 . ПМИД 24489112 .