Цитохром P450
| Цитохром P450 | |||
|---|---|---|---|
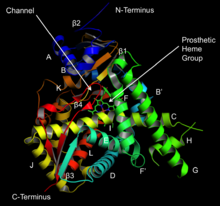 Структура ланостерол-14α-деметилазы ( CYP51 ) | |||
| Идентификаторы | |||
| Символ | стр.450 | ||
| Пфам | PF00067 | ||
| ИнтерПро | IPR001128 | ||
| PROSITE | PDOC00081 | ||
| ОБЛАСТЬ ПРИМЕНЕНИЯ 2 | 2cpp / SCOPe / СУПФАМ | ||
| Суперсемейство OPM | 39 | ||
| белок OPM | 2 спальни | ||
| CDD | cd00302 | ||
| Мембраном | 265 | ||
| |||
Цитохромы P450 ( P450 или CYP ) представляют собой суперсемейство ферментов , содержащих гем в качестве кофактора , которые в основном, но не исключительно, функционируют как монооксигеназы . [ 1 ] Однако они не вездесущи; например, они не обнаружены в Escherichia coli . [ 2 ] У млекопитающих эти ферменты окисляют стероиды , жирные кислоты , ксенобиотики , участвуют во многих биосинтезах. [ 1 ] Путем гидроксилирования ферменты CYP450 превращают ксенобиотики в гидрофильные производные, которые легче выводятся из организма.
P450, как правило, представляют собой концевые ферменты оксидазы в цепях переноса электронов , которые в широком смысле классифицируются как системы, содержащие P450 . Термин «P450» получен из спектрофотометрического пика на длине волны максимума поглощения фермента (450 нм ), когда он находится в восстановленном состоянии и образует комплекс с окисью углерода . Большинству P450 требуется белок-партнер для доставки одного или нескольких электронов для восстановления железа (и, в конечном итоге, молекулярного кислорода ).
Номенклатура
[ редактировать ]Гены, кодирующие ферменты P450, и сами ферменты обозначаются корневым символом CYP , обозначающим суперсемейство , за которым следует число, обозначающее семейство генов , заглавная буква, обозначающая подсемейство, и еще одна цифра, обозначающая отдельный ген. Принято выделять имя курсивом при упоминании гена. Например, CYP2E1 — это ген, который кодирует фермент CYP2E1 — один из ферментов, участвующих в метаболизме парацетамола (ацетаминофена). Номенклатура CYP является официальным соглашением об именах, хотя иногда CYP450 или CYP 450 используются как синонимы. Эти имена никогда не следует использовать в соответствии с номенклатурой (поскольку они обозначают P450 в семействе номер 450). Однако некоторые названия генов или ферментов для P450 также называются историческими названиями (например, P450 BM3 для CYP102A1) или функциональными названиями, обозначающими каталитическую активность и название соединения, используемого в качестве субстрата. включают CYP5A1 , тромбоксан А 2 сокращенно TBXAS1 ( тромбоксан . А синтазу ) , 2 синтаза Примеры 1 ) и CYP51A1 , ланостерол-14-α-деметилаза, иногда неофициально сокращенно называемая LDM в зависимости от ее субстрата ( L -аностерин) и активности ( D e M -этилирование). [ 3 ]
Текущие рекомендации по номенклатуре предполагают, что члены новых семейств CYP имеют как минимум 40% аминокислотной идентичности, тогда как члены подсемейств должны иметь как минимум 55% аминокислотной идентичности. Номенклатурные комитеты присваивают и отслеживают как основные названия генов ( домашняя страница Cytochrome P450 , архивировано 27 июня 2010 г. в Wayback Machine ), так и аллелей названия ( Комитет по номенклатуре аллелей CYP ). [ 4 ] [ 5 ]
Классификация
[ редактировать ]В зависимости от природы белков-переносчиков электронов P450 можно разделить на несколько групп: [ 6 ]
- Микросомальные системы P450
- при котором электроны передаются от НАДФН посредством редуктазы цитохрома P450 (различно CPR, POR или CYPOR). Цитохром b 5 (cyb 5 ) также может способствовать снижению мощности этой системы после восстановления цитохром b 5 редуктазой (CYB 5 R).
- Митохондриальные системы P450
- которые используют адренодоксинредуктазу и адренодоксин для переноса электронов от НАДФН к P450.
- Бактериальные системы P450
- которые используют ферредоксинредуктазу и ферредоксин для переноса электронов на P450.
- CYB 5 R/cyb 5 /P450 Системы
- в котором оба электрона, необходимые для CYP, происходят от цитохрома b 5 .
- Системы FMN/Fd/P450
- первоначально обнаружен у видов Rhodococcus , у которых содержащая FMN -домен, редуктаза, слита с CYP.
- Только системы P450
- которые не требуют внешней восстанавливающей мощности. Известные из них включают тромбоксансинтазу (CYP5), простациклинсинтазу (CYP8) и CYP74A ( алленоксидсинтаза ).
Наиболее распространенной реакцией, катализируемой цитохромами Р450, является монооксигеназная реакция, например, внедрение одного атома кислорода в алифатическое положение органического субстрата (RH), при этом другой атом кислорода восстанавливается до воды:
Родственные ферменты гидроксилирования
[ редактировать ]Во многих реакциях гидроксилирования (вставки гидроксильных групп) используются ферменты CYP, но существует множество других гидроксилаз. Альфа-кетоглутарат-зависимые гидроксилазы также основаны на промежуточном соединении Fe=O, но лишены гемов. Метанмонооксигеназа, которая превращает метан в метанол, представляет собой негемовые ферменты на основе железа и железа-меди. [ 7 ]
Механизм
[ редактировать ]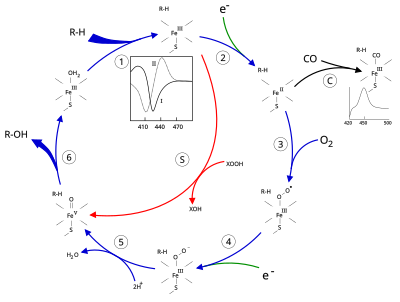
Структура
[ редактировать ]Активный центр цитохрома Р450 содержит гем-железный центр. Железо связано с белком через цистеина тиолатный лиганд . Этот цистеин и несколько фланкирующих остатков высококонсервативны в известных P450 и имеют формальный PROSITE консенсусный паттерн подписи [FW] - [SGNH] - x - [GD] - {F} - [RKHPT] - {P} - C - [ ЛИВМФАП] - [ГАД]. [ 8 ] В целом каталитический цикл P450 протекает следующим образом:
Каталитический цикл
[ редактировать ]- Субстрат связывается вблизи гемовой группы , на стороне, противоположной аксиальному тиолату. Связывание с субстратом вызывает изменение конформации активного центра, часто смещая молекулу воды из дистального аксиального координационного положения железа гема. [ 9 ] и изменение состояния гема железа с низкоспинового на высокоспиновое. [ 10 ]
- Связывание с субстратом индуцирует перенос электронов от НАД(Ф)Н через редуктазу цитохрома Р450 или другую ассоциированную редуктазу . [ 11 ] превращение Fe(III) в Fe(II).
- Молекулярный кислород связывается с образовавшимся центром гема железа в дистальном аксиальном координационном положении, первоначально образуя дикислородный аддукт, аналогичный оксимиоглобину.
- Переносится второй электрон либо от редуктазы цитохрома P450 , либо от ферредоксина , либо от цитохрома b 5 , восстанавливая аддукт Fe-O 2 с образованием короткоживущего пероксо-состояния.
- Пероксогруппа, образовавшаяся на этапе 4, дважды быстро протонируется, высвобождая одну молекулу воды и образуя высокореактивную разновидность, называемую Соединением 1 P450 (или просто Соединением I). Это высокореактивное промежуточное соединение было выделено в 2010 году. [ 12 ] ) железо(IV) P450 Соединение 1 представляет собой оксо- (или феррил с дополнительным окислительным эквивалентом, делокализованным над порфириновым и тиолатным лигандами. Доказательства альтернативы перферрил- железо(V)-оксо. [ 9 ] отсутствует. [ 12 ]
- В зависимости от субстрата и фермента ферменты P450 могут катализировать любую из самых разнообразных реакций. Проиллюстрировано гипотетическое гидроксилирование. После того как гидроксилированный продукт высвобождается из активного центра, фермент возвращается в исходное состояние, при этом молекула воды возвращается и занимает дистальную координационную позицию ядра железа.

- Альтернативный путь монооксигенации — через «перекисный шунт» (путь «S» на рисунке). Этот путь влечет за собой окисление комплекса железо-субстрат донорами атомов кислорода, такими как пероксиды и гипохлориты. [ 13 ] Гипотетический пероксид «XOOH» показан на схеме.
Детали механизма, включая механизм отскока кислорода , были исследованы с использованием синтетических аналогов, состоящих из оксогемовых комплексов железа. [ 14 ]
Спектроскопия
[ редактировать ]Связывание субстрата отражается на спектральных свойствах фермента с увеличением оптической плотности при 390 нм и уменьшением при 420 нм. Его можно измерить с помощью разностной спектроскопии, и он называется разностным спектром «типа I» (см. врезной график на рисунке). Некоторые субстраты вызывают противоположное изменение спектральных свойств, спектр «обратного типа I», посредством процессов, которые пока неясны. Ингибиторы и некоторые субстраты, которые непосредственно связываются с железом гема, вызывают разностный спектр типа II с максимумом при 430 нм и минимумом при 390 нм (см. врезной график на рисунке). Если восстанавливающие эквиваленты недоступны, этот комплекс может оставаться стабильным, что позволяет определить степень связывания на основе измерений поглощения in vitro. [ 13 ] C: Если оксид углерода (CO) связывается с восстановленным P450, каталитический цикл прерывается. Эта реакция дает классический разностный спектр CO с максимумом при 450 нм. Однако прерывающее и ингибирующее действие CO варьируется в зависимости от разных CYP, поэтому семейство CYP3A затрагивается относительно меньше. [ 15 ] [ 16 ]
См. также
[ редактировать ]Дальнейшее чтение
[ редактировать ]- Эстабрук Р.В. (декабрь 2003 г.). «Страсть к P450 (Воспоминания о ранней истории исследований цитохрома P450)». Метаболизм и распределение лекарств . 31 (12): 1461–1473. дои : 10.1124/dmd.31.12.1461 . ПМИД 14625342 . S2CID 43655270 .
Ссылки
[ редактировать ]- ^ Jump up to: а б «Цитохром Р450» . ИнтерПро .
- ^ Дэниелсон П.Б. (декабрь 2002 г.). «Суперсемейство цитохрома P450: биохимия, эволюция и метаболизм лекарств у человека». Современный метаболизм лекарств . 3 (6): 561–597. дои : 10.2174/1389200023337054 . ПМИД 12369887 .
- ^ «Просмотр последовательностей NCBI» . Проверено 19 ноября 2007 г.
- ^ Нельсон Д.Р. (октябрь 2009 г.). «Домашняя страница цитохрома p450» . Геномика человека . 4 (1): 59–65. дои : 10.1186/1479-7364-4-1-59 . ПМК 3500189 . ПМИД 19951895 .
- ^ Нельсон Д.Р. (январь 2011 г.). «Прогресс в отслеживании путей эволюции цитохрома P450». Biochimica et Biophysical Acta (BBA) - Белки и протеомика . 1814 (1): 14–18. дои : 10.1016/j.bbapap.2010.08.008 . ПМИД 20736090 .
- ^ Ханукоглу I (1996). «Белки-переносчики электронов систем цитохрома P450» (PDF) . Адв. Мол. Клеточная Биол . Достижения молекулярной и клеточной биологии. 14 :29–55. дои : 10.1016/S1569-2558(08)60339-2 . ISBN 978-0-7623-0113-3 .
- ^ Туччи FJ, Розенцвейг AC (февраль 2024 г.). «Прямое окисление метана медь- и железозависимыми метанмонооксигеназами» . Химические обзоры . 124 (3): 1288–1320. doi : 10.1021/acs.chemrev.3c00727 . ПМЦ 10923174 . ПМИД 38305159 .
- ^ [1] Архивировано 18 октября 2019 г. в Wayback Machine консенсусном шаблоне PROSITE для P450.
- ^ Jump up to: а б Менье Б., де Виссер С.П., Шайк С. (сентябрь 2004 г.). «Механизм реакций окисления, катализируемых ферментами цитохрома p450». Химические обзоры . 104 (9): 3947–3980. дои : 10.1021/cr020443g . ПМИД 15352783 . S2CID 33927145 .
- ^ Пулос Т.Л., Финзель Б.К., Ховард А.Дж. (июнь 1987 г.). «Кристаллическая структура цитохрома P450cam высокого разрешения». Журнал молекулярной биологии . 195 (3): 687–700. дои : 10.1016/0022-2836(87)90190-2 . ПМИД 3656428 .
- ^ Слайгар С.Г., Синти Д.Л., Гибсон Г.Г., Шенкман Дж.Б. (октябрь 1979 г.). «Контроль спинового состояния окислительно-восстановительного потенциала цитохрома P450 печени». Связь с биохимическими и биофизическими исследованиями . 90 (3): 925–932. дои : 10.1016/0006-291X(79)91916-8 . ПМИД 228675 .
- ^ Jump up to: а б Риттл Дж., Грин MT (ноябрь 2010 г.). «Соединение I цитохрома P450: захват, характеристика и кинетика активации связи CH». Наука . 330 (6006): 933–937. Бибкод : 2010Sci...330..933R . дои : 10.1126/science.1193478 . ПМИД 21071661 . S2CID 206528205 .
- ^ Jump up to: а б Ортис де Монтеллано PR (2005). Цитохром P450: структура, механизм и биохимия (3-е изд.). Нью-Йорк: Издательство Kluwer Academic/Plenum. ISBN 978-0-306-48324-0 .
- ^ Хуан Икс, Гроувс Дж.Т. (март 2018 г.). «Активация кислорода и радикальные превращения в гем-белках и металлопорфиринах» . Химические обзоры . 118 (5): 2491–2553. doi : 10.1021/acs.chemrev.7b00373 . ПМК 5855008 . ПМИД 29286645 .
- ^ Хоппер КП, Замбрана ПН, Гебель У, Уолборн Дж (июнь 2021 г.). «Краткая история угарного газа и его терапевтического происхождения». Оксид азота . 111–112: 45–63. дои : 10.1016/j.niox.2021.04.001 . ПМИД 33838343 . S2CID 233205099 .
- ^ Смит А.Т., Пазикни С., Марвин К.А., Стивенс Д.Д., Полсен К.М., Берстин Дж.Н. (апрель 2015 г.). «Функциональное расхождение геметиолатных белков: классификация, основанная на спектроскопических признаках». Химические обзоры . 115 (7): 2532–2558. дои : 10.1021/cr500056m . ПМИД 25763468 .