Тромбоксан-А синтаза
| ТВХАС1 | |||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | TBXAS1 , BDPLT14, CYP5, CYP5A1, GHOSAL, THAS, TS, TXAS, TXS, тромбоксан А-синтаза 1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | ОМИМ : 274180 ; МГИ : 98497 ; Гомологен : 130979 ; Генные карты : TBXAS1 ; OMA : TBXAS1 — ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
Тромбоксан А-синтаза 1 ( EC 5.3.99.5 , тромбоциты, цитохром P450, семейство 5, подсемейство A) , также известная как TBXAS1 , представляет собой цитохрома P450 фермент , который у человека кодируется TBXAS1 геном . [ 5 ] [ 6 ] [ 7 ]
Функция
[ редактировать ]Этот ген кодирует члена суперсемейства ферментов цитохрома P450. Белки цитохрома P450 представляют собой монооксигеназы, которые катализируют многие реакции, участвующие в метаболизме лекарств и синтезе холестерина, стероидов и других липидов. Однако этот белок считается членом суперсемейства цитохрома P450 на основании сходства последовательностей, а не функционального сходства. Этот мембранный белок эндоплазматической сети катализирует превращение простагландина H 2 в тромбоксан A 2 , мощный вазоконстриктор и индуктор агрегации тромбоцитов , а также в 12-гидроксигептадекатриеновую кислоту (т.е. 12-( S )-гидрокси-5 Z ,8 E ,10 E -гептадекатриеновая кислота или 12-HHT ) агонист рецепторов лейкотриена B4 (т.е. рецепторов BLT2 ) [ 8 ] и медиатор определенных действий рецептора BLT2 . [ 9 ] Фермент играет роль в нескольких патофизиологических процессах, включая гемостаз, сердечно-сосудистые заболевания и инсульт. Ген экспрессирует два варианта транскрипта. [ 5 ]
Ингибиторы тромбоксансинтазы
[ редактировать ]Ингибиторы тромбоксансинтазы используются в качестве антиагрегантных средств . Пикотамид действует как ингибитор тромбоксансинтазы и как антагонист рецепторов тромбоксана . [ 10 ]
Структура
[ редактировать ]Человеческая тромбоксан А (ТХА)синтаза представляет собой массой 60 кДа белок цитохрома P450 , содержащий 533 аминокислоты и гема простетическую группу . Этот фермент, прикрепленный к эндоплазматической сети, обнаружен в тромбоцитах, моноцитах и некоторых других типах клеток. Конец NH2 содержит два гидрофобных сегмента, вторичная структура которых считается спиральной. Имеющиеся данные свидетельствуют о том, что пептиды служат мембранным якорем для фермента. [ 11 ] Более того, исследование клонов кДНК, ставшее возможным с помощью методов полимеразной цепной реакции, дополнительно прояснило первичную структуру ТХА-синтазы. Подобно другим членам семейства цитохрома P450, ТХА-синтаза имеет гемовую группу, координированную с тиолатной группой остатка цистеина, в частности цистеина 480. [ 12 ] Исследования мутагенеза, в которых были сделаны замены в этом положении, привели к потере каталитической активности и минимальному связыванию гема. Другими остатками, давшими аналогичные результаты, были W133, R478, N110 и R413. Эти остатки, расположенные вблизи групп пропионата гема или дистальной поверхности гема, также важны для правильной интеграции гема в апопротеин. [ 13 ] К сожалению, исследователям было трудно получить кристаллическую структуру TXA-синтазы из-за необходимости экстракции детергентом из мембраны, но они использовали моделирование гомологии для создания трехмерной структуры. Одна модель показала два домена: домен, богатый альфа-спиралью, и домен, богатый бета-листами. Было обнаружено, что гем зажат между спиралями I и L. [ 14 ]
Механизм
[ редактировать ]
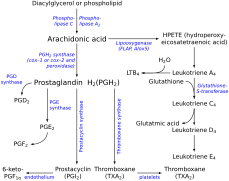
Тромбоксан А (TXA) получен из молекулы простагландина H2 (PGH2). PGH2 содержит относительно слабую эпидиокси-связь, и известен возможный механизм, включающий гомолитическое расщепление эпидиоксида и перегруппировку в ТХА. [ 15 ] Важную роль в этом механизме играет гемовая группа в активном центре ТХА-синтазы. Кинетические исследования с остановленным потоком с использованием аналога субстрата и рекомбинантной ТХА-синтазы показали, что связывание субстрата происходит в два этапа. [ 13 ] Во-первых, происходит быстрое первоначальное связывание с белком, а затем последующее лигирование с железом гема. На первом этапе механизма железо гема координируется с эндопероксидом кислорода C-9. Он участвует в гомолитическом разрыве связи ОО в эндопероксиде, что представляет собой лимитирующую стадию, и претерпевает изменение окислительно-восстановительного состояния с Fe(III) на Fe(IV). [ 16 ] Свободный радикал кислорода образуется при C-11, и этот промежуточный продукт подвергается расщеплению кольца. Теперь, когда свободный радикал находится на уровне C-12, гем железа затем окисляет этот радикал до карбокатиона. [ 17 ] Молекула теперь готова к образованию внутримолекулярного кольца. Отрицательно заряженный кислород атакует карбонил, и электроны одной из двойных связей притягиваются к карбокатиону, замыкая кольцо.
Биологическое значение
[ редактировать ]Поддержание баланса между простациклинами и тромбоксанами важно в организме, особенно потому, что эти два эйкозаноида оказывают противоположные эффекты. Катализируя синтез тромбоксанов, ТХА-синтаза участвует в пути потока, который может модулировать количество вырабатываемого тромбоксана. Этот контроль становится важным фактором в нескольких процессах, таких как регуляция артериального давления, свертывание крови и воспалительные реакции. Считается, что нарушение регуляции ТХА-синтазы и дисбаланс соотношения простациклин-тромбоксан лежат в основе многих патологических состояний, таких как легочная гипертензия . [ 18 ] Поскольку тромбоксаны играют роль в вазоконстрикции и агрегации тромбоцитов, их доминирование может нарушить сосудистый гомеостаз и вызвать тромботические сосудистые события. Кроме того, важность тромбоксанов и их синтеза в сосудистом гомеостазе иллюстрируется данными о том, что у пациентов, тромбоциты которых не реагируют на ТХА, наблюдаются дефекты гемостаза и что дефицит продукции ТХА тромбоцитами приводит к нарушениям свертываемости крови. [ 19 ]
Более того, было обнаружено, что экспрессия ТХА-синтазы может иметь решающее значение для развития и прогрессирования рака. Общее увеличение экспрессии ТХА-синтазы наблюдалось при различных видах рака, таких как папиллярная карцинома щитовидной железы , рак простаты и рак почки . Раковые клетки известны своим безграничным клеточным репликативным потенциалом, и была выдвинута гипотеза, что изменения в профиле эйкозаноидов влияют на рост рака. Исследования привели к предположению, что ТХА-синтаза способствует ряду путей выживания опухолей, включая рост, апоптоза ингибирование , ангиогенез и метастазирование . [ 20 ]
Путь
[ редактировать ]См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а б с GRCh38: Версия Ensembl 89: ENSG00000059377 – Ensembl , май 2017 г.
- ^ Jump up to: а б с GRCm38: выпуск Ensembl 89: ENSMUSG00000029925 – Ensembl , май 2017 г.
- ^ «Ссылка на Human PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Ссылка на Mouse PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ Jump up to: а б «Ген Энтреза: тромбоксан А-синтаза 1 TBXAS1 (тромбоциты, цитохром P450, семейство 5, подсемейство А)» .
- ^ Ёкояма С., Мията А., Ихара Х., Ульрих В., Танабэ Т. (август 1991 г.). «Молекулярное клонирование тромбоксана А-синтазы тромбоцитов человека». Связь с биохимическими и биофизическими исследованиями . 178 (3): 1479–1484. дои : 10.1016/0006-291X(91)91060-P . ПМИД 1714723 .
- ^ Пэк С.Дж., Ли К.Д., Шен Р.Ф. (сентябрь 1996 г.). «Геномная структура и полиморфизм гена, кодирующего тромбоксансинтазу человека». Джин . 173 (2): 251–256. дои : 10.1016/0378-1119(95)00881-0 . ПМИД 8964509 .
- ^ Окуно Т., Иидзука Ю., Оказаки Х., Ёкомизо Т., Тагучи Р., Симидзу Т. (апрель 2008 г.). «12(S)-Гидроксигептадека-5Z,8E,10E-триеновая кислота является природным лигандом лейкотриенового рецептора B4 2» . Журнал экспериментальной медицины . 205 (4): 759–766. дои : 10.1084/jem.20072329 . ПМК 2292216 . ПМИД 18378794 .
- ^ Ёкомизо Т. (февраль 2015 г.). «Два различных рецептора лейкотриена B4, BLT1 и BLT2». Журнал биохимии . 157 (2): 65–71. дои : 10.1093/jb/mvu078 . ПМИД 25480980 .
- ^ Ратти С., Куарато П., Касагранде С., Фумагалли Р., Корсини А. (август 1998 г.). «Пикотамид, антитромбоксановое средство, ингибирует миграцию и пролиферацию артериальных миоцитов». Европейский журнал фармакологии . 355 (1): 77–83. дои : 10.1016/S0014-2999(98)00467-1 . ПМИД 9754941 .
- ^ Руан К.Х., Ли П., Кулмач Р.Дж., Ву К.К. (август 1994 г.). «Характеристика структуры и мембранного взаимодействия NH2-концевого домена тромбоксан А2-синтазы» . Журнал биологической химии . 269 (33): 20938–20942. дои : 10.1016/S0021-9258(17)31912-9 . ПМИД 8063711 .
- ^ Охаши К., Руан К.Х., Кулмач Р.Дж., Ву К.К., Ван Л.Х. (январь 1992 г.). «Первичная структура тромбоксансинтазы человека, определенная по последовательности кДНК» . Журнал биологической химии . 267 (2): 789–793. дои : 10.1016/S0021-9258(18)48353-6 . ПМИД 1730669 .
- ^ Jump up to: а б Ван Л.Х., Кулмач Р.Дж. (август 2002 г.). «Тромбоксансинтаза: структура и функции белка и гена». Простагландины и другие липидные медиаторы . 68–69: 409–422. дои : 10.1016/s0090-6980(02)00045-x . ПМИД 12432933 .
- ^ Сюй П.Ю., Цай А.Л., Ван Л.Х. (ноябрь 2000 г.). «Идентификация аминокислотных остатков тромбоксансинтазы, участвующих в связывании гем-пропионата». Архив биохимии и биофизики . 383 (1): 119–127. дои : 10.1006/abbi.2000.2041 . ПМИД 11097184 .
- ^ Хекер М., Ульрих В. (январь 1989 г.). «О механизме биосинтеза простациклина и тромбоксана А2» . Журнал биологической химии . 264 (1): 141–150. дои : 10.1016/S0021-9258(17)31235-8 . ПМИД 2491846 .
- ^ Танабэ Т., Ульрих В. (октябрь 1995 г.). «Простациклин и тромбоксансинтазы». Журнал липидных медиаторов и клеточной сигнализации . 12 (2–3): 243–255. дои : 10.1016/0929-7855(95)00031-к . ПМИД 8777569 .
- ^ Брюггер Р., Ульрих В. (2003). «Простациклин и тромбоксансинтаза: новые аспекты геметиолатного катализа». Прикладная химия . 33 (19): 1911–1919. дои : 10.1002/anie.199419111 .
- ^ Пратико Д., Догне Ж.М. (сентябрь 2009 г.). «Сосудистая биология эйкозаноидов и атерогенез». Экспертный обзор сердечно-сосудистой терапии . 7 (9): 1079–1089. дои : 10.1586/erc.09.91 . ПМИД 19764861 . S2CID 207215183 .
- ^ Шен РФ, Тай Х.Х. (1998). «Тромбоксаны: синтаза и рецепторы». Журнал биомедицинской науки . 5 (3): 153–172. дои : 10.1007/bf02253465 . ПМИД 9678486 .
- ^ Кэткарт MC, Рейнольдс СП, О'Бирн К.Дж., Pidgeon GP (апрель 2010 г.). «Роль передачи сигналов простациклинсинтазы и тромбоксансинтазы в развитии и прогрессировании рака». Biochimica et Biophysical Acta (BBA) - Обзоры о раке . 1805 (2): 153–166. дои : 10.1016/j.bbcan.2010.01.006 . hdl : 2262/36848 . ПМИД 20122998 .
Дальнейшее чтение
[ редактировать ]- Шен РФ, Тай Х.Х. (1998). «Тромбоксаны: синтаза и рецепторы». Журнал биомедицинской науки . 5 (3): 153–172. дои : 10.1007/BF02253465 . ПМИД 9678486 .
- Смит Дж., Стаббинс М.Дж., Харрис Л.В., Вольф Ч.Р. (декабрь 1998 г.). «Молекулярная генетика суперсемейства монооксигеназ цитохрома P450 человека». Ксенобиотика; Судьба чужеродных соединений в биологических системах . 28 (12): 1129–1165. дои : 10.1080/004982598238868 . ПМИД 9890157 .
- Ван Л.Х., Кулмач Р.Дж. (август 2002 г.). «Тромбоксансинтаза: структура и функции белка и гена». Простагландины и другие липидные медиаторы . 68–69: 409–422. дои : 10.1016/S0090-6980(02)00045-X . ПМИД 12432933 .
- Ито С., Янагимото Т., Тагава С., Хашимото Х., Китамура Р., Накадзима Ю. и др. (март 1992 г.). «Геномная организация гена (генов), специфичного для плода человека P-450IIIA7 (цитохром P-450HFLa), и взаимодействие фактора регуляции транскрипции с его элементом ДНК в 5'-фланкирующей области». Биохимика и биофизика Acta . 1130 (2): 133–138. дои : 10.1016/0167-4781(92)90520-а . ПМИД 1562592 .
- Ёкояма С., Мията А., Ихара Х., Ульрих В., Танабэ Т. (август 1991 г.). «Молекулярное клонирование тромбоксана А-синтазы тромбоцитов человека». Связь с биохимическими и биофизическими исследованиями . 178 (3): 1479–1484. дои : 10.1016/0006-291X(91)91060-P . ПМИД 1714723 .
- Охаши К., Руан К.Х., Кулмач Р.Дж., Ву К.К., Ван Л.Х. (январь 1992 г.). «Первичная структура тромбоксансинтазы человека, определенная по последовательности кДНК» . Журнал биологической химии . 267 (2): 789–793. дои : 10.1016/S0021-9258(18)48353-6 . ПМИД 1730669 .
- Джонс Д.А., Фицпатрик Ф.А., Малкольм К.К. (октябрь 1991 г.). «Синтез тромбоксана А2 в клетках эритролейкемии человека». Связь с биохимическими и биофизическими исследованиями . 180 (1): 8–14. дои : 10.1016/S0006-291X(05)81247-1 . ПМИД 1930241 .
- Ван Л.Х., Охаши К., Ву К.К. (май 1991 г.). «Выделение частичной комплементарной ДНК, кодирующей тромбоксансинтазу человека». Связь с биохимическими и биофизическими исследованиями . 177 (1): 286–291. дои : 10.1016/0006-291X(91)91980-Q . ПМИД 2043115 .
- Нюсинг Р., Шнайдер-Фосс С., Ульрих В. (август 1990 г.). «Иммуноаффинная очистка тромбоксансинтазы человека». Архив биохимии и биофизики . 280 (2): 325–330. дои : 10.1016/0003-9861(90)90337-X . ПМИД 2195994 .
- Местель Ф., Отликер О., Бек Э., Феликс Р., Имбах П., Вагнер Х.П. (январь 1980 г.). «Сильное кровотечение, связанное с дефектом тромбоксансинтетазы». Ланцет . 1 (8160): 157. doi : 10.1016/S0140-6736(80)90642-X . ПМИД 6101498 . S2CID 29803926 .
- Мията А., Ёкояма С., Ихара Х., Бандо С., Такеда О., Такахаши Э., Танабэ Т. (сентябрь 1994 г.). «Характеристика человеческого гена (TBXAS1), кодирующего тромбоксансинтазу» . Европейский журнал биохимии . 224 (2): 273–279. дои : 10.1111/j.1432-1033.1994.00273.x . ПМИД 7925341 .
- Ван Л.Х., Тазава Р., Ланг А.К., Ву К.К. (декабрь 1994 г.). «Альтернативный сплайсинг мРНК тромбоксансинтазы человека». Архив биохимии и биофизики . 315 (2): 273–278. дои : 10.1006/abbi.1994.1500 . ПМИД 7986068 .
- Маруяма К., Сугано С. (январь 1994 г.). «Олиго-кэпирование: простой метод замены кэп-структуры эукариотических мРНК олигорибонуклеотидами». Джин . 138 (1–2): 171–174. дои : 10.1016/0378-1119(94)90802-8 . ПМИД 8125298 .
- Ли К.Д., Пэк С.Дж., Шен Р.Ф. (май 1994 г.). «Клонирование и характеристика промотора гена тромбоксансинтазы человека». Связь с биохимическими и биофизическими исследованиями . 201 (1): 379–387. дои : 10.1006/bbrc.1994.1712 . ПМИД 8198598 .
- Чейз М.Б., Пэк С.Дж., Пертелл Д.С., Шварц С., Шен Р.Ф. (июнь 1993 г.). «Картирование гена тромбоксансинтазы человека (TBXAS1) на хромосоме 7q34-q35 методом двухцветной флуоресцентной гибридизации in situ». Геномика . 16 (3): 771–773. дои : 10.1006/geno.1993.1264 . ПМИД 8325653 .
- Руан К.Х., Ван Л.Х., Ву К.К., Кулмач Р.Дж. (сентябрь 1993 г.). «Амино-концевая топология тромбоксансинтазы в эндоплазматическом ретикулуме» . Журнал биологической химии . 268 (26): 19483–19490. дои : 10.1016/S0021-9258(19)36541-X . ПМИД 8366093 .
- Тазава Р., Грин Э.Д., Охаши К., Ву К.К., Ван Л.Х. (октябрь 1996 г.). «Характеристика полной геномной структуры гена тромбоксансинтазы человека и функциональный анализ его промотора». Архив биохимии и биофизики . 334 (2): 349–356. дои : 10.1006/abbi.1996.0464 . ПМИД 8900410 .
- Пэк С.Дж., Ли К.Д., Шен Р.Ф. (сентябрь 1996 г.). «Геномная структура и полиморфизм гена, кодирующего тромбоксансинтазу человека». Джин . 173 (2): 251–256. дои : 10.1016/0378-1119(95)00881-0 . ПМИД 8964509 .
- Сузуки Ю, Ёситомо-Накагава К, Маруяма К, Суяма А, Сугано С (октябрь 1997 г.). «Создание и характеристика библиотеки кДНК, обогащенной по полной длине и по 5'-концу». Джин . 200 (1–2): 149–156. дои : 10.1016/S0378-1119(97)00411-3 . ПМИД 9373149 .
Внешние ссылки
[ редактировать ]- Тромбоксан-А + синтаза в Национальной медицинской библиотеке США по медицинским предметным рубрикам (MeSH)