Цитохром b5 редуктаза
| цитохром-b5 редуктаза | |||
|---|---|---|---|
 | |||
| Идентификаторы | |||
| Номер ЕС. | 1.6.2.2 | ||
| Номер CAS. | 9032-25-1 | ||
| Базы данных | |||
| ИнтЭнк | вид IntEnz | ||
| БРЕНДА | БРЕНДА запись | ||
| Экспаси | Просмотр NiceZyme | ||
| КЕГГ | КЕГГ запись | ||
| МетаЦик | метаболический путь | ||
| ПРЯМОЙ | профиль | ||
| PDB Структуры | RCSB PDB PDBe PDBsum | ||
| Генная онтология | АмиГО / QuickGO | ||
| |||
Цитохром b5-редуктаза
[ редактировать ]Цитохром - b5 - редуктаза представляет собой НАДН -зависимый фермент , который переводит феррицитохром из формы Fe3+ в форму Fe2+. [ 1 ] Он содержит ФАД и катализирует реакцию:
Благодаря своей b5-восстанавливающей способности этот фермент участвует в десатурации и элонгации жирных кислот, биосинтезе холестерина и метаболизме лекарств. Этот фермент также может восстанавливать метгемоглобин до нормального гемоглобина , получая его неточный синоним метгемоглобинредуктаза . Изоформы, экспрессируемые в эритроцитах (CYB5R1, CYB5R3), выполняют эту функцию in vivo . Феррицианид является еще одним субстратом in vitro . [ нужна ссылка ]
Введение
[ редактировать ]Цитохром b5-редуктаза (c5br) представляет собой НАДН-зависимый фермент, известный как флавопротеин , который приводит к химическому восстановлению до двух различных изоформ : растворимой формы и мембраносвязанной формы. [ 2 ] Этот фермент участвует в переносе восстанавливающих эквивалентов от НАДН за счет акцептора электронов ФАД в цитохроме b5 , расположенном в комплексе III электрон-транспортной цепи, что приводит к образованию двух изоформ за счет альтернативного сплайсинга . Общая реакция восстановления цитохрома b5-редуктазы помогает контролировать содержание железа в эритроцитах , что определяет количество кислорода, переносимого клетками. [ 3 ]
Цитохромы — это окислительно-восстановительные белки, которые необходимы для переноса энергии в цепи переноса электронов с помощью такого фермента, как редуктаза . Цитохромы подразделяются на три класса (a, b и c) в соответствии с типом гема, присутствующего в ядре, и их спектрами светопоглощения.
Специализированный белок-цитохром b5 представляет собой цитохром класса B с гемом b с высоким и низким потенциалом, прикрепленным к центральному железу белка. [ 4 ] Класс цитохрома b особенно уникален, поскольку он прикреплен к белкам внутри внутренней мембраны митохондрий, а не к внешней части, и этот конкретный класс имеет высокую вариабельность последовательностей. Белки цитохрома b , способные экспрессировать около 1080 пар оснований , обычно изучаются для анализа митохондриальной ДНК и определения филогенетических связей в ходе эволюции. [ 5 ]
Таким образом, ферменты цитохромредуктазы являются важным компонентом цепи переноса электронов, которые выполняют функцию белков-цитохромов и активируют их реакции. Цитохром b5-редуктаза успешно катализирует перенос электронов восстанавливающих эквивалентов , чтобы затем активировать цитохром b, чтобы он мог выполнять свою роль в организмах. [ 6 ]
Структура
[ редактировать ]
Фермент цитохром b5-редуктаза содержит типичную структуру оксидоредуктазы с комплексом диафоразного связывающего домена для НАДН и FAD-связывающего домена. Присутствует трехцепочечный линкерный домен, а также опосредованные водой водородные связи для биохимического соединения комплекса. [ 8 ] Когда цитохром b5-редуктаза катализирует перенос электронов, образующаяся восстановленная форма цитохрома b5 восстанавливает окисленный ион трехвалентного железа гемоглобина с Fe 3+ до Fe 2+. [ 1 ]
Механизм: НАДН + Н. + + 2 феррицитохром b5 -> НАД + + 2 ферроцитохром b5
Функция
[ редактировать ]Особенности ферментов цитохрома b5 редуктазы позволяют успешно восстанавливать молекулы цитохрома b5 и использовать их для различных функций в цепи переноса электронов и метаболизма. В метаболизме c5br активен в превращении липидов, включая удлинение и десатурацию жирных кислот и биосинтез холестерина. [ 9 ]
Специализированные изоформы фермента c5br активно функционируют в крови, помогая доставлять кислород к тканям организма путем конформационного изменения метгемоглобина на гемоглобин . Другие изоформы полезны в химических реакциях во всем организме, помогая расщеплению различных веществ. [ 10 ]
Восстановление метгемоглобина до гемоглобина
[ редактировать ]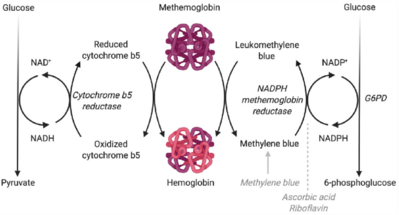
В живых организмах, поскольку метгемоглобин (MetHb) не способен связывать кислород, он должен восстанавливаться до гемоглобина (Hb) под действием растворимой изоформы цитохром b5-редуктазы. В целом, механика этой реакции включает перенос электрона посредством стадий окисления, который может быть осуществлен с помощью нескольких различных механизмов, включающих восстановление пиридиновых нуклеотидов . [ 11 ] Один механизм, который также является наиболее естественным путем, включает перенос электронов, катализируемый цитохром b5-редуктазой, посредством окисления НАДН до НАД+. Донор электронов, НАДН, который поддерживает эту реакцию, является продуктом окисления глюкозы в результате гликолиза . Реакция восстановления превращает окисленный метгемоглобин в восстановленную форму гемоглобина, которая теперь имеет сродство к кислороду. [ 12 ] Другой механизм включает превращение восстановленного пиридиннуклеотида трифосфопиридиннуклеотида (TPNH) в метиленовый синий , что индуцируется переносом электрона при окислении НАДФН до НАДФ+ метгемоглобинредуктазой НАФД. [ 11 ] ТПНГ является наиболее подходящим пиридиновым нуклеотидом для восстановления метгемоглобина; однако можно использовать и другие кофакторы, включая лейкометиленовый синий. [ 13 ] Дополнительные восстановленные нуклеотидные пиридины также могут катализировать окисление гемоглобина в метгемоглобин. Например, в обратной реакции метгемоглобинредуктазы NAPHD метиленовый синий может использоваться для катализа окисления гемоглобина в метгемоглобин. Другие ферменты, в том числе ферменты диафоразы , могут превращать восстановленный дифосфопиридиннуклеотид (ДПНГ) из глицеральдегид-3-фосфата , чтобы пополнить уровень метгемоглобина в клетке. [ 14 ]
Изоформы
[ редактировать ]Мембраносвязанный
[ редактировать ]Мембраносвязанная изоформа цитохром b5-редуктазы обнаруживается во всех типах клеток и не ограничивается эритроцитами. Обычно он обнаруживается встроенным в мембраны различных клеточных компартментов, причем домен встроен в липидный бислой на внешнем листке эндоплазматической сети. [ 10 ] Эта специфическая изоформа состоит примерно из 300 аминокислотных остатков с N-концевым хвостом из 24 остатков, который закрепляет белок на мембране. [ 6 ] Существует последующий растворимый домен, который является частью этой изоформы и прикрепляется к цитозолю. Благодаря своей структуре и расположению мембраносвязанная изоформа c5br необходима для биологических функций внутри организмов. [ 6 ] Обладая мембраносвязывающим доменом и водорастворимым доменом, эта изоформа способна осуществлять химические и окислительно-восстановительные реакции для цепи переноса электронов и участвует в образовании жирных кислот , образовании холестерина и распаде молекул. наркотики. [ 9 ]
Растворимый
[ редактировать ]Растворимая изоформа редуктазы цитохрома b5 присутствует только в эритроцитах. На эритроцитах , эритроцитах, фермент c5br отвечает за переработку и превращение метгемоглобина в гемоглобин. [ 6 ] Метгемоглобин представляет собой окисленную форму гемоглобина, присоединенную к железу в трехвалентном состоянии (Fe3+), которое, следовательно, не может переносить и доставлять кислород к тканям. [ 15 ] Образование метгемоглобина происходит, когда электроны не возвращаются к железу гемоглобина нормального состояния, что нежелательно для функционирующего организма. Метгемоглобин неблагоприятен для функционального организма, поскольку необходимо постоянно переносить кислород; следовательно, растворимая изоформа c5br необходима для поддержания низкого уровня метгемоглобина у людей. [ 16 ]
Гены
[ редактировать ]- CYB5R1 , НАДН-цитохром b5 редуктаза 1, расположена на хромосоме 1q32.1 с 9 экзонами, кодирующими c5br. [ 17 ]
- CYB5R2 , НАДН-цитохром b5 редуктаза 2, расположена на хромосоме 11p15.4 с 12 экзонами, кодирующими c5br. [ 18 ]
- CYB5R3 , НАДН-цитохром b5 редуктаза 3, расположена на хромосоме 22q13.2 с 12 экзонами, кодирующими c5br. [ 19 ]
- CYB5R4 , НАДН-цитохром b5 редуктаза 4, расположена на хромосоме 6q14.2 с 16 экзонами, кодирующими c5br. [ 20 ]
Клиническое значение
[ редактировать ]Мутации
[ редактировать ]Мутации редуктазы цитохрома b5 могут приводить ко многим заболеваниям, включая аутосомно-рецессивную врожденную метгемоглобинемию. Существует более 65 мутаций этого фермента, которые могут привести к различным типам расстройств. [ 10 ] Некоторые включают в себя:
- Метгемоглобинемия I типа (MHb)
- мутация, при которой фермент НАДН-цитохром b5-редуктаза отсутствует только в эритроцитах. Отсутствие этого фермента приводит к невозможности конформационного изменения трехвалентного железа в двухвалентное, что приводит к увеличению метгемоглобина в клетках и снижению гемоглобина. Уменьшение доступного гемоглобина приводит к уменьшению количества кислорода в организме. Из-за нехватки кислорода, который могут переносить эритроциты, симптомы включают синеватый оттенок кожи, губ и ногтей ( цианоз ). Это наиболее распространенный вариант мутации c5br. Вариант метгемоглобинемии I типа представляет собой первую категорию из двух врожденных заболеваний , аутосомно-рецессивных возникающих в результате мутаций гена c5br. Хотя это наиболее распространенная мутация, симптомы менее серьезные, а продолжительность жизни по большей части не изменяется. [ 21 ]
- Тип II МГб
- мутация, при которой фермента редуктазы цитохрома b5 НАДН недостает в различных тканях, помимо эритроцитов. [ 22 ] Эта мутация обычно приводит к полной потере активности редуктазы цитохрома b5 во всем организме, что в конечном итоге приводит к еще большему увеличению уровня метгемоглобина в эритроцитах. При еще более низком уровне гемоглобина в организме кислород не может переноситься должным образом, что приводит к еще более пагубным симптомам, включая неврологические проблемы и нарушение биосинтеза. Нарушение биосинтеза в организме можно увидеть по нарушению образования жирных кислот, что снижает выработку миелина в нервных клетках. Дефектные нервные клетки приводят к потере двигательной функции и двигательным расстройствам, которые тесно связаны с MHb II типа. [ 10 ] Вариация метгемоглобинемии II типа является второй и более тяжелой категорией врожденных нарушений, возникающих в результате мутаций гена c5br. Однако было обнаружено, что мутация специфична и более выражена в определенных популяциях, включая коренные народы Атабаски, Навахо и Якутска по всему миру. [ 21 ]
- Тип III МГб
- мутация, при которой дефицит фермента редуктазы цитохрома b5 НАДН влияет на все клетки крови, включая лейкоциты и тромбоциты, а также эритроциты. Характерными симптомами этой мутации являются только обычный цианоз из-за недостатка кислорода. [ 22 ]
- Тип IV МГб
- мутация, при которой фермент редуктазы цитохрома b5 НАДН отсутствует только в эритроцитах, аналогично дефициту MHb I типа. Механизмы и реакции также аналогичны мутации I типа, однако варианты этой мутации могут впоследствии перерасти в хронический цианоз. [ 22 ]
Лечение
[ редактировать ]Большинство случаев метгемоглобинемии поддаются лечению и не являются хроническими. Наиболее распространенным и успешным методом лечения пациентов с высоким уровнем метгемоглобинемии является антидот метиленовый синий. Метиленовый синий уже признан продуктом обратимой реакции, подпитываемой метгемоглобинредуктазой NAPHD и катализируемой лейкометиленом, для восстановления метгемоглобина до гемоглобина. Поэтому, когда у пациента уровень метгемоглобина высок, можно ввести дополнительный метиленовый синий для восстановления до лейкометилена, чтобы теперь катализировать восстановление избытка метгемоглобина в гемоглобин. [ 23 ] Хотя добавление метиленового синего для лечения случаев метгемоглобинемии было научно проверено и доказано, существуют некоторые побочные эффекты, которые следует учитывать и контролировать при высоких дозах антидота. Незначительные побочные эффекты включают изменение цвета мочи на зеленый или синий цвет; однако значительные побочные эффекты включают ухудшение существующей метгемоглобинемии. Поскольку метиленовый синий сам по себе является окислителем, когда он не восстанавливается эффективно, НАДФН не может должным образом восстанавливаться в клетке для переноса электронов, что приводит к увеличению уровня невосстановленного метгемоглобина, необходимого для поддержания метгемоглобинемии у пациентов. [ 23 ] Дополнительные исследования показали, что применение метиленового синего во время беременности связано с высоким риском атрезии тонкой кишки, которая может быть фатальной для плода. [ 24 ]
Рекомендуется, чтобы лечение метиленовым синим требовало двух доз, прежде чем оно будет признано неэффективным. Если симптомы метгемоглобинемии все еще присутствуют после второй дозы, можно рассмотреть альтернативные методы лечения, включая аскорбиновую кислоту , обменное переливание крови и гипербарическую оксигенотерапию . Однако ни один дополнительный антидот в отношении метиленового синего не был протестирован и подтвержден, и в большинстве случаев дополнительные антидоты обычно неэффективны. Также отмечено, что высокие дозы аскорбиновой кислоты связаны с увеличением экскреции оксалатов с мочой и почечной недостаточностью. [ 23 ] [ 25 ]
Исследовать
[ редактировать ]Цитохром b5-редуктаза является распространенной темой исследований и клинических испытаний, направленных на понимание дополнительных функций фермента в других метаболических путях в организме. Мыши и мухи — распространенные модельные организмы, используемые для проверки связи редуктазы цитохрома b5 с общим состоянием здоровья живых организмов.
В недавнем исследовании 2023 года мышей использовали в качестве модели для проверки расширенного воздействия c5br на снабжение кислородом в присутствии дополнительного окислительного стресса, например, при серповидно-клеточной анемии или ишемическом инсульте . Результаты показали, что c5br не только увеличивает снабжение и транспорт кислорода в организме дикого типа, но также регулирует реакцию эритропоэтина на ишемический инсульт. Эти результаты сделали цитохром b5-редуктазу целью будущих исследований по управлению риском инсульта и обеспечению селективного преимущества для людей с генетическими нарушениями, такими как серповидно-клеточная анемия. [ 26 ]
Другое исследование на мышах и мухах проверило физиологическую роль редуктазы цитохрома b5 на метаболизм липидов, здоровье и старение. Было замечено, что активация гена, экспрессирующего cb5r, в обоих модельных организмах оказала положительное влияние на продолжительность жизни и липидный обмен. На модельных мухах препарат тетрагидроинденоиндол использовался для активации активности редуктазы цитохрома b5, и наблюдения пришли к выводу, что повышенная функция cb5r продлевает продолжительность жизни мух. Повышенная экспрессия редуктазы цитохрома b5 у мышей привела к повышению уровня длинноцепочечных полиненасыщенных жирных кислот, улучшению функции митохондрий и уменьшению окислительного повреждения, что указывает на улучшение метаболических путей с высоким уровнем активности cb5r. Эти результаты показывают, что цитохром b5-редуктаза является новой целью для новых исследований и разработок липидного обмена и здоровья живых организмов. [ 9 ]
Ссылки
[ редактировать ]- ^ Перейти обратно: а б Тамура М., Юбисуи Т., Такешита М., Кавабата С., Мията Т., Иванага С. (май 1987 г.). «Структурное сравнение бычьих эритроцитов, мозга и печени НАДН-цитохром b5-редуктазы методом ВЭЖХ-картирования». Журнал биохимии . 101 (5): 1147–1159. doi : 10.1093/oxfordjournals.jbchem.a121979 . ПМИД 3654589 .
- ^ Элахиан Ф., Сепехризаде З., Могими Б., Мирзаи С.А. (июнь 2014 г.). «Цитохром b5 редуктаза человека: структура, функции и потенциальное применение». Критические обзоры по биотехнологии . 34 (2): 134–143. дои : 10.3109/07388551.2012.732031 . ПМИД 23113554 .
- ^ Сакко Дж.К., Трепанье Л.А. (январь 2010 г.). «Цитохром b5 и НАДН-цитохром b5-редуктаза: корреляция генотип-фенотип для снижения гидроксиламина» . Фармакогенетика и геномика . 20 (1): 26–37. дои : 10.1097/FPC.0b013e3283343296 . ПМК 2905818 . ПМИД 19997042 .
- ^ Уоллес, округ Колумбия, Лотт М.Т., Прокаччо В. (май 2013 г.). «Митохондриальная медицина: митохондриальная биология и генетика метаболических и дегенеративных заболеваний, рака и старения». В Римоин Д., Пьеритц Р., Корф Б. (ред.). Основная медицинская генетика Эмери и Римоана (Шестое изд.). Оксфорд: Академическая пресса. стр. 1–153. дои : 10.1016/b978-0-12-383834-6.00013-6 . ISBN 978-0-12-383834-6 .
- ^ Луйо-Асеро Г.Е., Уезато Х., Осиро М., Такей К., Кария К., Катакура К. и др. (май 2004 г.). «Вариация последовательности гена цитохрома b различных людей, заражающих представителей рода Leishmania, и их филогения». Паразитология . 128 (Часть 5): 483–491. дои : 10.1017/S0031182004004792 . ПМИД 15180316 .
- ^ Перейти обратно: а б с д Гутьеррес-Мерино С, Мартинес-Коста Огайо, Монсальве М, Самхан-Ариас АК (декабрь 2021 г.). «Структурные особенности образования комплекса цитохром b 5 -цитохром b 5 редуктазы и значение для внутримолекулярной динамики цитохром b 5 редуктазы» . Международный журнал молекулярных наук . 23 (1): 118. doi : 10.3390/ijms23010118 . ПМЦ 8745658 . ПМИД 35008543 .
- ^ Джаффи Дж.А., Ридинг Н.С., Гигер У., Абдулмалик О., Бакли Р.М., Джонстон С. и др. (ноябрь 2019 г.). «Клиническая, метаболическая и генетическая характеристика наследственной метгемоглобинемии, вызванной дефицитом цитохром b 5 редуктазы у кошек» . Журнал ветеринарной внутренней медицины . 33 (6): 2725–2731. дои : 10.1111/jvim.15637 . ПМК 6872605 . ПМИД 31650629 .
- ^ Бьюли MC, Мароник CC, Барбер MJ (ноябрь 2001 г.). «Структура и биохимия НАДН-зависимой цитохром b5-редуктазы теперь согласованы». Биохимия . 40 (45): 13574–13582. дои : 10.1021/bi0106336 . ПМИД 11695905 .
- ^ Перейти обратно: а б с Мартин-Монтальво А., Сунь Ю., Диас-Руис А., Али А., Гутьеррес В., Паласиос Х.Х. и др. (12 мая 2016 г.). «Цитохром b 5 редуктаза и контроль липидного обмена и продолжительности жизни» . npj Старение и механизмы болезней . 2 (1): 16006. doi : 10.1038/npjamd.2016.6 . ПМК 5515006 . ПМИД 28721264 .
- ^ Перейти обратно: а б с д «Ген CYB5R3» . МедлайнПлюс Генетика . Архивировано из оригинала 24 марта 2024 г. Проверено 24 марта 2024 г.
- ^ Перейти обратно: а б Харви Дж.В. (2008). «Эритроцит». Клиническая биохимия домашних животных . Эльзевир. стр. 173–240. дои : 10.1016/b978-0-12-370491-7.00007-6 . ISBN 978-0-12-370491-7 .
- ^ «Метгемоглобин» . www.acutecaretesting.org . Архивировано из оригинала 24 сентября 2023 г. Проверено 14 апреля 2024 г.
- ^ Де Крем Н., Верледен ГМ, Годинас Л., Вос Р. (2022). «Однажды в голубую луну: метгемоглобинемия, вызванная примахином – отчет о случае» . Отчеты о случаях респираторной медицины . 38 : 101675. doi : 10.1016/j.rmcr.2022.101675 . ПМК 9149194 . ПМИД 35651520 .
- ^ Пала А, Эркун О, Оздемир О, Шехмусоглу З (2020). «Метгемоглобинемия у двух младенцев, доставленных в педиатрическое отделение неотложной помощи» . Южные клиники Стамбула Евразия . 31 (4): 397–400. дои : 10.14744/scie.2020.16362 . Архивировано из оригинала 25 февраля 2021 г. Проверено 14 апреля 2024 г.
- ^ Отто CN (январь 2020 г.). «Глава 7: Метаболизм гемоглобина». В Кеохане Э.М., Отто К.Н., Валенге Дж.Н. (ред.). Гематология Родака (Шестое изд.). Сент-Луис (Миссури): Elsevier. стр. 91–103. дои : 10.1016/b978-0-323-53045-3.00016-7 . ISBN 978-0-323-53045-3 .
- ^ Бенц Э.Дж., Эберт Б.Л. (2018). «Варианты гемоглобина, связанные с гемолитической анемией, изменением сродства к кислороду и метгемоглобинемиями». Гематология . Эльзевир. стр. 608–615. дои : 10.1016/b978-0-323-35762-3.00043-3 . ISBN 978-0-323-35762-3 .
- ^ «Цитохром b5-редуктаза 1 CYB5R1 - Реестр генетических тестов NIH (GTR) - NCBI» . ncbi.nlm.nih.gov . Архивировано из оригинала 24 марта 2024 г. Проверено 24 марта 2024 г.
- ^ «Цитохром b5 редуктаза 2 CYB5R2 - Реестр генетических тестов NIH (GTR) - NCBI» . ncbi.nlm.nih.gov . Архивировано из оригинала 24 марта 2024 г. Проверено 24 марта 2024 г.
- ^ «Цитохром b5-редуктаза 3 CYB5R3 - Реестр генетических тестов NIH (GTR) - NCBI» . ncbi.nlm.nih.gov . Архивировано из оригинала 24 марта 2024 г. Проверено 24 марта 2024 г.
- ^ «Цитохром b5-редуктаза 4 CYB5R4 - Реестр генетических тестов NIH (GTR) - NCBI» . ncbi.nlm.nih.gov . Архивировано из оригинала 24 марта 2024 г. Проверено 24 марта 2024 г.
- ^ Перейти обратно: а б Паудель С., Адхикари Н., Мандал С., Шриватана П. (апрель 2022 г.). «Случай врожденной метгемоглобинемии: редкий, но реальный» . Куреус . 14 (4): e24152. дои : 10.7759/cureus.24152 . ПМК 9110037 . ПМИД 35592205 .
- ^ Перейти обратно: а б с Суббия С., Зильберштейн П.Т. (2014). «Метгемоглобинемия☆». Справочный модуль по биомедицинским наукам . Эльзевир. дои : 10.1016/b978-0-12-801238-3.05142-4 . ISBN 978-0-12-801238-3 .
- ^ Перейти обратно: а б с Ладлоу Дж. Т., Вилкерсон Р. Г., Nappe TM (2024 г.). «Метгемоглобинемия» . СтатПерлс . Остров сокровищ (Флорида): StatPearls Publishing. ПМИД 30726002 . Архивировано из оригинала 30 января 2023 г. Проверено 14 апреля 2024 г.
- ^ Кидд С.А., Ланкастер П.А., Андерсон Дж.К., Бугерт А., Фишер С.К., Робертсон Р. и др. (январь 1996 г.). «Смерть плода после воздействия красителя метиленового синего во время амниоцентеза в середине триместра при беременности двойней». Пренатальная диагностика . 16 (1): 39–47. doi : 10.1002/(SICI)1097-0223(199601)16:1<39::AID-PD789>3.0.CO;2-P . ПМИД 8821851 .
- ^ Менакуру С.Р., Диллон В.С., Атта М., Манн К., Салих А. (май 2023 г.). «Индуцированная феназопиридином метгемоглобинемия у Свидетеля Иеговы, получавшего высокие дозы аскорбиновой кислоты из-за противоречий с метиленовым синим: описание случая и обзор литературы» . Гематологические отчеты . 15 (2): 325–330. дои : 10.3390/hematolrep15020034 . ПМЦ 10298695 . ПМИД 37367083 .
- ^ Вуд К.С., Юань С., Шмидт Х., Хан С., Гош С., Офори-Акуа С. и др. (февраль 2023 г.). «Резюме 104: Цитохром B5-редуктаза 3 регулирует реакцию эритропоэтина на ишемический инсульт на мышиной модели хронической анемии и окислительного стресса» . Гладить . 54 (Приложение_1). дои : 10.1161/str.54.suppl_1.104 . ISSN 0039-2499 . Архивировано из оригинала 22 апреля 2024 г. Проверено 14 апреля 2024 г.