НАДФН-оксидаза
| НАД(P)H оксидаза | |||
|---|---|---|---|
| Идентификаторы | |||
| Номер ЕС. | 1.6.3.1 | ||
| Номер CAS. | 77106-92-4 | ||
| Базы данных | |||
| ИнтЭнк | вид IntEnz | ||
| БРЕНДА | БРЕНДА запись | ||
| Экспаси | Просмотр NiceZyme | ||
| КЕГГ | КЕГГ запись | ||
| МетаЦик | метаболический путь | ||
| ПРЯМОЙ | профиль | ||
| PDB Структуры | RCSB PDB PDBe PDBsum | ||
| |||
| Редуктаза железа | |||
|---|---|---|---|
| Идентификаторы | |||
| Символ | НАДФН-оксидаза | ||
| Пфам | PF01794 | ||
| ИнтерПро | ИПР013130 | ||
| TCDB | 5.Б.1 | ||
| Суперсемейство OPM | 464 | ||
| белок OPM | 5o05 | ||
| |||
НАДФН- оксидаза (никотинамидадениндинуклеотидфосфатоксидаза) представляет собой мембраносвязанный ферментный комплекс, обращенный во внеклеточное пространство. Его можно обнаружить в плазматической мембране, а также в мембранах фагосом, используемых нейтрофильными лейкоцитами для поглощения микроорганизмов. Человеческие изоформы каталитического компонента комплекса включают NOX1 , NOX2 , NOX3 , NOX4 , NOX5 , DUOX1 и DUOX2 . [1]
Реакция
[ редактировать ]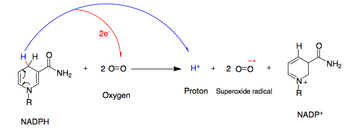
НАДФН-оксидаза катализирует образование супероксидного свободного радикала путем передачи одного электрона кислороду от НАДФН . [2]
- НАДФН + 2O 2 ↔ НАДФ + + 2О − 2 + Н +
Типы
[ редактировать ]У млекопитающих НАДФН-оксидаза обнаружена в двух типах: один в лейкоцитах (нейтрофильных), другой в сосудистых клетках, различающихся по биохимической структуре и функциям. [3] Нейтрофильная НАДФН-оксидаза производит супероксид почти мгновенно, тогда как сосудистый фермент производит супероксид за минуты или часы. [4] Более того, в лейкоцитах было обнаружено, что супероксид переносит электроны через мембрану к внеклеточному кислороду, тогда как в сосудистых клетках анион-радикал высвобождается преимущественно внутриклеточно. [5] [6]
Нейтрофильный тип
[ редактировать ]Изоформа нейтрофилов состоит из шести субъединиц. Эти субъединицы:
- Rho GTPase , обычно Rac1 или Rac2 (Rac означает Rho-связанный субстрат ботулинического токсина C3 )
- Пять субъединиц фагоцитарной оксидазы:
- gp91 лиса ( НОКС2 )
- стр.22 лиса ( СИБА )
- стр.40 лиса ( НКФ4 )
- стр. 47 лиса ( НКФ1 )
- стр.67 лиса ( НКФ2 )
Сосудистый тип
[ редактировать ]Существует несколько сосудистых изоформ комплекса, которые используют паралоги субъединицы NOX2:
Тип щитовидной железы
[ редактировать ]В щитовидной железе есть еще два паралога субъединицы NOX2:
Структура
[ редактировать ]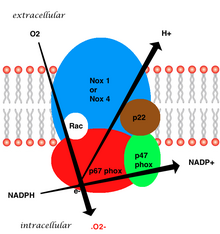
Вся структура мембраносвязанного сосудистого фермента состоит из пяти частей: двух цитозольных субъединиц (p47phox и p67phox), цитохрома b558, состоящего из gp91phox, p22phox и небольшого G-белка Rac. [3] Генерация супероксида в сосудистом НАДФН происходит путем одноэлектронного восстановления кислорода через субъединицу gp91phox с использованием восстановленного НАДФН в качестве донора электронов. Маленький G-белок играет важную роль в активации оксидазы путем переключения между GDP-связанной (неактивной) и GTP-связанной (активной) формами. [8]
Биологическая функция
[ редактировать ]НАДФН-оксидазы (NOX) являются одним из основных источников клеточных активных форм кислорода (АФК) и до сих пор находятся в центре обширного исследовательского интереса из-за их исключительной функции по производству АФК в нормальных физиологических условиях. Комплекс НАДФН-оксидазы в нормальных условиях находится в состоянии покоя, но активируется для сборки в мембранах во время респираторного взрыва . Активированная НАДФН-оксидаза генерирует супероксид, который играет роль в иммунном ответе животных и передаче сигналов растениям. [9]
Супероксид может вырабатываться в фагосомах, поглотивших бактерии и грибы , или вне клетки. [10] В макрофагах супероксид убивает бактерии и грибы посредством механизмов, которые еще не до конца изучены. [11] [12] Супероксид самопроизвольно дисмутирует с образованием пероксида, который затем протонируется с образованием перекиси водорода. Мнения относительно того, как оксидаза убивает микробы в нейтрофилах, разделились. С одной стороны, считается, что перекись водорода действует как субстрат для миелопероксидазы с образованием хлорноватистой кислоты. [13] Он также может инактивировать важные метаболические ферменты, инициировать перекисное окисление липидов , повреждать железо-серные кластеры , [14] и высвобождают окислительно-восстановительно-активное железо, что позволяет генерировать неизбирательные окислители, такие как гидроксильный радикал. [12] Альтернативная точка зрения состоит в том, что оксидаза повышает pH в вакуоли примерно до 9,0, что оптимально для нейтральных протеаз, дегранулирующих из цитоплазматических гранул (где они неактивны при pH ~ 5,5), и перекачивает калий в вакуоль, который растворяет ферменты, и именно активированные протеазы убивают и переваривают микробы. [15]
У насекомых были уточнены некоторые функции NOX. У членистоногих есть три типа NOX (NOX4-art, специфичный для членистоногих p22-phox-независимый NOX4 и два кальций-зависимых фермента, DUOX). [16] [17] [18] В кишечнике DUOX-зависимое производство АФК из стимулированной бактериями слизистой оболочки Drosophila melanogaster является важным механизмом уничтожения патогенов. [19] и может увеличить дефекацию в качестве защитной реакции. [20] У Aedes aegypti DUOX участвует в контроле местной микробиоты кишечника. [21] Rhodnius prolixus содержит активируемый кальцием DUOX, который участвует в затвердевании яичной скорлупы. [22] и NOX5, который участвует в контроле перистальтики кишечника и пищеварения крови. [23] [24]
Регулирование
[ редактировать ]Тщательное регулирование активности НАДФН-оксидазы имеет решающее значение для поддержания здорового уровня АФК в организме. Фермент находится в состоянии покоя в покоящихся клетках, но быстро активируется несколькими стимулами, включая бактериальные продукты и цитокины. [25] Сосудистые НАДФН-оксидазы регулируются различными гормонами и факторами, которые, как известно, играют важную роль в ремоделировании сосудов и заболеваниях. К ним относятся тромбин , фактор роста тромбоцитов (PDGF), фактор некроза опухоли (TNFa), лактозилцерамид , интерлейкин-1 и окисленные ЛПНП . [26] Его также стимулируют агонисты и арахидоновая кислота . [26] И наоборот, сборка комплекса может ингибироваться апоцинином и дифенилен-йодонием . Апоцинин уменьшает вызванное гриппом воспаление легких у мышей in vivo и поэтому может иметь клинические преимущества при лечении гриппа. [27]
Ang-1 заставляет NOX2, NOX4 и митохондрии высвобождать АФК, и эти АФК, полученные из этих источников, играют различную роль в регуляции сигнального пути Ang-1/Tie 2 и проангиогенных реакций. [28]
Патология
[ редактировать ]Супероксиды играют решающую роль в уничтожении чужеродных бактерий в организме человека. Следовательно, недостаточная активность может привести к повышенной восприимчивости к таким организмам, как каталазоположительные микробы, а чрезмерная активность может привести к окислительному стрессу и повреждению клеток.
Чрезмерное производство АФК в сосудистых клетках вызывает многие формы сердечно-сосудистых заболеваний, включая гипертонию , атеросклероз , инфаркт миокарда и ишемический инсульт . [29] Атеросклероз вызван накоплением макрофагов, содержащих холестерин ( пенистые клетки ), в стенках артерий (в интиме ). АФК, продуцируемые НАДФН-оксидазой, активируют фермент, который заставляет макрофаги прикрепляться к стенке артерии (путем полимеризации актиновых волокон). Этот процесс уравновешивается ингибиторами НАДФН-оксидазы и антиоксидантами. Дисбаланс в пользу АФК приводит к атеросклерозу. Исследования in vitro показали, что ингибиторы НАДФН-оксидазы апоцинин и дифенилендиодий вместе с антиоксидантами N-ацетилцистеином и ресвератролом деполимеризуют актин, разрушают спайки и позволяют пенистым клеткам мигрировать из интимы. [30] [31]
Одно исследование предполагает роль НАДФН-оксидазы в вызванной кетамином потере нейронального парвальбумина и экспрессии GAD67 . [32] Аналогичные потери наблюдаются при шизофрении , и результаты могут указывать на НАДФН-оксидазу как на возможного игрока в патофизиологии заболевания. [33] Нитросиний тетразолий используется в диагностических тестах, в частности, при хронической гранулематозной болезни - заболевании, при котором имеется дефект НАДФН-оксидазы; следовательно, фагоцит не может вырабатывать активные формы кислорода или радикалы, необходимые для уничтожения бактерий, в результате чего бактерии процветают внутри фагоцита. Чем выше синий показатель, тем лучше клетка вырабатывает активные формы кислорода.
Также было показано, что НАДФН-оксидаза играет роль в механизме, индуцирующем образование sFlt-1 , белка, который дезактивирует определенные проангиогенные факторы, играющие роль в развитии плаценты, путем облегчения образования активных форм кислорода . которые являются подозреваемыми посредниками в формировании sFlt-1. Эти эффекты частично ответственны за возникновение преэклампсии у беременных женщин. [34]
Мутации
[ редактировать ]Мутации в генах субъединицы НАДФН-оксидазы вызывают несколько хронических гранулематозных заболеваний (ХГБ), характеризующихся крайней восприимчивостью к инфекциям. [26] К ним относятся:
- Х-сцепленная хроническая гранулематозная болезнь (ХГБ)
- Аутосомно-рецессивная цитохром b-отрицательная ХГД
- Аутосомно-рецессивный цитохром b-положительный ХГД I типа
- Аутосомно-рецессивный цитохром b-положительный ХГД II типа .
При этих заболеваниях клетки обладают низкой способностью к фагоцитозу, возникают стойкие бактериальные инфекции. Участки инфицированных клеток общие, гранулемы. Подобное заболевание, называемое синдромом иммунодефицита нейтрофилов, связано с мутацией в RAC2, который также является частью комплекса.
Торможение
[ редактировать ]НАДФН-оксидаза может ингибироваться апоцинином , оксидом азота (NO) и дифенилен-йодонием . Апоцинин действует, предотвращая сборку субъединиц НАДФН-оксидазы. Апоцинин уменьшает вызванное гриппом воспаление легких у мышей in vivo и поэтому может иметь клинические преимущества при лечении гриппа. [27]
Ингибирование НАДФН-оксидазы NO блокирует источник окислительного стресса в сосудистой сети. Поэтому донорские препараты NO ( нитровазодилататоры ) уже более столетия используются для лечения ишемической болезни сердца , гипертонии и сердечной недостаточности , предотвращая разрушение избытком супероксида здоровых сосудистых клеток. [3]
Более продвинутые ингибиторы НАДФН-оксидазы включают GKT-831 (ранее GKT137831 ), двойной ингибитор изоформ NOX4 и NOX1. [35] который был запатентован в 2007 году. [36] Первоначально соединение было разработано для лечения идиопатического легочного фиброза и получило статус орфанного препарата от FDA и EMA . в конце 2010 года [37]
Ссылки
[ редактировать ]- ^ Саху С., Мейлес Д.Н., Пагано П.Дж. (март 2016 г.). «НАДФН-оксидазы: ключевые модуляторы старения и возрастных сердечно-сосудистых заболеваний?» . Клиническая наука . 130 (5): 317–335. дои : 10.1042/CS20150087 . ПМЦ 4818578 . ПМИД 26814203 .
- ^ Пандай А., Саху М.К., Осорио Д., Батра С. (январь 2015 г.). «НАДФН-оксидазы: обзор от структуры до патологий, связанных с врожденным иммунитетом» . Клеточная и молекулярная иммунология . 12 (1): 5–23. дои : 10.1038/cmi.2014.89 . ПМЦ 4654378 . ПМИД 25263488 .
- ^ Jump up to: а б с Дастин Г.Дж., Селемидис С., Цзян Ф. (март 2005 г.). «Механизмы подавления НАДФН-оксидазы в сосудистой стенке» . Мемориалы Института Освальдо Круса . 100 (Приложение 1): 97–103. дои : 10.1590/S0074-02762005000900016 . hdl : 1807/8204 . ПМИД 15962105 .
- ^ Пагано П.Дж., Чанок С.Дж., Сивик Д.А., Колуччи В.С., Кларк Дж.К. (август 1998 г.). «Ангиотензин II индуцирует экспрессию мРНК p67phox и генерацию супероксида НАДФН-оксидазы в адвентициальных фибробластах аорты кролика» . Гипертония . 32 (2): 331–337. дои : 10.1161/01.hyp.32.2.331 . ПМИД 9719063 .
- ^ Гриндлинг К.К., Миньери К.А., Оллереншоу Дж.Д., Александр Р.В. (июнь 1994 г.). «Ангиотензин II стимулирует активность НАДН и НАДФН-оксидазы в культивируемых гладкомышечных клетках сосудов» . Исследование кровообращения . 74 (6): 1141–1148. дои : 10.1161/01.res.74.6.1141 . ПМИД 8187280 .
- ^ Зафари А.М., Ушио-Фукай М., Акерс М., Инь К., Шах А., Харрисон Д.Г. и др. (сентябрь 1998 г.). «Роль H2O2, полученного из НАДН/НАДФН-оксидазы, в сосудистой гипертрофии, индуцированной ангиотензином II» . Гипертония . 32 (3): 488–495. дои : 10.1161/01.hyp.32.3.488 . ПМИД 9740615 .
- ^ Херб М. (февраль 2024 г.). «НАДФН-оксидаза 3: за пределами внутреннего уха» . Антиоксиданты . 13 (2). дои : 10.3390/antiox13020219 . ПМК 10886416 .
- ^ Хейворт П.Г., Кнаус Ю.Г., Сеттлман Дж., Кернатт Дж.Т., Бокох Г.М. (ноябрь 1993 г.). «Регуляция активности НАДФН-оксидазы с помощью белков, активирующих Rac-ГТФазу» . Молекулярная биология клетки . 4 (11): 1217–1223. дои : 10.1091/mbc.4.11.1217 . ПМЦ 275755 . ПМИД 8305740 .
- ^ Шарма, Паллави; Джа, Абудж Бхушан; Дубей, Рама Шанкер; Пессаракли, Мохаммед (24 апреля 2012 г.). «Активные формы кислорода, окислительное повреждение и механизм антиоксидантной защиты у растений в стрессовых условиях» . Журнал ботаники . 2012 : 1–26. дои : 10.1155/2012/217037 . ISSN 2090-0120 .
- ^ Херб М., Глушко А., Вигманн К., Фарид А., Вольф А., Утермёлен О. и др. (февраль 2019 г.). «Митохондриальные активные формы кислорода обеспечивают передачу провоспалительных сигналов через дисульфидную связь NEMO» . Научная сигнализация . 12 (568): eaar5926. doi : 10.1126/scisignal.aar5926 . ПМИД 30755476 .
- ^ Херб М., Шрамм М. (февраль 2021 г.). «Функции АФК в макрофагах и антимикробном иммунитете» . Антиоксиданты . 10 (2): 313. doi : 10.3390/antiox10020313 . ПМЦ 7923022 . PMID 33669824 .
- ^ Jump up to: а б Слауч Дж. М. (май 2011 г.). «Как окислительный взрыв макрофагов убивает бактерии? Вопрос все еще остается открытым» . Молекулярная микробиология . 80 (3): 580–583. дои : 10.1111/j.1365-2958.2011.07612.x . ПМК 3109634 . ПМИД 21375590 .
- ^ Клебанофф С.Дж., Кеттл А.Дж., Розен Х., Уинтерборн CC, Наусиф В.М. (февраль 2013 г.). «Миелопероксидаза: защитник на передовой от фагоцитируемых микроорганизмов» . Журнал биологии лейкоцитов . 93 (2): 185–198. дои : 10.1189/jlb.0712349 . ПМЦ 3545676 . ПМИД 23066164 .
- ^ Джаман О, Оуттен Ф.В., Имлай Дж.А. (октябрь 2004 г.). «Репарация окисленных железо-серных кластеров в Escherichia coli» . Журнал биологической химии . 279 (43): 44590–44599. дои : 10.1074/jbc.M406487200 . ПМИД 15308657 .
- ^ Левин А.П., Сигал А.В. (август 2016 г.). «НАДФН-оксидаза и уничтожение микробов нейтрофилами с особым акцентом на предполагаемую антимикробную роль миелопероксидазы в фагоцитарной вакуоли» . Микробиологический спектр . 4 (4). doi : 10.1128/microbiolspec.MCHD-0018-2015 . ПМИД 27726789 .
- ^ Гандара АС, Торрес А, Баия АС, Оливейра ПЛ, Шама Р (март 2017 г.). «Эволюционное происхождение и функция NOX4-art, НАДФН-оксидазы, специфичной для членистоногих» . Эволюционная биология BMC . 17 (1): 92. Бибкод : 2017BMCEE..17...92G . дои : 10.1186/s12862-017-0940-0 . ПМЦ 5372347 . ПМИД 28356077 .
- ^ Кавахара Т., Куинн М.Т., Ламбет Дж.Д. (июль 2007 г.). «Молекулярная эволюция семейства ферментов НАДФН-оксидазы (Nox/Duox), генерирующих активный кислород» . Эволюционная биология BMC . 7 (1): 109. Бибкод : 2007BMCEE...7..109K . дои : 10.1186/1471-2148-7-109 . ЧВК 1940245 . ПМИД 17612411 .
- ^ Гандара, Ана Кэролайн П.; Оливейра, Педро Л. (2023), Пик, Эдгар (ред.), «НАДФН-оксидазы у членистоногих» , « Возвращение к НАДФН-оксидазы: от функции к структуре » , Cham: Springer International Publishing, стр. 477–488, doi : 10.1007/978 -3-031-23752-2_28 , ISBN 978-3-031-23751-5 , получено 19 октября 2023 г.
- ^ Ха Э.М., О КТ, Бэ Ю.С., Ли У.Дж. (ноябрь 2005 г.). «Прямая роль двойной оксидазы в кишечном иммунитете дрозофилы». Наука . 310 (5749): 847–850. Бибкод : 2005Sci...310..847H . дои : 10.1126/science.1117311 . ПМИД 16272120 . S2CID 12476863 .
- ^ Ду Э.Дж., Ан Ти.Дж., Квон И., Ли Дж.Х., Пак Дж.Х., Пак Ш.Х. и др. (январь 2016 г.). Мигель-Алиага I (ред.). «TrpA1 регулирует дефекацию пищевых патогенов под контролем дуоксного пути» . ПЛОС Генетика . 12 (1): e1005773. дои : 10.1371/journal.pgen.1005773 . ПМЦ 4699737 . ПМИД 26726767 .
- ^ Оливейра Дж.Х., Гонсалвеш Р.Л., Лара Ф.А., Диас Ф.А., Гандара А.С., Менна-Баррето Р.Ф. и др. (март 2011 г.). Шнайдер Д.С. (ред.). «Гем, полученный из кровяной муки, снижает уровень АФК в средней кишке Aedes aegypti и способствует пролиферации кишечной микробиоты» . ПЛОС Патогены . 7 (3): e1001320. дои : 10.1371/journal.ppat.1001320 . ПМК 3060171 . ПМИД 21445237 .
- ^ Диаш Ф.А., Гандара А.С., Кейруш-Баррос Ф.Г., Оливейра Р.Л., Соржин М.Х., Браз Г.Р., Оливейра П.Л. (декабрь 2013 г.). «Активность двойной оксидазы яичников (Duox) необходима для затвердевания и водонепроницаемости яичной скорлупы насекомых» . Журнал биологической химии . 288 (49): 35058–35067. дои : 10.1074/jbc.M113.522201 . ПМЦ 3853258 . ПМИД 24174530 .
- ^ Монтесано А.С., Де Лукка Камарго Л., Перссон П., Риос Ф.Дж., Харви А.П., Анагностопулу А. и др. (июнь 2018 г.). «НАДФН-оксидаза 5 является про-сократительной изоформой Nox и точкой перекрестного взаимодействия для передачи сигналов кальция и окислительно-восстановительного потенциала - последствия для функции сосудов» . Журнал Американской кардиологической ассоциации . 7 (12). дои : 10.1161/JAHA.118.009388 . ПМК 6220544 . ПМИД 29907654 .
- ^ Гандара АК, Диас ФА, де Лемос ПК, Стиблер Р, Бомбаса АК, Менна-Баррето Р, Оливейра ПЛ (25 февраля 2021 г.). « Ураты и NOX5 контролируют пищеварение крови у гематофагов Rhodnius prolixus » . Границы в физиологии . 12 : 633093. doi : 10.3389/fphys.2021.633093 . ПМЦ 7947236 . ПМИД 33716782 .
- ^ Гейст М. (июль 2006 г.). «НАДФН-оксидазы: новые дети на блоке» . Сердечно-сосудистые исследования . 71 (2): 289–299. doi : 10.1016/j.cardiores.2006.05.004 . ПМИД 16765921 .
- ^ Jump up to: а б с Гриндлинг К.К., Сореску Д., Ушио-Фукай М. (март 2000 г.). «NAD(P)H-оксидаза: роль в сердечно-сосудистой биологии и заболеваниях» . Исследование кровообращения . 86 (5): 494–501. дои : 10.1161/01.res.86.5.494 . ПМИД 10720409 .
- ^ Jump up to: а б Влахос Р., Стамбас Дж., Бозиновски С., Бротон Б.Р., Драммонд Г.Р., Селемидис С. (февраль 2011 г.). «Ингибирование активности оксидазы Nox2 облегчает воспаление легких, вызванное вирусом гриппа А» . ПЛОС Патогены . 7 (2): e1001271. дои : 10.1371/journal.ppat.1001271 . ПМК 3033375 . ПМИД 21304882 .
- ^ Харель С., Маяки Д., Санчес В., Хуссейн С.Н. (май 2017 г.). «NOX2, NOX4 и митохондриальные активные формы кислорода способствуют передаче сигналов ангиопоэтина-1 и ангиогенным реакциям в эндотелиальных клетках». Сосудистая фармакология . 92 : 22–32. дои : 10.1016/j.vph.2017.03.002 . ПМИД 28351775 .
- ^ Ваттанапитаякул С.К., Бауэр Дж.А. (февраль 2001 г.). «Окислительные пути при сердечно-сосудистых заболеваниях: роль, механизмы и терапевтические последствия». Фармакология и терапия . 89 (2): 187–206. дои : 10.1016/S0163-7258(00)00114-5 . ПМИД 11316520 .
- ^ Пак Ю.М., Феббрайо М., Сильверстайн Р.Л. (январь 2009 г.). «CD36 модулирует миграцию макрофагов мыши и человека в ответ на окисленные ЛПНП и может способствовать захвату макрофагов в интиме артерий» . Журнал клинических исследований . 119 (1): 136–145. дои : 10.1172/JCI35535 . ПМЦ 2613464 . ПМИД 19065049 .
- ^ Кертисс Л.К. (март 2009 г.). «Обратить атеросклероз?». Медицинский журнал Новой Англии . 360 (11): 1144–1146. doi : 10.1056/NEJMcibr0810383 . ПМИД 19279347 .
- ^ Беренс М.М., Али С.С., Дао Д.Н., Лусеро Дж., Шехтман Г., Квик К.Л., Дуган Л.Л. (декабрь 2007 г.). «Вызванная кетамином потеря фенотипа быстрых интернейронов опосредована НАДФН-оксидазой». Наука . 318 (5856): 1645–1647. Бибкод : 2007Sci...318.1645B . дои : 10.1126/science.1148045 . ПМИД 18063801 . S2CID 41932041 .
- ^ Том Фэган. Связывает ли окислительный стресс гипотезы шизофрении NMDA и GABA? Архивировано 30 декабря 2007 г. на форуме по исследованию шизофрении Wayback Machine . 09 декабря 2007 г.
- ^ Хуан К.Т., Чжан М., Чжун М., Ю Ю.Х., Лян В.З., Ханг Л.Л. и др. (декабрь 2013 г.). «Конечные продукты гликирования в качестве вышестоящей молекулы запускают АФК-индуцированное производство sFlt-1 во вневорсинчатых трофобластах: новый мост между окислительным стрессом и преэклампсией». Плацента . 34 (12): 1177–1182. дои : 10.1016/j.placenta.2013.09.017 . ПМИД 24144948 .
- ^ Аояма Т., Пайк Ю.Х., Ватанабэ С., Лалеу Б., Гаггини Ф., Фиорасо-Картье Л. и др. (декабрь 2012 г.). «Никотинамидадениндинуклеотидфосфатоксидаза при экспериментальном фиброзе печени: GKT137831 как новый потенциальный терапевтический агент» . Гепатология . 56 (6): 2316–2327. дои : 10.1002/hep.25938 . ПМЦ 3493679 . ПМИД 22806357 .
- ^ «Эспейснет – Библиографические данные» . world.espacenet.com . Проверено 4 мая 2017 г.
- ^ «FDA предоставило Genkyotex статус орфанного препарата GKT137831 для IPF — Genkyotex SA» pauahosting.co.nz . Проверено 4 мая 2017 г. [ постоянная мертвая ссылка ]
Внешние ссылки
[ редактировать ]- НАДФН + Оксидаза в Национальной медицинской библиотеке США по медицинским предметным рубрикам (MeSH)
- ЭК 1.6.3.1