Пенопластовая ячейка
| Пенопластовая ячейка | |
|---|---|
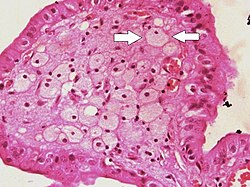 Пенистые клетки (одна из них обозначена стрелками), видимые в пальцеобразных выступах в просвет желчного пузыря при холестеринозе. | |
| Подробности | |
| Предшественник | моноцитарного происхождения макрофаги |
| Идентификаторы | |
| МеШ | D005487 |
| ФМА | 83586 |
| Анатомические термины микроанатомии | |
Пенистые клетки , также называемые нагруженными липидами макрофагами , представляют собой тип клеток, содержащих холестерин . Они могут образовывать бляшки , которые могут привести к атеросклерозу и спровоцировать инфаркт миокарда и инсульт . [1] [2] [3]
Пенистые клетки представляют собой насыщенные жиром клетки с макрофагоподобным фенотипом М2 . Они содержат липопротеины низкой плотности (ЛПНП) и их можно быстро обнаружить, исследуя жировую бляшку под микроскопом после ее удаления из организма. [4] Они названы так потому, что липопротеины придают клетке пенистый вид. [5]
Несмотря на связь с сердечно-сосудистыми заболеваниями, они могут не быть опасными по своей сути. [6]
Некоторые пенистые клетки происходят из гладкомышечных клеток и имеют ограниченный макрофагоподобный фенотип. [7] [8] [9]
Формирование
[ редактировать ]Образование пенистых клеток запускается рядом факторов, включая неконтролируемое поглощение модифицированных липопротеинов низкой плотности (ЛПНП), усиление этерификации холестерина и нарушение механизмов, связанных с высвобождением холестерина. [2] Пенистые клетки являются важным компонентом атеросклеротических поражений, которые образуются, когда циркулирующие моноцитарные клетки рекрутируются в участок атеросклеротического поражения или жировые отложения на стенках кровеносных сосудов. [10] Рекрутированию способствуют молекулы P-селектин и E-селектин , молекула межклеточной адгезии 1 ( ICAM-1 ) и молекула адгезии 1 сосудистых клеток ( VCAM-1 ). [11]
В ответ на воспалительные сигналы рекрутирования моноциты способны проникать через артериальную стенку посредством трансэндотелиальной миграции, как они могут даже в здоровых артериях. Попадая в субэндотелиальное пространство , воспалительные процессы вызывают дифференцировку моноцитов в зрелые макрофаги . [11] Макрофаги затем способны интернализировать модифицированные липопротеины, такие как βVLDL (бета-липопротеин очень низкой плотности), AcLDL (ацетилированный липопротеин низкой плотности) и OxLDL (окисленный липопротеин низкой плотности), посредством их связывания с рецепторами-поглотителями (SR), такими как CD36 и SR-A. на поверхности макрофагов. [2] Эти рецепторы-мусорщики действуют как « рецепторы распознавания образов » (PRR) на макрофагах и отвечают за распознавание и связывание oxLDL, что, в свою очередь, способствует образованию пенистых клеток посредством интернализации этих липопротеинов. [12]
покрытых ямок Эндоцитоз , фагоцитоз и пиноцитоз также ответственны за интернализацию липопротеинов. [13] После интернализации очищенные липопротеины транспортируются в эндосомы или лизосомы для деградации, при этом эфиры холестерина (CE) гидролизуются до неэтерифицированного свободного холестерина (FC) под действием лизосомальной кислой липазы (LPL). Свободный холестерин транспортируется в эндоплазматический ретикулум , где он повторно этерифицируется с помощью ACAT1 (ацил-КоА:холестерол-ацилтрансфераза 1) и впоследствии сохраняется в виде капель цитоплазматической жидкости. Эти капли ответственны за пенистый вид макрофагов и, следовательно, за название пенистых клеток. [2] На этом этапе пенистые клетки могут либо разрушаться за счет деэтерификации и секреции холестерина, либо могут способствовать дальнейшему развитию пенистых клеток и образованию бляшек – процесс, который зависит от баланса свободного холестерина и эстерифицированного холестерина. [2]
Состав
[ редактировать ]Холестерин липопротеинов низкой плотности (ЛПНП) (ХС-ЛПНП — также известный как «плохой» холестерин) и особенно модифицированные формы холестерина ЛПНП, такие как окисленный, гликированный или ацетилированный ЛПНП, содержатся в пенистой клетке — маркере атеросклероза. [3] Поглощение только ЛПНП не вызывает образования пенистых клеток; однако совместная интернализация ХС-ЛПНП с модифицированными ЛПНП в макрофагах может привести к развитию пенистых клеток. Модифицированные ЛПНП влияют на внутриклеточный транспорт и метаболизм нативных ЛПНП, поэтому не все ЛПНП необходимо модифицировать для образования пенистых клеток при высоких уровнях ЛПНП. [13]
Поддержание пенистых клеток и последующее прогрессирование образования бляшек обусловлено секрецией хемокинов и цитокинов макрофагами и пенистыми клетками. Пенистые клетки секретируют провоспалительные цитокины, такие как интерлейкины: IL-1, IL-6; фактор некроза опухоли (TNF); хемокины: хемокин-лиганд 2, CCL5, CXC-хемокин-лиганд 1 (CXCL1); а также факторы удержания макрофагов. [12] Макрофаги в области атеросклеротического легиона имеют пониженную способность к миграции, что дополнительно способствует образованию бляшек, поскольку они способны секретировать цитокины, хемокины, активные формы кислорода (АФК) и факторы роста, которые стимулируют модифицированное поглощение липопротеинов и гладкомышечные клетки сосудов (ГМК). распространение. [11] [6] [14] СГМК также может накапливать эфиры холестерина. [6]
При хронической гиперлипидемии кислорода , липопротеины агрегируют в интиме кровеносных сосудов и окисляются под действием свободных радикалов генерируемых либо макрофагами , либо эндотелиальными клетками. Макрофаги поглощают окисленные липопротеины низкой плотности (ЛПНП) путем эндоцитоза через рецепторы-мусорщики, которые отличаются от рецепторов ЛПНП. Окисленные ЛПНП накапливаются в макрофагах и других фагоцитах , которые затем называются пенистыми клетками. [15] Пенистые клетки образуют жировые прожилки бляшек атером в интиме оболочек артерий.
Пенистые клетки сами по себе не опасны, но могут стать проблемой, когда они накапливаются в определенных очагах, образуя некротический очаг атеросклероза . Если фиброзная оболочка, препятствующая выходу некротического центра в просвет сосуда, разрывается, может образоваться тромб , который может привести к эмболии, закупоривающей более мелкие сосуды. Окклюзия мелких сосудов приводит к ишемии и способствует развитию инсульта и инфаркта миокарда , двух основных причин смертности, связанной с сердечно-сосудистыми заболеваниями. [6] Однако на ранних стадиях патогенеза пенистые клетки также приобретают профиброзный фенотип, при котором они повышают стабильность образующейся бляшки за счет активации пути рецептора X печени (LXR) и увеличения экспрессия генов, связанных с внеклеточным матриксом (ECM). [16]
Пенистые клетки очень малы по размеру, и их можно достоверно обнаружить только при исследовании жировой бляшки под микроскопом после ее удаления из тела или, точнее, из сердца. Обнаружение обычно включает окрашивание участков аорты синуса или артерии маслом Red O (ORO) с последующей компьютерной визуализацией и анализом; или от окрашивания Нильским красным. Кроме того, флуоресцентная микроскопия или проточная цитометрия могут использоваться для обнаружения поглощения OxLDL, когда OxLDL метят 1,1'-диоктадецил-3,3,3'3'-тетраметилиндоцианид перхолоратом (DiI-OxLDL). [4]
Аутоиммунитет возникает, когда организм начинает атаковать сам себя. Связующим звеном между атеросклерозом и аутоиммунитетом являются плазмоцитоидные дендритные клетки (пДК). ПДК способствуют ранним стадиям формирования атеросклеротических поражений сосудов, высвобождая большое количество интерферонов 1 типа (ИНФ). Стимуляция пДК приводит к увеличению количества макрофагов, присутствующих в бляшках. Однако было показано, что на более поздних стадиях прогрессирования поражения пДК оказывают защитное действие путем активации Т-клеток и Treg функции ; что приводит к подавлению заболевания. [17]
Деградация
[ редактировать ]Деградация пенистых клеток или, точнее, распад этерифицированных холестеринов, облегчается рядом рецепторов и путей оттока. Этерифицированный холестерин из капель цитоплазматической жидкости снова гидролизуется до свободного холестерина кислой холестеринэстеразой. Свободный холестерин затем может секретироваться из макрофагов путем оттока к дискам ApoA1 и ApoE через рецептор ABCA1 . Этот путь обычно используется модифицированными или патологическими липопротеинами, такими как AcLDL, OxLDL и βVLDL. FC также могут транспортироваться в отделение рециркуляции посредством оттока к ApoA1, содержащему ЛПВП (липопротеины высокой плотности), посредством водной диффузии или транспорта через рецепторы SR-B1 или ABCG1 . Хотя этот путь также может использоваться модифицированными липопротеинами, холестерин, полученный из ЛПНП, может использовать этот путь только для выведения ФК. Различия в путях выведения между типами липопротеинов в основном являются результатом разделения холестерина по разным областям. [2] [6] [18]
Инфекционные заболевания
[ редактировать ]Пенистые макрофаги обнаруживаются также при заболеваниях, вызванных персистирующими в организме возбудителями, такими как хламидии , токсоплазмы или микобактерии туберкулеза . При туберкулезе (ТБ) бактериальные липиды не позволяют макрофагам откачивать избыток ЛПНП, заставляя их превращаться в пенистые клетки вокруг туберкулезных гранулем в легких. Холестерин является богатым источником пищи для бактерий. По мере гибели макрофагов масса холестерина в центре гранулемы превращается в творожистое вещество, называемое казеумом. [19]
Другие условия
[ редактировать ]Вокруг вытекшего силикона из грудных имплантатов могут образовываться пенистые клетки. [20] Нагруженные липидами альвеолярные макрофаги , также известные как легочные пенистые клетки, обнаруживаются в образцах бронхоальвеолярного лаважа при некоторых респираторных заболеваниях. [21]
Ссылки
[ редактировать ]- ^ Хотамислигил Г.С. (апрель 2010 г.). «Стресс эндоплазматической сети и атеросклероз» . Природная медицина . 16 (4): 396–399. дои : 10.1038/nm0410-396 . ПМК 2897068 . ПМИД 20376052 .
- ^ Jump up to: а б с д и ж Ю XH, Фу YC, Чжан Д.В., Инь К., Тан С.К. (сентябрь 2013 г.). «Пенистые клетки при атеросклерозе» . Клиника Химика Акта; Международный журнал клинической химии . 424 : 245–252. дои : 10.1016/j.cca.2013.06.006 . ПМИД 23782937 .
- ^ Jump up to: а б О Дж., Риек А.Е., Венг С., Петти М., Ким Д., Колонна М. и др. (апрель 2012 г.). «Стресс эндоплазматической сети контролирует дифференцировку макрофагов М2 и образование пенистых клеток» . Журнал биологической химии . 287 (15): 11629–11641. дои : 10.1074/jbc.M111.338673 . ПМК 3320912 . ПМИД 22356914 .
- ^ Jump up to: а б Сюй С., Хуан Ю, Се Ю, Лан Т, Ле К, Чен Дж и др. (октябрь 2010 г.). «Оценка образования пенистых клеток в культивируемых макрофагах: улучшенный метод с окрашиванием Oil Red O и поглощением DiI-oxLDL» . Цитотехнология . 62 (5): 473–481. дои : 10.1007/s10616-010-9290-0 . ПМЦ 2993859 . ПМИД 21076992 .
- ^ «Пененные ячейки - Последние исследования и новости | Природа» .
- ^ Jump up to: а б с д и Линтон М.Ф., Янси П.Г., Дэвис С.С. и др. Роль липидов и липопротеинов при атеросклерозе. [Обновлено 24 декабря 2015 г.]. В: Де Гроот Л.Дж., Хрусос Г., Дунган К. и др., редакторы. Эндотекст [Интернет]. Южный Дартмут (Массачусетс): MDText.com, Inc.; 2000-. Доступно по адресу: https://www.ncbi.nlm.nih.gov/books/NBK343489.
- ^ Ли Ю, Чжу Х, Чжан Ц, Хань Х, Чжан З, Шен Л и др. (ноябрь 2021 г.). «Макрофагоподобные клетки, происходящие из гладких мышц, способствуют образованию нескольких клеточных линий в атеросклеротической бляшке» . Открытие клеток . 7 (1): 111. дои : 10.1038/s41421-021-00328-4 . ПМЦ 8608914 . ПМИД 34811358 .
- ^ Гуй Ю, Чжэн Х, Цао Рю (2022). «Пенистые клетки при атеросклерозе: новый взгляд на его происхождение, последствия и молекулярные механизмы» . Границы сердечно-сосудистой медицины . 9 : 845942. дои : 10.3389/fcvm.2022.845942 . ПМК 9043520 . ПМИД 35498045 .
- ^ Прима К.С., Ортега К., Дубланд Дж.А., Фрэнсис Г.А. (апрель 2019 г.). «Пути образования пенистых клеток гладких мышц при атеросклерозе». Современное мнение в липидологии . 30 (2): 117–124. дои : 10.1097/MOL.0000000000000574 . ПМИД 30664015 . S2CID 58633787 .
- ^ Сципион К.А., Цибульский М.И. (октябрь 2022 г.). «Ранний атерогенез: новые идеи новых подходов» . Современное мнение в липидологии . 33 (5): 271–276. doi : 10.1097/MOL.0000000000000843 . ПМЦ 9594136 . ПМИД 35979994 .
- ^ Jump up to: а б с Бобрышев Ю.В., Иванова Е.А., Чистяков Д.А., Никифоров Н.Г., Орехов АН (2016). «Макрофаги и их роль в атеросклерозе: патофизиология и анализ транскриптома» . БиоМед Исследования Интернэшнл . 2016 : 9582430. doi : 10.1155/2016/9582430 . ПМЦ 4967433 . ПМИД 27493969 .
- ^ Jump up to: а б Мур К.Дж., Шиди Ф.Дж., Фишер Э.А. (октябрь 2013 г.). «Макрофаги при атеросклерозе: динамический баланс» . Обзоры природы. Иммунология . 13 (10): 709–721. дои : 10.1038/nri3520 . ПМК 4357520 . ПМИД 23995626 .
- ^ Jump up to: а б Джонс Н.Л., Рейган Дж.В., Уиллингем MC (март 2000 г.). «Патогенез образования пенистых клеток: модифицированные ЛПНП стимулируют поглощение совместно инкубированных ЛПНП посредством макропиноцитоза» . Атеросклероз, тромбоз и сосудистая биология . 20 (3): 773–781. дои : 10.1161/01.atv.20.3.773 . ПМИД 10712403 .
- ^ Шен С.М., Мао С.Дж., Хуан Г.С., Ян ПК, Чу Р.М. (декабрь 2001 г.). «Стимуляция пролиферации гладкомышечных клеток с помощью пенистых клеток, полученных из макрофагов, индуцированных ох-ЛПНП и ацетил-ЛПНП». Науки о жизни . 70 (4): 443–452. дои : 10.1016/s0024-3205(01)01428-x . ПМИД 11798013 .
- ^ Кумар, Аббас; Фаусто, Астер (2010). «11». Роббинс и Котран: патологическая основа болезней (восьмое международное издание). Филадельфия: Сондерс Эльзевир. стр. 500–501. ISBN 978-1-4160-3121-5 .
- ^ Томас AC, Эйгелаар WJ, Даемен MJ, Ньюби AC (июль 2015 г.). «Образование пенистых клеток in vivo превращает макрофаги в профиброзный фенотип» . ПЛОС ОДИН . 10 (7): e0128163. Бибкод : 2015PLoSO..1028163T . дои : 10.1371/journal.pone.0128163 . ПМК 4510387 . ПМИД 26197235 .
- ^ Деринг Ю, Цернеке А (2012). «Плазмоцитоидные дендритные клетки при атеросклерозе» . Границы в физиологии . 3 : 230. doi : 10.3389/fphys.2012.00230 . ПМЦ 3385355 . ПМИД 22754539 .
- ^ Ван М.Д., Кисс Р.С., Франклин В., Макбрайд Х.М., Уитмен С.К., Марсель Ю.Л. (март 2007 г.). «Различный клеточный транспорт холестерина ЛПНП и ацетилированного холестерина ЛПНП приводит к разным путям обратного транспорта холестерина» . Журнал исследований липидов . 48 (3): 633–645. doi : 10.1194/jlr.M600470-JLR200 . ПМИД 17148552 .
- ^ Рассел Д.Г., Кардона П.Дж., Ким М.Дж., Аллен С., Алтаре Ф. (сентябрь 2009 г.). «Пенистые макрофаги и прогрессирование туберкулезной гранулемы человека» . Природная иммунология . 10 (9): 943–948. дои : 10.1038/ni.1781 . ПМК 2759071 . ПМИД 19692995 .
- ^ ван Дист П.Дж., Бикман В.Х., Хейдж Дж.Дж. (июль 1998 г.). «Патология вытекания силикона из грудных имплантатов» . Журнал клинической патологии . 51 (7): 493–497. дои : 10.1136/jcp.51.7.493 . ПМК 500799 . ПМИД 9797723 .
- ^ Фесслер М.Б. (ноябрь 2017 г.). «Новый рубеж иммунометаболизма. Холестерин в здоровье и заболеваниях легких» . Анналы Американского торакального общества . 14 (Дополнение_5): S399–S405. doi : 10.1513/AnnalsATS.201702-136AW . ПМЦ 5711269 . ПМИД 29161079 .