Меланома
| Меланома | |
|---|---|
| Другие имена | Злокачественная меланома |
 | |
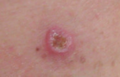
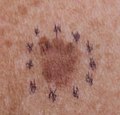
| Меланома размером примерно 2,5 см (1 дюйм) на 1,5 см (0,6 дюйма). | |
| Произношение | |
| Специальность | Онкология и дерматология |
| Симптомы | Родинка увеличивается в размерах, имеет неровные края, меняет цвет, вызывает зуд или повреждение кожи . [ 1 ] |
| Причины | Ультрафиолетовый свет (Солнце, солярии ) [ 2 ] |
| Факторы риска | Семейный анамнез, множество родинок, плохая иммунная функция. [ 1 ] |
| Метод диагностики | Биопсия ткани [ 1 ] |
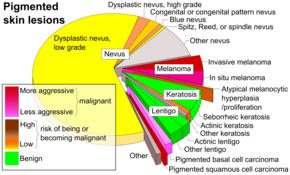
| Дифференциальный диагноз | Себорейный кератоз , лентиго , голубой невус , дерматофиброма. [ 3 ] |
| Профилактика | Солнцезащитный крем , избегая ультрафиолета [ 2 ] |
| Уход | Операция [ 1 ] |
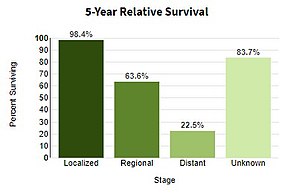
| Прогноз | Пятилетняя выживаемость в США 99% (локализованная), 25% (распространенная) [ 4 ] |
| Частота | 3,1 миллиона (2015) [ 5 ] |
| Летальные исходы | 59,800 (2015) [ 6 ] |
Меланома — самый опасный вид рака кожи ; он развивается из клеток, производящих меланин , известных как меланоциты . [ 1 ] Обычно она возникает на коже, но редко может возникать во рту, кишечнике или глазах ( увеальная меланома ). [ 1 ] [ 2 ] У женщин меланомы чаще всего возникают на ногах; а у мужчин - на спине. [ 2 ] Меланому часто называют злокачественной меланомой . Однако медицинское сообщество подчеркивает, что не существует такого понятия, как «доброкачественная меланома», и рекомендует избегать термина «злокачественная меланома» как излишнего . [ 7 ] [ 8 ] [ 9 ]
Около 25% меланом развиваются из родинок . [ 2 ] Изменения родинки, которые могут указывать на меланому, включают увеличение (особенно быстрое) размера, неровные края, изменение цвета, зуд или повреждение кожи . [ 1 ]
Основной причиной меланомы является воздействие ультрафиолетового света (УФ) у людей с низким уровнем кожного пигмента меланина . [ 2 ] [ 10 ] Ультрафиолетовый свет может исходить от солнца или других источников, например, от соляриев . [ 2 ] Те, у кого много родинок, больные члены семьи в анамнезе и плохая иммунная функция, подвергаются большему риску. [ 1 ] Ряд редких генетических заболеваний , таких как пигментная ксеродермия , также повышают риск. [ 11 ] Диагноз ставится на основе биопсии и анализа любого поражения кожи, имеющего признаки потенциально ракового заболевания. [ 1 ]
Избегание ультрафиолетового излучения и использование солнцезащитного крема в условиях яркого ультрафиолетового излучения может предотвратить меланому. [ 2 ] Лечение обычно заключается в хирургическом удалении меланомы и потенциально пораженной прилегающей ткани, граничащей с меланомой. [ 1 ] У пациентов с раком немного большего размера близлежащие лимфатические узлы можно проверить на предмет распространения ( метастазирования ). [ 1 ] Большинство людей излечиваются, если не возникло метастазов. [ 1 ] Для тех, у кого меланома распространилась, иммунотерапия , биологическая терапия , лучевая терапия или химиотерапия могут улучшить выживаемость. [ 1 ] [ 12 ] При лечении пятилетняя выживаемость в США составляет 99% среди лиц с локализованным заболеванием, 65%, когда заболевание распространилось на лимфатические узлы, и 25% среди лиц с отдаленным распространением. [ 4 ] Вероятность повторного возникновения или распространения меланомы зависит от ее толщины , скорости деления клеток и того, разрушилась ли лежащая над ней кожа. [ 2 ]
Меланома – самый опасный вид рака кожи. [ 2 ] Во всем мире в 2012 году это заболевание впервые произошло у 232 000 человек. [ 2 ] В 2015 году у 3,1 миллиона человек было активное заболевание, в результате которого 59 800 человек умерли. [ 5 ] [ 6 ] Австралия и Новая Зеландия имеют самые высокие показатели заболеваемости меланомой в мире. [ 2 ] Высокие показатели также наблюдаются в Северной Европе и Северной Америке, тогда как в Азии, Африке и Латинской Америке это встречается реже. [ 2 ] В США меланома встречается примерно в 1,6 раза чаще у мужчин, чем у женщин. [ 13 ] Меланома стала более распространенной с 1960-х годов в районах, в основном населенных людьми европейского происхождения . [ 2 ] [ 11 ]
Признаки и симптомы
[ редактировать ]Ранними признаками меланомы являются изменения формы или цвета существующих родинок или, в случае узловой меланомы , появление новой шишки в любом месте кожи. На более поздних стадиях родинка может чесаться , изъязвляться или кровоточить. Ранние признаки меланомы обобщаются мнемоникой «ABCDEEFG»: [ 14 ] [ 15 ]
- Симметрия
- Заказы B (неправильные с краями и углами)
- Цвет ( пестрый )
- Диаметр (более 6 мм (0,24 дюйма ), размером с ластик на карандаше)
- E меняется со временем
Эта классификация не распространяется на узловую меланому, которая имеет свои классификации: [ 16 ]
- Высота приподнята над поверхностью кожи
- Твердый на ощупь
- G гребля
Метастатическая меланома может вызывать неспецифические паранеопластические симптомы , включая потерю аппетита, тошноту , рвоту и усталость. Метастазирование (распространение) ранней меланомы возможно, но сравнительно редко; менее одной пятой меланомы, диагностированной на ранней стадии, становятся метастатическими. Метастазы в головной мозг особенно часто встречаются у пациентов с метастатической меланомой. [ 17 ] Он также может распространиться на печень, кости, брюшную полость или отдаленные лимфатические узлы. [ нужна ссылка ]
Причина
[ редактировать ]Меланомы обычно возникают в результате повреждения ДНК в результате воздействия ультрафиолетового излучения солнца. Генетика также играет роль. [ 18 ] [ 19 ] Меланома также может возникать на участках кожи, мало подверженных воздействию солнечных лучей (например, рот, подошвы ног, ладони, области гениталий). [ 20 ] Люди с синдромом диспластического невуса , также известным как семейная атипичная меланома множественных родинок, подвергаются повышенному риску развития меланомы. [ 21 ]
Наличие более 50 родинок указывает на повышенный риск возникновения меланомы. Ослабленная иммунная система облегчает развитие рака из-за ослабленной способности организма бороться с раковыми клетками. [ 18 ]
УФ-излучение
[ редактировать ]Воздействие ультрафиолетового излучения соляриев увеличивает риск развития меланомы. [ 22 ] Международное агентство по исследованию рака обнаружило, что солярии «канцерогенны для человека» и что люди, которые начинают пользоваться соляриями в возрасте до тридцати лет, имеют на 75% больше шансов заболеть меланомой. [ 23 ]
Те, кто работает в самолетах, также подвергаются повышенному риску, предположительно из-за большего воздействия ультрафиолета. [ 24 ]
Свет UVB , исходящий от солнца с длиной волны от 315 до 280 нм, поглощается непосредственно ДНК в клетках кожи. что приводит к типу прямого повреждения ДНК , называемому димерами циклобутан-пиримидина . тимина , цитозина или цитозин-тимина Димеры образуются путем соединения двух соседних пиримидиновых оснований внутри цепи ДНК. Свет UVA имеет длину волны больше, чем UVB (от 400 до 315 нм); и он также может поглощаться непосредственно ДНК в клетках кожи, но с более низкой эффективностью — примерно от 1/100 до 1/1000 от UVB. [ 25 ]
Воздействие радиации (UVA и UVB) является основным фактором развития меланомы. [ 26 ] Периодическое чрезмерное пребывание на солнце, приводящее к « солнечным ожогам » на участках человеческого тела, причинно связано с меланомой; [ 27 ] и такие области лишь периодического воздействия, по-видимому, объясняют, почему меланома чаще встречается на спине у мужчин и на ногах у женщин. Судя по всему, на риск сильно влияют социально-экономические условия, а не занятия в помещении или на открытом воздухе; это чаще встречается у профессиональных и административных работников, чем у неквалифицированных рабочих. [ 28 ] [ 29 ] Другими факторами являются мутации (или полная потеря) генов-супрессоров опухоли . Использование соляриев с глубоко проникающими лучами UVA связано с развитием рака кожи, включая меланому. [ 30 ]
Возможные важные элементы, определяющие риск, включают интенсивность и продолжительность пребывания на солнце, возраст, в котором происходит пребывание на солнце, и степень пигментации кожи . Заболеваемость меланомой, как правило, самая высокая в странах, заселенных мигрантами из Северной Европы, где много прямого и интенсивного солнечного света, к которому кожа поселенцев не адаптирована, особенно в Австралии. Воздействие в детстве является более важным фактором риска, чем воздействие во взрослом возрасте. Это видно из миграционных исследований в Австралии. [ 31 ]
Многократные серьезные солнечные ожоги увеличивают вероятность того, что в будущем солнечные ожоги перерастут в меланому из-за кумулятивного повреждения. [ 18 ] Солнечный свет с высоким содержанием УФ-излучения и солярии являются основными источниками УФ-излучения, повышающими риск развития меланомы. [ 32 ] а жизнь вблизи экватора увеличивает воздействие УФ-излучения. [ 18 ]
Генетика
[ редактировать ]Ряд редких мутаций, которые часто передаются в семьях, значительно повышают восприимчивость к меланоме. [ 33 ] Некоторые гены увеличивают риски. Некоторые редкие гены имеют относительно высокий риск возникновения меланомы; некоторые более распространенные гены, такие как ген MC1R , вызывающий рыжие волосы, имеют относительно меньший повышенный риск. генетическое тестирование . Для поиска мутаций можно использовать [ нужна ссылка ]
Один класс мутаций затрагивает ген CDKN2A . Альтернативная мутация рамки считывания в этом гене приводит к дестабилизации р53 , фактора транскрипции , участвующего в апоптозе и в 50% случаев рака у человека. Другая мутация в том же гене приводит к образованию нефункционального ингибитора CDK4 , циклин -зависимой киназы , которая способствует делению клеток . Мутации, вызывающие пигментную ксеродерму (XP), также повышают восприимчивость к меланоме. Разбросанные по всему геному, эти мутации снижают способность клетки восстанавливать ДНК. Мутации CDKN2A и XP обладают высокой проникающей способностью (шансы носителя проявить фенотип высоки). [ нужна ссылка ]
Семейная меланома генетически гетерогенна. [ 19 ] а локусы семейной меланомы появляются на плечах хромосомы 1p, 9p и 12q. меланомы связаны многочисленные генетические события . С патогенезом (развитием заболевания) [ 34 ] Ген множественного супрессора опухолей 1 (CDKN2A/MTS1) кодирует p16INK4a – низкомолекулярный белковый ингибитор циклин-зависимых протеинкиназ (CDK) – который локализован в области p21 хромосомы 9 человека . [ 35 ] FAMMM обычно характеризуется наличием 50 или более комбинированных родинок в дополнение к семейному анамнезу меланомы. [ 20 ] Он передается аутосомно-доминантно и в основном связан с мутациями CDKN2A . [ 20 ] У людей с мутацией CDKN2A, связанной с FAMMM, риск развития рака поджелудочной железы увеличивается в 38 раз. [ 36 ]
Другие мутации представляют меньший риск, но более распространены в популяции. У людей с мутациями в гене MC1R вероятность развития меланомы в два-четыре раза выше, чем у людей с двумя копиями дикого типа (типичный незатронутый тип). Мутации MC1R очень распространены, и у всех рыжеволосых людей есть мутированная копия. [ нужна ссылка ] Мутация гена SNP309 MDM2 связана с повышенным риском для молодых женщин. [ 37 ]
В группу повышенного риска входят светловолосые и рыжеволосые люди, лица с множественными атипичными невусами или диспластическими и лица, родившиеся с гигантскими врожденными меланоцитарными невусами . [ 38 ]
Семейный анамнез меланомы значительно увеличивает риск для человека, поскольку в семьях, склонных к меланоме, обнаружены мутации в нескольких генах. [ 39 ] [ 18 ] Люди, у которых в анамнезе была одна меланома, подвергаются повышенному риску развития второй первичной опухоли. [ 40 ]
Светлая кожа является результатом меньшего количества меланина в коже, что означает меньшую защиту от УФ-излучения. [ 18 ]
Патофизиология
[ редактировать ]

Самая ранняя стадия меланомы начинается, когда меланоциты начинают неконтролируемый рост. Меланоциты находятся между внешним слоем кожи ( эпидермисом ) и следующим слоем ( дермой ). Эта ранняя стадия заболевания называется фазой радиального роста, когда опухоль имеет толщину менее 1 мм и распространяется на уровне базального эпидермиса. [ 41 ] Поскольку раковые клетки еще не достигли кровеносных сосудов, расположенных глубже в коже, маловероятно, что меланома на ранней стадии распространится на другие части тела. Если меланома обнаруживается на этой стадии, ее обычно можно полностью удалить хирургическим путем. [ нужна ссылка ]
Когда опухолевые клетки начинают двигаться в другом направлении – вертикально вверх в эпидермис и в сосочковую дерму – поведение клеток резко меняется. [ 42 ]
Следующим шагом в эволюции является фаза инвазивного радиального роста, во время которой отдельные клетки начинают приобретать инвазивный потенциал. С этого момента меланома способна распространяться. [ нужна ссылка ] Глубина поражения по Бреслоу обычно составляет менее 1 мм (0,04 дюйма ), тогда как уровень Кларка обычно составляет 2.
Следующей фазой вертикального роста (VGP) является инвазивная меланома. Опухоль становится способной прорастать в окружающие ткани и распространяться по организму через кровеносные или лимфатические сосуды . Толщина опухоли обычно превышает 1 мм (0,04 дюйма ), и опухоль поражает более глубокие части дермы.
Хозяин вызывает иммунологическую реакцию против опухоли во время ВГП. [ 43 ] о чем судят по наличию и активности инфильтрирующих опухоль лимфоцитов (TIL). Эти клетки иногда полностью разрушают первичную опухоль; это называется регрессией, которая является последней стадией развития. В некоторых случаях первичная опухоль полностью разрушается и обнаруживается только метастатическая опухоль. Около 40% меланом человека содержат активирующие мутации, влияющие на структуру белка B-Raf , что приводит к конститутивной передаче сигналов через путь киназы Raf- MAP . [ 44 ]
Причиной, общей для большинства видов рака, является повреждение ДНК. [ 45 ] UVA-излучение в основном вызывает димеры тимина . [ 46 ] UVA также производит активные формы кислорода , которые вызывают другие повреждения ДНК, в первую очередь одноцепочечные разрывы, окисленные пиримидины и окисленный пурин 8-оксогуанин (мутагенное изменение ДНК) на 1/10, 1/10 и 1/3 частоты Димеры тимина, индуцированные UVA, соответственно.
Если их не восстановить, фотопродукты циклобутанпиримидинового димера (CPD) могут привести к мутациям из-за неточного синтеза транслейкоза во время репликации или репарации ДНК. Наиболее частыми мутациями, вызванными неточным синтезом прошлых CPD, являются мутации перехода цитозина в тимин (C>T) или CC>TT . Их обычно называют мутациями УФ-отпечатков пальцев, поскольку они являются наиболее специфической мутацией, вызываемой УФ-излучением, и часто обнаруживаются на коже, подвергающейся воздействию солнечных лучей, но редко обнаруживаются во внутренних органах. [ 47 ] Ошибки в репарации ДНК фотопродуктов УФ-излучения или неправильный синтез этих фотопродуктов также могут привести к делециям, инсерциям и хромосомным транслокациям .
Были секвенированы полные геномы 25 меланом. [ 48 ] В среднем на один геном меланомы обнаружено около 80 000 мутированных оснований (в основном переходы C>T) и около 100 структурных перестроек. Это намного больше, чем примерно 70 мутаций в разных поколениях (от родителей к детям). [ 49 ] [ 50 ] Среди 25 меланом около 6000 генов, кодирующих белки, имели миссенс- , нонсенс- мутации или мутации сайта сплайсинга . Транскриптомы более 100 меланом также были секвенированы и проанализированы. Почти 70% всех генов, кодирующих человеческие белки, экспрессируются при меланоме. Большинство этих генов также экспрессируются в других нормальных и раковых тканях, при этом около 200 генов демонстрируют более специфичный характер экспрессии при меланоме по сравнению с другими формами рака. Примерами генов, специфичных для меланомы, являются тирозиназа , MLANA и PMEL . [ 51 ] [ 52 ]
УФ-излучение вызывает повреждение ДНК клеток, обычно димеризацию тимина, которая, если ее не восстановить, может вызвать мутации в генах клетки. Этот сильный мутагенный фактор делает меланому кожи типом опухоли с наибольшим количеством мутаций. [ 53 ] Когда клетка делится , эти мутации передаются новым поколениям клеток. Если мутации возникают в протоонкогенах или генах-супрессорах опухолей , скорость митоза в клетках, несущих мутации, может стать неконтролируемой, что приведет к образованию опухоли . Данные пациентов позволяют предположить, что аберрантные уровни активирующего транскрипционного фактора в ядре клеток меланомы связаны с повышенной метастатической активностью клеток меланомы; [ 54 ] [ 55 ] [ 56 ] исследования рака кожи на мышах, как правило, подтверждают роль активации транскрипционного фактора-2 в прогрессировании рака. [ 57 ] [ 58 ]
Раковые стволовые клетки также могут быть вовлечены. [ 59 ]
Генные мутации
[ редактировать ]Крупномасштабные исследования, такие как «Атлас генома рака» , выявили рецидивирующие соматические изменения, которые, вероятно, способствуют возникновению и развитию меланомы кожи. Исследование «Атлас генома рака» выявило четыре подтипа: BRAF мутант , мутант RAS , мутант NF1 и тройной дикий тип. [ 60 ]
Наиболее часто мутация возникает в 600-м кодоне BRAF (50% случаев). BRAF обычно участвует в росте клеток, и эта специфическая мутация делает белок конститутивно активным и независимым от нормальной физиологической регуляции, тем самым способствуя росту опухоли. [ 61 ] Гены RAS ( NRAS , HRAS и KRAS ) также рекуррентно мутируют (30% случаев TCGA), а мутации в 61-м или 12-м кодонах вызывают онкогенную активность. Мутации потери функции часто затрагивают гены-супрессоры опухолей, такие как NF1 , TP53 и CDKN2A . Другие онкогенные изменения включают слияния с участием различных киназ, таких как BRAF, [ 62 ] РАФ1, [ 63 ] АЛК, РЕТ, РОС1, НТРК1., [ 64 ] НТРК3 [ 65 ] и МЕТ [ 66 ] Мутации BRAF, RAS и NF1 и слияния киназ являются в высшей степени взаимоисключающими, поскольку они встречаются у разных подгрупп пациентов. Таким образом, оценка мутационного статуса может улучшить стратификацию пациентов и предоставить информацию для таргетной терапии с использованием специфических ингибиторов. [ нужна ссылка ]
В некоторых случаях (3–7%) мутированные версии BRAF и NRAS подвергаются амплификации числа копий . [ 60 ]
Метастазирование
[ редактировать ]Исследование, проведенное командой Сарны, доказало, что сильно пигментированные клетки меланомы имеют модуль Юнга около 4,93, тогда как у непигментированных клеток он составляет всего 0,98. [ 67 ] В другом эксперименте они обнаружили, что эластичность клеток меланомы важна для ее метастазирования и роста: непигментированные опухоли были крупнее пигментированных, и им было гораздо легче распространяться. меланомы есть как пигментированные, так и непигментированные клетки Они показали, что в опухолях , поэтому они могут быть как устойчивыми к лекарствам , так и метастатическими. [ 67 ]
Диагностика
[ редактировать ]
Осмотр или визуальный осмотр рассматриваемой области является наиболее распространенным методом подозрения на меланому. [ 68 ] Родинки неправильного цвета и формы обычно рассматриваются как кандидаты. Для выявления меланом (и повышения выживаемости) рекомендуется научиться распознавать их (см. мнемосхему «ABCDE» ), регулярно осматривать родинки на предмет изменений (формы, размера, цвета, зуда или кровотечения) и при необходимости обращаться к квалифицированному врачу. появляется кандидат. [ 69 ] [ 70 ] Осмотр подозрительных поражений кожи при личном осмотре более точен, чем визуальный осмотр изображений подозрительных поражений кожи. [ 71 ] При использовании обученными специалистами дерматоскопия более полезна для выявления злокачественных поражений, чем использование только невооруженного глаза. [ 72 ] Отражательная конфокальная микроскопия может иметь лучшую чувствительность и специфичность, чем дерматоскопия, при диагностике меланомы кожи, но для подтверждения этого результата необходимы дополнительные исследования. [ 73 ]
Однако многие меланомы представляют собой очаги диаметром менее 6 мм, и все меланомы считаются злокачественными, когда они впервые появляются в виде маленькой точки. Врачи обычно исследуют все родинки, в том числе диаметром менее 6 мм. Себорейный кератоз может соответствовать некоторым или всем критериям ABCD и может приводить к ложным тревогам . Врачи обычно могут отличить себорейный кератоз от меланомы при осмотре или с помощью дерматоскопии . [ нужна ссылка ]
Некоторые выступают за замену «увеличения» на «эволюцию»: родинки, которые меняются и развиваются, вызывают беспокойство. Альтернативно, некоторые практикующие предпочитают «возвышение». Возвышение может помочь идентифицировать меланому, но отсутствие возвышения не означает, что поражение не является меланомой. Большинство меланом в США выявляются до того, как они достигают повышенного уровня. К тому времени, когда станет видно возвышение, они, возможно, перейдут в более опасную инвазивную стадию. [ нужна ссылка ]
-
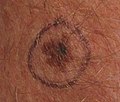
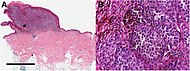
Меланома при биопсии кожи с окраской H&E – этот случай может представлять собой поверхностно распространяющуюся меланому.
-
Лимфатический узел с практически полным замещением метастатической меланомой. Коричневый пигмент представляет собой очаговое отложение меланина.
-
Дерматоскоп
-
Меланома задней поверхности правого бедра
-
Меланома in situ, макушка скальпа отмечена для биопсии
-
Меланома in situ, развивается, правая ключица отмечена для биопсии
-
Меланома, макушка скальпа отмечена для биопсии
-
Меланома, правое медиальное бедро, отмеченное для биопсии
-
Меланома, правое заднее плечо обведено кружком для биопсии.
-
Меланома левого предплечья отмечена для биопсии.
-
Меланома левого предплечья после иссечения с кисетным закрытием
-
Меланома in situ, правый лоб отмечен для биопсии.
-
Меланома in situ, изображение дерматоскопа, правый лоб отмечен для биопсии.
-
Меланома in situ, развивающаяся, медиальная часть правого виска с прилежащей к ней гиперплазией сальных желез, латеральная часть.
-
Меланома in situ, левое переднее плечо отмечено для биопсии.
-
Меланома in situ, правое переднее плечо отмечено для биопсии.
-
Меланома in situ, левая верхняя внутренняя часть руки
-
Меланома in situ, отмеченная для биопсии, левое предплечье
-
Меланома in situ, правая верхняя медиальная часть спины, отмечена для биопсии.
-
Меланома средней части лобной части черепа
-
Меланома левой середины спины отмечена для биопсии
-
Меланома, левая середина спины, отмечена для биопсии, через дерматоскоп.
-
Грубая патология метастазов меланомы, которая в подавляющем большинстве случаев является пигментообразующей, что придает ей темный вид.
-
Гистопатология метастатической меланомы в лимфатический узел, окраска H&E, демонстрирующая плохо дифференцированные клетки.
-
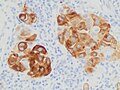
Метастатическая меланома по данным иммуногистохимии на Мелан-А , что помогает в диагностике неопределенных случаев.
-
Метастатическая меланома при иммуногистохимии на SOX10 , еще одно полезное окрашивание в неопределенных случаях.
Гадкий утенок
[ редактировать ]Одним из методов является « знак гадкого утенка ». [ 74 ] Выполнена корреляция общих характеристик поражения. Поражения, отклоняющиеся от общих характеристик, называют «гадким утенком», и требуется дальнейшее профессиональное обследование. Табличка « Красная Шапочка ». [ 74 ] предполагает, что люди со светлой кожей и светлыми волосами могут иметь трудно диагностируемые амеланотические меланомы . При обследовании таких лиц требуется особая осторожность, поскольку у них могут быть множественные меланомы и тяжелые диспластические невусы. Для обнаружения «гадких утят» необходимо использовать дерматоскоп, так как многие меланомы у этих особей напоминают немеланомы или считаются « волками в овечьей шкуре ». [ 75 ] У этих людей со светлой кожей часто наблюдаются слегка пигментированные или бесцветные меланомы, которые не демонстрируют легко наблюдаемых изменений цвета и вариаций. Границы их часто нечеткие, что затрудняет визуальную идентификацию без дерматоскопа.
Амеланотические меланомы и меланомы, возникающие у светлокожих людей, очень трудно обнаружить, поскольку они не проявляют многих характеристик правила ABCD, не нарушают признак «гадкого утенка» и их трудно отличить от рубцов от прыщей, укусов насекомых, дерматофибромы , или лентиго .
Биопсия
[ редактировать ]После визуального осмотра и дерматоскопического исследования [ 75 ] или с помощью диагностических инструментов in vivo , таких как конфокальный микроскоп, врач может провести биопсию подозрительной родинки. Биопсия кожи , выполняемая под местной анестезией , часто требуется для постановки или подтверждения диагноза, а также определения степени тяжести. Эллиптическая эксцизионная биопсия может удалить опухоль с последующим гистологическим анализом и оценкой Бреслоу. Инцизионные биопсии, такие как пункционная биопсия , обычно противопоказаны при подозрении на меланому из-за возможности ошибки отбора проб. [ 76 ] или местная имплантация, вызывающая неправильную оценку толщины опухоли. [ 77 ] [ 78 ] Однако опасения, что такие биопсии могут увеличить риск метастатического заболевания, кажутся необоснованными. [ 79 ] [ 80 ]
Общая фотография тела, которая предполагает фотографическое документирование как можно большей поверхности тела, часто используется во время наблюдения за пациентами из группы высокого риска. Сообщается, что этот метод обеспечивает раннее обнаружение и обеспечивает экономически эффективный подход (с любой цифровой камерой), но его эффективность подвергается сомнению из-за его неспособности обнаруживать макроскопические изменения. [ 68 ] Этот метод диагностики следует использовать в сочетании с дерматоскопической визуализацией (а не вместо нее), при этом комбинация обоих методов дает чрезвычайно высокие показатели обнаружения.
Гистопатологические типы
[ редактировать ]Меланома — разновидность нейроэктодермального новообразования . [ 81 ] Существует четыре основных типа меланомы: [ 82 ]
| СН | Тип | Функции | Заболеваемость [ 82 ] [ примечания 1 ] | Фотография | Микрофотография |
|---|---|---|---|---|---|
| 1. | Поверхностно распространяющаяся меланома | Клетки меланомы с образованием гнезд вдоль дермо-эпидермального соединения. | 70% | 
|

|
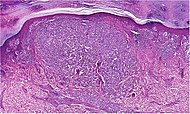
| 2. | Узловая меланома | Растет относительно больше в глубину, чем в ширину. | 15% - 20% | 
|
|
| 3. | Злокачественная меланома лентиго | Линейное распространение атипичных эпидермальных меланоцитов, а также инвазия в дерму. [ 83 ] | 5% - 10% | 
|

|
| 4. | Акрально-лентигинозная меланома | Непрерывная пролиферация атипичных меланоцитов в дермоэпидермальном соединении. [ 84 ] | 7% - 10% | 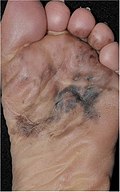
|
|
Другими гистопатологическими типами являются:

- меланома слизистой оболочки ; При возникновении меланомы на слизистых оболочках .
- Десмопластическая меланома
- Меланома с мелкими невусоподобными клетками
- Меланома с признаками невуса Шпица
- Увеальная меланома
- Вагинальная меланома
- Полиповидная меланома , подкласс узловой меланомы.
In situ или инвазивный
[ редактировать ]Меланома in situ не прорастает за пределы базальной мембраны , тогда как инвазивная меланома распространилась за ее пределы.
Некоторые гистопатологические типы меланомы по своей природе инвазивны, в том числе узловая меланома и меланома злокачественного лентиго , где in situ аналогом меланомы злокачественного лентиго является злокачественное лентиго . [ 85 ] Злокачественное лентиго иногда классифицируют как очень раннюю меланому. [ 86 ] а иногда и предшественник меланомы. [ 87 ]
Поверхностно распространяющиеся меланомы и акральные лентигинозные меланомы могут быть как in situ , так и инвазивными. [ 88 ] но акральные лентигинозные меланомы почти всегда инвазивны. [ 89 ]
Постановка
[ редактировать ]Дополнительную информацию о стадиях рака можно получить на сайте TNM .

Метастатические меланомы можно обнаружить с помощью рентгенографии, компьютерной томографии, МРТ, ПЭТ и ПЭТ/КТ, ультразвука, тестирования ЛДГ и фотоакустического обнаружения. [ 90 ] Однако недостаточно доказательств точности определения стадий людей с меланомой с помощью различных методов визуализации. [ 91 ]
Стадии меланомы по версии AJCC , 8-е издание: [ 92 ]
- TX: Толщина первичной опухоли не может быть оценена (например, диагноз путем выскабливания)
- Т0: нет признаков первичной опухоли (например, неизвестная первичная или полностью регрессировавшая меланома)
| Этап | Категория Т [ 92 ] | Толщина [ 92 ] | Изъязвление [ 92 ] |
|---|---|---|---|
| Этап 0 | Меланома in situ | ||
| Этап I | Т1а | Менее 0,8 мм | Нет |
| Т1б | Менее 0,8 мм | Да | |
| >0,8–1,0 мм | Да или нет | ||
| Т2а | >1,0–2,0 мм | Нет | |
| II этап | Т2б | >1,0–2,0 мм | Да |
| Т3а | >2,0–4,0 мм | Нет | |
| Т3б | >2,0–4,0 мм | Да | |
| Т4а | >4,0 мм | Нет | |
| Т4б | >4,0 мм | Да | |
Для стадий 1 и 2 требуется класс N (лимфатический узел):
- N0 – регионарных метастазов нет. [ 92 ]
| Этап | категория N | Количество пораженных опухолью регионарных лимфатических узлов | Наличие транзитных, сателлитных и/или микросателлитных метастазов. |
|---|---|---|---|
| Н/Д | НХ | Региональные узлы не оцениваются (например, не выполнена биопсия сторожевых лимфатических узлов или регионарные узлы ранее удалены по другой причине) [ примечания 2 ] | |
| III этап | N1 | Один пораженный лимфатический узел или любое количество транзитных, сателлитных и/или микросателлитных метастазов без узлов, пораженных опухолью. | |
| Н1а | Один клинически оккультный (то есть обнаруженный при биопсии сторожевого узла) | Нет | |
| N1b | Клинически обнаружен один | Нет | |
| N1c | Отсутствие поражения регионарных лимфатических узлов | Да | |
| Н2 | Два или три пораженных опухолью узла или любое количество транзитных, сателлитных и/или микросателлитных метастазов с одним пораженным опухолью узлом | ||
| Н2а | Два или три клинически оккультных (то есть обнаруженных при биопсии сторожевого узла) | Нет | |
| N2b | Два или три, по крайней мере один из которых был выявлен клинически. | Нет | |
| N2c | Один клинически оккультный или клинически обнаруженный | Да | |
| N3 | Четыре или более узлов, пораженных опухолью, или любое количество транзитных, сателлитных и/или микросателлитных метастазов с 2 или более узлами, пораженными опухолью, или любое количество спутанных узлов без или с транзитными, сателлитными и/или микросателлитными метастазами метастазы | ||
| N3a | Четыре или более клинически оккультных (т.е. обнаруженных при биопсии сторожевого узла) | Нет | |
| N3b | Четыре и более, из которых хотя бы один был выявлен клинически, или наличие любого количества спутанных узлов. | Нет | |
| N3c | Два или более клинически скрытых или клинически выявленных узла и/или наличие любого количества спутанных узлов. | Да | |
Для стадий 1, 2 и 3 требуется М (статус метастазов):
- М0 : нет признаков отдаленных метастазов.
| Этап | Категория М | Анатомический сайт | уровень лактатдегидрогеназы (ЛДГ) |
|---|---|---|---|
| IV этап | М1 | Признаки отдаленного метастазирования | |
| М1а | Отдаленные метастазы в кожу, мягкие ткани, включая мышцы, и/или нерегионарные лимфатические узлы. | Не записано или не указано | |
| М1а(0) | Не повышен | ||
| М1а(1) | Повышенный | ||
| М1б | Отдаленные метастазы в легкие с метастазами на участках M1a или без них. | Не записано или не указано | |
| М1б(0) | Не повышен | ||
| М1б(1) | Повышенный | ||
| M1c | Отдаленные метастазы в висцеральные участки вне ЦНС, с метастазами в участки M1a или M1b или без них. | Не записано или не указано | |
| М1с(0) | Не повышен | ||
| М1с(1) | Повышенный | ||
| М1д | Отдаленные метастазы в ЦНС с метастазами в участки M1a, M1b или M1c или без них. | Не записано или не указано | |
| М1д(0) | Не повышен | ||
| М1д(1) | Повышенный | ||
Более старые системы включают « уровень Кларка » и « глубину Бреслоу », количественно определяющие микроскопическую глубину инвазии опухоли.

Лаборатория
[ редактировать ]Тесты на лактатдегидрогеназу (ЛДГ) часто используются для выявления метастазов , хотя многие пациенты с метастазами (даже на терминальной стадии) имеют нормальный уровень ЛДГ; чрезвычайно высокий уровень ЛДГ часто указывает на метастатическое распространение заболевания в печень.
Пациентам с диагнозом меланома обычно проводят рентгенографию грудной клетки и тест на ЛДГ, а в некоторых случаях КТ , МРТ и/или ПЭТ . Хотя это и противоречиво, биопсию сторожевых лимфатических узлов и исследование лимфатических узлов пациентам также проводят для оценки распространения инфекции в лимфатические узлы. Диагноз меланомы подтверждается наличием белка-маркера S-100 .
HMB-45 представляет собой моноклональное антитело, которое реагирует на антиген, присутствующий в меланоцитарных опухолях, таких как меланома. Его используют в анатомической патологии как маркер таких опухолей. Антитело было получено к экстракту меланомы. Он положительно реагирует на меланоцитарные опухоли, но не на другие опухоли, демонстрируя тем самым специфичность и чувствительность. Антитело также положительно реагирует на клетки соединительного невуса, но не на внутридермальные невусы, и на фетальные меланоциты, но не на нормальные взрослые меланоциты.
HMB-45 не реагирует почти на все немеланомные злокачественные новообразования человека, за исключением редких опухолей с признаками меланогенеза (например, пигментная шваннома, светлоклеточная саркома) или опухолей, связанных с комплексом туберозного склероза (ангиомиолипома и лимфангиомиома).
Профилактика
[ редактировать ]Нет никаких доказательств, подтверждающих или опровергающих скрининг взрослого населения на меланому. [ 93 ]
Ультрафиолетовое излучение
[ редактировать ]Минимизация воздействия источников ультрафиолетового излучения (солнце и солярии), [ 94 ] Соблюдение мер по защите от солнца и ношение солнцезащитной одежды (рубашки с длинными рукавами, длинные брюки и широкополые шляпы) могут обеспечить защиту.
Когда-то считалось, что использование искусственного света для загара помогает предотвратить рак кожи, но на самом деле оно может привести к увеличению заболеваемости меланомой. [ 95 ]
УФ-лампы для ногтей, которые используются в маникюрных салонах для сушки лака для ногтей, являются еще одним распространенным и широко распространенным источником УФ-излучения, которого можно избежать. [ 96 ] [ 97 ] Хотя риск развития рака кожи при использовании УФ-лампы для ногтей невелик, перед использованием УФ-лампы для ногтей все же рекомендуется носить перчатки без пальцев и/или наносить на руки солнцезащитный крем с SPF 30 или выше. [ 96 ] [ 97 ]
Организм использует ультрафиолетовый свет для выработки витамина D, поэтому необходимо сбалансировать получение достаточного количества солнечного света для поддержания здорового уровня витамина D и снижения риска развития меланомы; организму требуется около получаса солнечного света, чтобы выработать витамин D в течение дня, и это примерно столько же времени, сколько светлокожим людям требуется, чтобы получить солнечный ожог. Воздействие солнечного света может быть прерывистым, а не все сразу. [ 98 ]
солнцезащитный крем
[ редактировать ]Солнцезащитный крем , по-видимому, эффективен в предотвращении меланомы. [ 2 ] [ 10 ] Раньше рекомендовалось использовать солнцезащитные кремы с фактором защиты от солнца (SPF) 50 или выше на открытых участках; поскольку старые солнцезащитные кремы более эффективно блокировали UVA с более высоким SPF. [ 99 ] В настоящее время новые солнцезащитные ингредиенты ( авобензон , оксид цинка и диоксид титана ) эффективно блокируют как UVA, так и UVB даже при более низких SPF. Солнцезащитный крем также защищает от плоскоклеточного рака , другого рака кожи. [ 100 ]
Высказывались опасения, что солнцезащитный крем может создать ложное чувство безопасности от вредного воздействия солнечных лучей. [ 101 ]
Лекарства
[ редактировать ]Обзор 2005 года обнаружил предварительные доказательства того, что статины и фибраты могут снизить риск развития меланомы. [ 102 ] Однако обзор 2006 года не подтвердил никаких преимуществ. [ 103 ]
Уход
[ редактировать ]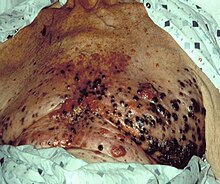
Подтверждение клинического диагноза осуществляется с помощью биопсии кожи . Обычно за этим следует более широкое иссечение рубца или опухоли. В зависимости от стадии сторожевого лимфатического узла может быть выполнена биопсия . Разногласия существуют вокруг доказательств биопсии сторожевых лимфатических узлов; [ 104 ] с неясными доказательствами пользы по состоянию на 2015 год. [ 105 ] Лечение распространенной меланомы осуществляется с использованием мультидисциплинарного подхода.
Операция
[ редактировать ]Эксцизионная биопсия может удалить опухоль, но для снижения риска рецидива часто необходимо дальнейшее хирургическое вмешательство. Стандартным является полное хирургическое иссечение с адекватными хирургическими краями и оценкой наличия обнаруживаемых метастазов, а также краткосрочное и долгосрочное наблюдение. Часто это делается путем широкого местного иссечения (WLE) с краями 1–2 см (0,4–0,8 дюйма). Меланома in-situ и злокачественное лентиго лечатся с использованием более узких хирургических границ, обычно 0,2–0,5 см (0,1–0,2 дюйма). Многие хирурги считают 0,5 см (0,2 дюйма) стандартным удалением меланомы на месте. [ 106 ] но запас в 0,2 см (0,1 дюйма) может быть приемлемым для операции с контролем поля ( операция Мооса или техника с двойным лезвием с контролем поля). Широкое иссечение направлено на снижение частоты рецидивов опухоли на месте исходного поражения. Это распространенная картина неудачи лечения меланомы. Значительные исследования были направлены на выяснение допустимых пределов иссечения с учетом общей тенденции к менее агрессивному лечению в течение последних десятилетий. [ 107 ] Метаанализ рандомизированных контролируемых исследований 2009 года выявил небольшую разницу в показателях выживаемости в пользу широкого удаления первичных меланом кожи, но эти результаты не были статистически значимыми. [ 108 ]
Сообщалось, что после операции Мооса уровень излечения составляет всего 77%. [ 109 ] и достигает 98,0% для меланомы in-situ. [ 110 ] CCPDMA и операция с контролируемым периферическим краем «двойного скальпеля» эквивалентна операции Мооса по эффективности при этом «интраэпителиальном» типе меланомы.
Меланомы, которые распространяются, обычно распространяются на лимфатические узлы в области опухоли, прежде чем распространиться на другие места. Попытки улучшить выживаемость путем хирургического удаления лимфатических узлов ( лимфаденэктомия ) были связаны со многими осложнениями, но не принесли общей пользы для выживаемости. Недавно была разработана методика биопсии сторожевых лимфатических узлов , позволяющая уменьшить осложнения операции на лимфатических узлах и одновременно позволяющая оценить поражение узлов опухолью. [ 111 ]
Биопсия сторожевых лимфатических узлов является широко используемой процедурой при лечении меланомы кожи. [ 112 ] [ 113 ]
Ни биопсию сторожевого лимфатического узла, ни другие диагностические тесты не следует проводить для оценки ранней тонкой меланомы, включая меланому in situ, меланому T1a или меланому T1b ≤ 0,5 мм. [ 114 ] У людей с этими заболеваниями рак вряд ли распространится на лимфатические узлы или где-либо еще, а 5-летняя выживаемость составляет 97%. [ 114 ] По этим соображениям биопсия сторожевого лимфатического узла считается для них ненужной медицинской помощью . [ 114 ] Кроме того, базовые анализы крови и рентгенологические исследования не следует проводить только на основе выявления этого вида меланомы, поскольку существуют более точные тесты для выявления рака, и эти тесты имеют высокий уровень ложноположительных результатов. [ 114 ] Чтобы потенциально исправить ложноположительные результаты, можно использовать профилирование экспрессии генов в качестве вспомогательного тестирования при неоднозначных и небольших поражениях. [ 115 ] [ 116 ]
Биопсия сторожевого лимфатического узла проводится часто, особенно при опухолях T1b/T2+, опухолях слизистой оболочки, меланоме глаза и опухолях конечностей. [ нужна ссылка ] Выполняется процесс, называемый лимфосцинтиграфией , при котором радиоактивный индикатор вводится в место опухоли для локализации сторожевого узла(ов). Дополнительная точность обеспечивается использованием синего индикаторного красителя и хирургическим вмешательством по биопсии узла(ов). Рутинное окрашивание гематоксилином и эозином (H&E) и иммунопероксидазой будет достаточным для исключения поражения узла. Тесты полимеразной цепной реакции (ПЦР) на узлах, обычно проводимые для проверки допуска к клиническим испытаниям, теперь показывают, что многие пациенты с отрицательным сигнальным лимфатическим узлом на самом деле имеют небольшое количество положительных клеток в своих узлах. Альтернативно может быть выполнена тонкоигольная аспирационная биопсия, которая часто используется для проверки образований.
Если лимфатический узел положительный, в зависимости от степени распространения лимфатического узла часто выполняется радикальная диссекция лимфатического узла. Если заболевание полностью удалено, пациенту будет предложена адъювантная терапия. Эксцизионная биопсия кожи является методом выбора. В этом случае подозрительное поражение полностью удаляется с сохранением адекватного (но минимального, обычно 1 или 2 мм) эллипса окружающей кожи и тканей. [ 117 ] Чтобы избежать нарушения местного лимфатического дренажа, предпочтительный хирургический край для первоначальной биопсии должен быть узким (1 мм). Биопсия должна включать эпидермальный, дермальный и подкожный слои кожи. Это позволяет гистопатологу определить толщину меланомы путем микроскопического исследования. Это описывается толщиной Бреслоу (измеряется в миллиметрах). Однако при больших поражениях, таких как подозрение на злокачественное лентиго, или при поражениях в хирургически сложных областях (лицо, пальцы ног, пальцы рук, веки), небольшая пункционная биопсия в репрезентативных областях даст адекватную информацию и не помешает окончательному определению стадии или глубины. . Ни при каких обстоятельствах первоначальная биопсия не должна включать окончательный хирургический край (0,5 см, 1,0 см или 2 см), поскольку ошибочный диагноз может привести к чрезмерному рубцеванию и осложнениям в результате процедуры. Большое первоначальное иссечение нарушит местный лимфатический дренаж и может повлиять на дальнейшую диссекцию лимфатических узлов под контролем лимфангиографии. Небольшую пункционную биопсию можно использовать в любое время, когда по логистическим и личным причинам пациент отказывается от более инвазивной эксцизионной биопсии. Небольшая пункционная биопсия минимально инвазивна и быстро заживает, обычно без заметных рубцов.
Добавить лечение
[ редактировать ]Адъювантное лечение после операции может снизить риск рецидива после операции, особенно при меланомах высокого риска. В разных странах процедуры различаются, но сегодня (2024 г.) наиболее распространенным адъювантным лечением является лечение ингибиторами иммунных контрольных точек в течение года после операции. [ 118 ]
в течение года В начале 2000-х годов относительно распространенной стратегией было лечение пациентов с высоким риском рецидива с помощью лечения высокими дозами интерферона , которое имеет серьезные побочные эффекты, но может немного улучшить прогноз пациента. [ 119 ] Метаанализ 2013 года показал, что добавление интерферона альфа увеличивает безрецидивную и общую выживаемость у людей с меланомой кожи II-III стадии AJCC TNM. [ 120 ] Метаанализ 2011 года показал, что интерферон может продлить время до возвращения меланомы, но увеличивает выживаемость всего на 3% за 5 лет. Неприятные побочные эффекты также значительно снижают качество жизни. [ 121 ] В Европейском Союзе интерферон обычно не используется вне рамок клинических исследований. [ 122 ] [ 123 ]
Химиотерапия
[ редактировать ]Химиотерапевтические препараты, такие как дакарбазин, были основой лечения метастатической меланомы с момента одобрения FDA в 1975 году; однако его эффективность с точки зрения выживаемости никогда не была доказана в РКИ . [ 124 ] С момента одобрения ингибиторов иммунных контрольных точек дакарбазин и его пероральный аналог темозоломид представляют собой потенциальные варианты лечения на более поздних линиях терапии. [ 125 ]
Пациентам доступны несколько лекарств для уменьшения размера опухоли. Уменьшив размер опухоли, можно облегчить некоторые симптомы; однако это не обязательно приводит к ремиссии. Некоторые из этих препаратов — дакарбазин , темозоломид и фотемустин . Также используются комбинации лекарств, которые в некоторых случаях обеспечивают более высокие показатели ремиссии. Эти комбинации лекарств могут иметь вредные побочные эффекты. Для поддержания качества жизни пациентам необходимы вспомогательные методы лечения и наблюдение. Хотя комбинации препаратов увеличивают частоту ремиссии, выживаемость не увеличивается. [ 126 ]
Было обнаружено, что у людей с местно-распространенными злокачественными новообразованиями кожи и саркомой изолированная инфузия конечностей (ГПЗ) является минимально инвазивной и хорошо переносимой процедурой проведения регионарной химиотерапии. [ 127 ] [ 128 ]
Таргетная терапия
[ редактировать ]Клетки меланомы имеют мутации, которые позволяют им выживать и неограниченно расти в организме. [ 124 ] Таргетная терапия с использованием малых молекул действует путем блокирования генов, участвующих в путях пролиферации и выживания опухолей. [ 124 ] Основными методами лечения являются ингибиторы BRAF, C-Kit и NRAS . [ 129 ] Эти ингибиторы ингибируют последующие пути, участвующие в пролиферации клеток и развитии опухолей из-за специфических генных мутаций. [ 130 ] Людей можно лечить низкомолекулярными таргетными ингибиторами, если у них положительный результат на конкретную мутацию. [ 124 ] Ингибиторы BRAF , такие как вемурафениб и дабрафениб, а также ингибитор MEK траметиниб, являются наиболее эффективными и одобренными методами лечения BRAF-положительной меланомы. [ 131 ] [ 124 ] Опухоли меланомы могут развивать резистентность во время терапии, что может сделать терапию неэффективной, но сочетание использования ингибиторов BRAF и MEK может создать быстрый и стойкий ответ на терапию меланомы. [ 132 ]
Ряд методов лечения улучшают выживаемость по сравнению с традиционной химиотерапией. [ 124 ] Биохимиотерапия (химиотерапия цитокинами IL-2 и IFN-α) в сочетании с ингибиторами BRAF улучшила выживаемость людей с BRAF-положительной меланомой. [ 124 ] Биохимиотерапия сама по себе не улучшала общую выживаемость и имела более высокую токсичность, чем химиотерапия. [ 124 ] Комбинирование нескольких химиотерапевтических препаратов (полихиотерапия) не улучшало выживаемость по сравнению с монохимиотерапией. [ 124 ] Таргетная терапия приводит к относительно короткому времени выживаемости без прогрессирования (ВБП). Комбинированная терапия дабрафенибом и траметинибом имеет 3-летнюю ВБП 23% и 5-летнюю ВБП 13%. [ 133 ]
Лифилеуцел (Амтагви) — это препарат аутологичной Т-клеточной иммунотерапии опухолевого происхождения, который был одобрен для медицинского применения в США в феврале 2024 года. [ 134 ] [ 135 ]
Иммунотерапия
[ редактировать ]Иммунотерапия направлена на стимуляцию иммунной системы человека против опухоли путем повышения способности организма распознавать и уничтожать раковые клетки. [ 136 ] Современный подход к лечению меланомы с помощью иммунотерапии включает три широкие категории лечения, включая цитокины , ингибиторы иммунных контрольных точек и адоптивный перенос клеток . [ 136 ] Эти варианты лечения чаще всего используются у людей с метастатической меланомой и значительно улучшают общую выживаемость. [ 124 ] Однако такое лечение зачастую является дорогостоящим. Например, один курс лечения ингибитором иммунных контрольных точек, пембролизумабом , стоит от 10 000 до 12 000 долларов США за однократное введение каждые 3 недели. [ 137 ]
Цитокиновая терапия, используемая при меланоме, включает IFN-a и IL-2 . [ 138 ] ИЛ-2 ( пролейкин ) был первым новым препаратом, одобренным (ЕС в 1990 г., США в 1992 г.) для лечения метастатической меланомы за 20 лет. [ 139 ] IL-2 может обеспечить возможность полной и длительной ремиссии этого заболевания у небольшого процента людей с меланомой. [ 140 ] Внутриочаговый IL-2 при транзитных метастазах имеет высокий уровень полного ответа – от 40 до 100%. [ 131 ] Аналогичным образом, IFN-a продемонстрировал лишь скромные преимущества для выживаемости и высокую токсичность, что ограничивает его использование в качестве самостоятельной терапии. [ 124 ] [ 138 ]
Ингибиторы иммунных контрольных точек включают против CTLA-4 моноклональные антитела ( ипилимумаб и тремелимумаб ), агонисты toll-подобных рецепторов (TLR), агонисты CD40 , антитела против PD-1 ( пембролизумаб , пидилизумаб и ниволумаб ) и PD-L1 . [ 136 ] [ 138 ] Имеющиеся данные свидетельствуют о том, что антитела против PD-1 более эффективны, чем антитела против CTLA4, с меньшей системной токсичностью. [ 124 ] Пятилетняя выживаемость без прогрессирования при иммунотерапии пембролизумабом составляет 21%. [ 133 ] Терапевтический подход, включающий комбинацию различных методов лечения, улучшает общую выживаемость и выживаемость без прогрессирования по сравнению с лечением отдельными иммунотерапевтическими препаратами. [ 124 ]
Продолжающиеся исследования направлены на лечение методом адоптивного переноса клеток . [ 141 ] Перенос адоптивных клеток подразумевает применение предварительно стимулированных модифицированных Т-клеток или дендритных клеток и в настоящее время используется для минимизации осложнений реакции «трансплантат против хозяина» . [ 138 ] [ 142 ]
Комбинация ниволумаб/релатлимаб (Опдуалаг) была одобрена для медицинского применения в США в марте 2022 года. [ 143 ]
Злокачественное лентиго
[ редактировать ]Большинство хирургов до сих пор выполняют стандартное иссечение. К сожалению, частота рецидивов чрезвычайно высока (до 50%). Это связано с нечетким видимым хирургическим краем и расположением поражений на лице (часто вынуждающим хирурга использовать узкий хирургический край). Узкий хирургический край в сочетании с ограничениями стандартной техники гистологии фиксированных тканей «хлебного хлеба» приводит к высокой частоте «ложноотрицательных» ошибок и частым рецидивам. Контроль маржи (периферийных полей) необходим для исключения ложноотрицательных ошибок. Если выпечка хлеба используется , расстояния от срезов должны приближаться к 0,1 мм, чтобы гарантировать, что метод приближается к полному контролю полей. Метаанализ литературы, проведенный в 2014 году, не выявил рандомизированных контролируемых исследований хирургических вмешательств для лечения злокачественного лентиго или меланомы in situ, хотя хирургическое вмешательство является наиболее широко используемым методом лечения. [ 144 ]
Была проведена операция по Моосу , при этом уровень излечения составил всего 77%. [ 109 ] и до 95% у другого автора. [ 110 ] Метод иссечения с контролем периферического края «двойным скальпелем» приближается к методу Мооса в контроле края, но требует от патологоанатома, хорошо знакомого со сложностью управления вертикальным краем на тонких периферических срезах и методами окрашивания. [ 145 ]
Некоторые меланоцитарные невусы и меланома in-situ ( злокачественное лентиго ) разрешились с помощью экспериментального лечения кремом для местного применения имиквимодом (Алдара), агентом, повышающим иммунитет. Некоторые дерма-хирурги комбинируют два метода: хирургическое иссечение рака и последующую послеоперационную обработку этой области кремом Алдара в течение трех месяцев. Хотя некоторые исследования предполагают адъювантное применение тазаротена местно, имеющихся данных недостаточно, чтобы рекомендовать его, и предполагается, что он усиливает местное воспаление, что приводит к снижению комплаентности пациентов. [ 144 ]
Радиация
[ редактировать ]Лучевая терапия часто используется после хирургической резекции у пациентов с местно- или регионарно-распространенной меланомой или у пациентов с неоперабельными отдаленными метастазами. Для этих процедур часто используются рентгеновские лучи киловольтного напряжения, которые обладают свойством максимальной дозы облучения, возникающей вблизи поверхности кожи. [ 146 ] Это может снизить частоту местных рецидивов, но не продлевает выживаемость. [ 147 ] Радиоиммунотерапия метастатической меланомы в настоящее время находится в стадии изучения. Лучевая терапия играет роль в паллиативном лечении метастатической меланомы. [ 148 ]
Прогноз
[ редактировать ]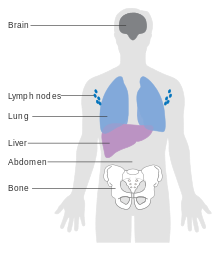
Факторы, влияющие на прогноз, включают:
- толщина опухоли в миллиметрах ( глубина Бреслоу ),
- глубина, связанная со структурами кожи ( уровень Кларка ),
- тип меланомы,
- наличие изъязвлений,
- наличие лимфатической/ периневральной инвазии ,
- наличие инфильтрирующих опухоль лимфоцитов (при их наличии прогноз лучше),
- место поражения,
- наличие сателлитных поражений и
- наличие регионарных или отдаленных метастазов . [ 149 ]
Определенные типы меланомы имеют худший прогноз, но это объясняется их толщиной . Менее инвазивные меланомы даже с метастазами в лимфатических узлах имеют лучший прогноз, чем глубокие меланомы без региональных метастазов на момент определения стадии. Локальные рецидивы, как правило, ведут себя так же, как и первичные, за исключением случаев, когда они находятся в месте широкого локального иссечения (в отличие от поэтапного иссечения или иссечения с ударом/бритьем), поскольку эти рецидивы, как правило, указывают на лимфатическую инвазию.
Когда меланома распространилась на лимфатические узлы , одним из наиболее важных факторов является количество злокачественных узлов. Также важна степень злокачественности внутри узла; микрометастазы , при которых злокачественность носит лишь микроскопический характер, имеют более благоприятный прогноз, чем макрометастазы. В некоторых случаях микрометастазы можно обнаружить только с помощью специального окрашивания, а если злокачественное новообразование можно обнаружить только с помощью редко используемого теста, известного как полимеразная цепная реакция (ПЦР), прогноз лучше. Макрометастазы, при которых злокачественность клинически очевидна (в некоторых случаях рак полностью замещает узел), имеют гораздо худший прогноз, а если узлы спутаны или имеют экстракапсулярное распространение, прогноз еще хуже. В дополнение к этим переменным для оценки прогноза меланомы можно использовать уровни экспрессии и вариации числа копий ряда соответствующих генов. [ 115 ] [ 116 ]
Меланома IV стадии, при которой она метастазирует, является наиболее опасным злокачественным новообразованием кожи: пятилетняя выживаемость составляет 22,5%. [ 133 ] При наличии отдаленных метастазов рак обычно считается неизлечимым. Пятилетняя выживаемость составляет менее 10%. [ 150 ] Медиана выживаемости составляет 6–12 месяцев. Лечение паллиативное , направленное на продление и качество жизни . В некоторых случаях пациенты с метастатической меланомой могут жить многие месяцы или даже годы (в зависимости от агрессивности лечения). Метастазы в кожу и легкие имеют лучший прогноз. Метастазы в головной мозг, кости и печень связаны с худшим прогнозом. Выживаемость выше при метастазах, при которых местоположение первичной опухоли неизвестно. [ 151 ]
Недостаточно точных данных, позволяющих адекватно определить стадию и, таким образом, дать прогноз для меланомы глаза и меланомы мягких частей или меланомы слизистых оболочек (например, меланомы прямой кишки), хотя они имеют тенденцию к более легкому метастазированию. Несмотря на то, что регрессия может увеличить выживаемость, когда меланома регрессировала, невозможно узнать ее первоначальный размер, и поэтому исходная опухоль часто хуже, чем может показаться в отчете о патологии .
Около 200 генов имеют прогностическое значение при меланоме: как неблагоприятные гены, высокая экспрессия которых коррелирует с плохой выживаемостью, так и благоприятные гены, где высокая экспрессия связана с более длительным временем выживания. Примерами неблагоприятных генов являются MCM6 и TIMELESS ; примером благоприятного гена является WIPI1 . [ 51 ] [ 52 ]
Повышенное соотношение нейтрофилов и лимфоцитов связано с худшими исходами. [ 152 ] [ 153 ] [ 154 ]
Эпидемиология
[ редактировать ]
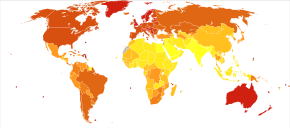
Во всем мире в 2012 году меланома возникла у 232 000 человек и привела к 55 000 смертей. [ 2 ] Австралия и Новая Зеландия имеют самые высокие показатели заболеваемости меланомой в мире. [ 2 ] За последние 20 лет он стал более распространенным в регионах, преимущественно кавказских . [ 2 ]
В последние годы заболеваемость меланомой возросла, но неясно, в какой степени это связано с изменениями в поведении, окружающей среде или раннем выявлении. [ 156 ]
Австралия
[ редактировать ]В Австралии очень высокий и постоянно растущий уровень заболеваемости меланомой. В 2012 году смертность от меланомы составила 7,3–9,8 на 100 000 населения. В Австралии меланома является третьим по распространенности раком у представителей обоих полов; действительно, заболеваемость им выше, чем раком легких , хотя на долю последнего приходится больше смертей. По оценкам, в 2012 году у более чем 12 000 австралийцев была диагностирована меланома: учитывая скромное население Австралии, это лучше выразить как 59,6 новых случаев на 100 000 населения в год; >1 из 10 всех новых случаев рака были меланомами. [ 157 ] Заболеваемость меланомой в Австралии имеет большое значение по следующим причинам:
- Заболеваемость меланомой в Австралии увеличилась более чем на 30 процентов в период с 1991 по 2009 год.
- Стандартизированные по возрасту показатели заболеваемости меланомой в Австралии по состоянию на 2008 год были как минимум в 12 раз выше, чем в среднем по миру.
- Заболеваемость меланомой в Австралии, с некоторым отрывом, является самой высокой в мире.
- Общая стандартизированная по возрасту заболеваемость раком в Австралии является самой высокой в мире, и это связано только с меланомой. Стандартизированная по возрасту общая заболеваемость раком аналогична новозеландской, но существует статистически значимая разница между Австралией и всеми другими частями развитого мира, включая Северную Америку, Западную Европу и Средиземноморье.
Соединенные Штаты
[ редактировать ]В США от меланомы умирают около 9000 человек в год. [ 159 ] В 2011 году оно затронуло 19,7 случаев на 100 000 человек и привело к смерти 2,7 случаев на 100 000 человек. [ 159 ]
В 2013 году:
- У 71 943 человек в США диагностирована меланома кожи, в том числе у 42 430 мужчин и 29 513 женщин.
- От меланомы кожи в США умерло 9394 человека, в том числе 6239 мужчин и 3155 женщин. [ 160 ]
По оценкам Американского онкологического общества заболеваемости меланомой в США на 2017 год:
- Будет диагностировано около 87 110 новых меланом (около 52 170 у мужчин и 34 940 у женщин).
- Ожидается, что от меланомы умрут около 9730 человек (около 6380 мужчин и 3350 женщин).
Меланома более чем в 20 раз чаще встречается у белых, чем у афроамериканцев. В целом риск развития меланомы в течение жизни составляет около 2,5% (1 из 40) для белых, 0,1% (1 из 1000) для афроамериканцев и 0,5% (1 из 200) для мексиканцев.
Риск меланомы увеличивается с возрастом. Средний возраст людей, когда диагностируется заболевание, составляет 63 года. [ 161 ]
История
[ редактировать ]Хотя меланома не является новым заболеванием, свидетельств ее возникновения в древности довольно мало. Однако одним из примеров является исследование девяти перуанских мумий, проведенное в 1960-х годах, радиоуглеродный возраст которых составил около 2400 лет, и которое выявило явные признаки меланомы: меланотические массы на коже и диффузные метастазы в костях. [ 162 ]
Сообщается, что Джон Хантер первым прооперировал метастатическую меланому в 1787 году. Хотя он и не знал точно, что это такое, он описал ее как «раковое грибковое разрастание». Вырезанная опухоль хранилась в Хантерианском музее Королевского колледжа хирургов Англии . Лишь в 1968 году микроскопическое исследование образца показало, что это пример метастатической меланомы. [ 163 ]
Французский врач Рене Лаэннек был первым, кто описал меланому как заболевание. Его отчет первоначально был представлен во время лекции на Парижском медицинском факультете в 1804 году, а затем опубликован в виде бюллетеня в 1806 году. [ 164 ]
Первое сообщение о меланоме на английском языке было представлено английским врачом общей практики из Стоурбриджа Уильямом Норрисом в 1820 году. [ 165 ] В своей более поздней работе в 1857 году он отметил, что существует семейная предрасположенность к развитию меланомы (« Восемь случаев меланоза с патологоанатомическими и терапевтическими замечаниями по поводу этого заболевания »). Норрис также был пионером, предположившим связь между невусами и меланомой и возможность связи между меланомой и воздействием окружающей среды, наблюдая, что у большинства его пациентов был бледный цвет лица. [ 166 ] Он также описал, что меланомы могут быть бесцветными, а позже показал метастатическую природу меланомы, наблюдая, что они могут распространяться на другие внутренние органы.
Первое официальное признание прогрессирующей меланомы неизлечимой было сделано Сэмюэлем Купером в 1840 году. Он заявил, что единственный шанс на излечение зависит от раннего устранения заболевания (т.е. раннего удаления злокачественной родинки)...» [ 167 ]
Спустя более полутора веков эта ситуация практически не изменилась.
Терминология
[ редактировать ]Слово «меланома» XIX века. пришло в английский язык из неолатыни [ 168 ] и использует комбинированные формы, происходящие от древнегреческих корней: мелано- (обозначающий меланин ) + -ома (обозначающий тканевую массу и особенно новообразование ), в свою очередь от греческого μέλας melas , «темный», [ 169 ] и -ωμα oma , «процесс». Слово «меланома» имеет долгую историю использования в более широком смысле для обозначения любой меланоцитарной опухоли , обычно, но не всегда злокачественной. [ 170 ] [ 171 ] но сегодня более узкий смысл, относящийся только к злокачественным типам, стал настолько доминирующим, что доброкачественные опухоли обычно больше не называют меланомами, и слово «меланома» теперь обычно означает злокачественную меланому, если не указано иное. Такие термины, как «доброкачественная меланоцитарная опухоль », однозначно обозначают доброкачественные типы, а современные гистопатологические классификации опухолей, используемые в медицине, не используют это слово для обозначения доброкачественных опухолей.
Исследовать
[ редактировать ]Исследования фармакотерапии неоперабельной или метастатической меланомы продолжаются. [ 172 ]
Таргетная терапия
[ редактировать ]В клинических исследованиях адоптивная клеточная терапия и генная терапия . проходят испытания [ 173 ]
Два вида экспериментального лечения, разработанные в Национальном институте рака (NCI), использовались при метастатической меланоме с предварительным успехом. [ 42 ]
Первый метод лечения включает адоптивную клеточную терапию (ACT) с использованием иммунных клеток TIL (проникающих в опухоль лимфоцитов), выделенных из собственной опухоли меланомы человека. [ 131 ] Эти клетки выращиваются в больших количествах в лаборатории и возвращаются пациенту после лечения, которое временно снижает количество нормальных Т-клеток в организме пациента. TIL-терапия после лимфодеплеции может привести к длительному полному ответу в различных условиях. [ 174 ] [ 175 ]
Второй метод лечения — адоптивный перенос генетически измененных аутологичных лимфоцитов — зависит от доставки генов, кодирующих так называемые Т-клеточные рецепторы (TCR), в лимфоциты пациента. [ 131 ] После этой манипуляции лимфоциты распознают и связываются с определенными молекулами, обнаруженными на поверхности клеток меланомы, и убивают их. [ 176 ]
против меланомы показала умеренную пользу. противораковая вакцина На поздней стадии испытаний в 2009 году [ 177 ] [ 178 ]
Ингибиторы BRAF
[ редактировать ]Около 60% меланом содержат мутацию гена B-Raf . Ранние клинические испытания показали, что ингибиторы B-Raf, включая вемурафениб компании Plexxicon, могут привести к существенной регрессии опухоли у большинства пациентов, если их опухоль содержит мутацию B-Raf. [ 179 ] В июне 2011 года крупное клиническое исследование подтвердило положительные результаты предыдущих исследований. [ 180 ] [ 181 ]
В августе 2011 года вемурафениб получил одобрение FDA для лечения меланомы поздней стадии. В мае 2013 года FDA США одобрило дабрафениб в качестве монотерапии для пациентов с распространенной меланомой с положительной мутацией BRAF V600E. [ 182 ]
Некоторые исследователи полагают, что комбинированная терапия, которая одновременно блокирует несколько путей, может повысить эффективность, затрудняя мутацию опухолевых клеток перед их уничтожением. В октябре 2012 года исследование показало, что сочетание дабрафениба с ингибитором MEK траметинибом привело к еще лучшим результатам. По сравнению с монотерапией дабрафенибом выживаемость без прогрессирования заболевания увеличилась до 41% с 9%, а медиана выживаемости без прогрессирования увеличилась до 9,4 месяцев против 5,8 месяцев. Однако в объединенном исследовании некоторые побочные эффекты были усилены. [ 183 ] [ 184 ]
В январе 2014 года FDA одобрило комбинацию дабрафениба и траметиниба для лечения людей с метастатической меланомой с мутацией BRAF V600E/K. [ 185 ] В июне 2018 года FDA одобрило комбинацию ингибитора BRAF энкорафениба и ингибитора MEK биниметиниба для лечения неоперабельной или метастатической меланомы с мутацией BRAF V600E или V600K. [ 186 ]
Возможная устойчивость к ингибиторам BRAF и MEK может быть связана с белком клеточной поверхности, известным как EphA2 , который сейчас исследуется. [ 187 ]
Ипилимумаб
[ редактировать ]На конференции Американского общества клинической онкологии в июне 2010 года фармацевтическая компания Bristol Myers Squibb сообщила о клинических результатах своего препарата ипилимумаба . Исследование выявило увеличение медианы выживаемости с 6,4 до 10 месяцев у пациентов с поздними стадиями меланомы, получавших моноклональный ипилимумаб, по сравнению с экспериментальной вакциной. Также было обнаружено, что годовая выживаемость составила 25% в контрольной группе, использующей вакцину, 44% в группе вакцины и ипилимумаба и 46% в группе, получавшей только ипилимумаб. [ 188 ] Однако некоторые выразили обеспокоенность по поводу этого исследования из-за использования нетрадиционной контрольной группы вместо сравнения препарата с плацебо или стандартным лечением. [ 189 ] [ 190 ] Критика заключалась в том, что, хотя ипилимумаб действовал лучше, чем вакцина, вакцина ранее не тестировалась и может вызывать токсичность, поэтому по сравнению с ней препарат выглядит лучше.
Ипилимумаб был одобрен FDA в марте 2011 года для лечения пациентов с меланомой поздней стадии, которая распространилась или не может быть удалена хирургическим путем. [ 191 ] [ 192 ] [ 193 ]
В июне 2011 года в ходе клинического испытания ипилимумаба плюс дакарбазина этот усилитель иммунной системы сочетался со стандартным химиотерапевтическим препаратом, воздействующим на деление клеток. Это показало увеличение медианы выживаемости для этих пациентов на поздней стадии до 11 месяцев вместо обычно наблюдаемых 9 месяцев. Исследователи также надеялись на улучшение пятилетней выживаемости, хотя у некоторых пациентов наблюдались серьезные побочные эффекты. Курс лечения стоит 120 тысяч долларов. Торговое название препарата – Ервой. [ 180 ] [ 194 ]
Методы наблюдения
[ редактировать ]Достижения в области ультразвукового сканирования с высоким разрешением позволили наблюдать за метастатической нагрузкой в сторожевых лимфатических узлах. [ 195 ] Исследование «Скрининг и наблюдение за ультразвуком при меланоме» (SUNMEL) оценивает ультразвук как альтернативу инвазивным хирургическим методам. [ 196 ]
Онколитическая виротерапия
[ редактировать ]В некоторых странах изучаются и применяются методы онколитической виротерапии для лечения меланомы. Онколитическая виротерапия — перспективное направление виротерапии , где онколитические вирусы для лечения заболеваний используются ; вирусы могут усиливать обмен веществ, снижать противоопухолевый иммунитет и дезорганизовать сосудистую систему. [ 197 ] В 2015 году было показано, что талимоген лагерпарепвек (T-VEC) (онколитическая иммунотерапия на основе вируса простого герпеса 1 типа) эффективен против метастатической меланомы с увеличением выживаемости на 4,4 месяца. [ 198 ] [ 12 ]
Противовирусные препараты
[ редактировать ]Антиретровирусные препараты были протестированы in vitro против меланомы. Обоснование этого заключается в их способности ингибировать эндогенные ретровирусы человека, активность которых связана с развитием меланомы. [ 199 ] [ 200 ] Результаты на злокачественных клетках показали умеренную эффективность, и ожидаются дальнейшие разработки путем тестирования на животных моделях.
Примечания
[ редактировать ]Ссылки
[ редактировать ]- ^ Перейти обратно: а б с д и ж г час я дж к л м «Лечение меланомы – для медицинских работников» . Национальный институт рака . 26 июня 2015 года. Архивировано из оригинала 4 июля 2015 года . Проверено 30 июня 2015 г.
- ^ Перейти обратно: а б с д и ж г час я дж к л м н тот п д р Мировой доклад о раке (PDF) . Всемирная организация здравоохранения. 2014. С. Глава 5.14. ISBN 978-92-832-0429-9 . Архивировано (PDF) из оригинала 30 мая 2014 г.
- ^ Гольдштейн Б.Г., Гольдштейн А.О. (апрель 2001 г.). «Диагностика и лечение злокачественной меланомы». Американский семейный врач . 63 (7): 1359–68, 1374. PMID 11310650 .
- ^ Перейти обратно: а б «Информационные бюллетени SEER: Меланома кожи» . НЦИ . Архивировано из оригинала 6 июля 2014 года.
- ^ Перейти обратно: а б Вос Т., Аллен С., Арора М., Барбер Р.М., Бхутта З.А., Браун А. и др. (Сотрудники ГББ по распространенности травматизма, 2015 г.) (октябрь 2016 г.). «Глобальная, региональная и национальная заболеваемость, распространенность и продолжительность жизни с инвалидностью по 310 заболеваниям и травмам, 1990-2015 гг.: систематический анализ для исследования глобального бремени болезней 2015 г.» . Ланцет . 388 (10053): 1545–1602. дои : 10.1016/S0140-6736(16)31678-6 . ПМК 5055577 . ПМИД 27733282 .
- ^ Перейти обратно: а б Ван Х., Нагави М., Аллен С., Барбер Р.М., Бхутта З.А., Картер А. и др. (GBD 2015 Смертность, причины смерти сотрудников) (октябрь 2016 г.). «Глобальная, региональная и национальная продолжительность жизни, смертность от всех причин и смертность от конкретных причин по 249 причинам смерти, 1980-2015 гг.: систематический анализ для исследования глобального бремени болезней 2015 г.» . Ланцет . 388 (10053): 1459–1544. дои : 10.1016/s0140-6736(16)31012-1 . ПМЦ 5388903 . ПМИД 27733281 .
- ^ Шварцман Р.М., Оркин М. (1962). Сравнительное исследование болезней собаки и человека . Спрингфилд, Иллинойс: Томас. п. 85.
Термин «меланома» в медицине человека обозначает злокачественный рост; приставка «злокачественный» является избыточной.
- ^ Бобонич М., Нолен М.Е. (2015). Дерматология для врачей передовой практики . Филадельфия: Уолтерс Клювер. п. 106.
Термин «злокачественная меланома» устаревает, поскольку слово «злокачественный» является излишним, поскольку доброкачественных меланом не существует.
- ^ Медицинский словарь партнера Farlex . 2012. Архивировано из оригинала 10 июня 2022 года . Проверено 4 марта 2021 г.
Избегайте избыточной фразы «злокачественная меланома».
- ^ Перейти обратно: а б Канави Х.Э., Герстенблит М.Р. (декабрь 2011 г.). «Ультрафиолетовое излучение и меланома». Семинары по кожной медицине и хирургии . 30 (4): 222–228. дои : 10.1016/j.sder.2011.08.003 . ПМИД 22123420 .
- ^ Перейти обратно: а б Азури СК, Ланге-младший (октябрь 2014 г.). «Эпидемиология, факторы риска, профилактика и раннее выявление меланомы». Хирургические клиники Северной Америки . 94 (5): 945–62, vii. дои : 10.1016/j.suc.2014.07.013 . ПМИД 25245960 .
- ^ Перейти обратно: а б Син Н.Л., Тенг М.В., Мок Т.С., Су Р.А. (декабрь 2017 г.). «De-novo и приобретенная устойчивость к нацеливанию на иммунные контрольные точки». «Ланцет». Онкология . 18 (12): е731–е741. дои : 10.1016/s1470-2045(17)30607-1 . ПМИД 29208439 .
- ^ «Визуализация данных USCS» . gis.cdc.gov . Архивировано из оригинала 17 марта 2020 года . Проверено 7 марта 2020 г.
Нужно выбрать «меланома»
- ^ «CDC – Каковы симптомы рака кожи?» . www.cdc.gov . 26 июня 2018 г. Архивировано из оригинала 7 декабря 2018 г. Проверено 1 февраля 2019 г.
- ^ Дэниел Дженсен Дж., Элевски Б.Е. (февраль 2015 г.). «Правило ABCDEF: объединение «правила ABCDE» и «знака гадкого утенка» в попытке улучшить самообследование пациентов» . Журнал клинической и эстетической дерматологии . 8 (2):15. ПМК 4345927 . ПМИД 25741397 .
- ^ «ЭФГ узловых меланом | MoleMap Новая Зеландия» . EFG узловых меланом | MoleMap Новая Зеландия . Архивировано из оригинала 2 февраля 2019 года . Проверено 1 февраля 2019 г.
- ^ Скрипач И.Дж. (октябрь 1995 г.). «Метастазы меланомы» . Контроль рака . 2 (5): 398–404. дои : 10.1177/107327489500200503 . ПМИД 10862180 .
- ^ Перейти обратно: а б с д и ж «Факторы риска меланомы» . Клиника Мэйо . Архивировано из оригинала 10 апреля 2017 года . Проверено 10 апреля 2017 г. .
- ^ Перейти обратно: а б Грин М.Х. (декабрь 1999 г.). «Генетика наследственной меланомы и невусов. Обновление 1998 года» . Рак . 86 (11 Приложение): 2464–2477. doi : 10.1002/(SICI)1097-0142(19991201)86:11+<2464::AID-CNCR3>3.0.CO;2-F . ПМИД 10630172 . S2CID 32817426 .
- ^ Перейти обратно: а б с Гойдос Дж.С., Шоен С.Л. (2016). «Акральная лентигинозная меланома». Меланома . Лечение и исследования рака. Том. 167. стр. 321–9. дои : 10.1007/978-3-319-22539-5_14 . ISBN 978-3-319-22538-8 . ПМИД 26601870 .
- ^ Перкинс А., Даффи Р.Л. (июнь 2015 г.). «Атипичные родинки: диагностика и лечение». Американский семейный врач . 91 (11): 762–767. ПМИД 26034853 .
- ^ Бониоль М., Отье П., Бойл П., Гандини С. (июль 2012 г.). «Меланома кожи, связанная с использованием солярия: систематический обзор и метаанализ» . БМЖ . 345 : е4757. дои : 10.1136/bmj.e4757 . ПМК 3404185 . ПМИД 22833605 .
- ^ Эль Гиссасси Ф., Баан Р., Стрейф К., Гросс И., Секретан Б., Бувар В. и др. (Рабочая группа по монографиям Международного агентства ВОЗ по исследованию рака) (август 2009 г.). «Обзор канцерогенов для человека — часть D: радиация» . «Ланцет». Онкология . 10 (8): 751–752. дои : 10.1016/S1470-2045(09)70213-X . ПМИД 19655431 .
- ^ Санлорензо М., Венер М.Р., Линос Э., Корнак Дж., Кайнц В., Пош С. и др. (январь 2015 г.). «Риск меланомы у пилотов и бортпроводников: метаанализ» . JAMA Дерматология . 151 (1): 51–58. дои : 10.1001/jamadermatol.2014.1077 . ПМЦ 4482339 . ПМИД 25188246 .
- ^ Рюнгер Т.М., Фарахваш Б., Хатвани З., Рис А. (январь 2012 г.). «Сравнение реакций на повреждение ДНК после эквимутагенных доз UVA и UVB: менее эффективная остановка клеточного цикла с помощью UVA может сделать пиримидиновые димеры, индуцированные UVA, более мутагенными, чем димеры, индуцированные UVA» . Фотохимические и фотобиологические науки . 11 (1): 207–215. дои : 10.1039/c1pp05232b . ПМИД 22005748 . S2CID 25209863 .
- ^ Ван С.К., Сетлоу Р., Бервик М., Польски Д., Мархуб А.А., Копф А.В. и др. (май 2001 г.). «Ультрафиолет А и меланома: обзор». Журнал Американской академии дерматологии . 44 (5): 837–846. дои : 10.1067/mjd.2001.114594 . ПМИД 11312434 . S2CID 7655216 .
- ^ Оливерия С.А., Сарайя М., Геллер А.С., Хенеган М.К., Йоргенсен С. (февраль 2006 г.). «Воздействие солнца и риск меланомы» . Архив болезней в детстве . 91 (2): 131–138. дои : 10.1136/adc.2005.086918 . ПМК 2082713 . ПМИД 16326797 .
- ^ Ли Дж. А., Стрикленд Д. (май 1980 г.). «Злокачественная меланома: социальный статус и работа на природе» . Британский журнал рака . 41 (5): 757–763. дои : 10.1038/bjc.1980.138 . ПМК 2010319 . ПМИД 7426301 .
- ^ Пион И.А., Ригель Д.С., Гарфинкель Л., Сильверман М.К., Копф А.В. (январь 1995 г.). «Профессия и риск злокачественной меланомы». Рак . 75 (2 приложения): 637–644. doi : 10.1002/1097-0142(19950115)75:2+<637::aid-cncr2820751404>3.0.co;2-# . ПМИД 7804988 . S2CID 196354681 .
- ^ «ВОЗ | Всемирная организация здравоохранения рекомендует лицам младше 18 лет не пользоваться солярием» . ВОЗ . Архивировано из оригинала 16 июня 2009 года.
- ^ Хлат М., Вейл А., Паркин М., Грин А. (май 1992 г.). «Смертность от меланомы у мигрантов в Австралию: вариации в зависимости от возраста на момент прибытия и продолжительности пребывания». Американский журнал эпидемиологии . 135 (10): 1103–1113. doi : 10.1093/oxfordjournals.aje.a116210 . ПМИД 1632422 .
- ^ «Можем ли мы заразиться раком кожи от соляриев?» . КурадермBCC . 1 сентября 2022 года. Архивировано из оригинала 3 сентября 2022 года . Проверено 3 сентября 2022 г.
- ^ Сура Э., Элиадес П.Дж., Шеннон К., Стратигос А.Дж., Цао Х. (март 2016 г.). «Наследственная меланома: обновленная информация о синдромах и лечении: генетика семейного синдрома атипичной меланомы множественных родинок» . Журнал Американской академии дерматологии . 74 (3): 395–407, викторина 408–410. дои : 10.1016/j.jaad.2015.08.038 . ПМК 4761105 . ПМИД 26892650 .
- ^ Халахми С., Гилкрест Б.А. (март 2001 г.). «Обновленная информация о генетических событиях в патогенезе меланомы». Современное мнение в онкологии . 13 (2): 129–136. дои : 10.1097/00001622-200103000-00008 . ПМИД 11224711 . S2CID 29876528 .
- ^ «Ингибитор циклинзависимой киназы CDKN2A 2А (меланома, p16, ингибирует CDK4)» . Национальная медицинская библиотека США. Архивировано из оригинала 17 ноября 2004 года . Проверено 4 сентября 2017 г.
- ^ Сура Э., Элиадес П.Дж., Шеннон К., Стратигос А.Дж., Цао Х. (март 2016 г.). «Наследственная меланома: обновленная информация о синдромах и лечении: генетика семейного синдрома атипичной меланомы множественных родинок» . Журнал Американской академии дерматологии . 74 (3): 395–407, викторина 408–10. дои : 10.1016/j.jaad.2015.08.038 . ПМК 4761105 . ПМИД 26892650 .
- ^ Фироз Э.Ф., Варыча М., Закшевски Дж., Полленс Д., Ван Г., Шапиро Р. и др. (апрель 2009 г.). «Ассоциация SNP309 MDM2, возраста начала и пола при меланоме кожи» . Клинические исследования рака . 15 (7): 2573–2580. дои : 10.1158/1078-0432.CCR-08-2678 . ПМЦ 3881546 . ПМИД 19318491 .
- ^ Блисс Дж.М., Форд Д., Свердлов А.Дж., Армстронг Б.К., Кристофолини М., Элвуд Дж.М. и др. (август 1995 г.). «Риск меланомы кожи, связанный с характеристиками пигментации и веснушками: систематический обзор 10 исследований случай-контроль. Международная группа анализа меланомы (IMAGE)». Международный журнал рака . 62 (4): 367–376. дои : 10.1002/ijc.2910620402 . ПМИД 7635560 . S2CID 9539601 .
- ^ Миллер AJ, Mihm MC (июль 2006 г.). «Меланома». Медицинский журнал Новой Англии . 355 (1): 51–65. дои : 10.1056/NEJMra052166 . ПМИД 16822996 .
- ^ Роудс А.Р., Вайнсток М.А., Фитцпатрик Т.Б., Михм М.К., Трезвый А.Дж. (декабрь 1987 г.). «Факторы риска меланомы кожи. Практический метод распознавания предрасположенных лиц». ДЖАМА . 258 (21): 3146–3154. дои : 10.1001/jama.258.21.3146 . ПМИД 3312689 .
- ^ Чиарлетта П., Форе Л., Бен Амар М. (март 2011 г.). «Фаза радиального роста злокачественной меланомы: многофазное моделирование, численное моделирование и анализ линейной стабильности» . Журнал Королевского общества, Интерфейс . 8 (56): 345–368. дои : 10.1098/rsif.2010.0285 . ПМК 3030817 . ПМИД 20656740 .
- ^ Перейти обратно: а б Гершковитц Л., Шахтер Дж., Тревес А.Дж., Бессер М.Дж. (2010). «Сосредоточьтесь на испытаниях по адоптивному переносу Т-клеток при меланоме» . Клиническая и развивающая иммунология . 2010 : 260267. дои : 10.1155/2010/260267 . ПМК 3018069 . ПМИД 21234353 .
- ^ Спатц А., Гимотти П.А., Кук М.Г., ван ден Оорд Дж.Дж., Десаи Н., Эггермонт А.М. и др. (2007). «Материалы ежегодного собрания ASCO, часть I. Краткое содержание: Защитный эффект оживленной опухоли, инфильтрирующей лимфоцитарный инфильтрат при меланоме: групповое исследование меланомы EORTC» . Журнал клинической онкологии . 25 (18S): 8519. doi : 10.1200/jco.2007.25.18_suppl.8519 . Архивировано из оригинала 25 июля 2011 года.
- ^ Дэвис М.А., Сэмюэлс Ю. (октябрь 2010 г.). «Анализ генома для персонализации терапии меланомы» . Онкоген . 29 (41): 5545–5555. дои : 10.1038/onc.2010.323 . ПМК 3169242 . ПМИД 20697348 .
- ^ Барретт Дж. К. (1991). «Мутагенез и канцерогенез» . В Брюгге Дж. , Карран Т. , Харлоу Э. , МакКормик Ф. (ред.). Происхождение рака человека . Пресса Колд-Спринг-Харбор. ISBN 0-87969-404-1 – через Интернет-архив.
- ^ Сейдж Э., Жирар П.М., Франческони С. (январь 2012 г.). «Разгадка мутагенеза, индуцированного UVA» . Фотохимические и фотобиологические науки . 11 (1): 74–80. дои : 10.1039/c1pp05219e . ПМИД 21901217 . S2CID 45189513 .
- ^ Бадден Т., Боуден Н.А. (январь 2013 г.). «Роль эксцизионной репарации измененных нуклеотидов и повреждения ДНК, вызванного ультрафиолетом B, в меланогенезе» . Международный журнал молекулярных наук . 14 (1): 1132–1151. дои : 10.3390/ijms14011132 . ПМЦ 3565312 . ПМИД 23303275 .
- ^ Бергер М.Ф., Ходис Э., Хеффернан Т.П., Дерибе Ю.Л., Лоуренс М.С., Протопопов А. и др. (май 2012 г.). «Секвенирование генома меланомы выявило частые мутации PREX2» . Природа . 485 (7399): 502–506. Бибкод : 2012Natur.485..502B . дои : 10.1038/nature11071 . ПМЦ 3367798 . ПМИД 22622578 .
- ^ Роуч Дж.К., Глусман Дж., Смит А.Ф., Хафф К.Д., Хабли Р., Шеннон П.Т. и др. (апрель 2010 г.). «Анализ генетического наследования в семейном квартете методом полногеномного секвенирования» . Наука . 328 (5978): 636–639. Бибкод : 2010Sci...328..636R . дои : 10.1126/science.1186802 . ПМК 3037280 . ПМИД 20220176 .
- ^ Кэмпбелл С.Д., Чонг Дж.С., Малиг М., Ко А., Дюмон Б.Л., Хан Л. и др. (ноябрь 2012 г.). «Оценка частоты мутаций человека с использованием аутозиготности в популяции основателей» . Природная генетика . 44 (11): 1277–1281. дои : 10.1038/ng.2418 . ПМЦ 3483378 . ПМИД 23001126 .
- ^ Перейти обратно: а б «Протеом патологии человека при меланоме - Атлас белков человека» . www.proteinatlas.org . Архивировано из оригинала 2 октября 2017 года . Проверено 2 октября 2017 г.
- ^ Перейти обратно: а б Улен М., Чжан С., Ли С., Сьёстедт Е., Фагерберг Л., Бидхори Г. и др. (август 2017 г.). «Атлас патологии транскриптома рака человека» . Наука . 357 (6352): eaan2507. дои : 10.1126/science.aan2507 . ПМИД 28818916 . S2CID 206659235 .
- ^ Эллротт К., Бэйли М.Х., Саксена Г., Ковингтон К.Р., Кандот С., Стюарт С. и др. (март 2018 г.). «Масштабируемый открытый научный подход к вызову мутаций экзомов опухолей с использованием нескольких геномных конвейеров» . Клеточные системы . 6 (3): 271–281.e7. дои : 10.1016/j.cels.2018.03.002 . ПМК 6075717 . ПМИД 29596782 .
- ^ Лесли MC, Бар-Эли М (январь 2005 г.). «Регуляция экспрессии генов при меланоме: новые подходы к лечению». Журнал клеточной биохимии . 94 (1): 25–38. дои : 10.1002/jcb.20296 . ПМИД 15523674 . S2CID 23515325 .
- ^ Бхумик А., Сингха Н., О'Коннелл М.Дж., Ронай З.А. (июнь 2008 г.). «Регуляция TIP60 с помощью ATF2 модулирует активацию ATM» . Журнал биологической химии . 283 (25): 17605–17614. дои : 10.1074/jbc.M802030200 . ПМЦ 2427333 . ПМИД 18397884 .
- ^ Бхумик А., Джонс Н., Ронай З. (март 2004 г.). «Переключение транскрипции путем активации пептида, производного транскрипционного фактора 2, повышает чувствительность клеток меланомы к апоптозу и ингибирует их онкогенность» . Труды Национальной академии наук Соединенных Штатов Америки . 101 (12): 4222–4227. Бибкод : 2004PNAS..101.4222B . дои : 10.1073/pnas.0400195101 . ПМЦ 384722 . ПМИД 15010535 .
- ^ Влахопулос С.А., Логотети С., Микас Д., Гиарика А., Горгулис В., Зумпурлис В. (апрель 2008 г.). «Роль АТФ-2 в онкогенезе». Биоэссе 30 (4): 314–327. дои : 10.1002/бис.20734 . ПМИД 18348191 . S2CID 678541 .
- ^ Хуан Ю, Мини Дж., Майлз С., Найлз Р.М. (февраль 2008 г.). «Ретиноевая кислота снижает фосфорилирование ATF-2 и повышает чувствительность клеток меланомы к таксол-опосредованному ингибированию роста» . Журнал молекулярной сигнализации . 3 :3. дои : 10.1186/1750-2187-3-3 . ПМК 2265711 . ПМИД 18269766 .
- ^ Пармиани Дж. (март 2016 г.). «Стволовые клетки рака меланомы: маркеры и функции» . Раки . 8 (3): 34. doi : 10.3390/cancers8030034 . ПМК 4810118 . ПМИД 26978405 .
- ^ Перейти обратно: а б Акбани Р., Акдемир К.С., Аксой Б.А., Альберт М., Элли А., Амин С.Б. и др. (Сеть атласов генома рака) (июнь 2015 г.). «Геномная классификация меланомы кожи» . Клетка . 161 (7): 1681–1696. дои : 10.1016/j.cell.2015.05.044 . ПМЦ 4580370 . ПМИД 26091043 .
- ^ Асьерто П.А., Кирквуд Дж.М., Гроб Дж.Дж., Симеоне Э., Гримальди А.М., Майо М. и др. (июль 2012 г.). «Роль мутации BRAF V600 в меланоме» . Журнал трансляционной медицины . 10 (1): 85. дои : 10.1186/1479-5876-10-85 . ПМК 3391993 . ПМИД 22554099 .
- ^ Боттон Т., Талевич Э., Мишра В.К., Чжан Т., Шайн А.Х., Берке Дж. и др. (октябрь 2019 г.). «Генетическая гетерогенность слитых киназ BRAF при меланоме влияет на реакцию на лекарства» . Отчеты по ячейкам . 29 (3): 573–588.e7. дои : 10.1016/j.celrep.2019.09.009 . ПМЦ 6939448 . ПМИД 31618628 .
- ^ МакЭвой Ч.Р., Сюй Х., Смит К., Этемадмогадам Д., Сан Леонг Х., Чунг Д.Ю. и др. (май 2019 г.). «Глубокая реакция ингибитора MEK при меланоме кожи, содержащей слияние GOLGA4-RAF1» . Журнал клинических исследований . 129 (5): 1940–1945. дои : 10.1172/JCI123089 . ПМК 6486352 . ПМИД 30835257 .
- ^ Виснер Т., Хе Дж., Еленский Р., Эстев-Пуч Р., Боттон Т., Йе И. и др. (май 2014 г.). «Слияния киназ часто встречаются в опухолях шпица и шпицоидных меланомах» . Природные коммуникации . 5 (1): 3116. Бибкод : 2014NatCo...5.3116W . дои : 10.1038/ncomms4116 . ПМК 4084638 . ПМИД 24445538 .
- ^ Йех И, Ти М.К., Боттон Т., Шейн А.Х., Спаратта А.Дж., Ганьон А. и др. (ноябрь 2016 г.). «Слияния киназы NTRK3 в опухолях Шпитца» . Журнал патологии . 240 (3): 282–290. дои : 10.1002/путь.4775 . ПМК 5071153 . ПМИД 27477320 .
- ^ Йех И, Боттон Т., Талевич Э., Шейн А.Х., Спаратта А.Дж., де ла Фушардьер А. и др. (май 2015 г.). «Активация перестроек киназы MET при меланоме и опухолях Шпица» . Природные коммуникации . 6 (1): 7174. Бибкод : 2015NatCo...6.7174Y . дои : 10.1038/ncomms8174 . ПМЦ 4446791 . ПМИД 26013381 .
- ^ Перейти обратно: а б Сарна М., Кшикавска-Серда М., Якубовска М., Задло А., Урбанска К. (июнь 2019 г.). «Присутствие меланина уникальным механическим способом подавляет распространение клеток меланомы у мышей» . Научные отчеты . 9 (1): 9280. Бибкод : 2019НатСР...9.9280С . дои : 10.1038/s41598-019-45643-9 . ПМК 6594928 . ПМИД 31243305 .
- ^ Перейти обратно: а б Вурм Э.М., Сойер Х.П. (октябрь 2010 г.). «Сканирование на меланому» . Австралийский врач . 33 : 150–55. дои : 10.18773/austprescr.2010.070 .
- ^ «Профилактика: азбука меланомы» . Американский фонд меланомы. Архивировано из оригинала 23 апреля 2003 года.
- ^ Фридман Р.Дж., Ригель Д.С., Копф А.В. (1985). «Раннее выявление злокачественной меланомы: роль врачебного осмотра и самообследования кожи» . КА . 35 (3): 130–151. дои : 10.3322/canjclin.35.3.130 . ПМИД 3921200 . S2CID 20787489 .
- ^ Диннес Дж., Дикс Дж.Дж., Грейндж М.Дж., Чучу Н., Ферранте ди Руффано Л., Матин Р.Н. и др. (декабрь 2018 г.). «Визуальный осмотр для диагностики меланомы кожи у взрослых» . Кокрановская база данных систематических обзоров . 2018 (12): CD013194. дои : 10.1002/14651858.CD013194 . ПМК 6492463 . ПМИД 30521684 .
- ^ Диннес Дж., Дикс Дж.Дж., Чучу Н., Ферранте ди Руффано Л., Матин Р.Н., Томсон Д.Р. и др. (декабрь 2018 г.). «Дерматоскопия с визуальным осмотром и без него для диагностики меланомы у взрослых» . Кокрановская база данных систематических обзоров . 2018 (12): CD011902. дои : 10.1002/14651858.CD011902.pub2 . ПМК 6517096 . ПМИД 30521682 .
- ^ Диннес Дж., Дикс Дж.Дж., Салех Д., Чучу Н., Бэйлисс С.Е., Патель Л. и др. (Кокрейновская скин-группа) (декабрь 2018 г.). «Отражательная конфокальная микроскопия для диагностики меланомы кожи у взрослых» . Кокрановская база данных систематических обзоров . 12 (12): CD013190. дои : 10.1002/14651858.CD013190 . ПМК 6492459 . ПМИД 30521681 .
- ^ Перейти обратно: а б Маскаро Дж. М., Маскаро Дж. М. (ноябрь 1998 г.). «Позиция дерматолога относительно невусов: видение варьируется от «гадкого утенка» до «красной шапочки» ». Архив дерматологии . 134 (11): 1484–1485. дои : 10.1001/archderm.134.11.1484 . ПМИД 9828892 .
- ^ Перейти обратно: а б «Введение в дерматоскопию» . ДермНет Новая Зеландия. Архивировано из оригинала 7 мая 2009 года.
- ^ Монтгомери Б.Д., Сэдлер ГМ (январь 2009 г.). «Пансионная биопсия пигментных поражений потенциально опасна» . Канадский семейный врач . 55 (1):24, ответ автора 24. PMC 2628830 . ПМИД 19155361 .
- ^ Люк П.П., Вилен Р., Крэйник О., Маккарти С.В., Томпсон Дж.Ф., Сколайер Р.А. (август 2015 г.). «Пансионная биопсия меланомы, вызывающая имплантацию опухолевых клеток: еще одна опасность использования частичной биопсии меланоцитарных опухолей». Австралазийский журнал дерматологии . 56 (3): 227–231. дои : 10.1111/ajd.12333 . ПМИД 25827527 . S2CID 2510803 .
- ^ Лин С.В., Кэй В., Гольдфарб Н., Равал А., Уоршоу Э. (июль 2012 г.). «Посев опухоли меланомы после пункционной биопсии». Дерматологическая хирургия . 38 (7, ч. 1): 1083–1085. дои : 10.1111/j.1524-4725.2012.02384.x . ПМИД 22471244 . S2CID 3431248 .
- ^ Мартин Р.К., Скоггинс С.Р., Росс М.И., Рейнтген Д.С., Нойес Р.Д., Эдвардс М.Дж. и др. (декабрь 2005 г.). «Вредна ли инцизионная биопсия меланомы?». Американский журнал хирургии . 190 (6): 913–917. дои : 10.1016/j.amjsurg.2005.08.020 . ПМИД 16307945 .
- ^ Ямашита Ю., Хашимото И., Абэ Ю., Сейке Т., Окава К., Сензаки Ю. и др. (март 2014 г.). «Влияние метода биопсии на выживаемость пациентов со злокачественной меланомой» . Архив пластической хирургии . 41 (2): 122–125. дои : 10.5999/aps.2014.41.2.122 . ПМЦ 3961608 . ПМИД 24665419 .
- ^ Mills SE (март 2002 г.). «Нейроэктодермальные новообразования головы и шеи с акцентом на нейроэндокринные карциномы» . Современная патология . 15 (3): 264–278. doi : 10.1038/modpathol.3880522 . ПМИД 11904342 . S2CID 34498802 .
- ^ Перейти обратно: а б Ферри Ф (2019). «Меланома» . Клинический консультант Ферри 2019: 5 книг в 1 . Филадельфия, Пенсильвания: Эльзевир. п. 805. ИСБН 978-0-323-52957-0 . OCLC 1040695302 . Архивировано из оригинала 4 августа 2020 года.
- ^ Сюн М., Чарифа А., Чен К.С. (2020). «Злокачественная меланома Лентиго». Рак, лентиго, злокачественная меланома . СтатПерлз. ПМИД 29489150 . Архивировано из оригинала 8 марта 2021 года . Проверено 13 февраля 2020 г. - через Национальный центр биотехнологической информации. Последнее обновление: 18 мая 2019 г.
- ^ Пилианг MP (сентябрь 2009 г.). «Акральная лентигинозная меланома». Клиники хирургической патологии . 2 (3): 535–541. дои : 10.1016/j.path.2009.08.005 . ПМИД 26838538 .
- ^ Маккенна Дж.К., Флорелл С.Р., Голдман Г.Д., Боуэн Г.М. (апрель 2006 г.). «Злокачественное лентиго/меланома лентиго злокачественное: современное состояние диагностики и лечения». Дерматологическая хирургия . 32 (4): 493–504. дои : 10.1111/j.1524-4725.2006.32102.x . ПМИД 16681656 . S2CID 8312676 .
- ^ «Предраковые состояния кожи» . Канадское онкологическое общество . Архивировано из оригинала 3 августа 2020 года . Проверено 26 февраля 2020 г.
- ^ Флеминг С. (2010). «Как вести пациентов со злокачественным лентиго». Исследования меланомы . 20 : е26. дои : 10.1097/01.cmr.0000382797.99333.66 . ISSN 0960-8931 . S2CID 71464540 .
- ^ Хейл CS. «Меланоцитарная опухоль кожи – Меланома – Меланома in situ» . Очертания патологии . Архивировано из оригинала 26 февраля 2020 года . Проверено 26 февраля 2020 г. Тема завершена: 1 мая 2013 г. Отредактирована: 23 мая 2019 г.
- ^ Пак Х.С., Чо К.Х. (апрель 2010 г.). «Акральная лентигинозная меланома in situ: проблема диагностики и лечения» . Раки . 2 (2): 642–652. дои : 10.3390/cancers2020642 . ПМЦ 3835096 . ПМИД 24281086 .
- ^ Вес РМ, Виатор Дж.А., Дейл П.С., Колдуэлл К.В., Лайл А.Е. (октябрь 2006 г.). «Фотоакустическое обнаружение метастатических клеток меланомы в системе кровообращения человека». Оптические письма . 31 (20): 2998–3000. Бибкод : 2006OptL...31.2998W . дои : 10.1364/OL.31.002998 . ПМИД 17001379 .
- ^ Диннес Дж., Ферранте ди Руффано Л., Таквоинги И., Чунг С.Т., Натан П., Матин Р.Н. и др. (Кокрейновская скин-группа) (июль 2019 г.). «УЗИ, КТ, МРТ или ПЭТ-КТ для определения и повторного определения стадии у взрослых с меланомой кожи» . Кокрановская база данных систематических обзоров . 2019 (7): CD012806. дои : 10.1002/14651858.CD012806.pub2 . ПМК 6601698 . ПМИД 31260100 .
- ^ Перейти обратно: а б с д и Гершенвальд Дж.Э., Скольер Р.А., Хесс К.Р., Сондак В.К., Лонг Г.В., Росс М.И. и др. (ноябрь 2017 г.). «Стадирование меланомы: научно обоснованные изменения в восьмом издании руководства по стадированию рака Американского объединенного комитета по раку» . КА . 67 (6): 472–492. дои : 10.3322/caac.21409 . ПМЦ 5978683 . ПМИД 29028110 . , цитируя
Амин М.Б., Эдж С.Б., Грин Ф.Л. и др., ред. Руководство AJCC по стадированию рака. 8-е изд. Нью-Йорк: Международное издательство Springer; 2017:563-585). - ^ Йоханссон М., Бродерсен Дж., Гётше П.С., Йоргенсен К.Дж. и др. (Кокрейновская скин-группа) (июнь 2019 г.). «Скрининг для снижения заболеваемости и смертности при злокачественной меланоме» . Кокрановская база данных систематических обзоров . 2019 (6): CD012352. дои : 10.1002/14651858.CD012352.pub2 . ПМК 6545529 . ПМИД 31157404 .
- ^ Отье П. (октябрь 2005 г.). «Злокачественная меланома кожи: факты о соляриях и солнцезащитном креме». Экспертный обзор противораковой терапии . 5 (5): 821–833. дои : 10.1586/14737140.5.5.821 . ПМИД 16221052 . S2CID 6091309 .
- ^ Клаф-Горр К.М., Титус-Эрнстофф Л., Перри А.Е., Спенсер С.К., Эрнстофф М.С. (сентябрь 2008 г.). «Воздействие солнечных ламп, соляриев и риск развития меланомы» . Причины рака и борьба с ним . 19 (7): 659–669. дои : 10.1007/s10552-008-9129-6 . ПМК 6367654 . ПМИД 18273687 .
- ^ Перейти обратно: а б Шихаб Н., Лим Х.В. (ноябрь 2018 г.). «Потенциальный кожный канцерогенный риск воздействия УФ-лампы для ногтей: обзор» . Фотодерматология, фотоиммунология и фотомедицина . 34 (6): 362–365. дои : 10.1111/phpp.12398 . ПМИД 29882991 . S2CID 46958616 .
- ^ Перейти обратно: а б О'Салливан Н.А., Тейт С.П. (май 2014 г.). «Использование солярия и лампы для ногтей и риск злокачественных новообразований кожи: обзор литературы». Австралазийский журнал дерматологии . 55 (2): 99–106. дои : 10.1111/ajd.12145 . ПМИД 24592921 . S2CID 206984768 .
- ^ Грейнерт Р., де Врис Э., Эрдманн Ф., Эспина С., Овинен А., Кесминиен А. и др. (декабрь 2015 г.). «Европейский кодекс борьбы с раком, 4-е издание: Ультрафиолетовое излучение и рак» . Эпидемиология рака . 39 (Приложение 1): S75–S83. дои : 10.1016/j.canep.2014.12.014 . hdl : 1765/86460 . ПМИД 26096748 .
- ^ «Можно ли предотвратить меланому?» . Архивировано из оригинала 27 июня 2006 года.
- ^ Бернетт М.Э., Ван SQ (апрель 2011 г.). «Текущие споры о солнцезащитных кремах: критический обзор». Фотодерматология, фотоиммунология и фотомедицина . 27 (2): 58–67. дои : 10.1111/j.1600-0781.2011.00557.x . ПМИД 21392107 . S2CID 29173997 .
- ^ Планта МБ (1 ноября 2011 г.). «Солнцезащитный крем и меланома: верна ли наша профилактика?» . Журнал Американского совета семейной медицины . 24 (6): 735–739. дои : 10.3122/jabfm.2011.06.100178 . ПМИД 22086817 . S2CID 1477485 .
- ^ Деллавалль Р.П., Дрейк А., Грабер М., Хейлиг Л.Ф., Хестер Э.Дж., Джонсон К.Р. и др. (октябрь 2005 г.). «Статины и фибраты для профилактики меланомы» . Кокрановская база данных систематических обзоров . 2014 (4): CD003697. дои : 10.1002/14651858.CD003697.pub2 . ПМЦ 11102950 . ПМИД 16235336 . Архивировано из оригинала 4 июля 2018 года . Проверено 3 июля 2018 г.
- ^ Фриман С.Р., Дрейк А.Л., Хейлиг Л.Ф., Грабер М., МакНили К., Шиллинг Л.М. и др. (ноябрь 2006 г.). «Статины, фибраты и риск меланомы: систематический обзор и метаанализ» . Журнал Национального института рака . 98 (21): 1538–1546. дои : 10.1093/jnci/djj412 . ПМИД 17077356 .
- ^ «Процедура биопсии сторожевого узла при меланоме не дает преимущества в выживании» . Злокачественная меланома. 8 января 2008 г. Архивировано из оригинала 11 июля 2012 г. Проверено 13 августа 2012 г.
- ^ Киргидис А., Целлос Т., Моселлин С., Апалла З., Лаллас А., Пилати П. и др. (май 2015 г.). «Биопсия сигнального лимфатического узла с последующей лимфаденэктомией при локализованной первичной меланоме кожи» . Кокрановская база данных систематических обзоров . 2015 (5): CD010307. дои : 10.1002/14651858.CD010307.pub2 . ПМК 6461196 . ПМИД 25978975 .
- ^ Кларк Г.С., Паппас-Политис ЕС, Черпелис Б.С., Мессина Дж.Л., Мёллер М.Г., Круз К.В. и др. (июль 2008 г.). «Хирургическое лечение меланомы in situ на коже, хронически поврежденной солнцем» . Контроль рака . 15 (3): 216–224. дои : 10.1177/107327480801500304 . ПМИД 18596673 .
- ^ Балч CM, Урист MM, Каракусис CP, Смит TJ, Темпл WJ, Джевецкий К. и др. (сентябрь 1993 г.). «Эффективность хирургических полей шириной 2 см при меланомах средней толщины (от 1 до 4 мм). Результаты многоинституционального рандомизированного хирургического исследования» . Анналы хирургии . 218 (3): 262–7, обсуждение 267–9. дои : 10.1097/00000658-199309000-00005 . ПМЦ 1242959 . ПМИД 8373269 .
- ^ Сладден М.Дж., Балч С., Барзилай Д.А., Берг Д., Фрейман А., Хандисайд Т. и др. (октябрь 2009 г.). «Хирургические края иссечения первичной меланомы кожи». Кокрановская база данных систематических обзоров . 129 (4): CD004835. дои : 10.1002/14651858.CD004835.pub2 . ПМИД 19821334 .
- ^ Перейти обратно: а б Моос Ф.Е., Михаил Г.Р. (январь 1991 г.). Микрографическая хирургия по Моосу . УБ Сондерс. стр. 13–14. ISBN 978-0-7216-3415-9 . Архивировано из оригинала 7 января 2016 года.
- ^ Перейти обратно: а б Бене Н.И., Хили С., Колдирон Б.М. (май 2008 г.). «Микрографическая хирургия Мооса точна в 95,1% случаев при меланоме in situ: проспективное исследование 167 случаев». Дерматологическая хирургия . 34 (5): 660–664. дои : 10.1111/j.1524-4725.2007.34124.x . ПМИД 18261099 . S2CID 23386371 .
процент излечения достигает 98% для небольшой меланомы in situ и достигает 95% для злокачественного лентиго варианта меланоны in situ Сообщается, что после операции Мооса .
- ^ «Исследование скрининга и наблюдения за ультразвуком при меланоме (SUNMEL)» . Архивировано из оригинала 6 января 2009 года.
- ^ Кроусон А.Н., Хаскелл Х. (октябрь 2013 г.). «Роль биопсии сторожевого лимфатического узла в лечении меланомы кожи». Giornale Italiano di Dermatologia e Venereologia . 148 (5): 493–499. ПМИД 24005142 .
- ^ Росс М.И., Гершенвальд Дж.Э. (май – июнь 2013 г.). «Биопсия сигнальных лимфатических узлов при меланоме: важные новости для дерматологов после двух десятилетий опыта». Клиники по дерматологии . 31 (3): 298–310. doi : 10.1016/j.clindermatol.2012.08.004 . ПМИД 23608449 .
- ^ Перейти обратно: а б с д Американская академия дерматологии (февраль 2013 г.), «Пять вопросов, которые должны задать врачи и пациенты» , «Выбирая мудро : инициатива Фонда ABIM» , Американская академия дерматологии , заархивировано из оригинала 1 декабря 2013 г. , получено 5 декабря 2013 г. , в котором цитируются :
- Бичакджян К.К., Халперн А.С., Джонсон Т.М., Фут Худ А., Гричник Дж.М., Светтер С.М. и др. (Американская академия дерматологии) (ноябрь 2011 г.). «Руководство по лечению первичной меланомы кожи. Американская академия дерматологии» . Журнал Американской академии дерматологии . 65 (5): 1032–1047. дои : 10.1016/j.jaad.2011.04.031 . hdl : 20.500.12749/1682 . ПМИД 21868127 .
- Американский объединенный комитет по раку (2010). Край С.Б. (ред.). Руководство AJCC по стадированию рака (7-е изд.). Спрингер. ISBN 978-0-387-88440-0 .
- Национальная комплексная онкологическая сеть (2012 г.), Рекомендации по клинической практике Национальной комплексной онкологической сети в онкологии (Руководства NCCN): меланома (PDF) , Форт Вашингтон, Пенсильвания : Национальная комплексная онкологическая сеть, заархивировано из оригинала (PDF) 28 декабря 2013 г. , получено 5 декабря 2013 г.

- ^ Перейти обратно: а б ван Кемпен Л.К., Редпат М., Роберт С., Спатц А. (ноябрь 2014 г.). «Молекулярная патология меланомы кожи» . Лечение меланомы . 1 (2): 151–164. дои : 10.2217/ммт.14.23 . ПМК 6094595 . ПМИД 30190820 .
- ^ Перейти обратно: а б Бруннер Г., Райц М., Хайнеке А., Липпольд А., Беркинг С., Сутер Л. и др. (февраль 2013 г.). «Сигнатура девяти генов, предсказывающая клинический исход меланомы кожи». Журнал исследований рака и клинической онкологии . 139 (2): 249–258. дои : 10.1007/s00432-012-1322-z . ПМИД 23052696 . S2CID 20257709 .
- ^ Суонсон Н.А., Ли К.К., Горман А., Ли Х.Н. (октябрь 2002 г.). «Методы биопсии. Диагностика меланомы». Дерматологические клиники . 20 (4): 677–680. дои : 10.1016/S0733-8635(02)00025-6 . ПМИД 12380054 .
- ^ Томас Д., Белло Д.М. (март 2021 г.). «Адъювантная иммунотерапия меланомы» . Журнал хирургической онкологии . 123 (3): 789–797. дои : 10.1002/jso.26329 . ISSN 0022-4790 . ПМИД 33595889 . S2CID 231943836 .
- ^ Кирквуд Дж.М., Стродерман М.Х., Эрнстофф М.С., Смит Т.Дж., Борден Э.К., Блюм Р.Х. (январь 1996 г.). «Адъювантная терапия интерфероном альфа-2b при резецированной меланоме кожи высокого риска: исследование EST 1684 Восточной кооперативной онкологической группы». Журнал клинической онкологии . 14 (1): 7–17. дои : 10.1200/JCO.1996.14.1.7 . ПМИД 8558223 . S2CID 24020903 .
- ^ Моселлин С., Ленс М.Б., Паскуали С., Пилати П., Киарион Силени В. (июнь 2013 г.). «Интерферон альфа для адъювантного лечения меланомы кожи» . Кокрановская база данных систематических обзоров . 2013 (6): CD008955. дои : 10.1002/14651858.CD008955.pub2 . ПМЦ 10773707 . ПМИД 23775773 . Архивировано из оригинала 12 июня 2018 года . Проверено 11 июня 2018 г.
- ^ Уитли К., Айвс Н., Эггермонт А., Кирквуд Дж., Касчинелли Н., Маркович С.Н. и др. (2007). «Интерферон-α как адъювантная терапия меланомы: индивидуальный метаанализ рандомизированных исследований пациентов». Дж. Клин Онкол . 25 (18 дополнений): 8526. doi : 10.1200/jco.2007.25.18_suppl.8526 .
- ^ Кирквуд Дж.М., Ибрагим Дж.Г., Сондак В.К., Ричардс Дж., Флаэрти Л.Е., Эрнстофф М.С. и др. (июнь 2000 г.). «Высокие и низкие дозы интерферона альфа-2b при меланоме высокого риска: первый анализ межгруппового исследования E1690/S9111/C9190». Журнал клинической онкологии . 18 (12): 2444–2458. дои : 10.1200/JCO.2000.18.12.2444 . ПМИД 10856105 .
- ^ Кирквуд Дж. М., Ибрагим Дж. Г., Сондак В. К., Эрнстофф М. С., Росс М. (март 2002 г.). «Интерферон альфа-2а при метастазах меланомы». Ланцет . 359 (9310): 978–979. дои : 10.1016/S0140-6736(02)08001-7 . ПМИД 11918944 . S2CID 33866115 .
- ^ Перейти обратно: а б с д и ж г час я дж к л м Паскуали С., Хаджиниколау А.В., Киарион Силени В., Росси Ч.Р., Моселлин С. (февраль 2018 г.). «Системное лечение метастатической меланомы кожи» . Кокрановская база данных систематических обзоров . 2 (2): CD011123. дои : 10.1002/14651858.CD011123.pub2 . ПМК 6491081 . ПМИД 29405038 .
- ^ Райден В., Эль-Наггар А.И., Колиади А., Ладжеварди К.О., Дигкас Е., Валачис А. и др. (29 декабря 2023 г.). «Роль терапии дакарбазином и темозоломидом после лечения ингибиторами иммунных контрольных точек у пациентов со злокачественной меланомой: серия случаев и метаанализ» . Исследование пигментных клеток и меланомы . 37 (3): 352–362. дои : 10.1111/pcmr.13156 . ISSN 1755-1471 . ПМИД 38158376 .
- ^ Гарбе С., Терхейден П., Кейлхольц Ю., Кёльбл О., Хаушильд А. (5 декабря 2008 г.). «Лечение меланомы» . Немецкий международный медицинский журнал . 105 (49): 845–851. дои : 10.3238/arztebl.2008.0845 . ISSN 1866-0452 . ПМЦ 2689638 . ПМИД 19561811 .
- ^ О'Донохью С., Перес М.К., Маллинакс Дж.Э., Хардман Д., Силено С., Накви С.М. и др. (декабрь 2017 г.). «Изолированная инфузия конечностей: опыт одного центра с более чем 200 инфузиями» . Анналы хирургической онкологии . 24 (13): 3842–3849. дои : 10.1245/s10434-017-6107-9 . ПМЦ 7771340 . ПМИД 29019175 . S2CID 28907006 .
- ^ Джайлз М.Х., Ковентри Б.Дж. (август 2013 г.). «Изолированная инфузионная химиотерапия меланомы конечностей: обзор раннего опыта отделения меланомы Аделаиды» . Управление раком и исследования . 5 : 243–249. дои : 10.2147/cmar.s45746 . ПМЦ 3753062 . ПМИД 23990731 .
- ^ Бергер М., Рихтиг Г., Кашофер К., Айгельсрайтер А., Рихтиг Э. (июнь 2018 г.). «Окно возможностей таргетной терапии меланомы BRAFwt/NRASwt/KITwt: биология и клиническое значение слитых белков и других мутаций». Giornale Italiano di Dermatologia e Venereologia . 153 (3): 349–360. дои : 10.23736/S0392-0488.18.05970-9 . ПМИД 29600692 .
- ^ Бруссард Л., Хоуленд А., Рю С., Сонг К., Норрис Д., Армстронг К.А. и др. (сентябрь 2018 г.). «Механизмы гибели клеток меланомы» . Медицинский журнал Чоннам . 54 (3): 135–142. дои : 10.4068/cmj.2018.54.3.135 . ПМК 6165917 . ПМИД 30288368 .
- ^ Перейти обратно: а б с д Маверакис Э., Корнелиус Л.А., Боуэн Г.М., Фан Т., Патель Ф.Б., Фицморис С. и др. (май 2015 г.). «Метастатическая меланома – обзор текущих и будущих вариантов лечения» . Acta Dermato-Venereologica . 95 (5): 516–524. дои : 10.2340/00015555-2035 . ПМИД 25520039 .
- ^ Куске М., Вестфаль Д., Венер Р., Шмитц М., Бейссерт С., Преториус С. и др. (октябрь 2018 г.). «Иммуномодулирующие эффекты ингибиторов BRAF и MEK: значение для терапии меланомы» . Фармакологические исследования . 136 : 151–159. дои : 10.1016/J.phrs.2018.08.019 . ПМИД 30145328 . S2CID 207369519 .
- ^ Перейти обратно: а б с Ребекка Ф.В., Херлин М. (2020). «Негенетические механизмы лекарственной устойчивости меланомы» . Ежегодный обзор биологии рака . 4 : 315–330. doi : 10.1146/annurev-cancerbio-030419-033533 .
- ^ «FDA одобрило первую клеточную терапию для лечения пациентов с неоперабельной или метастатической меланомой» . США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (пресс-релиз). 16 февраля 2024 г. Проверено 18 февраля 2024 г.
- ^ «Амтагви (лифилеуцел) компании Iovance получает ускоренное одобрение FDA США для лечения прогрессирующей меланомы» (пресс-релиз). Iovance Biotherapeutics Inc., 16 февраля 2024 г. Проверено 18 февраля 2024 г. - через GlobeNewswire.
- ^ Перейти обратно: а б с Санлорензо М., Вуич И., Пош С., Даджи А., Йен А., Ким С. и др. (июнь 2014 г.). «Иммунотерапия меланомы» . Биология и терапия рака . 15 (6): 665–674. дои : 10.4161/cbt.28555 . ПМК 4049781 . ПМИД 24651672 .
- ^ Драницарис Г., Чжу X, Адунлин Г., Винсент, доктор медицинских наук (август 2018 г.). «Экономичность и доступность в эпоху иммуноонкологических лекарств от рака». Экспертный обзор фармакоэкономических исследований и результатов исследований . 18 (4): 351–357. дои : 10.1080/14737167.2018.1467270 . ПМИД 29681201 . S2CID 5079628 .
- ^ Перейти обратно: а б с д Вест HJ (апрель 2015 г.). «Страница онкологического пациента JAMA. Ингибиторы иммунных контрольных точек» . JAMA Онкология . 1 (1): 115. doi : 10.1001/jamaoncol.2015.0137 . ПМИД 26182315 .
- ^ «Интерлейкин-2 (IL2) при метастатической меланоме» . Альянс исследований меланомы . Проверено 5 октября 2022 г.
- ^ Бузаид AC (октябрь 2004 г.). «Лечение метастатической меланомы кожи». Онкология . 18 (11): 1443–50, обсуждение 1457–9. ПМИД 15609471 .
- ^ Розенберг С.А., Рестифо НП (апрель 2015 г.). «Перенос адоптивных клеток как персонализированная иммунотерапия рака человека» . Наука . 348 (6230): 62–68. Бибкод : 2015Sci...348...62R . дои : 10.1126/science.aaa4967 . ПМК 6295668 . ПМИД 25838374 .
- ^ Цзан Ю.В., Гу С.Д., Сян Дж.Б., Чэнь З.И. (июнь 2014 г.). «Клиническое применение адоптивной Т-клеточной терапии при солидных опухолях» . Монитор медицинских наук . 20 : 953–959. дои : 10.12659/msm.890496 . ПМК 4063985 . ПМИД 24912947 .
- ^ «Управление по контролю за продуктами и лекарствами США одобрило первую комбинацию антител, блокирующих LAG-3, опдуалаг (ниволумаб и релатлимаб-rmbw) для лечения пациентов с неоперабельной или метастатической меланомой» (пресс-релиз). Бристоль Майерс Сквибб . 18 марта 2022 года. Архивировано из оригинала 19 марта 2022 года . Проверено 19 марта 2022 г. - через Business Wire.
- ^ Перейти обратно: а б Целлос Т., Киргидис А., Моселлин С., Чан А.В., Пилати П., Апалла З. (декабрь 2014 г.). «Вмешательства при меланоме in situ, включая злокачественное лентиго» . Кокрановская база данных систематических обзоров . 2016 (12): CD010308. дои : 10.1002/14651858.CD010308.pub2 . ПМЦ 11005944 . ПМИД 25526608 .
- ^ Джонсон Т.М., Хедингтон Дж.Т., Бейкер С.Р., Лоу Л. (ноябрь 1997 г.). «Полезность поэтапного иссечения злокачественного лентиго и меланомы злокачественного лентиго: «квадратная» процедура». Журнал Американской академии дерматологии . 37 (5, часть 1): 758–764. дои : 10.1016/S0190-9622(97)70114-2 . ПМИД 9366823 .
- ^ Хилл Р., Хили Б., Холлоуэй Л., Кунчич З., Туэйтс Д., Бэлдок С. (март 2014 г.). «Достижения в области киловольтной рентгеновской дозиметрии». Физика в медицине и биологии . 59 (6): Р183–Р231. Бибкод : 2014PMB....59R.183H . дои : 10.1088/0031-9155/59/6/r183 . ПМИД 24584183 . S2CID 18082594 .
- ^ Бастианнет Э., Беукема Х.К., Хоекстра Х.Дж. (февраль 2005 г.). «Лучевая терапия после диссекции лимфатических узлов у больных меланомой: лечение, исходы и осложнения». Обзоры лечения рака . 31 (1): 18–26. дои : 10.1016/j.ctrv.2004.09.005 . ПМИД 15707701 .
- ^ Форд М.Б., Митчелл М.Ф., Бойер К.Л., Форд М.Б., Джадкинс А.Ф., Левин Б. (1999). «Эпидемиология рака». Первичная онкология . стр. 1–27.
- ^ Хомси Дж., Кашани-Сабет М., Мессина Дж.Л., Дауд А. (октябрь 2005 г.). «Меланома кожи: прогностические факторы» . Контроль рака . 12 (4): 223–229. дои : 10.1177/107327480501200403 . ПМИД 16258493 .
- ^ Балч CM, Бузаид AC, Сунг С.Дж., Аткинс М.Б., Касчинелли Н., Койт Д.Г. и др. (август 2001 г.). «Окончательная версия системы стадирования меланомы кожи Американского объединенного комитета по раку» . Журнал клинической онкологии . 19 (16): 3635–3648. CiteSeerX 10.1.1.475.6560 . дои : 10.1200/JCO.2001.19.16.3635 . ПМИД 11504745 . Архивировано из оригинала 5 марта 2006 года . Проверено 31 июля 2006 г.
- ^ Пэ Дж.М., Чхве Ю.И., Ким Д.С., Ли Дж.Х., Чан Х.С., Ли Дж.Х. и др. (январь 2015 г.). «Метастатические меланомы неизвестной первичной имеют лучший прогноз, чем меланомы известной первичной: систематический обзор и метаанализ наблюдательных исследований». Журнал Американской академии дерматологии . 72 (1): 59–70. дои : 10.1016/j.jaad.2014.09.029 . ПМИД 25440435 .
- ^ Чжан Х, Ма Цзюй, Цзянь, королевский адвокат (сентябрь 2018 г.). «Прогностическое значение соотношения нейтрофилов и лимфоцитов перед лечением у пациентов с меланомой: метаанализ». Клиника Химика Акта; Международный журнал клинической химии . 484 : 136–140. дои : 10.1016/j.cca.2018.05.055 . ПМИД 29856976 . S2CID 44155588 .
- ^ Уэйд Р.Г., Робинсон А.В., Ло М.К., Кибл С., Марплс М., Дьюар Дж. и др. (октябрь 2018 г.). «Исходное соотношение нейтрофил-лимфоцитов и тромбоцитов-лимфоцитов как биомаркеры выживания при кожной меланоме: многоцентровое когортное исследование» . Анналы хирургической онкологии . 25 (11): 3341–3349. дои : 10.1245/s10434-018-6660-x . ПМК 6132419 . ПМИД 30066226 .
- ^ Робинсон А.В., Кибл С., Ло М.К., Торнтон О., Пич Х., Монкрифф М.Д. и др. (апрель 2020 г.). «Соотношение нейтрофилов и лимфоцитов и локорегиональная меланома: многоцентровое когортное исследование» . Иммунология рака, иммунотерапия . 69 (4): 559–568. дои : 10.1007/s00262-019-02478-7 . ПМЦ 7113207 . ПМИД 31974724 .
- ^ «РАКМондиаль (ГЛОБОКАН)» . ГЛОБОКАН . 2010. Архивировано из оригинала 17 февраля 2012 года . Проверено 12 августа 2010 г.
- ^ Бервик М., Виггинс С. (май 2006 г.). «Современная эпидемиология злокачественной меланомы кожи» . Границы бионауки . 11 : 1244–1254. дои : 10.2741/1877 . ПМИД 16368510 .
- ^ «Рак в Австралии: обзор 2012 г.» . АИХВ. Архивировано из оригинала 2 июня 2014 года . Проверено 1 июня 2014 г.
- ^ Рабочая группа США по статистике рака. Инструмент визуализации данных статистики рака США, основанный на данных, представленных за 2020 год (1999-2018 годы): Министерство здравоохранения и социальных служб США, Центры по контролю и профилактике заболеваний и Национальный институт рака; www.cdc.gov/cancer/dataviz, опубликовано в июне 2021 г.
- ^ Перейти обратно: а б Гай GP, Томас CC, Томпсон Т, Уотсон М, Массетти GM, Ричардсон LC (июнь 2015 г.). «Жизненно важные признаки: тенденции и прогнозы заболеваемости и смертности от меланомы - США, 1982-2030 гг.» . ММВР. Еженедельный отчет о заболеваемости и смертности . 64 (21): 591–596. ПМЦ 4584771 . ПМИД 26042651 . Архивировано из оригинала 31 мая 2017 года.
- ^ «CDC – Статистика рака кожи» . www.cdc.gov . Архивировано из оригинала 10 апреля 2017 года . Проверено 10 апреля 2017 г. .
- ^ «Основные статистические данные о меланомном раке кожи» . www.cancer.org . Архивировано из оригинала 10 апреля 2017 года . Проверено 10 апреля 2017 г. .
- ^ Уртеага О, Pack GT (май 1966 г.). «О древности меланомы» . Рак . 19 (5): 607–610. doi : 10.1002/1097-0142(196605)19:5<607::AID-CNCR2820190502>3.0.CO;2-8 . ПМИД 5326247 .
- ^ Боденхэм, округ Колумбия (октябрь 1968 г.). «Исследование 650 наблюдавшихся злокачественных меланом в Юго-Западном регионе» . Анналы Королевского колледжа хирургов Англии . 43 (4): 218–239. ПМК 2312310 . ПМИД 5698493 .
- ^ Лаэннек РТ (1806 г.). «О меланозах». Вестник медицинского факультета Парижа . 1 : 24–26.
- ^ Норрис В. (октябрь 1820 г.). «Случай грибкового заболевания» . Эдинбургский медицинский и хирургический журнал . 16 (65): 562–565. ПМК 5830209 . ПМИД 30332089 .
- ^ Норрис В. Восемь случаев меланоза с патологоанатомическими и терапевтическими замечаниями по этому заболеванию. Лондон: Лонгман; 1857.
- ^ Купер С. (1844 г.). Первые направления теории и практики хирургии: включая основные операции . СС и В. Вуд. Архивировано из оригинала 4 августа 2021 года . Проверено 14 декабря 2017 г.
- ^ Merriam-Webster , Университетский словарь Merriam-Webster , Merriam-Webster, заархивировано из оригинала 10 октября 2020 г. , получено 20 июля 2018 г.
- ^ Лидделл Х.Г., Скотт Р. «μέλας» . Греко-английский лексикон . Персей. Архивировано из оригинала 5 июня 2011 года.
- ^ «Иллюстрированный медицинский словарь Дорланда» . Эльзевир. Архивировано из оригинала 11 января 2014 года . Проверено 20 июля 2018 г.
- ^ «Словарь английского языка американского наследия» . Хоутон Миффлин Харкорт. Архивировано из оригинала 25 сентября 2015 года . Проверено 20 июля 2018 г.
- ^ «Препараты в клинической разработке для лечения меланомы» . Фармацевтическая медицина . 26 (3): 171–83. 23 декабря 2012 г. doi : 10.1007/BF03262391 . S2CID 13247048 . Архивировано из оригинала 1 января 2013 года . Проверено 12 июня 2012 г.
- ^ Сотомайор М.Г., Ю Х., Антония С., Сотомайор Э.М., Пардолл Д.М. (2002). «Достижения в генной терапии злокачественной меланомы». Контроль рака . 9 (1): 39–48. дои : 10.1177/107327480200900106 . ПМИД 11907465 .
- ^ Дадли М.Э., Ян Дж.К., Шерри Р., Хьюз М.С., Ройал Р., Каммула У. и др. (ноябрь 2008 г.). «Адаптивная клеточная терапия у пациентов с метастатической меланомой: оценка интенсивных препаративных схем миелоаблативной химиолучевой терапии» . Журнал клинической онкологии . 26 (32): 5233–5239. дои : 10.1200/JCO.2008.16.5449 . ПМК 2652090 . ПМИД 18809613 .
- ^ Бессер М.Дж., Шапира-Фроммер Р., Тревес А.Дж., Циппель Д., Ицхаки О., Хершковитц Л. и др. (май 2010 г.). «Клинические ответы в исследовании фазы II с использованием адоптивного переноса кратковременно культивируемых лимфоцитов опухолевой инфильтрации пациентам с метастатической меланомой» (PDF) . Клинические исследования рака . 16 (9): 2646–2655. дои : 10.1158/1078-0432.CCR-10-0041 . ПМИД 20406835 . S2CID 32568 . Проверено 15 августа 2011 г.
- ^ «Новый метод генной терапии изменяет иммунные клетки для лечения прогрессирующей меланомы; метод может также применяться к другим распространенным видам рака» . 30 декабря 2015 г. Архивировано из оригинала 28 сентября 2006 г.
- ^ «Иммунная система научилась бороться с меланомой» . CBSNews. 30 мая 2009 г. Архивировано из оригинала 29 октября 2010 г.
- ^ Шварцентрубер Д.Д., Лоусон Д.Х., Ричардс Дж.М., Конри Р.М., Миллер Д.М., Трейсман Дж. и др. (июнь 2011 г.). «Пептидная вакцина gp100 и интерлейкин-2 у пациентов с прогрессирующей меланомой» . Медицинский журнал Новой Англии . 364 (22): 2119–2127. дои : 10.1056/NEJMoa1012863 . ПМК 3517182 . ПМИД 21631324 .
- ^ Хармон А (21 февраля 2010 г.). «Погоня за лекарством на американских горках» . Нью-Йорк Таймс . Архивировано из оригинала 10 февраля 2017 года.
- ^ Перейти обратно: а б Поллак А (5 июня 2011 г.). «Лекарства обещают замедлить прогрессирование меланомы» . Нью-Йорк Таймс . Архивировано из оригинала 31 января 2017 года.
- ^ Чепмен П.Б., Хаушильд А., Роберт С., Хаанен Дж.Б., Асьерто П., Ларкин Дж. и др. (июнь 2011 г.). «Улучшение выживаемости при применении вемурафениба при меланоме с мутацией BRAF V600E» . Медицинский журнал Новой Англии . 364 (26): 2507–2516. дои : 10.1056/NEJMoa1103782 . ПМК 3549296 . ПМИД 21639808 .
- ^ «Лекарства GSK от меланомы увеличивают число одобренных лекарств в США» . Рейтер. 30 мая 2013 г. Архивировано из оригинала 24 сентября 2015 г.
- ^ «Комбинация дабрафениба и траметиниба задерживает развитие резистентности к лечению у пациентов с ММ» . Новости Медицинские. 1 октября 2012 г. Архивировано из оригинала 14 мая 2013 г.
- ^ Флаэрти К.Т., Инфанте Дж.Р., Дауд А., Гонсалес Р., Кеффорд Р.Ф., Сосман Дж. и др. (ноябрь 2012 г.). «Комбинированное ингибирование BRAF и MEK при меланоме с мутациями BRAF V600» . Медицинский журнал Новой Англии . 367 (18): 1694–1703. дои : 10.1056/NEJMoa1210093 . ПМЦ 3549295 . ПМИД 23020132 .
- ^ «Комбинация дабрафениб/траметиниб одобрена для лечения прогрессирующей меланомы» . ОнкЛайв. 9 января 2014 г. Архивировано из оригинала 25 января 2014 г. . Проверено 4 февраля 2015 г.
- ^ Ширли М. (август 2018 г.). «Энкорафениб и биниметиниб: первые глобальные одобрения». Наркотики . 78 (12): 1277–1284. дои : 10.1007/s40265-018-0963-x . ПМИД 30117021 . S2CID 52020890 .
- ^ «Противодействие лекарственной устойчивости меланомы» . 2015. Архивировано из оригинала 4 февраля 2015 года.
- ^ «Препарат «Бристоль» снижает риск смерти при запущенной меланоме» . Рейтер . 5 июня 2010 г. Архивировано из оригинала 9 ноября 2010 г.
- ^ «Риск для Бристоля» . Форбс . Архивировано из оригинала 15 марта 2011 года.
- ^ «Клиническое исследование фазы 3: Ипилимумаб усиливает и поддерживает реакцию иммунной системы против опухолей меланомы» . Новости-medical.net. 9 июня 2010 года. Архивировано из оригинала 19 октября 2012 года . Проверено 13 августа 2012 г.
- ^ Джефферсон Э. (25 марта 2011 г.). «FDA одобряет новый метод лечения рака кожи поздней стадии» (пресс-релиз). Управление по контролю за продуктами и лекарствами США (FDA). Архивировано из оригинала 27 марта 2011 года . Проверено 25 марта 2011 г.
- ^ Поллак А (25 марта 2011 г.). «Одобрение препарата для лечения меланомы» . Нью-Йорк Таймс . Архивировано из оригинала 1 апреля 2011 года . Проверено 27 марта 2011 г.
- ^ «Ервой» . Наркотики.com . Архивировано из оригинала 9 августа 2011 года.
- ^ Роберт С., Томас Л., Бондаренко И., О'Дэй С., Вебер Дж., Гарб С. и др. (июнь 2011 г.). «Ипилимумаб плюс дакарбазин при ранее нелеченной метастатической меланоме» . Медицинский журнал Новой Англии . 364 (26): 2517–2526. дои : 10.1056/NEJMoa1104621 . ПМИД 21639810 .
- ^ Войт С., Ван Аккуи А.С., Шефер-Хестерберг Г., Шёнген А., Ковальчик К., Рёверт Дж.К. и др. (февраль 2010 г.). «Ультразвуковые морфологические критерии прогнозируют метастатическое поражение сторожевых узлов у пациентов с меланомой» . Журнал клинической онкологии . 28 (5): 847–852. дои : 10.1200/JCO.2009.25.7428 . ПМИД 20065175 .
- ^ «malignant-melanoma.org» . Архивировано из оригинала 14 октября 2011 года.
- ^ Forbes NE, Абдельбари Х., Люпиен М., Белл Дж.С., Диалло Дж.С. (сентябрь 2013 г.). «Использование эпигенетики опухолей для улучшения онколитической виротерапии» . Границы генетики . 4 : 184. дои : 10.3389/fgene.2013.00184 . ПМЦ 3778850 . ПМИД 24062768 .
- ^ Андтбака Р.Х., Кауфман Х.Л., Колличио Ф., Аматруда Т., Сензер Н., Чесни Дж. и др. (сентябрь 2015 г.). «Талимоген Лагерпарепвек повышает частоту стойкого ответа у пациентов с прогрессирующей меланомой» . Журнал клинической онкологии . 33 (25): 2780–2788. дои : 10.1200/JCO.2014.58.3377 . ПМИД 26014293 . S2CID 23663167 .
- ^ Коста Б, Вейл Н (сентябрь 2023 г.). «Изучение влияния HERV-K (HML-2) на рак и перспективы терапевтических вмешательств» . Международный журнал молекулярных наук . 24 (19): 1615. doi : 10.3390/ijms25031615 . ПМЦ 10572383 . ПМИД 37834078 .
- ^ Мюллер, доктор медицинских наук, Хольст П.Дж., Нильсен К.Н. (январь 2022 г.). «Систематический обзор экспрессии и иммуногенности эндогенных ретровирусных белков человека при раке и обсуждение терапевтических подходов» . Международный журнал молекулярных наук . 23 (3): 1330. doi : 10.3390/ijms23031330 . ПМЦ 8836156 . ПМИД 35163254 .