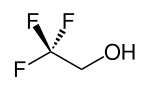
2,2,2-трифторэтанол
 | |
 | |
| Имена | |
|---|---|
| Предпочтительное название ИЮПАК 2,2,2-трифторэтан-1-ол | |
| Другие имена 2,2,2-трифторэтанол | |
| Идентификаторы | |
3D model ( JSmol ) | |
| 1733203 | |
| ЧЭБИ | |
| ЧЕМБЛ | |
| ХимическийПаук | |
| Лекарственный Банк | |
| Информационная карта ECHA | 100.000.831 |
| Номер ЕС |
|
| 2532 | |
ПабХим CID | |
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA ) | |
| Характеристики | |
| С 2 Ч 3 Ж 3 О | |
| Молярная масса | 100.04 g/mol |
| Появление | Бесцветная жидкость |
| Плотность | 1,325±0,06 г/мл при 20 °C, жидкость 760 Торр |
| Температура плавления | -43,5 ° C (-46,3 ° F; 229,7 К) |
| Точка кипения | 74,0 ° C (165,2 ° F; 347,1 К) |
| смешивается | |
| Растворимость в этаноле | смешивается |
| Кислотность ( pKa ) | 12,46±0,10. Самая кислая температура: 25 °C. |
| Вязкость | 0,9 сСт при 37,78 °C |
| Термохимия | |
Стандартная энтальпия горение (Δ c H ⦵ 298 ) | -886,6 кДж/моль |
| Опасности | |
| СГС Маркировка : | |
     | |
| Опасность | |
| H226 , H301 , H312 , H315 , H318 , H331 , H332 , H335 , H360 , H373 | |
| P201 , P202 , P210 , P233 , P240 , P241 , P242 , P243 , P260 , P261 , P264 , P270 , P271 , P280 , P281 , P301+P310 , P302+P352 , P303+P361+P 353 , П304+П312 , П304+ P340 , P305+P351+P338 , P308+P313 , P310 , P311 , P312 , P314 , P321 , P322 , P330 , P332+P313 , P362 , P363 , P370+P378 , P403+P233 , P40 3+П235 , П405 , П501 | |
| NFPA 704 (огненный алмаз) | |
| Родственные соединения | |
Родственные спирты | Гексафтор-2-пропанол |
Родственные соединения | 1,1,1-трифторэтан Трифторуксусная кислота |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
2,2,2-Трифторэтанол органическое соединение формулы – CF 3 CH 2 OH. Эта бесцветная, смешивающаяся с водой жидкость, также известная как ТФЭ или трифторэтиловый спирт , имеет запах, напоминающий этанол . Из-за электроотрицательности трифторметильной проявляет более сильный кислотный группы этот спирт характер по сравнению с этанолом.
Синтез
[ редактировать ]Трифторэтанол производят в промышленности путем гидрирования или гидридного восстановления производных трифторуксусной кислоты , таких как сложные эфиры или ацилхлорид. [1]
ТФЭ также можно получить гидрогенолизом соединений общей формулы CF 3 -CHOH-OR (где R представляет собой водород или алкильную группу, содержащую от одного до восьми атомов углерода ) в присутствии палладийсодержащего нанесенного катализатора, на активированный уголь . [ нужна ссылка ] В качестве сокатализатора этого превращения третичные алифатические амины, такие как триэтиламин обычно используют .
Характеристики
[ редактировать ]Трифторэтанол используется в качестве специализированного растворителя в органической химии. [2] [3] Окисление сернистых соединений перекисью водорода эффективно проводится в ТФЭ. [4]
Например, он конкурентно ингибирует алкогольдегидрогеназу. [5]
ТФЭ образует комплексы с основаниями Льюиса, такими как ТГФ или пиридин , посредством водородных связей , образуя аддукты 1:1. [6] Она классифицируется как жесткая кислота Льюиса , и ее акцепторные свойства обсуждаются в модели ECW, что дает E A = 2,07 и CA = 1,06.
ТФЭ можно использовать в биохимических экспериментах для стабилизации альфа-спирали . [7] [8] В ТФЭ также имеются стабильные бета-листы , что позволяет предположить, что ТФЭ стабилизирует вторичную структуру, которой последовательность отдает предпочтение. [8]
Реакции
[ редактировать ]Окисление трифторэтанола дает трифторуксусную кислоту . Он также служит источником трифторэтоксигруппы для различных химических реакций (модификация Стилла-Дженнари реакции HWE ).
2,2,2-Трифторэтилвиниловый эфир , ингаляционный препарат, представленный в клинике под торговым названием «Флюоромар», содержит виниловый эфир трифторэтанола. Этот вид был получен реакцией трифторэтанола с ацетиленом . [1]
Безопасность
[ редактировать ]Трифторэтанол классифицируется как токсичный для крови, репродуктивной системы, мочевого пузыря, головного мозга, верхних дыхательных путей и глаз. [9] Исследования показали, что он оказывает токсичное действие на яички крыс и собак. [10]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Перейти обратно: а б Зигемунд Г., Швертфегер В., Фейринг А., Смарт Б., Бер Ф., Фогель Х., МакКьюсик Б., Кирш П. (2000). «Соединения фтора органические». Энциклопедия промышленной химии Ульмана . Джон Уайли и сыновья . дои : 10.1002/14356007.a11_349 . ISBN 3527306730 .
- ^ Беге ЖП, Бонне-Дельпон Д, Крусс Б (2004). «Фторированные спирты: новая среда для селективной и чистой реакции». Синлетт (обзор) (1): 18–29. дои : 10.1055/s-2003-44973 .
- ^ Шуклов И.А., Дубровина Н.В., Бёрнер А (2007). «Фторированные спирты как растворители, сорастворители и добавки в гомогенном катализе». Синтез (обзор). 2007 (19): 2925–2943. дои : 10.1055/s-2007-983902 .
- ^ Равикумар К.С., Кесаван В., Крусс Б., Бонне-Дельпон Д., Беге Ж.П. (2003). «Мягкое и селективное окисление соединений серы в трифторэтаноле: дифенилдисульфид и метилфенилсульфоксид» . Органические синтезы . 80 : 184. дои : 10.15227/orgsyn.080.0184 .
- ^ Табер Р.Л. (1998). «Конкурентное ингибирование алкогольдегидрогеназы дрожжей 2,2,2-трифторэтанолом». Биохимическое образование . 26 (3): 239–242. дои : 10.1016/s0307-4412(98)00073-9 .
- ^ Шерри А.Д., Перселл К.Ф. (1970). «Линейные корреляции энтальпийно-спектрального сдвига для 2,2,2-трифторэтанола». Журнал физической химии . 74 (19): 3535–3543. дои : 10.1021/j100713a017 .
- ^ Перейра А.Ф., Пикколи В., Мартинес Л. (01.11.2022). «Прямое взаимодействие трифторэтанола с белковыми цепями дестабилизирует α-спирали» . Журнал молекулярных жидкостей . 365 : 120209. doi : 10.1016/j.molliq.2022.120209 . ISSN 0167-7322 . S2CID 251914912 .
- ^ Перейти обратно: а б Чжун Л., Джонсон WC (май 1992 г.). «Окружающая среда влияет на предпочтение аминокислот вторичной структуры» . Труды Национальной академии наук Соединенных Штатов Америки . 89 (10): 4462–4465. Бибкод : 1992PNAS...89.4462Z . дои : 10.1073/pnas.89.10.4462 . ПМЦ 49102 . ПМИД 1584778 .
- ^ «Научная лаборатория MSDS» . Архивировано из оригинала 3 марта 2016 г. Проверено 8 ноября 2011 г.
- ^ Fischer Scientific MSDS
Внешние ссылки
[ редактировать ]- Галогенуглеродные фторхимические вещества. Архивировано 28 мая 2016 г. в Wayback Machine.
- Патент США № 4647706 «Способ синтеза 2,2,2-трифторэтанола и 1,1,1,3,3,3-гексафторизопропанола».
