Диффузный панбронхиолит
| Диффузный панбронхиолит | |
|---|---|
 | |
| Изображения компьютерной томографии высокого разрешения нижней части грудной клетки у 16-летнего мальчика с диффузным панбронхиолитом. | |
| Специальность | Пульмонология |
Диффузный панбронхиолит ( ДПБ ) — воспалительное заболевание легких неизвестной причины. Это тяжелая прогрессирующая форма бронхиолита , воспалительного заболевания бронхиол ( небольших дыхательных путей в легких). Термин «диффузный» означает, что поражения появляются в обоих легких, тогда как панбронхиолит относится к воспалению, обнаруживаемому во всех слоях респираторных бронхиол (тех, которые участвуют в газообмене ). ДПБ вызывает тяжелое воспаление и узелкообразные поражения терминальных бронхиол , хронический синусит и интенсивный кашель с большого количества мокроты выделением .
Считается, что заболевание возникает при наличии восприимчивости или отсутствия устойчивости иммунной системы , вызывающим ДПБ к бактериям или вирусам , вызванным несколькими генами, которые обнаруживаются преимущественно у лиц восточноазиатского происхождения. Самая высокая заболеваемость наблюдается среди японцев , за ними следуют корейцы . ДПБ чаще встречается у мужчин и обычно начинается примерно в возрасте около 40 лет. В начале 1960-х годов оно было признано как отдельное новое заболевание, а в 1969 году оно было официально названо диффузным панбронхиолитом .
Если не лечить, ДПБ прогрессирует до бронхоэктазов , необратимого заболевания легких, которое включает увеличение бронхиол и скопление слизи в бронхиолярных проходах. Ежедневное лечение ДПБ макролидными антибиотиками, такими как эритромицин, облегчает симптомы и увеличивает продолжительность жизни, но в настоящее время болезнь не поддается лечению. Конечным результатом ДПБ может стать дыхательная недостаточность и проблемы с сердцем.
Классификация
[ редактировать ]Термин «бронхиолит» обычно относится к воспалению бронхиол. [1] ДПБ классифицируется как форма «первичного бронхиолита», что означает, что основная причина бронхиолита возникает в бронхиолах или ограничивается ими. [2] [3] Наряду с ДПБ к дополнительным формам первичного бронхиолита относятся облитерирующий бронхиолит , фолликулярный бронхиолит, респираторный бронхиолит , минерально-пылевая болезнь дыхательных путей и ряд других. [2] В отличие от ДПБ, бронхиолит, который не считается «первичным», может быть связан с заболеваниями крупных дыхательных путей, такими как хронический бронхит . [2] [3]
Признаки и симптомы
[ редактировать ]Симптомы ДПБ включают хронический синусит (воспаление околоносовых пазух ), хрипы, хрипы ( дыхательные звуки, возникающие из-за препятствий, таких как мокрота и секрет в легких), одышка (одышка) и сильный кашель с выделением большого количества мокроты (кашель - мокрота). может присутствовать гной В мокроте , у больных может наблюдаться лихорадка. Типичные признаки прогрессирования ДПБ включают дилатацию (увеличение) бронхиальных ходов и гипоксемию (низкий уровень кислорода в крови). Если ДПБ не лечить, возникнут бронхоэктазы; он характеризуется расширением и утолщением стенок бронхиол, воспалительным поражением респираторных и терминальных бронхиол и скоплением слизи в легких. [4] [5] ДПБ связан с прогрессирующей дыхательной недостаточностью , гиперкапнией (повышением уровня углекислого газа в крови) и в конечном итоге может привести к легочной гипертензии (высокому кровяному давлению в легочной вене и артерии ) и легочному сердцу (дилатации правого желудочка сердца). или «правосердечная недостаточность»). [6] [7]
Причина
[ редактировать ]
ДПБ является идиопатическим , что означает, что точная физиологическая , экологическая или патогенная причина заболевания неизвестна. Однако предполагается, что в его патогенез (способ развития заболевания) вовлечены несколько факторов. [4]
Главный комплекс гистосовместимости (MHC) — это большая область генома , обнаруженная у большинства позвоночных и связанная с иммунной системой. У человека он расположен на шестой хромосоме . Подмножеством MHC у человека является человеческий лейкоцитарный антиген (HLA), который контролирует антигенпрезентирующую систему как часть адаптивного иммунитета против таких патогенов, как бактерии и вирусы . Когда клетки человека инфицированы патогеном, некоторые из них могут представлять на своей поверхности части белков патогена; это называется «презентацией антигена». Инфицированные клетки затем становятся мишенью для цитотоксических Т-клеток , которые убивают инфицированные клетки, чтобы их можно было удалить из организма. [8]
Генетическая предрасположенность к восприимчивости к DPB локализована в двух гаплотипах HLA ( разница в последовательностях нуклеотидов или генов между парными хромосомами , которая с большей вероятностью встречается среди людей общей этнической принадлежности или признака), общих для людей восточноазиатского происхождения. HLA-B54 связан с DPB у японцев, тогда как HLA-A11 связан с заболеванием у корейцев. [9] Считается, что несколько генов в этой области HLA класса I ответственны за ДПБ, обеспечивая повышенную восприимчивость к этому заболеванию. [7] [10] Общий генетический фон и сходство профиля HLA у больных японцев и корейцев учитывались при поиске гена DPB. [10] Было высказано предположение, что мутация предполагаемого гена предрасположенности к заболеванию, расположенного где-то между HLA-B [11] и HLA-А [12] произошел на наследственной хромосоме, несущей как HLA-B54, так и HLA-A11. Кроме того, возможно, что ряд событий генетической рекомбинации заболевания вокруг локуса (расположения на хромосоме) мог привести к тому, что заболевание было связано с HLA-B54 у японцев и HLA-A11 у корейцев. После дальнейшего исследования был сделан вывод, что ген восприимчивости к DPB расположен рядом с локусом HLA-B на хромосоме 6p21.3. В этой области поиск генетической причины заболевания продолжается. [9] [10]
Поскольку многие гены, принадлежащие HLA, остаются неидентифицированными, позиционное клонирование (метод, используемый для идентификации конкретного гена, когда известно только его расположение на хромосоме) было использовано для определения того, что муциноподобный ген связан с DPB. Кроме того, были исследованы заболевания, вызванные идентифицированными генами HLA в области чувствительности к DPB. Один из них, синдром голых лимфоцитов I (BLS I), имеет ряд сходств с ДПБ у больных, включая хронический синусит, бронхиолярное воспаление и узелки, а также наличие H. influenzae . Как и DPB, BLS I положительно реагирует на терапию эритромицином, демонстрируя разрешение симптомов. Сходство между этими двумя заболеваниями, соответствующий успех при одном и том же методе лечения, а также тот факт, что ген, ответственный за BLS I, расположен в вызывающей DPB области HLA, сужает установление гена, ответственного за DPB. [9] Считается, что факторы окружающей среды, такие как вдыхание токсичных паров и курение сигарет, не играют роли в развитии ДПБ, а неизвестные экологические и другие негенетические причины, такие как неопознанные бактерии или вирусы, не исключены. [4] [6] [7]
Муковисцидоз (МВ), прогрессирующее мультисистемное заболевание легких, рассматривался в поисках генетической причины ДПБ. Это происходит по ряду причин. CF, как и DPB, вызывает тяжелое воспаление легких, обильное выделение слизи, инфекцию и демонстрирует генетическое преобладание среди европеоидов одной географической группы при редкости других; тогда как DPB доминирует среди жителей Восточной Азии, CF в основном поражает лиц европейского происхождения. Хотя ни один ген не является причиной ДПБ, мутация в конкретном гене, которая гораздо чаще встречается у европейцев, вызывает МВ. Эта мутация в гене, вызывающем МВ, не является фактором ДПБ, но известно, что уникальный полиморфизм (вариация) этого гена встречается у многих азиатов, не обязательно затронутых каким-либо заболеванием. Исследуется, может ли этот ген в любом состоянии мутации способствовать развитию DPB. [4] [9]
Патофизиология
[ редактировать ]Воспаление является нормальной частью иммунного ответа человека, при котором собираются лейкоциты (лейкоциты), включая нейтрофилы (лейкоциты, которые специализируются на возникновении воспаления), и хемокины (белки, высвобождаемые из определенных клеток, которые активируют или вызывают реакцию другие клетки) накапливаются в любом месте организма, где возникают бактериальные или вирусные инфекции. Воспаление препятствует деятельности бактерий и вирусов и способствует их выведению из организма. При ДПБ такие бактерии, как Haemophilus influenzae и Pseudomonas aeruginosa, могут вызывать пролиферацию воспалительных клеток в бронхиолярные ткани. Однако, когда при ДПБ нет ни одной бактерии, воспаление продолжается по пока неизвестной причине. [4] [5] В любом случае воспаление при ДПБ может быть настолько серьезным, что в стенках бронхиол образуются узелки, содержащие воспалительные клетки. [4] [13] Наличие воспаления и инфекции в дыхательных путях также приводит к выработке избыточной слизи, которую необходимо откашливать в виде мокроты. [4] [6] Сочетание воспаления, развития узелков, инфекции, слизи и частого кашля способствует затруднению дыхания при ДПБ. [4] [5]
Тот факт, что воспаление при ДПБ сохраняется независимо от наличия или отсутствия P. aeruginosa и H. influenzae, дает возможность определить несколько механизмов патогенеза ДПБ. [5] Лейкотриены — это эйкозаноиды , сигнальные молекулы , состоящие из незаменимых жирных кислот , которые играют роль во многих заболеваниях легких, вызывая пролиферацию воспалительных клеток и избыточное производство слизи в дыхательных путях. [14] При ДПБ и других заболеваниях легких преобладающим медиатором воспаления, связанного с нейтрофилами, является лейкотриен B4 , который специализируется на пролиферации нейтрофилов посредством хемотаксиса (движения некоторых типов клеток к определенным молекулам или от них). [4] [9]
Воспаление при ДПБ также вызвано хемокином MIP-1альфа и его участием в CD8. + Т-клетки . Бета-дефенсины , семейство антимикробных пептидов, обнаруживаемых в дыхательных путях, ответственны за дальнейшее воспаление при ДПБ при такого патогена, как P. aeruginosa наличии . Если он присутствует вместе с ДПБ, Т-лимфотропный вирус человека типа I , ретровирус , модифицирует патогенез ДПБ, инфицируя Т-хелперные клетки и изменяя их эффективность в распознавании присутствия известных или неизвестных патогенов, связанных с ДПБ. [4] [9]
Диагностика
[ редактировать ]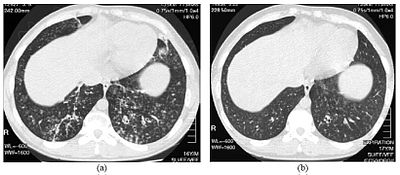
Диагноз ДПБ требует анализа легких и бронхиолярных тканей, для чего может потребоваться биопсия легких или более предпочтительная компьютерная томография высокого разрешения (КТВР) легких. [7] Диагностические критерии включают выраженное воспаление во всех слоях респираторных бронхиол и поражение легочной ткани в виде узелков внутри терминальных и респираторных бронхиол обоих легких. [4] Узелки при ДПБ выглядят как непрозрачные комки при осмотре на рентгеновских снимках легких и могут вызывать обструкцию дыхательных путей , которую оценивают с помощью функционального теста легких или PFT. [6] Рентгенография легких также может выявить расширение бронхиол, еще один признак ДПБ. КТВР часто показывает закупорку некоторых бронхиолярных проходов слизью, что называется паттерном «дерево в бутоне» . [7] Гипоксемия, еще один признак затруднения дыхания, выявляется путем измерения содержания кислорода и углекислого газа в крови с помощью анализа крови, называемого газом артериальной крови . Другие результаты, наблюдаемые при ДПБ, включают пролиферацию лимфоцитов ( лейкоцитов , которые борются с инфекцией), нейтрофилов и пенистых гистиоцитов (тканевых макрофагов легких ) в слизистой оболочке . Также обнаруживаются такие бактерии, как H. influenzae и P. aeruginosa , причем последние становятся более заметными по мере прогрессирования заболевания. [4] [5] Белую кровь, бактериальный и другой клеточный состав крови можно измерить путем проведения общего анализа крови (ОАК). Могут наблюдаться повышенные уровни IgG и IgA (классы иммуноглобулинов ), а также наличие ревматоидного фактора (показатель аутоиммунитета ). Также может возникнуть гемагглютинация – слипание эритроцитов в ответ на присутствие антител в крови. Нейтрофилы, бета-дефензины, лейкотриены и хемокины также могут быть обнаружены в жидкости бронхоальвеолярного лаважа , введенной, а затем удаленной из бронхиолярных дыхательных путей у людей с ДПБ для оценки. [4] [9]
Дифференциальный диагноз
[ редактировать ]При дифференциальной диагностике (постановке правильного диагноза между заболеваниями, имеющими перекрывающиеся признаки) некоторых обструктивных заболеваний легких часто учитывают ДПБ. Ряд симптомов ДПБ напоминают симптомы других обструктивных заболеваний легких, таких как астма , хронический бронхит и эмфизема . Распространенными симптомами таких заболеваний являются свистящее дыхание , кашель с выделением мокроты и одышка, а при тестировании функции легких выявляют обструктивные нарушения функции дыхания . [6] Муковисцидоз, как и ДПБ, вызывает тяжелое воспаление легких, избыточное выделение слизи и инфекцию; но ДПБ не вызывает нарушений поджелудочной железы или электролитов , как МВ, поэтому эти два заболевания различны и, вероятно, не связаны между собой. [4] [9] ДПБ отличается наличием очагов поражения, которые на рентгенограммах проявляются в виде узелков в бронхиолах обоих легких; воспаление во всех тканевых слоях респираторных бронхиол; и его более высокая распространенность среди людей восточноазиатского происхождения. [4]
ДПБ и облитерирующий бронхиолит представляют собой две формы первичного бронхиолита. [2] К специфическим совпадающим признакам обоих заболеваний относятся сильный кашель с большим количеством мокроты, часто наполненной гноем; узелки, видимые на рентгенограмме легких в нижних бронхах и бронхиолярной области; и хронический синусит. При ДПБ узелки более ограничены респираторными бронхиолами, тогда как при ОБ они часто обнаруживаются в мембранозных бронхиолах (начальный нехрящевой отдел бронхиолы, отделяющийся от третичного бронха ) вплоть до вторичных бронхов . ОБ — бронхиолярное заболевание, распространенное во всем мире, тогда как ДПБ имеет более локализованную распространенность, преимущественно в Японии. [2] [6] До клинического признания ДПБ в последние годы его часто ошибочно диагностировали как бронхоэктазию , ХОБЛ , ИЛФ , милиарный туберкулез , саркоидоз или альвеолярно-клеточную карциному . [15]
Уход
[ редактировать ]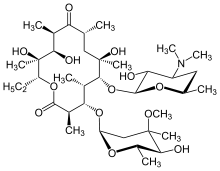
Макролидные антибиотики, такие как эритромицин , являются эффективным средством лечения ДПБ при регулярном приеме в течение длительного периода времени. [16] [17] [18] кларитромицин или рокситромицин . Также часто используются [19] Успешные результаты применения макролидов при ДПБ и подобных заболеваниях легких обусловлены контролем определенных симптомов посредством иммуномодуляции (регулирования иммунного ответа). [17] Этого можно достичь, принимая антибиотики в низких дозах . Лечение заключается в ежедневном пероральном приеме эритромицина. [7] в течение двух-трех лет, длительного периода, который, как было показано, значительно улучшает эффекты DPB. Это становится очевидным, когда у человека, проходящего лечение от ДПБ, среди ряда критериев ремиссии, связанных с заболеванием, имеется нормальное количество нейтрофилов, обнаруженное в жидкости БАЛ и газах крови ( анализ артериальной крови , который измеряет количество кислорода и углекислого газа в крови) показания показывают, что свободный кислород в крови находится в пределах нормы. [16] [17] [20] В этих случаях было предложено разрешить временный перерыв в терапии эритромицином, чтобы уменьшить образование устойчивых к макролидам P. aeruginosa . [16] Однако симптомы ДПБ обычно возвращаются, и лечение необходимо возобновить. Несмотря на свою высокую эффективность, эритромицин не может оказаться успешным у всех людей с этим заболеванием, особенно если присутствует устойчивый к макролидам P. aeruginosa или если ранее не леченная ДПБ прогрессировала до точки, приводящей к развитию дыхательной недостаточности. [17] [20]
При терапии эритромицином при ДПБ значительное снижение воспаления и повреждения бронхиол достигается за счет подавления не только пролиферации нейтрофилов , но и активности лимфоцитов, а также обструктивного выделения слизи и воды в дыхательных путях. [16] Антибиотическое действие макролидов не связано с их благоприятным действием на уменьшение воспаления при ДПБ. [20] Это очевидно, поскольку лечебная дозировка слишком мала для борьбы с инфекцией, а в случаях ДПБ с появлением устойчивых к макролидам P. aeruginosa терапия эритромицином все же уменьшает воспаление. [16]
В подавлении воспаления эритромицином и другими макролидами участвует ряд факторов. Они особенно эффективны для ингибирования пролиферации нейтрофилов за счет уменьшения способности интерлейкина 8 и лейкотриена B4 привлекать их. [21] Макролиды также снижают эффективность молекул адгезии , которые позволяют нейтрофилам прилипать к слизистой оболочке бронхиол. Выработка слизи в дыхательных путях является основной причиной заболеваемости и смертности от ДПБ и других респираторных заболеваний. Значительное уменьшение воспаления при ДПБ, приписываемое терапии эритромицином, также помогает ингибировать выработку избыточной слизи. [21]
Прогноз
[ редактировать ]Без лечения ДПБ приводит к бронхоэктазам, дыхательной недостаточности и смерти. Журнальный отчет 1983 года показал, что без лечения DPB имел пятилетнюю выживаемость 62,1%, а 10-летнюю выживаемость составляла 33,2%. [6] Благодаря лечению эритромицином люди с ДПБ теперь имеют гораздо большую продолжительность жизни благодаря лучшему лечению симптомов, замедлению прогрессирования и предотвращению сопутствующих инфекций, таких как P. aeruginosa . [20] 10-летняя выживаемость при лечении ДПБ составляет около 90%. [4] В случаях ДПБ, когда лечение приводило к значительному улучшению, что иногда происходит примерно через два года, лечение разрешалось на некоторое время прекратить. Однако лица, которым разрешено прекратить лечение в течение этого времени, находятся под пристальным наблюдением. Поскольку доказано, что ДПБ рецидивирует, терапию эритромицином необходимо незамедлительно возобновить, как только симптомы заболевания начнут появляться снова. Несмотря на улучшение прогноза при лечении, лечение ДПБ в настоящее время не известно. [4] [9]
Эпидемиология
[ редактировать ]Самая высокая распространенность DPB наблюдается среди японцев - 11 на 100 000 населения. [4] Корейский, [22] Китайский, [23] и тайский [24] Сообщалось также о людях с этим заболеванием. Предполагается генетическая предрасположенность среди жителей Восточной Азии. [9] Заболевание чаще встречается у мужчин, [25] с соотношением мужчин и женщин 1,4–2:1 (или примерно 5 мужчин на 3 женщины). [4] Среднее начало заболевания приходится на возраст около 40 лет, две трети заболевших — некурящие, хотя курение не считается причиной заболевания. [7] Наличие HLA-Bw54 увеличивает риск диффузного панбронхиолита в 13,3 раза. [26]
В Европе и Америке относительно небольшое количество случаев ДПБ было зарегистрировано у иммигрантов и жителей Азии, а также у лиц неазиатского происхождения. [27] [28] [29] На Западе возникали ошибочные диагнозы из-за меньшего признания этого заболевания, чем в азиатских странах. По сравнению с большим количеством азиатов, живущих на западе, небольшое количество из них, которые, как полагают, страдают от ДПБ, позволяет предположить, что негенетические факторы могут играть определенную роль в его причине. Эта редкость, наблюдаемая у жителей Западной Азии, также может быть частично связана с ошибочным диагнозом. [7] [30]
История
[ редактировать ]В начале 1960-х годов врачи в Японии наблюдали и описывали относительно новое хроническое заболевание легких. В 1969 году [31] Название «диффузный панбронхиолит» было введено для отличия его от хронического бронхита, эмфиземы, альвеолита и других обструктивных заболеваний легких с воспалением. В период с 1978 по 1980 год результаты общенационального исследования, инициированного Министерством здравоохранения и социального обеспечения Японии, выявили более 1000 вероятных случаев ДПБ, из которых 82 были гистологически подтверждены. К 1980-м годам это заболевание было признано во всем мире как отдельное заболевание легких. [4] [6]
До 1980-х годов прогноз или ожидаемый исход ДПБ был плохим, особенно в случаях с суперинфекцией (появлением новой вирусной или бактериальной инфекции в дополнение к имеющейся в настоящее время инфекции) P. aeruginosa . [13] Уровень смертности от ДПБ продолжал оставаться очень высоким до того, как генерализованное лечение антибиотиками и кислородную терапию для лечения симптомов начали регулярно использовать . Примерно в 1985 году, когда долгосрочное лечение антибиотиком эритромицином стало стандартом лечения ДПБ, прогноз значительно улучшился. [20] В 1990 г. впервые была подтверждена связь DPB с HLA. [9]
Ссылки
[ редактировать ]- ^ Вишер Д.В., Майерс Дж.Л. (2006). «Бронхиолит: взгляд патологоанатома» . Труды Американского торакального общества . 3 (1): 41–7. дои : 10.1513/pats.200512-124JH . ПМИД 16493150 . Архивировано из оригинала (Полный текст) 16 апреля 2010 года . Проверено 16 августа 2015 г.
- ^ Jump up to: а б с д и Рю Дж. Х., Майерс Дж. Л., Свенсен С. Дж. (декабрь 2003 г.). «Бронхиолярные заболевания» . Американский журнал респираторной медицины и медицины интенсивной терапии . 168 (11): 1277–92. doi : 10.1164/rccm.200301-053SO . ПМИД 14644923 . Архивировано из оригинала (Полный текст) 2 декабря 2009 года . Проверено 16 августа 2015 г.
- ^ Jump up to: а б Рю Дж. Х. (март 2006 г.). «Классификация и подход к бронхиолярным заболеваниям». Современное мнение в области легочной медицины . 12 (2): 145–51. дои : 10.1097/01.mcp.0000208455.80725.2a . ПМИД 16456385 . S2CID 23668839 .
- ^ Jump up to: а б с д и ж г час я дж к л м н тот п д р с т Полетти В., Касони Г., Чилоси М., Зомпатори М. (октябрь 2006 г.). «Диффузный панбронхиолит» . Европейский респираторный журнал . 28 (4): 862–71. дои : 10.1183/09031936.06.00131805 . ПМИД 17012632 .
- ^ Jump up to: а б с д и Янагихара К., Кадото Дж., Коно С. (2001). «Диффузный панбронхиолит - патофизиология и механизмы лечения». Международный журнал противомикробных средств . 18 (Приложение 1): S83-7. дои : 10.1016/s0924-8579(01)00403-4 . ПМИД 11574201 .
- ^ Jump up to: а б с д и ж г час Хомма Х., Яманака А., Танимото С., Тамура М., Чиджимацу Ю., Кира С., Изуми Т. (январь 1983 г.). «Диффузный панбронхиолит. Заболевание переходной зоны легкого». Грудь . 83 (1): 63–9. дои : 10.1378/сундук.83.1.63 . ПМИД 6848335 .
- ^ Jump up to: а б с д и ж г час Энтони М., Сингхэм С., Соанс Б., Тайлер Дж. (октябрь 2009 г.). «Диффузный панбронхиолит: не просто азиатское заболевание: серия австралийских случаев и обзор литературы» . Журнал биомедицинской визуализации и вмешательств . 5 (4): е19. дои : 10.2349/biij.5.4.e19 . ПМК 3097723 . ПМИД 21610988 .
- ^ Моррис А.Г., Хьюитт С., Янг С. (1994). Главный комплекс гистосовместимости: его гены и их роль в презентации антигена . Том. 15. Пергам.
- ^ Jump up to: а б с д и ж г час я дж к Кейчо Н., Хиджиката М. (май 2011 г.). «Генетическая предрасположенность к диффузному панбронхиолиту». Респирология . 16 (4): 581–8. дои : 10.1111/j.1440-1843.2011.01946.x . ПМИД 21303426 . S2CID 13600381 .
- ^ Jump up to: а б с Интернет-менделевское наследование у человека (OMIM): панбронхиолит, диффузный - 604809, дата обращения 11 ноября 2011 г.
- ^ Интернет-менделевское наследование у человека (OMIM): человеческий лейкоцитарный антиген B - 142830, дата обращения 21 сентября 2011 г.
- ^ Интернет-менделевское наследование у человека (OMIM): человеческий лейкоцитарный антиген A - 142800, получено 21 сентября 2011 г.
- ^ Jump up to: а б Адзума А., Кудо С. (май 2006 г.). «Диффузный панбронхиолит в Восточной Азии». Респирология . 11 (3): 249–61. дои : 10.1111/j.1440-1843.2006.00845.x . ПМИД 16635082 . S2CID 24559334 .
- ^ Буссе WW (июнь 1998 г.). «Лейкотриены и воспаление» . Американский журнал респираторной медицины и медицины интенсивной терапии . 157 (6 Пт 1): С210-3. doi : 10.1164/ajrccm.157.6.mar-1 . ПМИД 9620941 . Архивировано из оригинала (Полный текст) 10 мая 2007 года . Проверено 16 августа 2015 г.
- ^ Ли Х, Чжоу Ю, Фань Ф, Чжан Ю, Ли Х, Ю Х и др. (август 2011 г.). «Влияние азитромицина на пациентов с диффузным панбронхиолитом: ретроспективное исследование 51 случая» . Внутренняя медицина . 50 (16): 1663–9. doi : 10.2169/internalmedicine.50.4727 . ПМИД 21841323 .
- ^ Jump up to: а б с д и Канох С., Рубин Б.К. (июль 2010 г.). «Механизмы действия и клиническое применение макролидов как иммуномодулирующих препаратов» . Обзоры клинической микробиологии (бесплатный полный текст). 23 (3): 590–615. дои : 10.1128/CMR.00078-09 . ПМК 2901655 . ПМИД 20610825 .
- ^ Jump up to: а б с д Лопес-Боадо Ю.С., Рубин Б.К. (июнь 2008 г.). «Макролиды как иммуномодулирующие препараты для терапии хронических заболеваний легких». Современное мнение в фармакологии . 8 (3): 286–91. дои : 10.1016/j.coph.2008.01.010 . ПМИД 18339582 .
- ^ Линь X, Лу Дж, Ян М, Донг БР, Ву ХМ (январь 2015 г.). «Макролиды при диффузном панбронхиолите» . Кокрановская база данных систематических обзоров . 1 (1): CD007716. дои : 10.1002/14651858.CD007716.pub4 . ПМК 6464977 . ПМИД 25618845 .
- ^ Кейчо Н., Кудо С. (2002). «Диффузный панбронхиолит: роль макролидов в терапии». Американский журнал респираторной медицины . 1 (2): 119–31. дои : 10.1007/BF03256601 . ПМИД 14720066 . S2CID 39880028 .
- ^ Jump up to: а б с д и Шульц MJ (июль 2004 г.). «Активность макролидов, выходящая за рамки их антимикробного действия: макролиды при диффузном панбронхиолите и муковисцидозе» (бесплатный полный текст) . Журнал антимикробной химиотерапии . 54 (1): 21–8. дои : 10.1093/jac/dkh309 . ПМИД 15190022 .
- ^ Jump up to: а б Тамаоки Дж., Кадота Дж., Такидзава Х. (ноябрь 2004 г.). «Клинические последствия иммуномодулирующего действия макролидов». Американский медицинский журнал . 117 Приложение 9А (9): 5S–11S. doi : 10.1016/j.amjmed.2004.07.023 . ПМИД 15586558 .
- ^ Ким Ю.В., Хан С.К., Шим Ю.С., Ким К.Ю., Хан Ю.К., Со Дж.В., Им Дж.Г. (май 1992 г.). «Первое сообщение о диффузном панбронхиолите в Корее: пять сообщений о случаях заболевания» . Внутренняя медицина . 31 (5): 695–701. дои : 10.2169/internalmedicine.31.695 . ПМИД 1504438 .
- ^ Чен Ю, Кан Дж, Ли С (январь 2005 г.). «Диффузный панбронхиолит в Китае». Респирология . 10 (1): 70–5. дои : 10.1111/j.1440-1843.2005.00622.x . ПМИД 15691241 . S2CID 37365518 .
- ^ Чантароторн С., Палватвичай А., Ваттанатум А., Тантамахарик Д. (август 1999 г.). «Диффузный панбронхиолит, первое сообщение о случае в Таиланде». Журнал Медицинской ассоциации Таиланда = Chotmaihet Thangphaet . 82 (8): 833–8. ПМИД 10511794 .
- ^ Хойби Н. (июнь 1994 г.). «Диффузный панбронхиолит и муковисцидоз: Восток встречается с Западом» . Торакс . 49 (6): 531–2. дои : 10.1136/thx.49.6.531 . ПМЦ 474936 . ПМИД 8016786 .
- ^ Лазарь СК (2005). Учебник респираторной медицины Мюррея и Наделя (4-е изд.). УБ Сондерс. п. 1300 . ISBN 978-0-7216-0327-8 .
- ^ Фицджеральд Дж.Э., Кинг Т.Э., Линч Д.А., Тудер Р.М., Шварц М.И. (август 1996 г.). «Диффузный панбронхиолит в США». Американский журнал респираторной медицины и медицины интенсивной терапии . 154 (2 ч. 1): 497–503. дои : 10.1164/ajrccm.154.2.8756828 . PMID 8756828 .
- ^ Мартинес Х.А., Гимарайнш С.М., Феррейра Р.Г., Перейра, Калифорния (март 2000 г.). «Диффузный панбронхиолит в Латинской Америке». Американский журнал медицинских наук . 319 (3): 183–5. дои : 10.1097/00000441-200003000-00008 . ПМИД 10746829 .
- ^ Сандрини А., Балтер М.С., Чепмен К.Р. (2003). «Диффузный панбронхиолит у мужчины европеоидной расы в Канаде» . Канадский респираторный журнал . 10 (8): 449–51. дои : 10.1155/2003/786531 . hdl : 1807/82124 . ПМИД 14679410 .
- ^ Брюжьер О, Миллерон Б, Антуан М, Каретт МФ, Филипп С, Маяуд С (октябрь 1996 г.). «Диффузный панбронхиолит у азиатского иммигранта» . Торакс . 51 (10): 1065–7. дои : 10.1136/thx.51.10.1065 . ПМК 472677 . ПМИД 8977613 .
- ^ Яманака А., Сайки С., Тамура С., Сайто К. (март 1969 г.). «[Проблемы хронических обструктивных бронхиальных заболеваний с особым акцентом на диффузный панбронхиолит]». Найка. Внутренняя медицина (на японском языке). 23 (3): 442–51. ПМИД 5783341 .