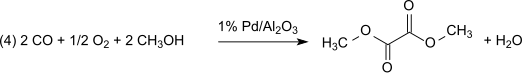Диметилоксалат

| |
| |
| Имена | |
|---|---|
| Предпочтительное название ИЮПАК
Диметилоксалат | |
| Идентификаторы | |
3D model ( JSmol )
|
|
| ХимическийПаук | |
| Информационная карта ECHA | 100.008.231 |
ПабХим CID
|
|
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA )
|
|
| Характеристики | |
| С 4 Н 6 О 4 | |
| Молярная масса | 118.088 g·mol −1 |
| Появление | Белые кристаллы |
| Температура плавления | От 53 до 55 ° C (от 127 до 131 ° F; от 326 до 328 К) [ 1 ] |
| Точка кипения | От 166 до 167 ° C (от 331 до 333 ° F; от 439 до 440 К) [ 1 ] |
| -55.7·10 −6 см 3 /моль | |
| Родственные соединения | |
Родственные соединения
|
Дифенилоксалат |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |
Диметилоксалат — органическое соединение формулы (CO 2 CH 3 ) 2 или (СН 3 ) 2 С 2 О 4 . Это диметиловый эфир кислоты щавелевой . Диметилоксалат представляет собой бесцветное или белое твердое вещество, растворимое в воде.
Производство
[ редактировать ]Диметилоксалат можно получить этерификацией щавелевой кислоты метанолом с использованием серной кислоты в качестве катализатора : [ 2 ]
Путь окислительного карбонилирования
[ редактировать ]Получение путем окислительного карбонилирования вызвало интерес, поскольку для него требуются только предшественники C1 : [ 3 ]
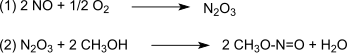
Реакцию катализирует Pd. 2+ . [ 4 ] [ 5 ] Синтез-газ в основном получают из угля или биомассы . Окисление протекает через триоксид азота , который образуется по (1) из монооксида азота и кислорода и затем реагирует по (2) с метанолом с образованием метилнитрита : [ 6 ]
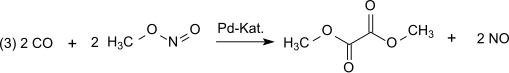
На следующей стадии дикарбонилирования (3) окись углерода реагирует с метилнитритом с образованием диметилоксалата в паровой фазе при атмосферном давлении и температуре 80-120 °С на палладиевом катализаторе:
Уравнение суммы:
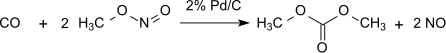
Этот метод без потерь по отношению к метилнитриту, который выступает практически как носитель эквивалентов окисления. Однако образовавшуюся воду необходимо удалить, чтобы предотвратить гидролиз продукта диметилоксалата. С 1% Pd/α-Al 2 O 3 диметилоксалат получают селективно по реакции дикарбонилирования, в тех же условиях с 2% Pd/C диметилкарбонат получают монокарбонилированием:
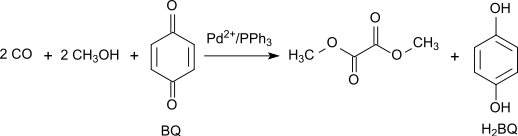
Альтернативно, окислительное карбонилирование метанола может быть проведено с высоким выходом и селективностью с использованием 1,4-бензохинона в качестве окислителя в системе Pd(OAc) 2 / PPh 3 /бензохинон с массовым соотношением 1/3/100 при 65 °С. и 70 атм CO : [ 5 ]
Реакции
[ редактировать ]Диметилоксалат (и родственный ему диэтиловый эфир) используется в различных реакциях конденсации . [ 7 ] Например, диэтилоксалат конденсируется с циклогексаноном с образованием дикетоэфира, предшественника пимелиновой кислоты. [ 8 ] С диаминами диэфиры щавелевой кислоты конденсируются с образованием циклических диамидов. Хиноксалиндион получают конденсацией диметилоксалата и о-фенилендиамина :
- C 2 O 2 (OMe) 2 + C 6 H 4 (NH 2 ) 2 → C 6 H 4 (NHCO) 2 + 2 MeOH
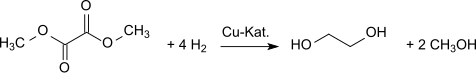
Гидрирование дает этиленгликоль . [ 9 ] Диметилоксалат можно превратить в этиленгликоль с высокими выходами (94,7%). [ 10 ] [ 11 ]
Образующийся метанол рециклируется в процессе окислительного карбонилирования. [ 12 ] Планируются и другие заводы общей годовой мощностью более 1 млн тонн этиленгликоля в год.
Декарбонилирование дает диметилкарбонат . [ 13 ]
Дифенилоксалат получают переэтерификацией фенолом . в присутствии титановых катализаторов [ 14 ] который снова декарбонилируется до дифенилкарбоната в жидкой или газовой фазе.
Диметилоксалат также можно использовать в качестве метилирующего агента . Он значительно менее токсичен, чем другие метилирующие агенты, такие как йодистый метил или диметилсульфат . [ 15 ]
Ссылки
[ редактировать ]- ^ Перейти обратно: а б ППТ Сах и СЛ. Чиен, Журнал Американского химического общества , 1931 , 53 , 3901-3903.
- ^ Эверетт Боуден (1930). «Метилоксалат». Органические синтезы . 10:78 . дои : 10.15227/orgsyn.010.0078 .
- ^ Ханс-Юрген Арпе: Промышленная органическая химия: важные предварительные и промежуточные продукты , стр. 168; ISBN 978-3-527-31540-6 .
- ^ US 4467109 , Сусуму Тахара и др., «Способ непрерывного получения диэфира щавелевой кислоты», выдан 19 мая 1983 г., передан Ube Industries и EP 108359 , К. Масунага и др., «Способ получения диэфира щавелевой кислоты», передан Ube Industries. EP 425197 , К. Нишихира и К. Мизутаре, «Способ получения диэфира угольной кислоты», опубликовано 2 мая 1991 г., передано Ube Industries. US 4451666 , Дж. А. Софранко, А. М. Гаффни, «Синтез оксалатных эфиров путем окислительного карбонилирования спиртов», опубликован 29 мая 1984 г., передан компании Atlantic Richfield Co.
- ^ Перейти обратно: а б Э. Амадио: Окислительное карбонилирование алканолов, катализируемое комплексами Pd(II)-фосфин , докторская диссертация, Университет Ка'Фоскари, Венеция, 2009 г.
- ^ Х.-З. Цзян, Катализаторы на палладиевом носителе в реакциях CO + RONO , Platinum Metals Rev., 1990, 34 , (4), 178–180.
- ^ Бергман, Ян; Норрби, Пер-Ола; Сэнд, Питер (1990). «Алкилирование эфирами щавелевой кислоты. Область применения и механизм». Тетраэдр . 46 (17): 6113–6124. дои : 10.1016/S0040-4020(01)87933-3 . S2CID 94945519 .
- ^ Х.Р. Снайдер; Л. А. Брукс; С.Х. Шапиро; А. Мюллер (1931). «Пимелиновая кислота». Органические синтезы . 11:42 . дои : 10.15227/orgsyn.011.0042 .
- ^ Nexant/Chemsystems, « Уголь для MEG, меняя правила игры » (PDF) . Архивировано из оригинала 14 июля 2011 года . Проверено 8 августа 2016 г.
{{cite web}}: CS1 maint: bot: статус исходного URL неизвестен ( ссылка ) (PDF; 5,4 МБ), Проспект 2011 г. - ^ 983 EP 046983 , S. Tahara и др., «Способ непрерывного получения этиленгликоля», передано Ube Industries и HT Teunissen и CJ Elsevier, Катализируемое рутением гидрирование диметилоксалата до этиленгликоля , J. Chem. Соц., хим. Сообщ., 1997, 667-668), DOI:10.1039/A700862G .
- ^ С. Чжан и др., Высокодисперсные катализаторы на основе меди из прекурсора многослойного двойного гидроксида Cu-Zn-Al для газофазного гидрирования диметилоксалата в этиленгликоль , Catalysis Letters, сентябрь 2012 г., 142 (9), 1121 –1127, DOI:10.1007/s10562-012-0871-8
- ^ «Отдельные новости» .
- ^ US 4544507 , П. Фоли, «Производство диэфиров карбонатов из диэфиров оксалатов», присвоен Celanese Corp.
- ^ US 5834614 , К. Нишихира и др., «Способ получения диарилкарбоната», передан Ube Industries, Ltd. и XB Ma et al., Получение дифенилоксалата переэтерификацией диметилоксалата фенолом на катализаторе TS-1 , Китай. хим. Lett., 14 (5), 461–464 (2003), DOI:10.1016/s0378-3820(03)00075-4 .
- ^ Бергман, Ян; Норрби, Пер-Ола; Сэнд, Питер (1 января 1990 г.). «Алкилирование эфирами щавелевой кислоты. Область применения и механизм» . Тетраэдр . 46 (17): 6113–6124. дои : 10.1016/S0040-4020(01)87933-3 . ISSN 0040-4020 . S2CID 94945519 .