Антитромбин
| СЕРПИНЦ1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | SERPINC1 , AT3, AT3D, ATIII, THPH7, член 1 семейства серпинов C, ATIII-R2, ATIII-T2, ATIII-T1 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | ОПУСТИТЬ : 107300 ; МГИ : 88095 ; Гомологен : 20139 ; GeneCards : SERPINC1 ; OMA : SERPINC1 — ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Антитромбин (АТ) – небольшой гликопротеин , инактивирующий некоторые ферменты системы свертывания крови . Это белок, состоящий из 464 аминокислот, вырабатываемый печенью . Он содержит три дисульфидные связи и всего четыре возможных сайта гликозилирования . α-Антитромбин является доминирующей формой антитромбина, обнаруженной в плазме крови , и имеет олигосахарид, занимающий каждый из четырех сайтов гликозилирования. Единственный сайт гликозилирования остается неизменно незанятым в минорной форме антитромбина, β-антитромбине. [5] Его активность многократно увеличивается антикоагулянтом гепарином фактором , который усиливает связывание антитромбина с фактором IIa (тромбином) и Ха . [6]
Структура
[ редактировать ]Антитромбин также называют антитромбином III (АТ III). Обозначения от антитромбина I до антитромбина IV возникли в ранних исследованиях, проведенных в 1950-х годах Сигерсом, Джонсоном и Феллом. [7]
Антитромбин I (AT I) относится к связыванию тромбина с фибрином после того, как тромбин активировал фибриноген , в некаталитическом сайте связывания тромбина. Антитромбин II (АТ II) относится к кофактору плазмы, который вместе с гепарином препятствует взаимодействию тромбина и фибриногена . Антитромбин III (АТ III) относится к веществу в плазме , которое инактивирует тромбин. Антитромбин IV (АТ IV) относится к антитромбину, который активируется во время и вскоре после свертывания крови . [8] Только AT III и, возможно, AT I имеют медицинское значение. AT III обычно называют исключительно «антитромбином», и именно антитромбин III обсуждается в этой статье.

антитромбина Период полувыведения в плазме крови составляет около 3 дней. [9] Нормальная концентрация антитромбина в плазме крови человека составляет примерно 0,12 мг/мл, что эквивалентно молярной концентрации 2,3 мкМ. [10] Антитромбин был выделен из плазмы большого числа видов, помимо человека. [11] Как показало секвенирование белков и кДНК , все антитромбины коров, овец, кроликов и мышей состоят из 433 аминокислот, что на одну аминокислоту длиннее человеческого антитромбина. Считается, что дополнительная аминокислота находится в положении аминокислоты 6. Коровьи, овечьи, кроличьи, мышиные и человеческие антитромбины имеют идентичность аминокислотных последовательностей от 84 до 89%. [12] Шесть аминокислот образуют три внутримолекулярные дисульфидные связи : Cys 8-Cys128, Cys21-Cys95 и Cys248-Cys430.Все они имеют четыре потенциальных сайта N-гликозилирования . Они встречаются с аминокислотами аспарагина (Asn) под номерами 96, 135, 155 и 192 у людей и с аналогичными номерами аминокислот у других видов. Все эти сайты заняты ковалентно присоединенными боковыми цепями олигосахаридов в преобладающей форме человеческого антитромбина, α-антитромбине, в результате чего молекулярная масса этой формы антитромбина равна 58 200. [5] Потенциальный сайт гликозилирования аспарагина 135 не занят в минорной форме (около 10%) антитромбина, β-антитромбине (см. фигуру 1 ). [13]
Рекомбинантные антитромбины со свойствами, подобными свойствам нормального человеческого антитромбина, были получены с использованием инфицированных бакуловирусом клеток насекомых и линий клеток млекопитающих, выращенных в культуре клеток . [14] [15] [16] [17] Эти рекомбинантные антитромбины обычно имеют паттерны гликозилирования, отличные от нормального антитромбина, и обычно используются в структурных исследованиях антитромбина. По этой причине многие структуры антитромбина, хранящиеся в банке данных по белкам и представленные в этой статье, демонстрируют переменные паттерны гликозилирования.
Антитромбин начинается в нативном состоянии, которое имеет более высокую свободную энергию по сравнению со латентным состоянием, до которого он распадается в среднем через 3 дня. Латентное состояние имеет ту же форму, что и активированное состояние, то есть когда происходит ингибирование тромбина. По сути, это классический пример преимуществ кинетического и термодинамического контроля сворачивания белка.
Функция
[ редактировать ]

Антитромбин представляет собой серпин (ингибитор сериновой протеазы) и, таким образом, по структуре похож на большинство других плазмы протеаз ингибиторов , таких как альфа-1-антихимотрипсин , альфа-2-антиплазмин и кофактор гепарина II .
Физиологическими протеазами- мишенями антитромбина являются протеазы контактного пути активации (ранее известные как внутренний путь), а именно активированные формы фактора X (Xa), фактора IX (IXa), фактора XI (XIa), фактора XII (XIIa). и, в большей степени, фактор II (тромбин) (IIa), а также активированную форму фактора VII (VIIa) пути тканевого фактора (ранее известного как внешний путь). [20] Ингибитор также инактивирует калликреин и плазмин. [ нужна ссылка ] , также участвует в свертывании крови. Однако он инактивирует некоторые другие сериновые протеазы, которые не участвуют в коагуляции, такие как трипсин и субъединицу C1s фермента C1, участвующего в классическом пути комплемента . [12] [21]
Инактивация протеазы возникает вследствие захвата протеазы в эквимолярный комплекс с антитромбином, в котором активный центр фермента протеазы недоступен для ее обычного субстрата . [12] Образование комплекса антитромбин-протеаза включает взаимодействие между протеазой и специфической реактивной пептидной связью внутри антитромбина. В человеческом антитромбине эта связь находится между аргинином (arg) 393 и серином (ser) 394 (см. Фигуру 2 и Фигуру 3 ). [12]
Считается, что ферменты протеазы оказываются в ловушке неактивных комплексов антитромбин-протеаза в результате их атаки на реактивную связь. Хотя атака аналогичной связи внутри нормального субстрата протеазы приводит к быстрому протеолитическому расщеплению субстрата, инициирование атаки на реактивную связь с антитромбином приводит к активации антитромбина и захвату фермента на промежуточной стадии протеолитического процесса. Со временем тромбин способен расщепить реактивную связь внутри антитромбина, и неактивный комплекс антитромбин-тромбин диссоциирует, однако время, необходимое для этого, может превышать 3 дня. [22] Однако связи P3-P4 и P1'-P2' могут быть быстро расщеплены нейтрофильной эластазой и бактериальным ферментом термолизином соответственно, в результате чего неактивные антитромбины больше не способны ингибировать активность тромбина. [23]
Скорость ингибирования антитромбином активности протеазы значительно увеличивается за счет его дополнительного связывания с гепарином , а также его инактивации нейтрофильной эластазой . [23]
Антитромбин и гепарин
[ редактировать ]Антитромбин инактивирует свои физиологические ферменты-мишени, тромбин, фактор Ха и фактор IXa, с константами скорости 7–11 x 10. 3 , 2,5 х 10 3 М −1 с −1 и 1 х 10 М −1 с −1 соответственно. [5] [24] Скорость антитромбин-тромбиновой инактивации увеличивается до 1,5 - 4 х 10. 7 М −1 с −1 в присутствии гепарина, т.е. реакция ускоряется в 2000-4000 раз. [25] [26] [27] [28] Ингибирование фактора Ха ускоряется только в 500–1000 раз в присутствии гепарина, а максимальная константа скорости в 10 раз ниже, чем у ингибирования тромбина. [25] [28] Скорость усиления ингибирования антитромбина-фактора IXa увеличивается примерно в 1 миллион раз в присутствии гепарина и физиологических уровней кальция . [24]
AT-III связывается со специфической сульфатированной последовательностью пентасахарида, содержащейся в полимере гепарина.
GlcNAc/NS(6S)-GlcA-GlcNS(3S,6S)-IdoA(2S)-GlcNS(6S)
При связывании с этой пентасахаридной последовательностью ингибирование активности протеазы усиливается гепарином в результате двух различных механизмов. [29] В одном из механизмов стимуляция гепарином фактора IXa и ингибирование Ха зависит от конформационного изменения антитромбина, затрагивающего петлю реактивного центра, и, таким образом, является аллостерическим . [30] По другому механизму стимуляция ингибирования тромбина зависит от образования тройного комплекса между АТ-III, тромбином и гепарином. [30]
Аллостерическая активация
[ редактировать ]
Повышенное ингибирование факторов IXa и Ха требует минимальной последовательности пентасахарида гепарина. Конформационные изменения, которые происходят в антитромбине в ответ на связывание пентасахарида, хорошо документированы. [18] [31] [32]
В отсутствие гепарина аминокислоты P14 и P15 (см. рисунок 3 ) из петли реактивного центра встроены в основную часть белка (в частности, в верхнюю часть бета-листа A). Эта особенность является общей с другими серпинами, такими как кофактор гепарина II , альфа-1-антихимотрипсин и MENT .
Конформационное изменение, наиболее значимое для ингибирования факторов IXa и Ха, затрагивает аминокислоты P14 и P15 в N-концевой области петли реактивного сайта (обведено кружком на рисунке 4, модель B ). Эту область назвали шарнирной областью. Конформационное изменение внутри шарнирной области в ответ на связывание гепарина приводит к изгнанию P14 и P15 из основной части белка, и было показано, что предотвращение этого конформационного изменения не приводит к усилению ингибирования факторов IXa и Ха. [30] Считается, что повышенная гибкость, придаваемая петле реактивного сайта в результате конформационного изменения шарнирной области, является ключевым фактором, влияющим на усиление ингибирования факторов IXa и Ха. Подсчитано, что в отсутствие пентасахарида только одна из каждых 400 молекул антитромбина (0,25%) находится в активной конформации с удаленными аминокислотами Р14 и Р15. [30]
Неаллостерическая активация
[ редактировать ]
Для усиления ингибирования тромбина требуется минимальное количество пентасахарида гепарина плюс, по меньшей мере, дополнительные 13 мономерных единиц. [33] Считается, что это связано с требованием, чтобы антитромбин и тромбин связывались с одной и той же цепью гепарина, прилегающей друг к другу. Это можно увидеть в серии моделей, показанных на рисунке 5 .
В структурах, показанных на фигуре 5, С-концевая часть (P'-сторона) петли реактивного сайта находится в расширенной конформации по сравнению с другими неактивированными или активированными гепарином антитромбиновыми структурами. [34] P'-область антитромбина необычно длинна по сравнению с P'-областью других серпинов и в неактивированных или активированных гепарином структурах антитромбина образует прочно связанный водородными связями β-поворот . Удлинение P' происходит за счет разрыва всех водородных связей, участвующих в β-повороте . [34]
Шарнирную область антитромбина в комплексе на фигуре 5 невозможно смоделировать из-за ее конформационной гибкости, а аминокислоты P9-P14 не наблюдаются в этой структуре. Эта конформационная гибкость указывает на то, что равновесие внутри комплекса может существовать между конформацией антитромбина, в которую вставлена петля реактивного сайта P14 P15, и конформацией исключенной петли реактивного сайта P14 P15. В подтверждение этого анализ положения P15 Gly в комплексе на рисунке 5 (обозначенном в модели B) показывает, что он вставлен в бета-лист A (см. модель C). [34]
Влияние гликозилирования на активность
[ редактировать ]α-Антитромбин и β-антитромбин различаются по сродству к гепарину. [35] Разница в константе диссоциации между ними трехкратная для пентасахарида, показанного на рисунке 3 , и более чем десятикратная для полноразмерного гепарина, при этом β-антитромбин имеет более высокое сродство. [36] Считается, что более высокое сродство β-антитромбина связано с повышенной скоростью, с которой происходят последующие конформационные изменения внутри белка при первоначальном связывании гепарина. Считается, что для α-антитромбина дополнительное гликозилирование Asn-135 не мешает первоначальному связыванию гепарина, а скорее ингибирует любые возникающие конформационные изменения. [35]
Несмотря на то, что он присутствует только на уровне 5–10% от уровней α-антитромбина, из-за его повышенного сродства к гепарину считается, что β-антитромбин более важен, чем α-антитромбин, в контроле тромбогенных событий, возникающих в результате повреждения тканей. Действительно, ингибирование тромбина после повреждения аорты приписывают исключительно β-антитромбину. [37]
Недостатки
[ редактировать ]Доказательства важной роли антитромбина в регуляции нормального свертывания крови подтверждаются корреляцией между наследственным или приобретенным дефицитом антитромбина и повышенным риском развития тромботических заболеваний у любого больного. [38] Дефицит антитромбина обычно выявляется, когда у пациента возникает рецидивирующий венозный тромбоз и тромбоэмболия легочной артерии .
Приобретенный дефицит антитромбина
[ редактировать ]Приобретенный дефицит антитромбина возникает в результате трех совершенно разных механизмов. Первым механизмом является повышенная экскреция, которая может возникнуть при почечной недостаточности, связанной с нефротическим синдромом протеинурии . Второй механизм возникает в результате снижения выработки, что наблюдается при печеночной недостаточности или циррозе печени, а также незрелости печени вследствие преждевременных родов . Третий механизм возникает в результате ускоренного потребления, которое наиболее выражено в результате тяжелой травмы , но также может наблюдаться в меньшем масштабе в результате таких вмешательств, как обширное хирургическое вмешательство или искусственное кровообращение . [39]
Наследственный дефицит антитромбина
[ редактировать ]Частота наследственного дефицита антитромбина оценивается в пределах от 1:2000 до 1:5000 среди нормальной популяции, причем первая семья, страдающая от наследственного дефицита антитромбина, была описана в 1965 году. [40] [41] Впоследствии было предложено классифицировать наследственную недостаточность антитромбина как тип I или тип II на основе функционального и иммунохимического анализа антитромбина. [42] Поддержание адекватного уровня активности антитромбина, составляющего не менее 70% от нормального функционального уровня, необходимо для обеспечения эффективного ингибирования протеаз свертывания крови. [43] Обычно в результате дефицита антитромбина I или II типа функциональные уровни антитромбина снижаются до уровня ниже 50% от нормы. [44]
Дефицит антитромбина I типа
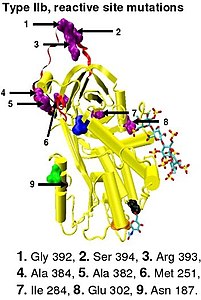
[ редактировать ]Дефицит антитромбина I типа характеризуется снижением как антитромбиновой активности, так и концентрации антитромбина в крови больных. Дефицит типа I первоначально был разделен на две подгруппы: Ia и Ib, в зависимости от сродства к гепарину. Антитромбин лиц подгруппы Ia показал нормальное сродство к гепарину, тогда как антитромбин лиц подгруппы Ib показал пониженное сродство к гепарину. [45] Последующий функциональный анализ группы случаев 1b выявил не только снижение сродства к гепарину, но и множественные или «плейотрофические» нарушения, влияющие на реактивный центр, сайт связывания гепарина и концентрацию антитромбина в крови. В пересмотренной системе классификации, принятой Комитетом по науке и стандартизации Международного общества тромбозов и гемостаза, случаи типа Ib теперь обозначаются как ТЭЛА типа II, плейотрофический эффект. [46]
Большинство случаев дефицита I типа обусловлены точечными мутациями , делециями или незначительными вставками в гене антитромбина. Эти генетические мутации приводят к дефициту типа I посредством различных механизмов:
- Мутации могут производить нестабильные антитромбины, которые либо не экспортируются в кровь должным образом после завершения биосинтеза, либо существуют в крови в течение более короткого периода времени, например, при удалении 6 пар оснований в кодонах 106–108. [47]
- Мутации могут влиять на процессинг мРНК гена антитромбина.
- Незначительные вставки или делеции могут привести к мутациям сдвига рамки и преждевременной терминации гена антитромбина.
- Точечные мутации также могут привести к преждевременному образованию терминирующего или стоп-кодона , например, мутация кодона 129, CGA → TGA ( UGA после транскрипции), заменяет нормальный кодон аргинина терминирующим кодоном. [48]
Дефицит антитромбина II типа
[ редактировать ]Дефицит антитромбина II типа характеризуется нормальным уровнем антитромбина, но сниженной активностью антитромбина в крови больных людей. Первоначально было предложено разделить дефицит II типа на три подгруппы (IIa, IIb и IIc) в зависимости от того, функциональная активность антитромбина снижается или сохраняется. [45]
- Подгруппа IIa — снижение инактивации тромбина, снижение инактивации фактора Ха и снижение сродства к гепарину.
- Подгруппа IIб – Снижение инактивации тромбина и нормальное сродство к гепарину.
- Подгруппа IIc — нормальная инактивация тромбина, нормальная инактивация фактора Ха и пониженное сродство к гепарину.
В пересмотренной системе классификации, вновь принятой Комитетом по науке и стандартизации Международного общества по тромбозам и гемостазу, дефицит антитромбина типа II по-прежнему подразделяется на три подгруппы: уже упомянутый PE типа II наряду с RS типа II, где мутации влияют на реактивный сайт и HBS типа II, где мутации влияют на сайт связывания антитромбина и гепарина. [46] Для целей базы данных мутаций антитромбина, составленной членами Подкомитета по ингибиторам плазменной коагуляции Комитета по науке и стандартизации Международного общества по тромбозу и гемостазу, случаи типа IIa теперь классифицируются как PE типа II, случаи типа IIb - как RS типа II. и случаи типа IIc как HBS типа II. [49]
Топонимы
[ редактировать ]В настоящее время относительно легко охарактеризовать специфическую генетическую мутацию антитромбина. Однако до использования современных методов характеристики исследователи называли мутации в честь города, в котором проживал человек, страдающий от дефицита, т.е. мутация антитромбина обозначалась топонимом . [50] Современная мутационная характеристика с тех пор показала, что многие отдельные топонимы антитромбина на самом деле являются результатом одной и той же генетической мутации, например антитромбин-Тояма эквивалентен антитромбину-Кумамото, -Амьен, -Тур, -Париж-1, -Париж-2, -Париж-2, -Амьен, -Париж-2, -Алжир, -Падуя-2 и -Барселона. [49]
Медицинское использование
[ редактировать ]Антитромбин используется в качестве белкового терапевтического препарата , который можно выделить из плазмы человека. [51] или производятся рекомбинантным путем (например, Атрин, который производится в молоке генетически модифицированных коз [52] [53] ).
Он одобрен FDA в качестве антикоагулянта для предотвращения образования тромбов до, во время или после операции или родов у пациентов с наследственной недостаточностью антитромбина. [51] [53]
Его изучали при сепсисе для снижения диффузного внутрисосудистого свертывания крови и других исходов. Не было обнаружено никакой пользы от него у людей в критическом состоянии с сепсисом. [54]
Расщепленный и латентный антитромбин
[ редактировать ]
Расщепление в реактивном сайте приводит к захвату тромбиновой протеазы с перемещением петли расщепленного реактивного сайта вместе со связанной протеазой, так чтопетля образует дополнительную шестую цепь в середине бета-листа А. Это перемещение петли реактивного центра также может быть индуцировано без расщепления, при этом полученная кристаллографическая структура будет идентична структуре физиологически латентной конформации ингибитора активатора плазминогена-1 (PAI). -1). [55] По этой причине конформация антитромбина, в которой петля реактивного центра включена в нерасщепленную основную часть белка, называется латентным антитромбином. В отличие от PAI-1 переход антитромбина из нормальной или нативной конформации в латентную конформацию необратим.
Нативный антитромбин можно превратить в латентный антитромбин (L-антитромбин) путем нагревания отдельно или в присутствии цитрата . [56] [57] Однако без чрезмерного нагревания и при температуре 37 °C (температура тела) 10% всего антитромбина, циркулирующего в крови, превращается в L-антитромбин в течение 24 часов. [58] [59] Структура L-антитромбина показана на фигуре 6 .
Трехмерная структура нативного антитромбина была впервые определена в 1994 году. [31] [32] Неожиданно белок кристаллизовался в виде гетеродимера, состоящего из одной молекулы нативного антитромбина и одной молекулы латентного антитромбина. Латентный антитромбин при образовании сразу же связывается с молекулой нативного антитромбина с образованием гетеродимера, и только когда концентрация латентного антитромбина превышает 50% от общего антитромбина, его можно обнаружить аналитически. [59] Латентная форма антитромбина не только неактивна в отношении целевых протеаз свертывания крови, но и ее димеризация с активной в других отношениях молекулой нативного антитромбина также приводит к инактивации нативных молекул. Физиологическое воздействие потери активности антитромбина либо через латентное образование антитромбина, либо через последующее образование димера усугубляется предпочтением возникновения димеризации между активированным гепарином β-антитромбином и латентным антитромбином, в отличие от α-антитромбина. [59]
Также была выделена форма антитромбина, которая является промежуточным звеном в превращении нативной и латентной форм антитромбина, и ее назвали прелатентным антитромбином . [60]
Антиангиогенный антитромбин
[ редактировать ]Ангиогенез — это физиологический процесс, включающий рост новых кровеносных сосудов из ранее существовавших сосудов. В нормальных физиологических условиях ангиогенез жестко регулируется и контролируется балансом ангиогенных стимуляторов и ангиогенных ингибиторов . Рост опухоли зависит от ангиогенеза, и во время развития опухоли требуется устойчивая продукция ангиогенных стимулирующих факторов наряду со снижением количества ангиогенных ингибирующих факторов, продуцируемых опухолевыми клетками. [61] Расщепленная и латентная форма антитромбина мощно ингибируют ангиогенез и рост опухоли на животных моделях. [62] Было показано, что прелатентная форма антитромбина ингибирует ангиогенез in vitro, но на сегодняшний день не тестировалась на экспериментальных моделях животных.
Ссылки
[ редактировать ]- ^ Перейти обратно: а б с GRCh38: Версия Ensembl 89: ENSG00000117601 – Ensembl , май 2017 г.
- ^ Перейти обратно: а б с GRCm38: выпуск Ensembl 89: ENSMUSG00000026715 – Ensembl , май 2017 г.
- ^ «Ссылка на Human PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Ссылка на Mouse PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ Перейти обратно: а б с Бьорк I, Олсон, Дж. Э. (1997). Антитромбин, очень важный серпин (в химии и биологии серпинов) . Пленум Пресс. стр. 17–33. ISBN 978-0-306-45698-5 .
- ^ Финли А., Гринберг С. (1 июня 2013 г.). «Обзорная статья: чувствительность и резистентность к гепарину: ведение во время искусственного кровообращения» . Анестезия и анальгезия . 116 (6): 1210–1222. дои : 10.1213/ANE.0b013e31827e4e62 . ISSN 1526-7598 . ПМИД 23408671 . S2CID 22500786 .
- ^ Сигерс WH, Джонсон Дж. Ф., Фелл С. (1954). «Антитромбиновая реакция на активацию протромбина». Являюсь. Дж. Физиол . 176 (1): 97–103. дои : 10.1152/ajplegacy.1953.176.1.97 . ПМИД 13124503 .
- ^ Инь Э.Т., Весслер С., Столл П.Дж. (1971). «Идентичность плазменного ингибитора фактора X с антитромбином 3 и кофактором гепарина» . Ж. Биол. Хим . 246 (11): 3712–3719. дои : 10.1016/S0021-9258(18)62185-4 . ПМИД 4102937 .
- ^ Коллен Д., Шец Дж., де Кок Ф., Холмер Э., Верстраете М. (1977). «Метаболизм антитромбина III (кофактора гепарина) у человека: эффекты венозного тромбоза при введении гепарина». Евро. Дж. Клин. Инвестируйте . 7 (1): 27–35. дои : 10.1111/j.1365-2362.1977.tb01566.x . ПМИД 65284 . S2CID 22494710 .
- ^ Конард Дж., Бросстад Ф., Ли Ларсен М., Самама М., Абильдгаард Ю. (1983). «Молярная концентрация антитромбина в плазме нормального человека». Гемостаз . 13 (6): 363–368. дои : 10.1159/000214823 . ПМИД 6667903 .
- ^ Джордан Р.Э. (1983). «Антитромбин у позвоночных: сохранение гепарин-зависимого антикоагулянтного механизма». Арх. Биохим. Биофиз . 227 (2): 587–595. дои : 10.1016/0003-9861(83)90488-5 . ПМИД 6607710 .
- ^ Перейти обратно: а б с д Олсон С.Т., Бьорк I (1994). «Регуляция активности тромбина антитромбином и гепарином». Семин. Тромб. Гемост . 20 (4): 373–409. дои : 10.1055/s-2007-1001928 . ПМИД 7899869 . S2CID 28872063 .
- ^ Бреннан С.О., Джордж П.М., Джордан Р.Э. (1987). «Физиологический вариант антитромбина-III не имеет углеводной боковой цепи в Asn 135». ФЭБС Летт . 219 (2): 431–436. Бибкод : 1987FEBSL.219..431B . дои : 10.1016/0014-5793(87)80266-1 . ПМИД 3609301 . S2CID 35438503 .
- ^ Стивенс А.В., Сиддики А., Хирс CH (1987). «Экспрессия функционально активного человеческого антитромбина III» . Труды Национальной академии наук Соединенных Штатов Америки . 84 (11): 3886–3890. Бибкод : 1987PNAS...84.3886S . дои : 10.1073/pnas.84.11.3886 . ПМК 304981 . ПМИД 3473488 .
- ^ Зеттлмейсль Г., Конрад Х.С., Нимц М., Каргес Х.Э. (1989). «Характеристика рекомбинантного человеческого антитромбина III, синтезированного в клетках яичника китайского хомячка» . Ж. Биол. Хим . 264 (35): 21153–21159. дои : 10.1016/S0021-9258(19)30060-2 . ПМИД 2592368 .
- ^ Гиллеспи Л.С., Хиллесланд К.К., Кнауэр DJ (1991). «Экспрессия биологически активного человеческого антитромбина III рекомбинантным бакуловирусом в клетках Spodoptera frugiperda» . Ж. Биол. Хим . 266 (6): 3995–4001. дои : 10.1016/S0021-9258(19)67892-0 . ПМИД 1995647 .
- ^ Эрсдал-Баджу Э, Лу А, Пэн Х, Пикард В, Зендеру П, Тёрк Б, Бьорк И, Олсон С.Т., Бок С.К. (1995). «Устранение гетерогенности гликозилирования, влияющей на сродство к гепарину рекомбинантного человеческого антитромбина III, путем экспрессии бета-подобного варианта в клетках насекомых, инфицированных бакуловирусом» . Биохим. Дж . 310 (Часть 1): 323–330. дои : 10.1042/bj3100323 . ПМЦ 1135891 . ПМИД 7646463 .
- ^ Перейти обратно: а б Уиссток Дж.К., Пайк Р.Н. и др. (2000). «Конформационные изменения серпинов: II. Механизм активации антитромбина гепарином». Дж. Мол. Биол . 301 (5): 1287–1305. дои : 10.1006/jmbi.2000.3982 . ПМИД 10966821 .
- ^ Шехтер I, Бергер А (1967). «О размерах активного центра протеаз. И. Папаин». Биохим. Биофиз. Рез. Коммун . 27 (2): 157–162. дои : 10.1016/S0006-291X(67)80055-X . ПМИД 6035483 .
- ^ Перссон Э., Бак Х., Олсен О.Г. (2001). «Замена валина на лейцин 305 в факторе VIIa увеличивает внутреннюю ферментативную активность» . Ж. Биол. Хим . 276 (31): 29195–29199. дои : 10.1074/jbc.M102187200 . ПМИД 11389142 .
- ^ Огстон Д., Мюррей Дж. Кроуфорд ГП (1976). «Ингибирование активированной субъединицы Cls первого компонента комплемента антитромбином III в присутствии гепарина». Тромб. Рез . 9 (3): 217–222. дои : 10.1016/0049-3848(76)90210-3 . ПМИД 982345 .
- ^ Даниэльссон А, Бьорк I (1980). «Медленная, спонтанная диссоциация комплекса антитромбин-тромбин приводит к образованию протеолитически модифицированной формы ингибитора». ФЭБС Летт . 119 (2): 241–244. Бибкод : 1980FEBSL.119..241D . дои : 10.1016/0014-5793(80)80262-6 . ПМИД 7428936 . S2CID 40067251 .
- ^ Перейти обратно: а б Чанг В.С., Уорделл М.Р., Ломас Д.А., Каррелл Р.В. (1996). «Изучение конформаций реактивной петли серпина путем протеолитического расщепления» . Биохим. Дж . 314 (2): 647–653. дои : 10.1042/bj3140647 . ПМК 1217096 . ПМИД 8670081 .
- ^ Перейти обратно: а б Бедстед Т., Суонсон Р., Чуанг Ю.Дж., Бок П.Е., Бьорк И., Олсон С.Т. (2003). «Ионы гепарина и кальция резко усиливают реактивность антитромбина с фактором IXa, создавая новые экзосайты взаимодействия». Биохимия . 42 (27): 8143–8152. дои : 10.1021/bi034363y . ПМИД 12846563 .
- ^ Перейти обратно: а б Джордан Р.Э., генеральный менеджер Оосты, Гарднер В.Т., Розенберг Р.Д. (1980). «Кинетика гемостатических фермент-антитромбиновых взаимодействий в присутствии низкомолекулярного гепарина» . Ж. Биол. Хим . 255 (21): 10081–10090. дои : 10.1016/S0021-9258(19)70431-1 . ПМИД 6448846 .
- ^ Гриффит М.Дж. (1982). «Кинетика усиленной гепарином реакции антитромбин III/тромбин. Доказательства шаблонной модели механизма действия гепарина» . Ж. Биол. Хим . 257 (13): 7360–7365. дои : 10.1016/S0021-9258(18)34385-0 . ПМИД 7085630 .
- ^ Олсон С.Т., Бьорк I (1991). «Преимущественный вклад поверхностного приближения в механизм ускорения гепарином реакции антитромбин-тромбин. Выяснение эффектов концентрации соли» . Ж. Биол. Хим . 266 (10): 6353–6354. дои : 10.1016/S0021-9258(18)38125-0 . ПМИД 2007588 .
- ^ Перейти обратно: а б Олсон С.Т., Бьорк И., Шеффер Р., Крейг П.А., Шор Дж.Д., Чой Дж. (1992). «Роль антитромбинсвязывающего пентасахарида в ускорении гепарином антитромбин-протеиназных реакций. Разрешение вклада конформационных изменений антитромбина в повышение скорости гепарина» . Ж. Биол. Хим . 267 (18): 12528–12538. дои : 10.1016/S0021-9258(18)42309-5 . ПМИД 1618758 .
- ^ Джонсон DJ, Лэнгдаун Дж., Ли В., Луис С.А., Бэглин Т.П., Хантингтон Дж.А. (2006). «Кристаллическая структура мономерного нативного антитромбина обнаруживает новую конформацию петли реактивного центра» . Ж. Биол. Хим . 281 (46): 35478–35486. дои : 10.1074/jbc.M607204200 . ПМЦ 2679979 . ПМИД 16973611 .
- ^ Перейти обратно: а б с д Лэнгдаун Дж., Джонсон DJ, Бэглин Т.П., Хантингтон Дж.А. (2004). «Аллостерическая активация антитромбина критически зависит от расширения шарнирной области» . Ж. Биол. Хим . 279 (45): 47288–47297. дои : 10.1074/jbc.M408961200 . ПМИД 15326167 .
- ^ Перейти обратно: а б Шредер Х.А., де Бур Б., Дейкема Р., Малдерс Дж., Теуниссен Х.Дж., Гроотенхейс П.Д., Хол В.Г. (1994). «Интактный и расщепленный комплекс антитромбина III человека как модель взаимодействия серпин-протеиназы». Структурная и молекулярная биология природы . 1 (1): 48–54. дои : 10.1038/nsb0194-48 . ПМИД 7656006 . S2CID 39110624 .
- ^ Перейти обратно: а б Каррелл Р.В., Стейн П.Е., Ферми Г., Уорделл М.Р. (1994). «Биологическое значение структуры 3 А димерного антитромбина» . Структура . 2 (4): 257–270. дои : 10.1016/S0969-2126(00)00028-9 . ПМИД 8087553 .
- ^ Петиту М., Эро Ж.П., Бернат А., Дригес П.А., Дюшосой П., Лормо Ж.К., Герберт Ж.М. (1999). «Синтез миметиков гепарина, ингибирующих тромбин, без побочных эффектов». Природа . 398 (6726): 417–422. Бибкод : 1999Natur.398..417P . дои : 10.1038/18877 . ПМИД 10201371 . S2CID 4339441 .
- ^ Перейти обратно: а б с Ли В., Джонсон DJ, Эсмон CT, Хантингтон Дж.А. (2004). «Структура тройного комплекса антитромбин-тромбин-гепарин раскрывает антитромботический механизм гепарина». Структурная и молекулярная биология природы . 11 (9): 857–862. дои : 10.1038/nsmb811 . ПМИД 15311269 . S2CID 28790576 .
- ^ Перейти обратно: а б Маккой А.Дж., Пей XY, Скиннер Р., Абрахамс Дж.П., Каррелл Р.В. (2003). «Структура бета-антитромбина и влияние гликозилирования на сродство и активность антитромбина к гепарину». Дж. Мол. Биол . 326 (3): 823–833. дои : 10.1016/S0022-2836(02)01382-7 . hdl : 1887/3620879 . ПМИД 12581643 .
- ^ Терк Б., Бриедитис И., Бок С.К., Олсон С.Т., Бьорк И. (1997). «Олигосахаридная боковая цепь Asn-135 альфа-антитромбина, отсутствующая в бета-антитромбине, снижает сродство ингибитора к гепарину, влияя на конформационные изменения, индуцированные гепарином». Биохимия . 36 (22): 6682–6691. дои : 10.1021/bi9702492 . ПМИД 9184148 .
- ^ Фребелиус С., Исакссон С., Сведенборг Дж. (1996). «Ингибирование тромбина антитромбином III на субэндотелии объясняется изоформой АТ бета». Артериосклер. Тромб. Васк. Биол . 16 (10): 1292–1297. дои : 10.1161/01.ATV.16.10.1292 . ПМИД 8857927 .
- ^ ван Бовен Х.Х., Лейн Д.А. (1997). «Антитромбин и его наследственные состояния дефицита». Семин. Гематол . 34 (3): 188–204. ПМИД 9241705 .
- ^ Маклин П.С., Тейт RC (2007). «Наследственный и приобретенный дефицит антитромбина: эпидемиология, патогенез и варианты лечения». Наркотики . 67 (10): 1429–1440. дои : 10.2165/00003495-200767100-00005 . ПМИД 17600391 . S2CID 46971091 .
- ^ Лейн Д.А., Кунц Г., Олдс Р.Дж., Тейн С.Л. (1996). «Молекулярная генетика дефицита антитромбина». Кровавый преподобный . 10 (2): 59–74. дои : 10.1016/S0268-960X(96)90034-X . ПМИД 8813337 .
- ^ Эгеберг О (1965). «Наследственный дефицит антитромбина, вызывающий тромбофилию». Тромб. Диат. Геморрой . 13 (2): 516–530. дои : 10.1055/s-0038-1656297 . ПМИД 14347873 . S2CID 42594050 .
- ^ Сас Г, Пето И, Банхедьи Д, Бласко Г, Домьян Г (1980). «Гетерогенность «классического» дефицита антитромбина III». Тромб. Гемост . 43 (2): 133–136. дои : 10.1055/s-0038-1650034 . ПМИД 7455972 . S2CID 38459609 .
- ^ Лейн Д.А., Олдс Р.Дж., Конард Дж., Буаклер М., Бок С.К., Халтин М., Абильдгаард Ю., Ирландия Х., Томпсон Э., Сас Дж. (1992). «Плейотропные эффекты мутаций замены цепи антитромбина 1C» . Дж. Клин. Инвестируйте . 90 (6): 2422–2433. дои : 10.1172/JCI116133 . ПМЦ 443398 . ПМИД 1469094 .
- ^ Лейн Д.А., Олдс Р.Дж., Тейн С.Л. (1994). «Антитромбин III: краткое изложение первого обновления базы данных» . Нуклеиновые кислоты Рез . 22 (17): 3556–3559. ПМК 308318 . ПМИД 7937056 .
- ^ Перейти обратно: а б Сас Джи (1984). «Наследственный дефицит антитромбина III: биохимические аспекты». Гематологическая . 17 (1): 81–86. ПМИД 6724355 .
- ^ Перейти обратно: а б Лейн Д.А., Олдс Р.Дж., Буасклер М., Чоудхури В., Тейн С.Л., Купер Д.Н., Блайчман М., Перри Д., Эммерих Дж., Айах М. (1993). «База данных мутаций антитромбина III: первое обновление. Для подкомитета по тромбину и его ингибиторам Комитета по науке и стандартизации Международного общества по тромбозу и гемостазу». Тромб. Гемост . 70 (2): 361–369. дои : 10.1055/s-0038-1649581 . ПМИД 8236149 . S2CID 43884122 .
- ^ Олдс Р.Дж., Лейн Д.А., Бересфорд CH, Абильдгаард Ю., Хьюз П.М., Тейн С.Л. (1993). «Рекуррентная делеция гена антитромбина AT106-108 (-6 п.н.), выявленная методом гетеродуплексного обнаружения ДНК». Геномика . 16 (1): 298–299. дои : 10.1006/geno.1993.1184 . ПМИД 8486379 .
- ^ Олдс Р.Дж., Лейн Д.А., Ирландия Х., Финацци Г., Барбуи Т., Абильдгаард У., Джиролами А., Тейн С.Л. (1991). «Общая точечная мутация, вызывающая дефицит антитромбина III типа 1А: AT129 CGA в TGA (Arg to Stop)». Тромб. Рез . 64 (5): 621–625. дои : 10.1016/S0049-3848(05)80011-8 . ПМИД 1808766 .
- ^ Перейти обратно: а б Имперский колледж Лондона, медицинский факультет, база данных мутаций антитромбина . Проверено 16 августа 2008 г.
- ^ Блайхман М.А., Остин Р.К., Фернандес-Рачубински Ф., Шеффилд В.П. (1992). «Молекулярные основы наследственного дефицита антитромбина человека» . Кровь . 80 (9): 2159–2171. дои : 10.1182/blood.V80.9.2159.2159 . ПМИД 1421387 .
- ^ Перейти обратно: а б «Этикетка Тромбата III» (PDF) . Архивировано из оригинала (PDF) 15 ноября 2012 г. Проверено 23 февраля 2013 г.
- ^ Веб-сайт FDA для ATryn (BL 125284)
- ^ Перейти обратно: а б Антитромбин (рекомбинантный) Вкладыш в упаковку США ATryn для инъекций, 3 февраля 2009 г.
- ^ Аллингструп М., Веттерслев Дж., Равн Ф.Б., Мёллер А.М., Афшари А. (9 февраля 2016 г.). «Антитромбин III для пациентов в критическом состоянии: систематический обзор с мета-анализом и последовательным анализом исследований» . Интенсивная медицина . 42 (4): 505–520. дои : 10.1007/s00134-016-4225-7 . ПМК 2137061 . ПМИД 26862016 .
- ^ Моттонен Дж., Стрэнд А., Симерски Дж., Свит Р.М., Дэнли Д.Е., Геохеган К.Ф., Джерард Р.Д., Голдсмит Э.Дж. (1992). «Структурные основы латентного периода ингибитора активатора плазминогена-1». Природа . 355 (6357): 270–273. Бибкод : 1992Natur.355..270M . дои : 10.1038/355270a0 . ПМИД 1731226 . S2CID 4365370 .
- ^ Чанг В.С., Харпер П.Л. (1997). «Коммерческий концентрат антитромбина содержит неактивные L-формы антитромбина». Тромб. Гемост . 77 (2): 323–328. дои : 10.1055/s-0038-1655962 . ПМИД 9157590 . S2CID 21583152 .
- ^ Уорделл М.Р., Чанг В.С., Брюс Д., Скиннер Р., Леск А.М., Каррелл Р.В. (1997). «Препаратная индукция и характеристика L-антитромбина: структурного гомолога латентного ингибитора активатора плазминогена-1». Биохимия . 36 (42): 13133–13142. дои : 10.1021/bi970664u . ПМИД 9335576 .
- ^ Каррелл Р.В., Хантингтон Дж.А., Мушуньдже А., Чжоу А. (2001). «Конформационные основы тромбоза». Тромб. Гемост . 86 (1): 14–22. дои : 10.1055/s-0037-1616196 . ПМИД 11487000 . S2CID 21452323 .
- ^ Перейти обратно: а б с Чжоу А., Хантингтон Дж.А., Каррелл Р.В. (1999). «Образование гетеродимера антитромбина in vivo и возникновение тромбоза». Кровь . 94 (10): 3388–3396. дои : 10.1182/blood.V94.10.3388.422k20_3388_3396 . ПМИД 10552948 .
- ^ Ларссон Х., Акеруд П., Нордлинг К., Рауб-Сегалл Э., Клаессон-Уэлш Л., Бьорк И. (2001). «Новая антиангиогенная форма антитромбина с сохраненной способностью связывать протеиназы и сродством к гепарину» . Ж. Биол. Хим . 276 (15): 11996–12002. дои : 10.1074/jbc.M010170200 . ПМИД 11278631 .
- ^ О'Рейли М.С. (2007). «Антиангиогенный антитромбин». Семин. Тромб. Гемост . 33 (7): 660–666. дои : 10.1055/s-2007-991533 . ПМИД 18000792 . S2CID 260321466 .
- ^ О'Рейли М.С., Пири-Шеперд С., Лейн В.С., Фолкман Дж. (1999). «Антиангиогенная активность расщепленной конформации серпинового антитромбина». Наука . 285 (5435): 1926–1928. дои : 10.1126/science.285.5435.1926 . ПМИД 10489375 .
Дальнейшее чтение
[ редактировать ]- Панцер-Хейниг, Сабина (2009). Антитромбин (III) - Установление педиатрических референтных значений, актуальность для ДВС-синдрома в 1992 г. по сравнению с 2007 г. (Диссертация). Медицинский факультет Шарите - Медицинский университет Берлина.
Внешние ссылки
[ редактировать ]- Онлайн-база данных MEROPS . по пептидазам и их ингибиторам: I04.018. Архивировано 16 октября 2019 г. на Wayback Machine
- Антитромбин + III в Национальной медицинской библиотеке США по медицинским предметным рубрикам (MeSH)
- Расположение генома человека SERPINC1 и SERPINC1 страница сведений о гене в браузере генома UCSC .