альфа-2-макроглобулин
| А2М | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | A2M , A2MD, CPAMD5, FWP007, S863-7, транскупреин, альфа-2-макроглобулин | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | Опустить : 103950 ; МГИ : 2449119 ; Гомологен : 37248 ; Генные карты : A2M ; ОМА : А2М – ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
α 2 -Макроглобулин ( α 2 M ) или альфа-2-макроглобулин представляет собой крупный (720 кДа) белок плазмы , обнаруживаемый в крови . Продуцируется главным образом печенью , а также локально синтезируется макрофагами , фибробластами и клетками коры надпочечников . У человека он кодируется геном А2М .
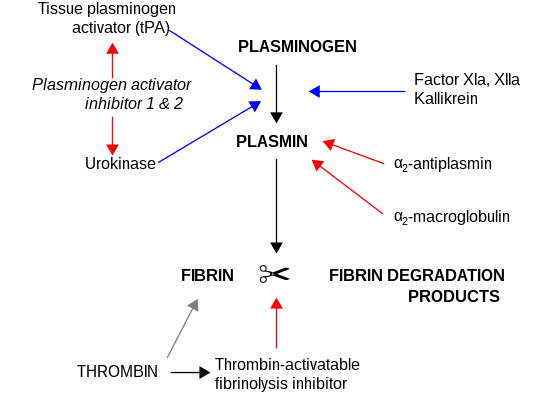
α 2 -Макроглобулин действует как антипротеаза и способен инактивировать огромное количество протеиназ. Он действует как ингибитор фибринолиза, ингибируя плазмин и калликреин . Он действует как ингибитор коагуляции, ингибируя тромбин . α 2 -макроглобулин может действовать как белок-носитель, поскольку он также связывается с многочисленными факторами роста и цитокинами, такими как фактор роста тромбоцитов, основной фактор роста фибробластов, TGF-β, инсулин и IL-1β.
Никакого специфического дефицита, связанного с заболеванием, не выявлено, и ни одно болезненное состояние не связано с низкими концентрациями α 2 -макроглобулина. Концентрация α2 - макроглобулина повышается в 10 и более раз при нефротическом синдроме, когда другие низкомолекулярные белки теряются с мочой. Потери α 2 -макроглобулина в мочу предотвращает его большой размер. Конечным результатом является то, что уровень α2 - макроглобулина в сыворотке крови равен или превышает уровень альбумина при нефротическом синдроме, что приводит к поддержанию онкотического давления .
Структура
[ редактировать ]Человеческий α2 - макроглобулин состоит из четырех идентичных субъединиц, связанных между собой -SS-связями . [ 5 ] [ 6 ] Помимо тетрамерных форм α2 - макроглобулина, димерные , а в последнее время и мономерные ингибиторы αM-протеазы. были идентифицированы [ 7 ] [ 8 ]
Каждый мономер человеческого α 2 -макроглобулина состоит из нескольких функциональных доменов, включая домены макроглобулина, домен, содержащий тиоловый эфир, и рецептор-связывающий домен. [ 9 ] В целом, α2 - макроглобулин является крупнейшим основным неиммуноглобулиновым белком в плазме человека.
Было показано, что аминокислотная последовательность α 2 -макроглобулина на 71% совпадает с аминокислотной последовательностью белка зоны беременности -гликопротеин , связанный с беременностью (PZP; также известного как α 2 ). [ 10 ]
Функция
[ редактировать ]Семейство α-макроглобулина (αM) белков включает ингибиторы протеаз , [ 11 ] типичным примером является человеческий тетрамерный α 2 -макроглобулин (α 2 М); они принадлежат к семейству ингибиторов протеиназ MEROPS I39, клану IL. Эти ингибиторы протеаз имеют несколько общих свойств, которые включают (1) способность ингибировать протеазы всех каталитических классов, (2) наличие «приманочной области» (также известной как последовательность аминокислот в молекуле α 2 -макроглобулина). , или гомологичный белок, который содержит разрезаемые пептидные связи для тех протеиназ, которые он ингибирует) и тиоловый эфир, (3) аналогичный механизм ингибирования протеаз и (4) инактивация ингибирующей способности за счет реакции тиолового эфира с небольшим первичным амины . αM- Ингибиторы протеазы ингибируют за счет стерических препятствий. [ 12 ] Механизм расщеплению включает расщепление протеазой области-приманки, сегмента αM, который особенно восприимчив к протеолитическому , что инициирует конформационные изменения , такие, что αM коллапсирует вокруг протеазы. В образовавшемся комплексе αM-протеаза активный центр протеазы стерически экранирован, что существенно снижает доступ к белковым субстратам . Два дополнительных события происходят как следствие расщепления области-приманки, а именно (1) тиоловый эфир h-цистеинил-g-глутамила становится высокореактивным и (2) значительное конформационное изменение обнажает консервативный COOH-концевой рецептор. , связывающий домен [ 13 ] (РБД). αM Воздействие RBD позволяет протеазному комплексу связываться с клиренса рецепторами и удаляться из кровообращения. [ 14 ] Были идентифицированы тетрамерные, димерные и, в последнее время, мономерные ингибиторы αM-протеазы. [ 7 ] [ 8 ]
α 2 -Макроглобулин способен инактивировать огромное количество протеиназ (в том числе серин- , цистеин- , аспарагин- и металлопротеиназы ). Он действует как ингибитор фибринолиза, ингибируя плазмин и калликреин. Он действует как ингибитор коагуляции, ингибируя тромбин . [ 15 ] α 2 -Макроглобулин имеет в своей структуре участок «приманки» из 35 аминокислот. Протеиназы, связывающиеся и расщепляющие область приманки, становятся связанными с α 2 M. Комплекс протеиназа-α 2 M распознается рецепторами макрофагов и выводится из системы.
α 2 Известно, что -макроглобулин связывает цинк , а также медь в плазме, даже сильнее, чем альбумин, и поэтому он также известен как транскупреин . [ 16 ] От 10 до 15% меди в плазме человека хелатируется α 2 -макроглобулином. [ 17 ]
Болезнь
[ редактировать ]Уровни α2 - макроглобулина повышаются, когда уровень сывороточного альбумина низкий, [ 18 ] который чаще всего наблюдается при нефротическом синдроме , состоянии, при котором почки начинают выделять некоторые более мелкие белки крови. Из-за своего размера α 2 -макроглобулин удерживается в кровотоке. Увеличение производства всех белков означает увеличение концентрации α2 - макроглобулина. Это увеличение оказывает незначительное неблагоприятное воздействие на здоровье, но используется в качестве диагностического признака.
Увеличение α 2 -макроглобулина при нормальном количестве альбумина преимущественно указывает на острое и/или хроническое воспаление. [ 19 ]
Распространенный вариант (29,5%) ( полиморфизм ) α 2 -макроглобулина приводит к повышенному риску болезни Альцгеймера . [ 20 ] [ 21 ]
α 2 -Макроглобулин связывается и удаляет активные формы желатиназы ( MMP -2 и MMP-9 ) из кровообращения через рецепторы-мусорщики на фагоцитах.
Ссылки
[ редактировать ]- ^ Перейти обратно: а б с GRCh38: Версия Ensembl 89: ENSG00000175899 – Ensembl , май 2017 г.
- ^ Перейти обратно: а б с GRCm38: выпуск Ensembl 89: ENSMUSG00000030111 – Ensembl , май 2017 г.
- ^ «Ссылка на Human PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Ссылка на Mouse PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ Андерсен Г.Р., Кох Т.Дж., Долмер К., Соттруп-Йенсен Л., Нюборг Дж. (октябрь 1995 г.). «Рентгеновская структура низкого разрешения человеческого альфа-2-макроглобулина, обработанного метиламином» . Ж. Биол. Хим . 270 (42): 25133–41. дои : 10.1074/jbc.270.42.25133 . ПМИД 7559647 . S2CID 86387917 .
- ^ Соттруп-Йенсен Л., Степаник Т.М., Кристенсен Т., Вежбицкий Д.М., Джонс К.М., Лёнблад П.Б. и др. (1984). «Первичная структура альфа-2-макроглобулина человека. V. Полная структура» . J Биол Хим . 259 (13): 8318–27. дои : 10.1016/S0021-9258(17)39730-2 . ПМИД 6203908 .
- ^ Перейти обратно: а б Доддс А.В., Лоу С.К. (декабрь 1998 г.). «Филогения и эволюция белков C3, C4, содержащих тиоэфирную связь, и альфа-2-макроглобулина». Иммунол. Преподобный . 166 : 15–26. дои : 10.1111/j.1600-065X.1998.tb01249.x . ПМИД 9914899 . S2CID 84262599 .
- ^ Перейти обратно: а б Армстронг П.Б., Куигли Дж.П. (1999). «Альфа2-макроглобулин: эволюционно консервативная часть врожденной иммунной системы». Дев. Комп. Иммунол . 23 (4–5): 375–90. дои : 10.1016/s0145-305x(99)00018-x . ПМИД 10426429 .
- ^ Доан Н., Геттинс П.Г. (2007). «Человеческий альфа2-макроглобулин состоит из нескольких доменов, как и предсказывает гомология с компонентом комплемента C3» . Биохим Дж . 407 (1): 23–30. дои : 10.1042/BJ20070764 . ПМК 2267405 . ПМИД 17608619 .
- ^ Девриендт К., Ван ден Берге Х., Кассиман Дж. Дж., Маринен П. (1991). «Первичная структура белка зоны беременности. Молекулярное клонирование полноразмерного клона кДНК PZP с помощью полимеразной цепной реакции». Biochimica et Biophysical Acta (BBA) – Структура и экспрессия генов . 1088 (1): 95–103. дои : 10.1016/0167-4781(91)90157-h . ПМИД 1989698 .
- ^ Соттруп-Йенсен Л. (июль 1989 г.). «Альфа-макроглобулины: строение, форма и механизм образования протеиназных комплексов» . Ж. Биол. Хим . 264 (20): 11539–42. дои : 10.1016/S0021-9258(18)80094-1 . ПМИД 2473064 .
- ^ Энгильд Дж. Дж., Салвесен Г., Тёгерсен И.Б., Пиццо С.В. (июль 1989 г.). «Связывание и ингибирование протеиназы мономерным альфа-макроглобулином крысиного альфа-1-ингибитора-3» . Ж. Биол. Хим . 264 (19): 11428–35. дои : 10.1016/S0021-9258(18)60482-X . ПМИД 2472396 .
- ^ Энгильд Дж. Дж., Тёгерсен И.Б., Рош П.А., Пиццо С.В. (февраль 1989 г.). «Консервативная область альфа-макроглобулинов участвует в связывании с рецептором альфа-макроглобулина млекопитающих». Биохимия . 28 (3): 1406–12. дои : 10.1021/bi00429a069 . ПМИД 2469470 .
- ^ Ван Левен Ф., Кассиман Дж. Дж., Ван ден Берге Х. (декабрь 1986 г.). «Белок зоны беременности человека и альфа-2-макроглобулин. Высокоаффинное связывание комплексов с одним и тем же рецептором на фибробластах и характеристика с помощью моноклональных антител» . Ж. Биол. Хим . 261 (35): 16622–5. дои : 10.1016/S0021-9258(18)66612-8 . ПМИД 2430968 .
- ^ де Бур Дж.П., Кризи А.А., Чанг А., Аббинк Дж.Дж., Роем Д., Эренберг А.Дж., Хак CE, Тейлор Ф.Б. (декабрь 1993 г.). «Альфа-2-макроглобулин действует как ингибитор фибринолитических, свертывающих и нейтрофильных протеиназ при сепсисе: исследования на модели павиана» . Заразить. Иммунитет . 61 (12): 5035–43. дои : 10.1128/iai.61.12.5035-5043.1993 . ПМК 281280 . ПМИД 7693593 .
- ^ Лю Н., Ло Л.С., Аскари С.Х., Джонс Л., Кидане Т.З., Нгуен Т.Т., Гофорт Дж., Чу Ю.Х., Вивас Э., Цай М., Уэстбрук Т., Линдер MC (сентябрь 2007 г.). «Транкупреин — это макроглобулин, регулируемый наличием меди и железа» . Журнал пищевой биохимии . 18 (9): 597–608. дои : 10.1016/j.jnutbio.2006.11.005 . ПМЦ 4286573 . ПМИД 17363239 .
- ^ Лю Нм, Нгуен Т, Кидане Т, Мория М, Гофорт Дж, Чу А, Линдер М (6 марта 2006 г.). «Транкупреины являются сывороточными переносчиками меди из семейства макроглобулинов и могут регулироваться железом и медью» . Журнал ФАСЭБ . 20 (4): А553–А554. doi : 10.1096/fasebj.20.4.A553-d . ISSN 0892-6638 . S2CID 90794136 .
- ^ Стивенсон Ф.Т., Грин С., Кайсен Г.А. (январь 1998 г.). «Концентрации альфа-2-макроглобулина и альфа-1-ингибитора 3 в сыворотке увеличиваются при гипоальбуминемии за счет посттранскрипционных механизмов» . Почки Интернешнл . 53 (1): 67–75. дои : 10.1046/j.1523-1755.1998.00734.x . ПМИД 9453001 .
- ^ «Электрофорез белков – сыворотка» . Медицинская школа Икан на горе Синай . Последний отзыв: 25.01.2022. Рецензент: Тодд Герстен, доктор медицинских наук, и Дэвид Зив, доктор медицинских наук
- ^ Блэкер Д., Уилкокс М.А., Лэрд Н.М., Родес Л., Хорват С.М., Го Р.К., Перри Р., Уотсон Б., Бассетт С.С., Макиннис М.Г., Альберт М.С., Хайман Б.Т., Танци Р.Э. (август 1998 г.). «Макроглобулин альфа-2 генетически связан с болезнью Альцгеймера». Нат. Жене . 19 (4): 357–60. дои : 10.1038/1243 . ПМИД 9697696 . S2CID 15628847 .
- ^ Ковач Д.М. (июль 2000 г.). «Альфа2-макроглобулин при болезни Альцгеймера с поздним началом». Эксп. Геронтол . 35 (4): 473–9. дои : 10.1016/S0531-5565(00)00113-3 . ПМИД 10959035 . S2CID 54409507 .
- Макферсон и Пинкус: Клиническая диагностика и лечение Генри с помощью лабораторных методов, 21-е изд.
- Файрштейн: Учебник ревматологии Келли, 8-е издание.
Внешние ссылки
[ редактировать ]- Онлайн-база данных MEROPS . по пептидазам и их ингибиторам: I39.001 [ постоянная мертвая ссылка ]
- альфа + 2-макроглобулин Национальной медицинской библиотеки США по медицинским предметным рубрикам (MeSH)
- A2M Расположение человеческого гена в браузере генома UCSC .
- Подробности о гене человека A2M в браузере генома UCSC .



