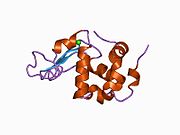
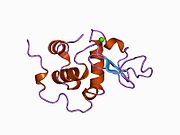
α-лактальбумин
| ЧЕТВЕРГ | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | ЛАЛЬБА , entrez:3906, LYZG, лактальбумин альфа, ГАМЛЕТ | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | Опустить : 149750 ; МГИ : 96742 ; Гомологен : 1720 ; GeneCards : LALBA ; ОМА : ЛАЛБА - ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Альфа-лактальбумин , также известный как LALBA , представляет собой белок , который у человека кодируется LALBA геном . [ 5 ] [ 6 ] [ 7 ]
Обзор
[ редактировать ]α-лактальбумин — белок, регулирующий выработку лактозы в молоке практически всех видов млекопитающих . [ 8 ] У приматов экспрессия α-лактальбумина повышается в ответ на гормон пролактин и увеличивает выработку лактозы . [ 9 ]
α-лактальбумин образует регуляторную субъединицу гетеродимера лактозосинтазы ( LS), а β-1,4-галактозилтрансфераза (beta4Gal-T1) образует каталитический компонент. Вместе эти белки позволяют LS производить лактозу путем переноса галактозных фрагментов на глюкозу . Будучи мультимером, α-лактальбумин прочно связывает ионы кальция и цинка и может обладать бактерицидной или противоопухолевой активностью. Складной вариант альфа-лактальбумина человека, который может образовываться в кислой среде, например, в желудке, называемый HAMLET , вероятно, индуцирует апоптоз в опухолевых и незрелых клетках. [ 5 ] Таким образом, соответствующая динамика сворачивания α-лактальбумина весьма необычна. [ 10 ]
, α-лактальбумин, образуя комплекс с Gal-T1 Галактозилтрансфераза , увеличивает сродство фермента к глюкозе примерно в 1000 раз и ингибирует способность полимеризовать несколько единиц галактозы . Это приводит к возникновению пути образования лактозы путем преобразования Gal-TI в лактозосинтазу .
Физические свойства
[ редактировать ]Структура α-лактальбумина хорошо известна и состоит из 123 аминокислот и 4 дисульфидных мостиков. Молекулярная масса составляет 14178 Да, а изоэлектрическая точка находится между 4,2 и 4,5. α-лактальбумин имеет две известные формы: голо-состояние и апо-состояние. Голо-состояние — это естественная форма, сложенная и связанная кальцием. Апо-состояние возникает в кислых условиях и связано с высвобождением ионов кальция и разворачиванием бета-листа. [ 11 ] Одним из основных структурных отличий бета-лактоглобулина является отсутствие у него свободной тиоловой группы , которая могла бы служить отправной точкой для реакции ковалентной агрегации. В результате чистый α-лактальбумин не будет образовывать гели при денатурации и подкислении. α-лактальбумин представляет собой Ca 2+ связывающий белок с одним сильным пятном связывания кальция, показанным ниже. Кальций связывается с карбоксильными группами трех остатков аспартата (Asp 82, 87, 88), показанными синим цветом, и с карбонильными группами лизина 79 и аспартата 84, показанными фиолетовым цветом. Это связывание координируется двумя молекулами воды (красными). Эти сайты связывания остатков консервативны среди большинства видов, содержащих α-лактальбумин. [ 11 ]
Эволюция
[ редактировать ]Сравнение последовательностей α-лактальбумина показывает сильное сходство с последовательностями лизоцимов , особенно с Ca 2+ -связывающий с-лизоцим. [ 12 ] Эти два белка во многом имеют общую физическую структуру, но содержат менее половины одинаковой аминокислотной последовательности и, следовательно, сильно различаются по функциям. [ 11 ] Итак, ожидаемая эволюционная история такова, что за дупликацией гена c-лизоцима последовала мутация, приводящая к потере каталитической активности лизоцима в α-лактальбумине. [ 8 ] [ 13 ] Этот ген предшествует последнему общему предку млекопитающих и птиц, что, вероятно, относит его происхождение примерно к 300 млн лет назад. [ 14 ]
Функции
[ редактировать ]Текущие исследования находят новое применение α-лактальбумина помимо физиологического производства лактозы.
Питание: α-лактальбумин необходим для питания новорожденного. Этот белок обеспечивает незаменимые аминокислоты и биологически активные соединения, необходимые для оптимального роста, развития и здоровья. Альфа-лактальбумин является наиболее распространенным сывороточным белком в грудном молоке, и его свойства были исследованы для включения в детские смеси для воспроизведения соединений грудного молока. Этот белок является мощным источником разветвленных аминокислот , остатков цистеина и триптофана, каждый из которых имеет свою пользу для здоровья. [ 15 ]
Клиническое использование: α-лактальбумин исследовался в сочетании со многими различными заболеваниями, и считается, что он коррелирует с положительными результатами. Многие из этих преимуществ обусловлены биологически активными соединениями, из которых он состоит, и способностью белка связывать комплексы. [ 13 ]
СПКЯ : Синдром поликистозных яичников (СПКЯ) – это одно из заболеваний, облегчение симптомов которого связано с повышением уровня альфа-лактальбумина. Это состояние тесно связано с дисбактериозом кишечника, вызванным воспалением слизистой оболочки кишечника и дисбалансом микробиоты. α-лактальбумин способствует развитию здоровых бактериальных штаммов, таких как Lactobacillus acidophilus , Bifidobacterium short Bifidobacterium и longum . Эти бактерии производят короткоцепочечные жирные кислоты (КЦЖК), которые улучшают биом кишечника. В контролируемом исследовании группа, которая придерживалась диеты с высоким содержанием альфа-лактальбумина, испытала уменьшение симптомов, связанных с СПКЯ , и более высокий уровень здоровых бактерий. Хотя лекарства от этого состояния не существует, это может быть краткосрочным средством. [ 16 ]
Психическое здоровье: α-лактальбумин является источником аминокислот, которые способствуют улучшению психического здоровья. Этот белок богат остатками триптофана, которые являются предшественником серотонина , нейромедиатора, связанного с позитивным настроением. Белок также увеличивает концентрацию в плазме других крупных нейтральных аминокислот (LNAA), которые помогают сбалансировать гормоны. Остатки цистеина способствуют синтезу глутатиона, который является важным антиоксидантом. [ 15 ] [ 16 ]
Рак. Было проведено обширное исследование апоптотических эффектов, которые потенциально оказывает альфа-лактальбумин, когда он образует комплекс с олеиновой кислотой под названием HAMLET (человеческий альфа-лактальбумин, смертельный для опухолевых клеток). Этот комплекс HAMLET при связывании разрушает структуру мембраны, способствуя гибели клеток и защищая целостность организма. Этот комплекс может транслоцироваться в ядра раковых клеток, но не в здоровые клетки. В многочисленных исследованиях было показано , что в раковых клетках этот комплекс белок-ОА замедляет прогрессирование опухолей. Нативное состояние α-лактальбумина не проявляет тех же противораковых функций, поэтому вполне вероятно, что олеиновая кислота выполняет апоптотические функции, в то время как α-лактальбумин отвечает за воздействие на определенные линии клеток, такие как раковые клетки толстой кишки, мочевого пузыря и глиобластомы. . [ 13 ]
Ссылки
[ редактировать ]- ^ Перейти обратно: а б с GRCh38: Версия Ensembl 89: ENSG00000167531 – Ensembl , май 2017 г.
- ^ Перейти обратно: а б с GRCm38: выпуск Ensembl 89: ENSMUSG00000022991 – Ensembl , май 2017 г.
- ^ «Ссылка на Human PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Ссылка на Mouse PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ Перейти обратно: а б «Ген Энтреза: лактальбумин LALBA, альфа-» .
- ^ Холл Л., Дэвис М.С., Крейг Р.К. (январь 1981 г.). «Создание, идентификация и характеристика плазмид, содержащих последовательности кДНК альфа-лактальбумина человека» . Исследования нуклеиновых кислот . 9 (1): 65–84. дои : 10.1093/нар/9.1.65 . ПМК 326669 . ПМИД 6163135 .
- ^ Холл L, Эмери, округ Колумбия, Дэвис М.С., Паркер Д., Крейг Р.К. (март 1987 г.). «Организация и последовательность человеческого гена альфа-лактальбумина» . Биохимический журнал . 242 (3): 735–742. дои : 10.1042/bj2420735 . ПМЦ 1147772 . ПМИД 2954544 .
- ^ Перейти обратно: а б Касба ПК, Кумар С (1997). «Молекулярное расхождение лизоцимов и альфа-лактальбумина». Критические обзоры по биохимии и молекулярной биологии . 32 (4): 255–306. дои : 10.3109/10409239709082574 . ПМИД 9307874 .
- ^ Кляйнберг Д.Л., Тодд Дж., Бабицкий Г. (июль 1983 г.). «Ингибирование эстрадиолом лактогенного эффекта пролактина в тканях молочной железы приматов: обращение антиэстрогенов LY 156758 и тамоксифена» . Труды Национальной академии наук Соединенных Штатов Америки . 80 (13): 4144–4148. Бибкод : 1983PNAS...80.4144K . дои : 10.1073/pnas.80.13.4144 . ПМЦ 394217 . ПМИД 6575400 .
- ^ Бу Зи, Кук Джей, Callaway DJ (сентябрь 2001 г.). «Динамические режимы и коррелирующая структурная динамика нативного и денатурированного альфа-лактальбумина». Журнал молекулярной биологии . 312 (4): 865–873. дои : 10.1006/jmbi.2001.5006 . ПМИД 11575938 .
- ^ Перейти обратно: а б с Пермяков Е.А. (август 2020). «α-лактальбумин, удивительный кальцийсвязывающий белок» . Биомолекулы . 10 (9): 1210. doi : 10.3390/biom10091210 . ПМЦ 7565966 . ПМИД 32825311 .
- ^ Ачарья К.Р., Стюарт Д.И., Уокер Н.П., Льюис М., Филлипс, округ Колумбия (июль 1989 г.). «Уточненная структура альфа-лактальбумина павиана при разрешении 1,7 А. Сравнение с лизоцимом C-типа». Журнал молекулярной биологии . 208 (1): 99–127. дои : 10.1016/0022-2836(89)90091-0 . ПМИД 2769757 .
- ^ Перейти обратно: а б с Эль-Фахарани EM, Редван EM (ноябрь 2019 г.). «Белково-липидные комплексы: молекулярная структура, современные сценарии и механизмы цитотоксичности» . РСК Прогресс . 9 (63): 36890–36906. Бибкод : 2019RSCAd...936890E . дои : 10.1039/C9RA07127J . ПМЦ 9075609 . ПМИД 35539089 .
- ^ Прагер Э.М., Уилсон AC (1988). «Древнее происхождение лактальбумина из лизоцима: анализ ДНК и аминокислотных последовательностей». Журнал молекулярной эволюции . 27 (4): 326–335. Бибкод : 1988JMolE..27..326P . дои : 10.1007/BF02101195 . ПМИД 3146643 . S2CID 10039589 .
- ^ Перейти обратно: а б Алмейда CC, Мендонса Перейра БФ, Леандро КЦ, Коста MP, Списсо БФ, Конте-Жуниор CA (14 мая 2021 г.). Спиньо Дж. (ред.). «Биоактивные соединения в детских смесях и их влияние на питание и здоровье младенцев: систематический обзор литературы» . Международный журнал пищевой науки . 2021 : 8850080. doi : 10.1155/2021/8850080 . ПМЦ 8140835 . ПМИД 34095293 .
- ^ Перейти обратно: а б Кардинале В., Лепор Э., Башиани С., Артале С., Нордио М., Биццарри М., Унфер В. (август 2022 г.). «Положительное влияние α-лактальбумина на лечение симптомов синдрома поликистозных яичников» . Питательные вещества . 14 (15): 3220. дои : 10.3390/nu14153220 . ПМЦ 9370664 . ПМИД 35956395 .
Дальнейшее чтение
[ редактировать ]- Хейне В.Е., Кляйн П.Д., Ридс П.Дж. (март 1991 г.). «Важность альфа-лактальбумина в питании детей грудного возраста» . Журнал питания . 121 (3): 277–283. дои : 10.1093/jn/121.3.277 . ПМИД 2002399 .
- Пермяков Е.А., Берлинер ЖЖ (май 2000 г.). «Альфа-лактальбумин: строение и функции». Письма ФЭБС . 473 (3): 269–274. дои : 10.1016/S0014-5793(00)01546-5 . ПМИД 10818224 . S2CID 83964232 .
- Холл L, Эмери, округ Колумбия, Дэвис М.С., Паркер Д., Крейг Р.К. (март 1987 г.). «Организация и последовательность человеческого гена альфа-лактальбумина» . Биохимический журнал . 242 (3): 735–742. дои : 10.1042/bj2420735 . ПМЦ 1147772 . ПМИД 2954544 .
- Дэвис М.С., Вест Л.Ф., Дэвис М.Б., Пови С., Крейг Р.К. (июль 1987 г.). «Ген человеческого альфа-лактальбумина присвоен хромосоме 12q13». Анналы генетики человека . 51 (3): 183–188. дои : 10.1111/j.1469-1809.1987.tb00869.x . ПМИД 3479943 . S2CID 37901087 .
- Финдли Дж. Б., Brew K (май 1972 г.). «Полная аминокислотная последовательность человеческого лактальбумина» . Европейский журнал биохимии . 27 (1): 65–86. дои : 10.1111/j.1432-1033.1972.tb01812.x . ПМИД 5049057 .
- Холл Л., Крейг Р.К., Эдбрук М.Р., Кэмпбелл П.Н. (июнь 1982 г.). «Сравнение нуклеотидной последовательности клонированной кДНК пре-альфа-лактальбумина человека и морской свинки с кДНК пре-лизоцима цыпленка предполагает эволюцию от общего предкового гена» . Исследования нуклеиновых кислот . 10 (11): 3503–3515. дои : 10.1093/нар/10.11.3503 . ПМК 320727 . ПМИД 6285305 .
- Хоканссон А, Животовский Б, Оррениус С, Сабхарвал Х, Сванборг С (август 1995 г.). «Апоптоз, индуцированный белком женского молока» . Труды Национальной академии наук Соединенных Штатов Америки . 92 (17): 8064–8068. Бибкод : 1995PNAS...92.8064H . дои : 10.1073/pnas.92.17.8064 . ПМК 41287 . ПМИД 7644538 .
- Стейси А., Шниеке А., Керр М., Скотт А., Макки С., Коттингем И. и др. (март 1995 г.). «Лактация нарушается из-за дефицита альфа-лактальбумина и может быть восстановлена путем замены человеческого гена альфа-лактальбумина у мышей» . Труды Национальной академии наук Соединенных Штатов Америки . 92 (7): 2835–2839. Бибкод : 1995PNAS...92.2835S . дои : 10.1073/pnas.92.7.2835 . ПМК 42313 . ПМИД 7708733 .
- Фудзивара И., Мива М., Такахаши Р., Хирабаяши М., Сузуки Т., Уэда М. (июнь 1997 г.). «Независимая от положения и высокий уровень экспрессии альфа-лактальбумина человека в молоке трансгенных крыс, несущих ДНК YAC размером 210 т.п.н.». Молекулярное воспроизводство и развитие . 47 (2): 157–163. doi : 10.1002/(SICI)1098-2795(199706)47:2<157::AID-MRD5>3.0.CO;2-L . ПМИД 9136116 . S2CID 43232515 .
- Линднер Р.А., Капур А., Карвер Дж.А. (октябрь 1997 г.). «Взаимодействие молекулярного шаперона альфа-кристаллина с расплавленными глобулами бычьего альфа-лактальбумина» . Журнал биологической химии . 272 (44): 27722–27729. дои : 10.1074/jbc.272.44.27722 . ПМИД 9346914 .
- Джуффрида М.Г., Кавалетто М., Джунта С., Нойтебум Б., Кантисани А., Наполитано Л. и др. (ноябрь 1997 г.). «Необычный аминокислотный триплет Asn-Ile-Cys представляет собой консенсусный сайт гликозилирования в альфа-лактальбумине человека». Журнал белковой химии . 16 (8): 747–753. дои : 10.1023/А:1026359715821 . ПМИД 9365923 . S2CID 42107172 .
- Чандра Н., Брю К., Ачарья К.Р. (апрель 1998 г.). «Структурные доказательства наличия вторичного сайта связывания кальция в альфа-лактальбумине человека». Биохимия . 37 (14): 4767–4772. дои : 10.1021/bi973000t . ПМИД 9537992 .
- Хоканссон А, Андреассон Дж, Животовский Б, Карпман Д, Оррениус С, Сванборг С (февраль 1999 г.). «Мультимерный альфа-лактальбумин из женского молока вызывает апоптоз посредством прямого воздействия на ядра клеток». Экспериментальные исследования клеток . 246 (2): 451–460. дои : 10.1006/excr.1998.4265 . ПМИД 9925761 .
- Свенссон М., Сабхарвал Х., Хоканссон А., Моссберг А.К., Липнюнас П., Леффлер Х. и др. (март 1999 г.). «Молекулярная характеристика вариантов сворачивания альфа-лактальбумина, которые индуцируют апоптоз в опухолевых клетках» . Журнал биологической химии . 274 (10): 6388–6396. дои : 10.1074/jbc.274.10.6388 . ПМИД 10037730 .
- Харата К., Абэ Ю., Мураки М. (март 1999 г.). «Кристаллографическая оценка внутреннего движения альфа-лактальбумина человека, уточненная полноматричным методом наименьших квадратов». Журнал молекулярной биологии . 287 (2): 347–358. дои : 10.1006/jmbi.1999.2598 . ПМИД 10080897 .
- Last AM, Шульман Б.А., Робинсон К.В., Редфилд К. (август 2001 г.). «Изучение тонких различий в поведении водородного обмена вариантов расплавленной шарики человеческого альфа-лактальбумина с использованием масс-спектрометрии». Журнал молекулярной биологии . 311 (4): 909–919. дои : 10.1006/jmbi.2001.4911 . ПМИД 11518539 .
- Бай П, Пэн Цз (ноябрь 2001 г.). «Кооперативное сворачивание изолированного альфа-спирального домена лизоцима белка куриного яйца». Журнал молекулярной биологии . 314 (2): 321–329. дои : 10.1006/jmbi.2001.5122 . ПМИД 11718563 .
- Эндрюс П. (август 1970 г.). «Очистка белка лактозосинтетазы из женского молока и демонстрация его взаимодействия с альфа-лактальбумином». Письма ФЭБС . 9 (5): 297–300. дои : 10.1016/0014-5793(70)80382-9 . ПМИД 11947697 . S2CID 23041445 .
Внешние ссылки
[ редактировать ]- альфа-лактальбумин Национальной медицинской библиотеки США по медицинским предметным рубрикам (MeSH)
- человека Расположение генома LALBA и LALBA страница сведений о гене в браузере генома UCSC .