Фибрин
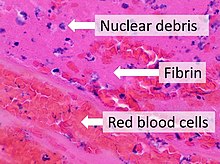

Фибрин (также называемый фактором Ia ) представляет собой волокнистый неглобулярный белок участвующий в свертывании крови , . Он образуется в результате действия протеазы тромбина на фибриноген , что вызывает его полимеризацию . Полимеризованный фибрин вместе с тромбоцитами образует гемостатическую пробку или сгусток на месте раны.
Когда оболочка кровеносного сосуда повреждена, тромбоциты притягиваются, образуя тромбоцитарную пробку . Эти тромбоциты имеют на своей поверхности рецепторы тромбина , которые связывают молекулы сывороточного тромбина. [1] которые, в свою очередь, превращают растворимый фибриноген в сыворотке в фибрин на месте раны. Фибрин образует длинные нити прочного нерастворимого белка, которые связываются с тромбоцитами. Фактор XIII завершает сшивание фибрина, в результате чего он затвердевает и сжимается. Сшитый фибрин образует сетку на пробке тромбоцитов, которая завершает сгусток. был открыт фибрин. [2] Марчелло Мальпиги в 1666 году. [3]
в болезни Роль

Избыточное образование фибрина вследствие активации каскада свертывания приводит к тромбозу , закупорке сосуда путем агглютинации эритроцитов, тромбоцитов, полимеризованного фибрина и других компонентов. Неэффективная генерация или преждевременный лизис фибрина повышают вероятность кровоизлияния .
Дисфункция или заболевание печени может привести к снижению выработки неактивного предшественника фибрина, фибриногена , или к выработке аномальных молекул фибриногена со сниженной активностью ( дисфибриногенемия ). Наследственные нарушения фибриногена (ген переносится на 4-й хромосоме) носят как количественный, так и качественный характер и включают афибриногенемию , гипофибриногенемию , дисфибриногенемию и гиподисфибриногенемию .
Снижение, отсутствие или нарушение функции фибрина может привести к тому, что пациенты станут больными гемофилией .
Физиология [ править ]

Фибрин из различных источников животного происхождения обычно гликозилируется связанными с аспарагином, сложного типа двухантенными гликанами, . Разнообразие обнаружено в степени фукозилирования ядра и в типе связи сиаловой кислоты и галактозы . [4]
Структура [ править ]

Фибрин образуется после отщепления тромбином фибринопептида А (FPA) от альфа-цепей фибриногена, тем самым инициируя полимеризацию фибрина. Двухцепочечные фибриллы образуются посредством ассоциаций конца-среднего домена (D:E), а сопутствующие ассоциации боковых фибрилл и их разветвления создают сгустковую сеть. [5] [6] Сборка фибрина способствует межмолекулярному антипараллельному С-концевому выравниванию пар гамма-цепей, которые затем ковалентно «сшиваются» фактором XIII («плазменная протрансглутаминаза») или XIIIa с образованием «гамма-димеров». Изображение слева представляет собой кристаллическую структуру дабл-d-фрагмента фибрина человека с двумя связанными лигандами. Экспериментальный метод, использованный для получения изображения, представлял собой дифракцию рентгеновских лучей и имел разрешение 2,30 Å. Структура в основном состоит из одиночных альфа-спиралей, показанных красным, и бета-листов, показанных желтым. Две синие структуры представляют собой связанные лиганды . Химическая структура лигандов: Ca 2+ ион, альфа-D-манноза (C 6 H 12 O 6 ) и D-глюкозамин (C 6 H 13 NO 5 ). [7]
См. также [ править ]
Ссылки [ править ]
- ^ Керель Б.Е. (2003). «[Тромбоциты: биохимия и физиология]». Hamostaseologie (на немецком языке). 23 (4): 149–158. дои : 10.1055/s-0037-1619592 . ПМИД 14603379 .
- ^ Арни, Кэт (31 мая 2017 г.). «Фибрин и фибриноген» . Химический мир . Кембридж, Великобритания: Королевское химическое общество . Проверено 25 ноября 2022 г.
- ^ «350 лет открытия фибрина (1666–2016) История фибрина (огена)» . МСФО . Уинстон-Салем: Международное общество исследования фибриногена. 23 июня 2016 г. Проверено 25 ноября 2022 г.
- ^ Пабст М., Бондили Дж.С., Стадлманн Дж., Мах Л., Альтманн Ф. (июль 2007 г.). «Масса + время удерживания = структура: стратегия анализа N-гликанов с помощью углеродной ЖХ-ESI-MS и ее применение к N-гликанам фибрина». Анальный. Хим . 79 (13): 5051–7. дои : 10.1021/ac070363i . ПМИД 17539604 .
- ^ Мозессон, М.В. (август 2005 г.). «Фибриноген и структура и функции фибрина» . Журнал тромбозов и гемостаза . 3 (8): 1894–1904. дои : 10.1111/j.1538-7836.2005.01365.x . ISSN 1538-7933 . ПМИД 16102057 . S2CID 22077267 .
- ^ Ундас, Анетта; Ариенс, Роберт А.С. (1 декабря 2011 г.). «Структура и функция фибринового сгустка» . Атеросклероз, тромбоз и сосудистая биология . 31 (12): е88–е99. дои : 10.1161/ATVBAHA.111.230631 . ПМИД 21836064 .
- ^ Вайзель, Джон В.; Литвинов, Рустем И. (2017), Парри, Дэвид А.Д.; Сквайр, Джон М. (ред.), «Формирование, структура и свойства фибрина», Волокнистые белки: структуры и механизмы , том. 82, Чам: Springer International Publishing, стр. 405–456, номер документа : 10.1007/978-3-319-49674-0_13 , ISBN. 978-3-319-49672-6 , ПМК 5536120 , ПМИД 28101869
Внешние ссылки [ править ]
- TGW1916.net , Дефибринированная кровь, полученная от овец (видео)
- Фибрин: молекула месяца. Архивировано 10 октября 2015 г. в Wayback Machine , Дэвид Гудселл, Банк данных белков RCSB.