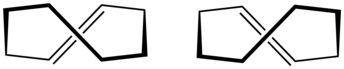
транс -Циклооктен
 | |
| Имена | |
|---|---|
| Предпочтительное название ИЮПАК ( E )-Циклооктен | |
| Другие имена транс -Циклооктен | |
| Идентификаторы | |
3D model ( JSmol ) | |
| ЧЭБИ | |
| ХимическийПаук | |
| Номер ЕС |
|
ПабХим CID | |
Панель управления CompTox ( EPA ) | |
| Характеристики | |
| С 8 Ч 14 | |
| Молярная масса | 110.200 g·mol −1 |
| Появление | бесцветная жидкость |
| Плотность | 0,848 г/мл |
| Температура плавления | -59 ° C (-74 ° F; 214 К) |
| Точка кипения | 143 °С (1 атм); 68–72 °С (100 Торр) [2] |
| Опасности | |
| СГС Маркировка : | |
  | |
| Опасность | |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
транс -Циклооктен представляет собой циклический углеводород с формулой [–(CH 2 ) 6 CH=CH–], где две одинарные связи C–C, соседние с двойной связью, находятся на противоположных сторонах плоскости последней. Это бесцветная жидкость с неприятным запахом.
Циклооктен известен как самый маленький циклоалкен, который легко выделить в виде его транс - изомера . Цис - изомер гораздо более стабилен; [3] энергии кольцевой деформации составляют 16,7 и 7,4 ккал/моль соответственно. [4]
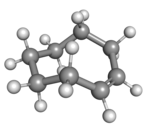 | 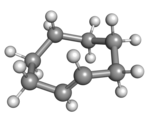 |
| цис -Циклооктен в стула форме | ( R p )- транс -Циклооктен в кроны форме |
Плоское расположение атомов углерода в кольце было бы слишком напряженным, поэтому стабильные конформации транс- формы имеют изогнутое (неплоское) кольцо. Расчеты показывают, что наиболее стабильная конформация «корона» имеет атомы углерода попеременно выше и ниже плоскости кольца. [5] Конформация «полукресла» с более высокой энергией примерно на 6 ккал/моль имеет атомы углерода 2,3,5,6 и 8 на одной стороне плоскости атомов углерода 1,4 и 7. [5]
Все конформации транс -циклооктена хиральны (в частности, то, что некоторые называют планарно-хиральным). [6] ) и энантиомеры можно разделить. [7] [8] [9] Теоретически превращение между энантиомерами можно осуществить, не разрывая никаких связей, жестко скручивая всю группу –CH=CH– на 180 градусов. Однако это влечет за собой прохождение одного из его атомов водорода через переполненное кольцо. [7]
Подготовка
[ редактировать ]Транс -Циклооктен был впервые синтезирован в подготовительном масштабе Артуром К. Коупом с помощью элиминирования Гофмана реакции йодида N,N,N -триметилциклооктиламмония. [10] В результате реакции образуется смесь цис- и транс -изомеров, причем транс -изомер избирательно улавливается в виде комплекса с нитратом серебра .
Существуют и другие методы, в которых транс -изомер синтезируется из цис- изомера в несколько этапов синтеза. Например, его можно получить почти со 100% выходом путем превращения цис- изомера в 1,2-эпоксициклооктан («оксид циклооктена») с последующей реакцией с дифенилфосфидом лития ( LiPPh
2 ) и с метилиодидом CH
3 Я. (Аналогичные процедуры позволяют получить цис- , транс- изомеры 1,4-циклооктадиена и 1,5-циклооктадиена ). [2]
Кроме того, существует фотохимический метод прямой цис - транс -изомеризации. Хотя это равновесие сильно благоприятствует более стабильной цис- форме, реакцию можно перевести в транс- форму за счет захвата ионами серебра. [11] [12]
Реакции
[ редактировать ]Из-за более высокой внутренней деформации двойной связи транс -изомер более реакционноспособен, чем цис -изомер и типичные ненасыщенные углеводороды. Например, его двойная связь быстро присоединяет тетразин и его производные. [5] Соединение также легко полимеризуется с инициатором на основе рутения . [4]
Ссылки
[ редактировать ]- ^ « цис -Циклооктен» . Сигма-Олдрич .
- ^ Jump up to: а б Ведейс, Эдвин; Сноубл, Карел А.Дж.; Фукс, Филип Л. (1973). «Бетаины фосфора, полученные из оксидов циклогептена и циклооктена. Инверсия циклооктена». Журнал органической химии . 38 (6): 1178–1183. дои : 10.1021/jo00946a024 .
- ^ Нойеншвандер, Ульрих; Херманс, Айв (2011). «Конформации циклооктена: последствия для химии эпоксидирования». Журнал органической химии . 76 (24): 10236–10240. дои : 10.1021/jo202176j . ПМИД 22077196 .
- ^ Jump up to: а б Уокер, Рон; Конрад, Розмари М.; Граббс, Роберт Х. (2009). «Живой ROMP транс -циклооктена» . Макромолекулы . 42 (3): 599–605. Бибкод : 2009МаМол..42..599Вт . дои : 10.1021/ma801693q . ПМЦ 2850575 . ПМИД 20379393 .
- ^ Jump up to: а б с Сельварадж, Рамаджеям; Фокс, Джозеф М. (2013). « Транс -циклооктен — стабильный, прожорливый диенофил для биоортогонального мечения» . Современное мнение в области химической биологии . 17 (5): 753–760. дои : 10.1016/j.cbpa.2013.07.031 . ПМЦ 3925366 . ПМИД 23978373 .
- ^ ИЮПАК , Сборник химической терминологии , 2-е изд. («Золотая книга») (1997). Интернет-исправленная версия: (2006–) « Планарная хиральность ». doi : 10.1351/goldbook.P04681
- ^ Jump up to: а б Коуп, Артур К.; Ганеллин, ЧР; Джонсон, HW; Ван Аукен, ТВ; Винклер, Ганс Дж.С. (1963). «Молекулярная асимметрия олефинов. I. Разрешение транс -циклооктена. 1-3 ". Журнал Американского химического общества . 85 (20): 3276–3279. doi : 10.1021/ja00903a049 .
- ^ Коуп, Артур К.; Мехта, Анил С. (1964). «Молекулярная асимметрия олефинов. II. Абсолютная конфигурация транс -циклооктена». Журнал Американского химического общества . 86 (24): 5626–5630. дои : 10.1021/ja01078a044 .
- ^ Стивен Д. Пейджет (2001). «(-)-Дихлор(этилен)(α-метилбензиламин)платина(II)». Энциклопедия реагентов для органического синтеза . Джон Уайли и сыновья. дои : 10.1002/047084289X.rd119 . ISBN 0-471-93623-5 .
- ^ Коуп, Артур С .; Бах, Роберт Д. (1969). « Транс -Циклооктен» . Органические синтезы . 49:39 ; Сборник томов , т. 5, с. 315 .
- ^ Свентон, Джон С. (1969). «Фотоизомеризация цис -циклооктена в транс -циклооктен». Журнал органической химии . 34 (10): 3217–3218. дои : 10.1021/jo01262a102 .
- ^ Ройзен, Максим; Да, Гленн, Пенсильвания; Фокс, Джозеф М. (2008). «Фотохимический синтез функционализированных транс -циклооктенов, обусловленный комплексообразованием металлов». Журнал Американского химического общества . 130 (12): 3760–3761. дои : 10.1021/ja8001919 . ПМИД 18321114 .