Металлоорганическая химия

Металлоорганическая химия — это изучение металлоорганических соединений , химических соединений, содержащих по крайней мере одну химическую связь между углерода атомом органической молекулы и металлом , включая щелочные , щелочноземельные и переходные металлы , и иногда расширяемую за счет включения металлоидов, таких как бор, кремний, и селен тоже. [1] [2] Помимо связей с органильными фрагментами или молекулами, связи с «неорганическим» углеродом, таким как окись углерода ( карбонилы металлов ), цианид или карбид , обычно также считаются металлоорганическими. Некоторые родственные соединения, такие как гидриды переходных металлов и комплексы фосфина металлов , часто включаются в обсуждение металлоорганических соединений, хотя, строго говоря, они не обязательно являются металлоорганическими. Родственный, но отдельный термин « металлоорганическое соединение » относится к металлосодержащим соединениям, не имеющим прямых связей металл-углерод, но содержащим органические лиганды. β-дикетонаты металлов, алкоксиды , диалкиламиды и комплексы фосфинов металлов являются типичными представителями этого класса. Область металлоорганической химии сочетает в себе аспекты традиционной неорганической и органической химии . [3]
Металлоорганические соединения широко используются как стехиометрически в исследованиях и промышленных химических реакциях, а также в роли катализаторов для увеличения скорости таких реакций (например, при использовании гомогенного катализа ), где целевые молекулы включают полимеры, фармацевтические препараты и многие другие. другие виды практичных изделий.
Металлоорганические соединения [ править ]

Металлоорганические соединения выделяются приставкой «органо-» (например, палладийорганические соединения) и включают все соединения, которые содержат связь между атомом металла и атомом углерода органильной группы . [2] В дополнение к традиционным металлам ( щелочные металлы , щелочноземельные металлы , переходные металлы и постпереходные металлы ), лантаноиды , актиниды , полуметаллы и элементы бор , кремний , мышьяк и селен считаются образующими металлоорганические соединения. [2] Примеры металлоорганических соединений: реактивы Гильмана , содержащие литий и медь , и реактивы Гриньяра , содержащие магний . Борсодержащие металлоорганические соединения часто являются результатом реакций гидроборирования и карбоборирования . Тетракарбонильный никель и ферроцен являются примерами металлоорганических соединений, содержащих переходные металлы . Другие примеры металлорганических соединений включают литийорганические соединения, такие как н -бутиллитий (n-BuLi), цинкорганические соединения, такие как диэтилцинк (Et 2 Zn), оловоорганические соединения, такие как гидрид трибутилолова (Bu 3 SnH), органоборановые соединения, такие как триэтилборан (Et 3 Б) и алюминийорганические соединения, такие как триметилалюминий (Me 3 Al). [3]
Встречающийся в природе металлоорганический комплекс представляет собой метилкобаламин (форма витамина B 12 ), который содержит связь кобальт - метил . Этот комплекс, наряду с другими биологически значимыми комплексами, часто обсуждается в рамках области металлоорганической химии . [4]
- Типичные металлоорганические соединения
- Ферроцен – это типичный железоорганический комплекс. Это устойчивое на воздухе сублимируемое соединение.
- Кобальтоцен является структурным аналогом ферроцена, но очень активен по отношению к воздуху.
- Карбонилгидрид трис(трифенилфосфин)родия используется в коммерческом производстве многих ароматов на основе альдегидов .
- Соль Цейзе является примером алкенового комплекса переходного металла .
- Триметилалюминий представляет собой металлоорганическое соединение с мостиковой метильной группой . Его используют в промышленном производстве некоторых спиртов.
- Диметилцинк имеет линейную координацию. Это летучая пирофорная жидкость, которую используют при изготовлении полупроводниковых пленок.
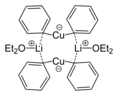
- Бис(диэтилэфират) дифенилкупрата лития является примером реагента Гилмана , типа медноорганического комплекса, часто используемого в органическом синтезе.
- Аденозилкобаламин является кофактором, необходимым для нескольких важнейших ферментативных реакций, происходящих в организме человека. Это редкий пример алкила металла (кобальта) в биологии.
- Пентакарбонил железа(0) представляет собой красно-оранжевую жидкость, полученную непосредственно из соединения мелкодисперсного железа и газообразного угарного газа под давлением.
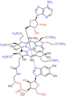
- Технеций[ 99 м Tc] сестамиби используется для визуализации сердечной мышцы в ядерной медицине.
Отличие от координационных соединений с органическими лигандами [ править ]
Во многих комплексах имеются координационные связи между металлом и органическими лигандами . Комплексы, в которых органические лиганды связывают металл через гетероатом, такой как кислород или азот, считаются координационными соединениями (например, гем А и Fe(acac) 3 ). Однако если какой-либо из лигандов образует прямую связь металл-углерод (MC), то комплекс считается металлоорганическим. Хотя ИЮПАК формально не определил этот термин, некоторые химики используют термин «металлорганический» для описания любого координационного соединения, содержащего органический лиганд, независимо от наличия прямой связи MC. [5]
Статус соединений, в которых канонический анион имеет отрицательный заряд, который разделен между ( делокализованным ) атомом углерода и атомом, более электроотрицательным, чем углерод (например, еноляты ), может варьироваться в зависимости от природы анионной группы, иона металла и, возможно, среда. В отсутствие прямых структурных доказательств связи углерод-металл такие соединения не считаются металлоорганическими. [2] Например, еноляты лития часто содержат только связи Li-O и не являются металлоорганическими, тогда как еноляты цинка ( реактивы Реформатского ) содержат как связи Zn-O, так и Zn-C и имеют металлоорганическую природу. [3]
Структура и свойства [ править ]
Связь металл-углерод в металлоорганических соединениях обычно высококовалентна . [1] Для сильно электроположительных элементов, таких как литий и натрий, углеродный лиганд проявляет карбанионный характер, но свободные анионы на основе углерода встречаются крайне редко, примером является цианид .

Большинство металлоорганических соединений при комнатной температуре являются твердыми веществами, однако некоторые из них представляют собой жидкости, такие как метилциклопентадиенилтрикарбонил марганца , или даже летучие жидкости, такие как тетракарбонил никеля . [1] Многие металлоорганические соединения чувствительны к воздуху (реактивны по отношению к кислороду и влаге), поэтому с ними необходимо обращаться в инертной атмосфере . [1] Некоторые металлоорганические соединения, такие как триэтилалюминий и , пирофорны воспламеняются при контакте с воздухом. [6]
Концепции и методы [ править ]
Как и в других областях химии, подсчет электронов полезен для организации металлоорганической химии. Правило 18 электронов помогает предсказать стабильность металлоорганических комплексов, например карбонилов металлов и гидридов металлов . Правило 18e имеет две репрезентативные модели подсчета электронов: модели ионного и нейтрального (также известного как ковалентный) лиганда соответственно. [7] Тактильность комплекса металл-лиганд может влиять на количество электронов. [7] Гаптичность (η, строчная греческая буква «эта») описывает количество смежных лигандов, связанных с металлом. [7] Например, ферроцен , [(η 5 -C 5 H 5 ) 2 Fe], имеет два циклопентадиенильных лиганда, дающих гаптичность 5, где все пять атомов углерода лиганда C 5 H 5 связываются поровну и вносят один электрон в железный центр. Лиганды, связывающие несмежные атомы, обозначаются греческой буквой каппа, κ. [7] хелатирование Примером может служить κ2-ацетата. Метод классификации ковалентных связей идентифицирует три класса лигандов: X, L и Z; которые основаны на электронодонорных взаимодействиях лиганда. Многие металлоорганические соединения не подчиняются правилу 18e. Атомы металлов в металлоорганических соединениях часто характеризуются числом d-электронов и степенью окисления . Эти концепции могут быть использованы для прогнозирования их реакционной способности и предпочтительной геометрии . Химическую связь и реакционную способность в металлоорганических соединениях часто обсуждают с точки зрения изолобального принципа .
Для определения структуры, состава и свойств металлоорганических соединений используются самые разнообразные физические методы. Рентгеновская дифракция — особенно важный метод, позволяющий определить положение атомов внутри твердого соединения и дать подробное описание его структуры. [1] [8] Другие методы, такие как инфракрасная спектроскопия и спектроскопия ядерного магнитного резонанса, также часто используются для получения информации о структуре и связях металлоорганических соединений. [1] [8] Ультрафиолетово-видимая спектроскопия — распространенный метод, используемый для получения информации об электронном строении металлоорганических соединений. Его также используют для наблюдения за ходом металлоорганических реакций, а также для определения их кинетики . [8] Динамику металлоорганических соединений можно изучать с помощью динамической ЯМР-спектроскопии . [1] Другие известные методы включают рентгеновскую абсорбционную спектроскопию , [9] спектроскопия электронного парамагнитного резонанса и элементный анализ . [1] [8]
Из-за их высокой реакционной способности по отношению к кислороду и влаге с металлоорганическими соединениями часто приходится обращаться безвоздушными методами . Безвоздушное обращение с металлоорганическими соединениями обычно требует использования лабораторного оборудования, такого как перчаточный бокс или линия Шленка . [1]
История [ править ]
Ранние разработки в металлоорганической химии включают синтез Луи Клодом Каде соединений метилового мышьяка, родственных какодилу , Уильяма Кристофера Зейза . [10] платино-этиленовый комплекс , [11] Эдвардом Франклендом Открытие диэтил- и диметилцинка , Людвигом Мондом открытие Ni(CO) 4 , [1] и Виктора Гриньяра магнийорганические соединения , комплекс железа и цианида смешанной валентности, не всегда признается как металлоорганическое соединение . (Хотя берлинская лазурь , она была впервые получена в 1706 году мастером красок Иоганном Якобом Дисбахом как первый координационный полимер и синтетический материал, содержащий связь металл-углерод. [12] ) Обильные и разнообразные продукты из угля и нефти привели к Циглера-Натта , Фишера-Тропша , катализу гидроформилирования в котором в качестве сырья и лигандов используются CO, H 2 и алкены.
Признание металлоорганической химии как отдельной области привело к присуждению Нобелевской премии Эрнсту Фишеру и Джеффри Уилкинсону за работы по металлоценам . В 2005 году Ив Шовен , Роберт Х. Граббс и Ричард Р. Шрок разделили Нобелевскую премию за метатезис олефинов , катализируемый металлами . [13]
химии Хронология металлоорганической
- 1760 Луи Клод Каде де Гассикур выделяет ареноорганическое соединение какодил.
- 1827 г. Уильям Кристофер Зейзе производит соль Цейзе ; первый платина / олефин комплекс
- 1848 г. Эдвард Франкленд открывает диэтилцинк.
- 1890 Людвиг Монд открывает карбонил никеля.
- 1899 Джон Ульрик Неф открывает алкинилирование натрия с использованием ацетилидов .
- 1909 Пауль Эрлих представляет Сальварсан для лечения сифилиса, первое металлоорганическое соединение на основе мышьяка.
- 1912 года Нобелевская премия Виктор Гриньяр и Поль Сабатье
- 1930 Генри Гилман изобретает купраты лития, см. Реагент Гилмана.
- 1940 г. Юджин Г. Рохов и Рихард Мюллер открывают прямой процесс получения кремнийорганических соединений.
- 1930-е и 1940-е годы Отто Рулен и Уолтер Реппе разрабатывают катализируемое металлами гидроформилирование и химию ацетилена.
- В 1951 году Уолтер Хибер был награжден премией Альфреда Стока за свои работы в области химии карбонилов металлов .
- 1951 г. ферроцен . Открыт
- 1956 Дороти Кроуфут Ходжкин определяет структуру витамина B12 , первой биомолекулы, содержащей связь металл-углерод, см. биоорганометаллическую химию.
- 1963 года Нобелевская премия за Карлу Циглеру и Джулио Натте катализатор Циглера-Натты
- 1973 года Нобелевская премия Джеффри Уилкинсон и Эрнст Отто Фишер за сэндвич-соединения.
- 1981 года Нобелевская премия Роальда Хоффмана и Кеничи Фукуи за создание правил Вудворда-Хоффмана.
- 2001 г. Нобелевская премия У. С. Ноулз , Р. Нойори и Карл Барри Шарплесс за асимметричное гидрирование.
- 2005 г. Нобелевская премия Ив Шовен , Роберт Граббс и Ричард Шрок , катализируемый металлами. за метатезис алкенов
- 2010 г. Нобелевская премия Ричард Ф. Хек , Эйичи Негиши , Акира Сузуки за реакции кросс-сочетания, катализируемые палладием.
Область применения [ править ]
К специальным областям металлоорганической химии относятся:
- Элементы периода 2 : литийорганическая химия , химия бериллия , химия органоборанов .
- Элементы периода 3 : натрийорганическая химия , магнийорганическая химия , алюминийорганическая химия , кремнийорганическая химия .
- Элементы периода 4 : кальцийорганическая химия , химия скандия , титаноорганическая химия , ванадийорганическая химия , хроморганическая химия , марганцевоорганическая химия , железоорганическая химия , кобальторганическая химия химия , никельорганическая химия , медноорганическая химия , цинкорганическая , , германийорганическая галлийорганическая химия , химия селенорганическая мышьякорганическая химия , химия
- Элементы периода 5 : иттрийорганическая химия , цирконийорганическая химия , , монобийорганическая химия химия молибденорганическая , технецийорганическая , химия , рутенийорганическая химия родийорганическая химия , палладорганическая химия , серебряноорганическая химия , , кадмийорганическая химия , индийорганическая химия , оловоорганическая химия сурьмяорганическая химия , химия
- Элементы периода 6 : химия лантанидов , химия церия , танталорганическая , химия , вольфрамовая химия , химия органорения , химия осмия , химия иридия , платиноорганическая химия , химия золота , ртутьорганическая химия органического таллия , химия химия химия свинца , химия висмута , полония
- Элементы периода 7 : химия органоактинидов , химия тория органического , химия уранорганического соединения , химия органонептуния .
применение Промышленное
Металлоорганические соединения находят широкое применение в промышленных реакциях как в качестве гомогенных катализаторов , так и в качестве стехиометрических реагентов . Например, литийорганические , магнийорганические и алюминийорганические соединения , примеры которых являются высокоосновными и сильно восстанавливающими, полезны стехиометрически, но также катализируют многие реакции полимеризации. [14]
Почти все процессы, связанные с окисью углерода, основаны на катализаторах, известные примеры описываются как карбонилирование . [15] Производство уксусной кислоты из метанола и монооксида углерода катализируется карбонильными комплексами металлов в процессах Monsanto и Cativa . Большинство синтетических альдегидов получают путем гидроформилирования . Основная часть синтетических спиртов, по крайней мере тех, которые больше, чем этанол, получают путем гидрирования альдегидов, полученных гидроформилированием. Точно так же процесс Вакера используется при окислении этилена в ацетальдегид . [16]

Почти все промышленные процессы с использованием полимеров на основе алкенов основаны на использовании металлоорганических катализаторов. Полиэтилен и полипропилен в мире производятся как гетерогенно с помощью катализа Циглера-Натта , так и гомогенно, например, с помощью катализаторов с ограниченной геометрией . [17]
Большинство процессов с использованием водорода основаны на катализаторах на основе металлов. В то время как массовое гидрирование (например, производство маргарина) основано на гетерогенных катализаторах, при производстве тонких химикатов такое гидрирование основано на растворимых (гомогенных) металлоорганических комплексах или включает металлоорганические промежуточные соединения. [18] Металлоорганические комплексы позволяют проводить это гидрирование асимметрично.
Многие полупроводники производятся из триметилгаллия , триметилиндия , триметилалюминия и триметилсурьмы . Эти летучие соединения разлагаются вместе с аммиаком , арсином , фосфином и родственными гидридами на нагретой подложке посредством процесса газофазной эпитаксии металлорганических соединений (MOVPE) при производстве светоизлучающих диодов (LED).
Металлоорганические реакции [ править ]
Металлоорганические соединения вступают в ряд важных реакций:
- ассоциативное и диссоциативное замещение
- окислительное присоединение и восстановительное отщепление
- трансметаллирование
- миграционная вставка
- удаление β-гидрида
- перенос электрона
- активация углерод-водородной связи
- карбометаллирование
- гидрометаллирование
- циклометалирование
- нуклеофильная абстракция
Синтезу многих органических молекул способствуют металлоорганические комплексы. Метатезис сигма-связей — это синтетический метод образования новых углерод-углеродных сигма-связей . Метатезис сигма-связи обычно используется с ранними комплексами переходных металлов, которые находятся в высшей степени окисления. [19] Использование переходных металлов, находящихся в высшей степени окисления, предотвращает возникновение других реакций, таких как окислительное присоединение . Помимо метатезиса сигма-связи, метатезис олефинов используется для синтеза различных пи-связей углерод-углерод . Ни метатезис сигма-связи, ни метатезис олефинов не изменяют степень окисления металла. [20] [21] Для образования новых углерод-углеродных связей используются многие другие методы, включая внедрения бета-гидрида отщепления и реакции .
Катализ [ править ]
Металлоорганические комплексы широко используются в катализе. Основные промышленные процессы включают гидрирование , гидросилилирование , гидроцианирование , метатезис олефинов , полимеризацию алкенов , олигомеризацию алкенов , гидрокарбоксилирование , карбонилирование метанола и гидроформилирование . [16] Металлоорганические промежуточные соединения также используются во многих процессах гетерогенного катализа , аналогичных перечисленным выше. предполагаются металлоорганические промежуточные соединения Кроме того, в процессе Фишера-Тропша .
Металлоорганические комплексы также обычно используются в мелкомасштабном тонком химическом синтезе, особенно в реакциях кросс-сочетания. [22] которые образуют связи углерод-углерод, например соединение Сузуки-Мияуры , [23] Аминирование Бухвальда-Хартвига для получения ариламинов из арилгалогенидов, [24] и муфта Соногашира и т. д.
проблемы Экологические

В окружающей среде встречаются природные и загрязняющие металлоорганические соединения. Некоторые из них, такие как свинцовоорганические и ртутьорганические соединения, являются остатками использования человеком, представляют собой опасность токсичности. Тетраэтилсвинец был подготовлен для использования в качестве добавки к бензину , но вышел из употребления из-за токсичности свинца. Его заменителями являются другие металлоорганические соединения, такие как ферроцен и метилциклопентадиенилтрикарбонил марганца (ММТ). [25] Мышьяковоорганическое соединение роксарсон является спорной добавкой в корм для животных. В 2006 году только в США было произведено около миллиона килограммов этого напитка. [26] Оловоорганические соединения когда-то широко использовались в красках, препятствующих обрастанию , но с тех пор были запрещены из-за экологических проблем. [27]
См. также [ править ]
Ссылки [ править ]
- ↑ Перейти обратно: Перейти обратно: а б с д и ж г час я дж Крэбтри 2009 , с. [ нужна страница ] .
- ↑ Перейти обратно: Перейти обратно: а б с д ИЮПАК , Сборник химической терминологии , 2-е изд. («Золотая книга») (1997). Интернет-исправленная версия: (2006–) « Металлоорганические соединения ». два : 10.1351/goldbook.O04328
- ↑ Перейти обратно: Перейти обратно: а б с К. Эльшенбройх (2006). Металлоорганические соединения . ВЧ. ISBN 978-3-527-29390-2 .
- ^ Липпард и Берг 1994 , с. [ нужна страница ] .
- ^ Родригес-Рейес, JCF; Сильва-Киньонес, Д. (2018). «Металорганическая функционализация в вакууме». Энциклопедия межфазной химии . стр. 761–768. дои : 10.1016/B978-0-12-409547-2.13135-X . ISBN 978-0-12-809894-3 .
- ^ «Триэтилалюминий – ДСН» (PDF) . химБлинк . 24 мая 2016 года . Проверено 3 января 2021 г.
- ↑ Перейти обратно: Перейти обратно: а б с д Крэбтри, Роберт Х. (2014). Металлоорганическая химия переходных металлов (6-е изд.). Хобокен, Нью-Джерси. стр. 43, 44, 205. ISBN. 978-1-118-78824-0 . OCLC 863383849 .
{{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка ) - ↑ Перейти обратно: Перейти обратно: а б с д Шрайвер и др. 2014 , с. [ нужна страница ] .
- ^ Нельсон, Райан С.; Миллер, Джеффри Т. (2012). «Введение в рентгеновскую абсорбционную спектроскопию и ее применение in situ к металлоорганическим соединениям и гомогенным катализаторам». Катал. наук. Технол . 2 (3): 461–470. дои : 10.1039/C2CY00343K .
- ^ Хант, LB (1 апреля 1984 г.). «Первые металлоорганические соединения». Обзор платиновых металлов . 28 (2): 76–83. CiteSeerX 10.1.1.693.9965 .
- ^ Цейзе, туалет (1831 г.). «О влиянии хлорида платины на спирт и о новых веществах , образующихся при этом». Анналы физики и химии (на немецком языке). 97 (4): 497–541. Бибкод : 1831АнП....97..497Z . дои : 10.1002/andp.18310970402 .
- ^ Крэбтри 2009 , с. 98.
- ^ Драгутан, В.; Драгутан, И.; Балабан, АТ (1 января 2006 г.). «Нобелевская премия по химии 2005 года» . Обзор платиновых металлов . 50 (1): 35–37. дои : 10.1595/147106706X94140 .
- ^ Эльшенбройх 2016 , с. [ нужна страница ] .
- ^ В. Бертлефф; М. Ропер; Х. Сава. «Карбонилирование». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a05_217 . ISBN 978-3527306732 .
- ↑ Перейти обратно: Перейти обратно: а б Леувен 2005 , с. [ нужна страница ] .
- ^ Клосин, Ежи; Фонтейн, Филип П.; Фигероа, Рут (21 июля 2015 г.). «Разработка молекулярных катализаторов группы IV для высокотемпературных реакций сополимеризации этилена с α-олефином» . Отчеты о химических исследованиях . 48 (7): 2004–2016. doi : 10.1021/acs.accounts.5b00065 . ПМИД 26151395 .
- ^ Райландер, Пол Н. «Гидрирование и дегидрирование». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a13_487 . ISBN 978-3527306732 .
- ^ Уотерман, Рори (23 декабря 2013 г.). «Метатезис σ-связей: 30-летняя ретроспектива». Металлоорганические соединения . 32 (24): 7249–7263. дои : 10.1021/om400760k .
- ^ «Метатезис олефинов» . Металлоорганический гипертекст .
- ^ «Метатезис Сигма-связей» . Металлоорганический гипертекст .
- ^ Яна, Ранджан; Патак, Теджас П.; Сигман, Мэтью С. (9 марта 2011 г.). «Достижения в реакциях кросс-сочетания, катализируемых переходными металлами (Pd, Ni, Fe), с использованием алкилметаллорганических соединений в качестве партнеров реакции» . Химические обзоры . 111 (3): 1417–1492. дои : 10.1021/cr100327p . ПМК 3075866 . ПМИД 21319862 .
- ^ Малуэнда, Ирен; Наварро, Оскар (24 апреля 2015 г.). «Последние события в реакции Сузуки-Мияуры: 2010–2014 гг.» . Молекулы . 20 (5): 7528–7557. doi : 10.3390/molecules20057528 . ПМК 6272665 . ПМИД 25919276 .
- ^ Магано, Хавьер; Дунец, Джошуа Р. (9 марта 2011 г.). «Масштабное применение соединений, катализируемых переходными металлами, для синтеза фармацевтических препаратов». Химические обзоры . 111 (3): 2177–2250. дои : 10.1021/cr100346g . ПМИД 21391570 .
- ^ Сейферт, Д. (2003). «Взлет и падение тетраэтилсвинца. 2» . Металлоорганические соединения . 22 (25): 5154–5178. дои : 10.1021/om030621b .
- ^ Хилман, Бетт (9 апреля 2007 г.). «Мышьяк в курином производстве» . Новости химии и техники . 85 (15): 34–35. doi : 10.1021/cen-v085n015.p034 .
- ^ Лагерстрем, Мария; Стрэнд, Якоб; Эклунд, Бритта; Итреберг, Эрик (январь 2017 г.). «Общее образование олова и оловоорганических соединений в исторических слоях необрастающей краски на корпусах прогулочных лодок» . Загрязнение окружающей среды . 220 (Часть Б): 1333–1341. дои : 10.1016/j.envpol.2016.11.001 . ПМИД 27836476 .
Источники [ править ]
- Клейден, Джонатан; Гривз, Ник; Уоррен, Стюарт (2012). Органическая химия . ОУП Оксфорд. ISBN 978-0-19-927029-3 .
- Крэбтри, Роберт Х. (2009). Металлоорганическая химия переходных металлов . Джон Уайли и сыновья. ISBN 978-0-470-25762-3 .
- Эльшенбройх, Кристоф (2016). Металлоорганические соединения . Джон Уайли и сыновья. ISBN 978-3-527-80514-3 .
- Гупта, Б.Д.; Элиас, Эй Джей (2013). Основная металлоорганическая химия: концепции, синтез и применение переходных металлов . Хайдарабад: Universities Press. ISBN 978-81-7371-709-3 . OCLC 903314566 .
- Дженкинс, Пол Р. (1992). Металлоорганические реагенты в синтезе . Издательство Оксфордского университета. ISBN 978-0-19-855666-4 .
- Леувен, фургон Пита WNM (2005). Гомогенный катализ: понимание техники . Springer Science & Business Media. ISBN 978-1-4020-3176-2 .
- Липпард, Стивен Дж.; Берг, Джереми Марк (1994). Основы бионеорганической химии . Университетские научные книги. ISBN 978-0-935702-73-6 .
- Пирсон, Энтони Дж (1985). Металлоорганическая химия . Уайли. OCLC 1200566627 .
- Шрайвер, Дювард; Веллер, Марк; Овертон, Тина; Армстронг, Фрейзер; Рурк, Джонатан (2014). Неорганическая химия . У. Х. Фриман. ISBN 978-1-4292-9906-0 .







![Технеций[99mTc] сестамиби используется для визуализации сердечной мышцы в ядерной медицине.](http://upload.wikimedia.org/wikipedia/commons/thumb/1/17/Tc99_sestamibi_2D_structure.svg/100px-Tc99_sestamibi_2D_structure.svg.png)