Реакция внедрения
Реакция внедрения — это химическая реакция , при которой одно химическое вещество ( молекула или молекулярный фрагмент) вставляется в существующую связь , обычно состоящую из второго химического соединения, например :
Этот термин относится только к результату реакции и не указывает на ее механизм . Реакции внедрения наблюдаются в органической , неорганической и металлоорганической химии. участвует связь металл- лиганд В тех случаях, когда в координационном комплексе , эти реакции обычно носят металлоорганический характер и включают связь между переходным металлом и углеродом или водородом . [1] Обычно его относят к случаю, когда координационное число и степень окисления металла остаются неизменными. [2] Когда эти реакции обратимы, удаление небольшой молекулы из связи металл-лиганд называется экструзией или элиминированием.
| ( а ) |
| ( б ) |
Существует две распространенные геометрии вставки — 1,1 и 1,2 (на фото выше). Кроме того, внедряющая молекула может действовать либо как нуклеофил , либо как электрофил по отношению к металлокомплексу. [2] Это поведение будет обсуждаться более подробно для CO (нуклеофильное поведение) и SO 2 (электрофильное поведение).
Органическая химия
[ редактировать ]Реакции омологации, такие как омологация эфира Ковальского. [3] приведите простые примеры процесса внедрения в органический синтез. В реакции Арндта- Эйстерта [4] [5] Метиленовое звено вставляется в карбоксильно -углеродную связь карбоновой кислоты с образованием следующей кислоты в гомологическом ряду . Компания Organic Syntheses приводит пример t -BOC-защищенного ( S ) -фенилаланина (2-амино-3-фенилпропановой кислоты), который последовательно реагирует с триэтиламином , этилхлорформиатом и диазометаном с образованием α-диазокетона , который затем реагирует с трифторацетатом серебра. / триэтиламин в водном растворе для получения t -BOC защищенной формы ( S )-3-амино-4-фенилбутановой кислоты. [6]
Механистически, [7] α-диазокетон подвергается перегруппировке Вольфа [8] [9] с образованием кетена в 1,2-перегруппировке . Следовательно, метиленовая группа α- к карбоксильной группе в продукте является метиленовой группой диазометанового реагента. Было показано, что 1,2-перегруппировка сохраняет стереохимию хирального центра, поскольку продукт, образованный из t -BOC-защищенного ( S )-фенилаланина, сохраняет стереохимию ( S ) с зарегистрированным энантиомерным избытком по меньшей мере 99%. [6]
Родственным преобразованием является реакция Ниренштейна , в которой диазометан-метиленовая группа вставляется в связь углерод-хлор хлорангидрида с образованием α-хлоркетона. [10] [11] Пример, опубликованный в 1924 году, иллюстрирует реакцию в системе замещенного бензоилхлорида : [12]
Возможно, это удивительно, но α-бромацетофенон является второстепенным продуктом, когда эту реакцию проводят с бензоилбромидом , а димерный диоксан . основным продуктом является [13] Органические азиды также представляют собой пример реакции внедрения в органическом синтезе, и, как и в приведенных выше примерах, превращения протекают с потерей газообразного азота . При реакции тозилазида с норборнадиеном происходит реакция расширения кольца , в которой атом азота внедряется в углерод-углеродную связь α- к головке мостика: [14]
Перегруппировка Бекмана [15] [16] Это еще один пример реакции расширения кольца, в которой гетероатом внедряется в связь углерод-углерод. Наиболее важным применением этой реакции является превращение циклогексанона в его оксим, который затем в кислых условиях перегруппировывают с получением ε- капролактама . [17] сырье для производства нейлона 6 . Ежегодное производство капролактама превышает 2 миллиарда килограммов. [18]
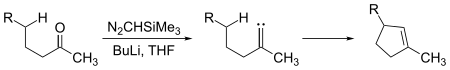
Карбены подвергаются реакциям как межмолекулярного , так и внутримолекулярного внедрения. Циклопентеновые фрагменты могут быть получены из достаточно длинноцепных кетонов реакцией с триметилсилилдиазометаном , (CH 3 ) 3 Si–CHN 2 :
Здесь промежуточный карбен встраивается в связь углерод-водород, образуя связь углерод-углерод, необходимую для замыкания циклопентенового кольца. Внедрение карбена в углерод-водородные связи может происходить и межмолекулярно:
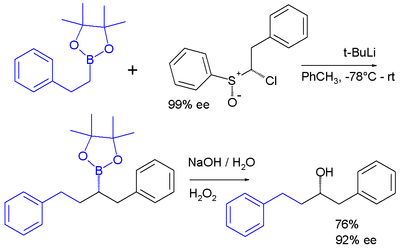
Карбеноиды — это реакционноспособные промежуточные соединения , которые ведут себя аналогично карбенам. [19] Одним из примеров является карбеноидный реагент хлоралкиллития, полученный in situ из сульфоксида и t -BuLi , который внедряется в связь углерод-бор боронового эфира пинакола : [20]
Металлоорганическая химия
[ редактировать ]Многие реакции в металлоорганической химии включают внедрение одного лиганда (L) в металл-гидридную или металл-алкил/арильную связь. Обычно гидридная, алкильная или арильная группа мигрирует на L, которым часто является CO, алкен или алкин.
Карбонилирование
[ редактировать ]Введение монооксида углерода и алкенов в связи металл-углерод представляет собой широко используемую реакцию, имеющую большое промышленное применение. [21] [22]

Такие реакции подчиняются обычным параметрам, которые влияют на другие реакции координационной химии, но стерические эффекты особенно важны при определении стереохимии и региохимии реакций. Обратная реакция – удаление CO и алкенов – также имеет фундаментальное значение во многих каталитических циклах.
Широко используемыми применениями миграционного внедрения карбонильных групп являются гидроформилирование и карбонилированное производство уксусной кислоты. Первый превращает алкены, водород и окись углерода в альдегиды. Производство уксусной кислоты карбонилированием осуществляется двумя схожими промышленными процессами. на основе родия Более традиционным является процесс уксусной кислоты Monsanto , но этот процесс был заменен процессом Cativa на основе иридия . [23] [24] К 2002 году годовое производство уксусной кислоты во всем мире составило 6 миллионов тонн, из которых примерно 60% производится по процессу Cativa. [23]
процесса Cativa Каталитический цикл , показанный выше, включает этапы как внедрения, так и удаления. Реакция окислительного присоединения йодистого метила с ( 1 ) включает формальное внедрение центра иридия(I) в связь углерод-йод, тогда как стадии ( 3 )-( 4 ) являются примером миграционного внедрения оксида углерода в иридий. -углеродная связь. Активные частицы катализатора регенерируются путем восстановительного удаления ацетилйодида 4 из ( ) - реакции деинсерции. [23]
Вставка олефина
[ редактировать ]Введение этилена и пропилена в алкилы титана является краеугольным камнем катализа Циглера-Натта , коммерческого пути получения полиэтилена и полипропилена. Эта технология в основном использует гетерогенные катализаторы, но широко распространено мнение, что принципы и наблюдения над гомогенными системами применимы и к твердотельным версиям. Сопутствующие технологии включают процесс производства высших олефинов Shell , который производит предшественники моющих средств . [25] олефин может быть координирован с металлом перед введением. В зависимости от плотности лигандов металла может потребоваться диссоциация лиганда для обеспечения координационного центра олефина. [26]

Другие реакции внедрения в координационной химии
[ редактировать ]Многие электрофильные оксиды встраиваются в углеродные связи металлов; к ним относятся диоксид серы , диоксид углерода и оксид азота. Эти реакции имеют ограниченное практическое значение, но представляют исторический интерес. С алкилами переходных металлов эти оксиды ведут себя как электрофилы и внедряются в связь между металлами и их относительно нуклеофильными алкильными лигандами. Как обсуждалось в статье о комплексах диоксида серы металлов , внедрение SO 2 было исследовано особенно подробно.
Еще реакции внедрения по органической химии
[ редактировать ]Электроположительные металлы, такие как натрий, калий, магний, цинк и т. д., могут встраиваться в алкилгалогениды, разрывая связь галоидуглерода. (галогениды могут быть хлором, бромом, йодом) и образуют связь углерод-металл. Эта реакция происходит по механизму SET (механизм одноэлектронного переноса). Если магний реагирует с алкилгалогенидом, образуется реактив Гриньяра , а если реагирует литий, литийорганический реагент образуется . Таким образом, этот тип реакций внедрения имеет важные применения в химическом синтезе .

Ссылки
[ редактировать ]- ^ Дуглас, МакДэниел и Александр (1994). Концепции и модели неорганической химии 3-е изд . Джон Уайли и сыновья, Inc. ISBN 978-0-471-62978-8 .
{{cite book}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Jump up to: а б Джей Джей Александр (1985). Хартли и Патай (ред.). Химия связи металл-углерод, вып. 2 . Джон Уайли и сыновья.
- ^ Редди, RE; Ковальски, CJ (1993). «Этил-1-нафтилацетат: омологация сложного эфира с помощью инолат-анионов» . Органические синтезы . 71 :146 ; Сборник томов , т. 9, с. 426 .
- ^ Арндт, Ф .; Эйстерт, Б. (1935). «Процесс преобразования карбоновых кислот в их высшие гомологи или их производные». Бер. Немецкий. Хим. Гес . 68 (1): 200–208. дои : 10.1002/cber.19350680142 .
- ^ Еще.; МакКерви, Массачусетс (1994). «Органический синтез с α-диазокарбонильными соединениями». хим. Откр. 94 (4): 1091–1160. дои : 10.1021/cr00028a010 .
- ^ Jump up to: а б Линдер, MR; Штойрер, С.; Подлеч, Дж. (2002). «( S )-3-( трет- Бутилоксикарбониламино)-4-фенилбутановая кислота» . Органические синтезы . 79 :154 ; Сборник томов , т. 10, с. 194 .
- ^ Хаггетт, К.; Арнольд, RT; Тейлор, TI (1942). «Механизм реакции Арндта-Эйстерта». Дж. Ам. хим. Соц. 64 (12): 3043. doi : 10.1021/ja01264a505 .
- ^ Мейер, Х.; Целлер, К.-П. (1975). «Перегруппировка Вольфа α-диазокарбонильных соединений». Энджью. хим. Межд. Эд. 14 (1): 32–43. дои : 10.1002/anie.197500321 .
- ^ Кирмсе, В. (2002). «100 лет перегруппировки Вольфа». Евро. Дж. Орг. хим. 2002 (14): 2193–2256. doi : 10.1002/1099-0690(200207)2002:14<2193::AID-EJOC2193>3.0.CO;2-D .
- ^ Клиббенс, Д.А.; Ниренштейн, М. (1915). «Действие диазометана на некоторые ароматические ацилхлориды» . Дж. Хим. Соц., Пер. 107 : 1491–1494. дои : 10.1039/CT9150701491 .
- ^ Бахманн, МЫ ; Струве, WS (1942). «Реакция Арндта-Эйстерта». Орг. Реагировать. 1:38 .
- ^ Ниренштайн, М.; Ван, генеральный директор; Уорр, Дж. К. (1924). «Действие диазометана на некоторые ароматические ацилхлориды II. Синтез физетола». Дж. Ам. хим. Соц. 46 (11): 2551–2555. дои : 10.1021/ja01676a028 .
- ^ Льюис, Х.Х.; Ниренштайн, М.; Рич, Э.М. (1925). «Действие диазометана на некоторые ароматические ацилхлориды III. Механизм реакции». Дж. Ам. хим. Соц. 47 (6): 1728–1732. дои : 10.1021/ja01683a036 .
- ^ Рид, Д.Д.; Бергмайер, Южная Каролина (2007). «Простой синтез полигидроксилированного 2-азабицикло[3.2.1]октана». Дж. Орг. хим. 72 (3): 1024–1026. дои : 10.1021/jo0619231 . ПМИД 17253828 .
- ^ Бекманн, Э. (1886). «О знаниях изонитрозосоединений» . Бер. Немецкий. Хим. Гес . 19 :988-993. дои : 10.1002/cber.188601901222 .
- ^ Гоули, RE (1988). «Реакции Бекмана: перегруппировка, устранение-присоединение, фрагментация и перегруппировка-циклизация». Орг. Реагировать. 35 : 14–24. дои : 10.1002/0471264180.или035.01 . ISBN 0471264180 .
- ^ Эк, Джей Си; Марвел, CS (1939). «ε-Бензоиламинокапроновая кислота» . Органические синтезы . 19:20 ; Сборник томов , т. 2, 1943, с. 76 .
- ^ Ритц, Дж.; Фукс, Х.; Кечка, Х.; Моран, WC (2000). «Капролактам». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a05_031 . ISBN 3527306730 .
- ^ Макмерри, Дж. (1988). Органическая химия (2-е изд.). Брукс/Коул . ISBN 0-534-07968-7 .
- ^ Блейкмор, PR ; Бердж, MS (2007). «Итеративная стереоспецифическая омологация боронатов пинакола, контролируемая реагентами, с помощью энантиообогащенных хлоралкиллитиевых реагентов». Дж. Ам. хим. Соц. 129 (11): 3068–3069. дои : 10.1021/ja068808s . ПМИД 17326640 .
- ^ Эльшенбройх, К. «Металлоорганические соединения» (2006) Wiley-VCH: Weinheim. ISBN 978-3-527-29390-2
- ^ Хартвиг, Дж. Ф. Химия органопереходных металлов, от связывания к катализу; Университетские научные книги: Нью-Йорк, 2010. ISBN 1-891389-53-X
- ^ Jump up to: а б с Джонс, Дж. Х. (2000). «Процесс Cativa производства уксусной кислоты» (PDF) . Платиновые металлы Ред. 44 (3): 94–105. дои : 10.1595/003214000X44394105 . Архивировано из оригинала (PDF) 24 сентября 2015 г. Проверено 22 декабря 2010 г.
- ^ Санли, Дж.Дж.; Уотсон, диджей (2000). «Высокопроизводительный катализ карбонилирования метанола с использованием иридия - процесс Cativa для производства уксусной кислоты». Катализ сегодня . 58 (4): 293–307. дои : 10.1016/S0920-5861(00)00263-7 .
- ^ Крэбтри, Р. Х. (2009). Металлоорганическая химия переходных металлов . Джон Уайли и сыновья . стр. 19–25. ISBN 978-0-470-25762-3 .
- ^ Кисин Ю.В. (2008). «Синтез, химический состав и структура компонентов переходных металлов и сокатализаторов в каталитических системах полимеризации алкенов» . Реакции полимеризации алкенов с катализаторами из переходных металлов . Амстердам: Эльзевир . стр. 207–290. ISBN 978-0-444-53215-2 .