изоцианид
Изоцианид группой (также называемый изонитрилом или карбиламином ) представляет собой органическое соединение с функциональной – Н + ≡C − . Это изомер родственного нитрила (–C≡N), поэтому префикс — изоциано . [1] Органический фрагмент связан с изоцианидной группой через атом азота , а не через углерод . Они используются в качестве строительных блоков для синтеза других соединений. [2]
Характеристики
[ редактировать ]Структура и связь
[ редактировать ]Расстояние CN в изоцианидах составляет 115,8 пм в метилизоцианиде . Углы ЧПУ составляют около 180°. [3]
Подобно монооксиду углерода , изоцианиды описываются двумя резонансными структурами : одна с тройной связью между азотом и углеродом, а другая с двойной связью между ними. Неподеленная π-пара азота стабилизирует структуру и отвечает за линейность изоцианидов, хотя реакционная способность изоцианидов отражает некоторый карбеновый характер, по крайней мере, в формальном смысле. Таким образом, обе резонансные структуры являются полезными представлениями. [4] Они подвержены полимеризации . [4]
Спектроскопия
[ редактировать ]Изоцианиды проявляют сильное поглощение в ИК-спектрах в диапазоне 2165–2110 см-1. −1 . [5]
Электронная симметрия относительно изоцианида 14 Ядро N приводит к медленной квадруполярной релаксации , так что 13 С- 14 N-ядерное спиновое взаимодействие Можно наблюдать с константами взаимодействия ок . 5 Гц для изоцианида 13 ядра C и 5–14 Гц для 13 Ядро С, к которому присоединена изоцианидная группа. [5]
Запах
[ редактировать ]Изоцианиды имеют очень неприятный запах. Цитируя Лике: « У него резкий, крайне неприятный запах ; достаточно открыть колбу с аллил[изо]цианидом, чтобы загрязнить воздух в комнате на несколько дней). Обратите внимание, что во времена Лике разница между изоцианидом и нитрилом не была полностью оценена. [ Эта цитата нуждается в цитировании ]
Ивар Карл Уги утверждает, что « развитие химии изоцианидов, вероятно, претерпело лишь небольшую задержку из-за характерного запаха летучих изонитрилов, который Хофманн и Готье описали как «очень специфический, почти подавляющий», «ужасный» и « Это правда, что многие потенциальные работники в этой области отвернулись от запаха, но это сильно перевешивается тем фактом, что изонитрилы можно обнаружить даже в следах, и что большинство путей, ведущих к образованию изонитрилов. изонитрилы были обнаружены по запаху этих соединений». [6] Изоцианиды исследовались как потенциальное оружие несмертельного действия . [7]
Некоторые изоцианиды передают менее неприятные запахи, такие как солод, натуральный каучук, креозот, вишня или старое дерево. [8] Нелетучие производные, такие как тозилметилизоцианид, не имеют запаха. [9]
Токсичность
[ редактировать ]Хотя некоторые изоцианиды ( например, циклогексилизоцианид) токсичны, другие «не проявляют заметной токсичности для млекопитающих». Что касается этилизоцианида, то токсикологические исследования, проведенные в 1960-х годах в компании Bayer, показали, что «мыши могут переносить пероральные и подкожные дозы 500-5000 мг/кг». [6]
Синтез
[ редактировать ]Разработано множество путей получения изоцианидов. [2]
Из формамидов
[ редактировать ]синтезируют путем дегидратации формамидов Обычно изоцианиды . Формид можно дегидратировать толуолсульфонилхлоридом , оксихлоридом фосфора , фосгеном , дифосгеном или реагентом Берджесса в присутствии основания, такого как пиридин или триэтиламин. [10] [11] [12] [13]
- RNHC(O)H + ArSO 2 Cl + 2 C 5 H 5 N → RNC + [C 5 H 5 NH] + [ АрСО3 ] − + [С 5 Н 5 НН] + кл. −
Предшественники формамида, в свою очередь, получают из аминов формилированием муравьиной кислотой или формилацетилангидридом. [14] .или из реакции Риттера алкенов (и других источников карбокатионов) и цианистого водорода. [15]
Из дихлоркарбена
[ редактировать ]В реакции карбиламина (также известной как синтез изоцианида Гофмана) щелочное основание реагирует с хлороформом с образованием дихлоркарбена . Затем карбен превращает первичные амины в изоцианиды. Показательным является синтез трет -бутилизоцианида из трет -бутиламина в присутствии каталитического количества катализатора межфазного переноса бензилтриэтиламмония хлорида. [16]
- Me 3 CNH 2 + CHCl 3 + 3 NaOH → Me 3 CNC + 3 NaCl + 3 H 2 O
Поскольку она эффективна только для первичных аминов, эту реакцию можно использовать в качестве химического теста на их присутствие.
Маршрут цианида серебра
[ редактировать ]Представляя исторический интерес, но не всегда практическую ценность, первый изоцианид, аллилизоцианид , был получен реакцией аллилиодида и цианида серебра . [17]
- RI + AgCN → RNC + AgI
Другие методы
[ редактировать ]Другой путь получения изоцианидов включает депротонирование оксазолов и бензоксазолов во 2-м положении. [8] Полученное литийорганическое соединение находится в химическом равновесии с 2-изоцианофенолятом , который может быть захвачен электрофилом, таким как хлорангидрид .
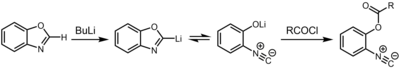
Реакции
[ редактировать ]Изоцианиды обладают разнообразной реакционной способностью. [2]
Изоцианиды устойчивы к сильным основаниям (их часто производят в сильноосновных условиях), но чувствительны к кислоте. В присутствии водной кислоты изоцианиды гидролизуются до соответствующих формамидов :
- РНК + Н 2 О → RNHC(O)H
Эту реакцию используют для разрушения пахучих смесей изоцианидов. Некоторые изоцианиды могут полимеризоваться в присутствии кислот Льюиса и Бренстеда. [18]
Изоцианиды участвуют во многих многокомпонентных реакциях, представляющих интерес для органического синтеза , две из которых: реакция Уги и реакция Пассерини .
Изоцианиды также участвуют в реакциях циклоприсоединения , таких как [4+1]-циклоприсоединение с тетразинами. [19] В зависимости от степени замещения изоцианида эта реакция превращает изоцианиды в карбонилы или дает стабильные циклоаддукты. [20] Они также подвергаются внедрению в связи C–Cl ацилхлоридов в реакции изоцианида Нефа , процессе, который считается согласованным и иллюстрирует их карбеновый характер.
Также было показано, что изоцианиды являются полезным реагентом в реакциях, катализируемых палладием, в которых с помощью этого метода образуется широкий спектр соединений. [21]
α-положение изоцианидов имеет значительную кислотность. Например, бензилизоцианид имеет ap K a 27,4. Для сравнения, у бензилцианида ap K a составляет 21,9. [22] В газовой фазе CH 3 NC на 1,8 ккал/моль менее кислый, чем СН 3 CN . [23]
Хлорирование изоцианидов дает дихлориды изоцианидов .
Лиганды в координационной химии
[ редактировать ]
Изоцианиды образуют координационные комплексы с большинством переходных металлов. [24] Они ведут себя как богатые электронами аналоги угарного газа. Например, трет-бутилизоцианида формы Fe 2 (tBuNC) 9 , аналогичный Fe 2 (СО) 9 . [25] Несмотря на структурное сходство, аналогичные карбонилы различаются по нескольким признакам, главным образом потому, что t -BuNC является лучшим донорным лигандом, чем CO. Таким образом, Fe(tBuNC) 5 легко протонируется, тогда как его аналог Fe(CO) 5 нет. [26]
Природные изоцианиды
[ редактировать ]Лишь немногие встречающиеся в природе соединения обладают изоцианидной функциональностью. Первый был обнаружен в 1957 году в экстракте плесени Penicillium notatum . Соединение ксантоциллин позже использовалось в качестве антибиотика . С тех пор было выделено множество других изоцианидов. Большинство морских изоцианидов являются терпеноидами, тогда как некоторые наземные изоцианиды происходят из α-аминокислот. [27]

Ксантоциллин – редкий природный продукт , содержащий две изоцианидные группы.
Номенклатура
[ редактировать ]ИЮПАК использует приставку «изоциано» для систематической номенклатуры изоцианидов: изоцианометан , изоцианоэтан, изоцианопропан и т. д.
Иногда используемый старый термин «карбиламин» противоречит систематической номенклатуре. Амин : всегда имеет три одинарные связи [28] тогда как изоцианид имеет только одну одинарную и одну кратную связь.
Функциональная группа изоцианамида состоит из аминогруппы , присоединенной к изоцианогруппе.для номенклатуры в зависимости от таблицы приоритетов используется суффикс изонитрила или префикс изоциано.
Ссылки
[ редактировать ]- ^ Золотой книги ИЮПАК Изоцианиды
- ^ Перейти обратно: а б с Патил, Правин; Ахмадиан-Могаддам, Марьям; Дёмлинг, Александр (29 сентября 2020 г.). «Изоцианид 2.0» . Зеленая химия . 22 (20): 6902–6911. дои : 10.1039/D0GC02722G . ISSN 1463-9270 .
- ^ Кесслер, М.; Ринг, Х.; Трамбаруло, Р.; Горди, В. (1950). «Микроволновые спектры и молекулярные структуры метилцианида и метилизоцианида». Физический обзор . 79 (1): 54–56. Бибкод : 1950PhRv...79...54K . дои : 10.1103/PhysRev.79.54 .
- ^ Перейти обратно: а б Рамоцци, Р.; Шерон, Н.; Брайда, Б.; Хиберти, ПК; Флёра-Лессард, П. (2012). «Валентная связь электронной структуры изоцианидов». Новый химический журнал . 36 (5): 1137–1340. дои : 10.1039/C2NJ40050B .
- ^ Перейти обратно: а б Стефани, RW; де Би, MJA; Дрент, В. (1974). "А 13 С-ЯМР и ИК исследование изоцианидов и некоторых их комплексов». Органический магнитный резонанс . 6 (1): 45–47. doi : 10.1002/mrc.1270060112 .
- ^ Перейти обратно: а б Уги, И.; Фетцер, Ю.; Эхольцер, У.; Кнупфер, Х.; Офферманн, К. (1965). «Синтез изонитрила». Angewandte Chemie, международное издание . 4 (6): 472–484. дои : 10.1002/anie.196504721 .
- ^ Пиррунг, MC; Гораи, С.; Ибарра-Ривера, ТР (2009). «Многокомпонентные реакции конвертируемых изонитрилов». Журнал органической химии . 74 (11): 4110–4117. дои : 10.1021/jo900414n . ПМИД 19408909 .
- ^ Перейти обратно: а б Пиррунг, MC; Гораи, С. (2006). «Универсальные, ароматные, конвертируемые изонитрилы». Журнал Американского химического общества . 128 (36): 11772–11773. дои : 10.1021/ja0644374 . ПМИД 16953613 .
- ^ Б.Е. Хугенбум, О.Г. Олдензиль и А.М. ван Леузен «Органический синтез толуолсульфонилметилизоцианида», Coll. Том. 6, с.987 (1988).
- ^ Р.Э. Шустер; Дж. Э. Скотт (1966). «Метилизоцианид» . Органические синтезы . 46:75 . дои : 10.15227/orgsyn.046.0075 .
- ^ Ивар Карл Уги ; Р. Мейр (1958). «Новый метод представления изонитрилов». Прикладная химия . 70 (22–23): 702–703. Бибкод : 1958АнгЧ..70..702У . дои : 10.1002/anie.19580702213 .
- ^ Шивон Кридон; Х. Кевин Кроули; Дэниел Дж. Маккарти (1998). «Обезвоживание формамидов с использованием реагента Берджесса: новый путь к изоцианидам». Дж. Хим. Soc., Перкин Транс. 1 (6): 1015–1018. дои : 10.1039/a708081f .
- ^ Басокку, Франческо; Кукко, Федерико; Касти, Федерико; Моччи, Рита; Фаттуони, Клаудия; Порчедду, Андреа (22 июня 2022 г.). «Надежный механохимический путь получения изоцианидов» . Журнал органической химии Байльштейна . 18 : 732–737. дои : 10.3762/bjoc.18.73 . ПМЦ 9235834 . ПМИД 35821692 .
- ^ 정선호; 안진희; Пак, Сан-Кю; 최중권 (20 января 2002 г.). «Практическая и удобная процедура N-формилирования аминов с использованием муравьиной кислоты» . Бюллетень Корейского химического общества . 23 (1): 149–150. дои : 10.5012/BKCS.2002.23.1.149 .
- ^ «а,b-ДИМЕТИЛ-b-ФЕНЕТИЛАМИН» . Органические синтезы . 44 : 44. 1964. doi : 10.15227/orgsyn.044.0044 .
- ^ Г.В.Гокель; Р.П. Видера; В.П. Вебер (1988). «Фазовая реакция карбиламина Гофмана: трет-бутилизоцианид». Органические синтезы . 55 : 232. дои : 10.15227/orgsyn.055.0096 .
- ^ В. Лике (1859). «О цианоаллиле» . Анналы химии и фармации . 112 (3): 316–321. дои : 10.1002/jlac.18591120307 .
- ^ Деминг, Ти Джей; Новак, Б.М. (1993). «Механистические исследования катализируемой никелем полимеризации изоцианидов». Дж. Ам. хим. Соц . 115 (20): 9101. doi : 10.1021/ja00073a028 .
- ^ Имминг, П.; Р. Мор; Э. Мюллер; В. Оверё; Г. Зейтц (1982). «[4 + 1]Циклоприсоединение изоцианидов к 1,2,4,5-тетразинам: новый синтез пиразола». Angewandte Chemie, международное издание . 21 (4): 284. doi : 10.1002/anie.198202841 .
- ^ Штёкманн, Х.; А. Невес; С. Лестница; К. Бриндл; Ф. Липер (2011). «Изучение клик-химии на основе изонитрила для лигирования биомолекул». Органическая и биомолекулярная химия . 9 (21): 7303–7305. дои : 10.1039/C1OB06424J . ПМИД 21915395 .
- ^ Ланг, С. (2013). «Разгадка лабиринта катализируемых палладием реакций с участием изоцианидов». Обзоры химического общества . 42 (12): 4867–4880. дои : 10.1039/C3CS60022J . ПМИД 23443313 .
- ^ «Таблица pKa Bordwell (кислотность в ДМСО)» . www.chem.wisc.edu . Проверено 20 декабря 2018 г.
- ^ Филли, Джонатан; ДеПей, Чарльз Х.; Бирбаум, Вероника М. (1 сентября 1987 г.). «Газофазная химия отрицательных ионов метилизоцианида». Журнал Американского химического общества . 109 (20): 5992–5995. дои : 10.1021/ja00254a017 . ISSN 0002-7863 .
- ^ Синглтон, Эрик; Остхейзен, Хестер Э. (1983). «Комплексы изоцианидов металлов». Достижения металлоорганической химии . 22 : 209–310. дои : 10.1016/S0065-3055(08)60404-9 . ISBN 9780120311224 .
- ^ Бассетт, Дж. М.; Баркер, ГК; Грин, М.; Ховард, Дж.А.; Стоун, Джорджия; Уолси, В.К. «Химия изоцианидных комплексов низковалентных металлов». Журнал Химического общества, Dalton Transactions . 1981 : 219–227.
- ^ Бассетт, Ж.-М.; Фарруджа, LJ; Стоун, FGA (1980). «Примечания. Протонирование пентакис(т-бутилизоцианида) железа». Журнал Химического общества, Dalton Transactions . 1980 (9): 1789–1790. дои : 10.1039/DT9800001789 .
- ^ Шойер, П.Дж. (1992). «Изоцианиды и цианиды как натуральные продукты». Отчеты о химических исследованиях . 25 (10): 433–439. дои : 10.1021/ar00022a001 .
- ^ Номенклатура органических соединений ИЮПАК (рекомендации 1993 г.)
![{\displaystyle \left[{\ce {R}}-{\overset {\oplus }{\ce {N}}}{\ce {#}}{\overset {\ominus }{\ce {C}} }{\what {:\,<->R-{\ddot {N}}=C{:}}}\right]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/31596ad44ed69b7ad7230333e4059f48ef0d3b65)
