Пирролидин
| |||
| Имена | |||
|---|---|---|---|
| Предпочтительное название ИЮПАК
Пирролидин [ 1 ] | |||
| Другие имена
Азолидин
Азациклопентан Тетрагидропиррол Проламин Азолан | |||
| Идентификаторы | |||
3D model ( JSmol )
|
|||
| 102395 | |||
| КЭБ | |||
| ХЭМБЛ | |||
| ХимическийПаук | |||
| Информационная карта ECHA | 100.004.227 | ||
| Номер ЕС |
| ||
| 1704 | |||
ПабХим CID
|
|||
| номер РТЭКС |
| ||
| НЕКОТОРЫЙ | |||
| Число | 1922 | ||
Панель управления CompTox ( EPA )
|
|||
| Характеристики | |||
| С 4 Ч 9 Н | |||
| Молярная масса | 71.123 g·mol −1 | ||
| Появление | Прозрачная бесцветная жидкость | ||
| Плотность | 0,866 г/см 3 | ||
| Температура плавления | -63 ° C (-81 ° F; 210 К) | ||
| Точка кипения | 87 ° C (189 ° F; 360 К) | ||
| смешивается | |||
| Кислотность ( pKa ) | 11,27 (pKa сопряженной , кислоты в воде) [ 2 ] 19,56 (pKa сопряженной ) кислоты в ацетонитриле [ 3 ] | ||
| -54.8·10 −6 см 3 /моль | |||
Показатель преломления ( n D )
|
1,4402 при 28°С | ||
| Опасности | |||
| Безопасность и гигиена труда (OHS/OSH): | |||
Основные опасности
|
легковоспламеняющийся, вредный, коррозионный, возможен мутаген | ||
| СГС Маркировка : | |||
  
| |||
| Опасность | |||
| Х225 , Х302 , Х314 , Х332 | |||
| P210 , P233 , P240 , P241 , P242 , P243 , P260 , P261 , P264 , P270 , P271 , P280 , P301+P312 , P301+P330+P331 , P303+P361+P353 , P304+P312 , P304+P340 , P305+P351+P338 , P310 , P312 , P321 , P330 , P363 , P370+P378 , P403+P235 , P405 , P501 | |||
| NFPA 704 (огненный алмаз) | |||
| точка возгорания | 3 ° С (37 ° F; 276 К) | ||
| 345 ° C (653 ° F; 618 К) | |||
| Паспорт безопасности (SDS) | Паспорт безопасности | ||
| Родственные соединения | |||
Родственные азотистые гетероциклические соединения
|
Пиррол (ароматический с двумя двойными связями) Пирролин (одна двойная связь) Пирролизидин (два пятиугольных кольца) | ||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |||
Пирролидин , также известный как тетрагидропиррол , представляет собой органическое соединение с молекулярной формулой (CH 2 ) 4 NH. Это циклический вторичный амин , также классифицируемый как насыщенный гетероцикл . Это бесцветная жидкость, смешивающаяся с водой и большинством органических растворителей. Он имеет характерный запах, который описывают как «аммиачный, рыбный, напоминающий моллюсков». [ 4 ] Помимо самого пирролидина известно множество замещенных пирролидинов.
Производство и синтез
[ редактировать ]Промышленное производство
[ редактировать ]Пирролидин получают промышленным путем реакцией 1,4-бутандиола и аммиака при температуре 165–200 °С и давлении 17–21 МПа в присутствии кобальт- и оксидного катализатора, нанесенного на оксид алюминия . [ 5 ]
Реакцию проводят в жидкой фазе в трубчатом или пучковом реакторе непрерывного действия, который работает по методу рециркуляционного газа. Катализатор выполнен в виде неподвижного слоя, конверсия осуществляется в нисходящем режиме. Продукт получают после многоступенчатой очистки и разделения экстрактивной и азеотропной перегонкой . [ 5 ]
Лабораторный синтез
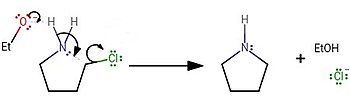
[ редактировать ]В лаборатории пирролидин обычно синтезировали обработкой 4-хлорбутан-1-амина сильным основанием:
Кроме того, 5-членное N -гетероциклическое кольцо производных пирролидина может быть синтезировано посредством каскадных реакций . [ 6 ]
возникновение
[ редактировать ]Многие модификации пирролидина встречаются в природных и синтетических лекарствах, а также в потенциальных лекарствах. [ 6 ] Пирролидиновая кольцевая структура присутствует во многих природных алкалоидах , в т.ч. никотин и гигрин . Он содержится во многих лекарствах, таких как проциклидин и бепридил . Он также является основой соединений рацетама ( например , пирацетама , анирацетама ). Аминокислоты . пролин и гидроксипролин в структурном смысле являются производными пирролидина
Реакции
[ редактировать ]Пирролидин – основание. Его основность типична для других диалкиламинов. [ 7 ] По сравнению со многими вторичными аминами пирролидин отличается своей компактностью, являющейся следствием его циклической структуры.
Пирролидин используется в качестве строительного материала при синтезе более сложных органических соединений. Он используется для активации кетонов и альдегидов в направлении нуклеофильного присоединения путем образования енаминов (например, используется при алкилировании енаминов Сторка ): [ 8 ]
Ссылки
[ редактировать ]- ^ Международный союз теоретической и прикладной химии (2014). Номенклатура органической химии: Рекомендации ИЮПАК и предпочтительные названия 2013 . Королевское химическое общество . п. 142. дои : 10.1039/9781849733069 . ISBN 978-0-85404-182-4 .
- ^ Холл, Гонконг (1957). «Корреляция основных сил аминов». Журнал Американского химического общества . 79 (20): 5441–5444. дои : 10.1021/ja01577a030 .
- ^ Кальюранд, И.; Кютт, А.; Соовяли, Л.; Родима, Т.; Мяэметс, В.; Лейто, И.; Коппель, ИА (2005). «Расширение самосогласованной спектрофотометрической шкалы основности в ацетонитриле до полного диапазона 28 единиц пКа: унификация различных шкал основности». Журнал органической химии . 70 (3): 1019–1028. дои : 10.1021/jo048252w . ПМИД 15675863 .
- ^ Пирролидин. Архивировано 21 ноября 2017 г. в Wayback Machine , The Good Scents Company.
- ^ Jump up to: а б Бу Чедид, Роланд; Мельдер, Иоганн-Петер; Досталек, Роман; Пастре, Йорг; Тан, Айк Меам. «Способ получения пирролидина» . Гугл Патенты . БАСФ СЭ. Архивировано из оригинала 5 июля 2019 года . Проверено 5 июля 2019 г.
- ^ Jump up to: а б Ловицкий, Даниэль; Пшибыльский, Петр (2022). «Тандемное построение биологически важных алифатических 5-членных N-гетероциклов». Европейский журнал медицинской химии . 235 : 114303. doi : 10.1016/j.ejmech.2022.114303 . ПМИД 35344904 . S2CID 247580048 .
- ^ Х. К. Холл младший (1957). «Корреляция основных сил аминов». Дж. Ам. хим. Соц . 79 (20): 5441. doi : 10.1021/ja01577a030 .
- ^ Р.Б. Вудворд , И.Дж. Пахтер и М.Л. Шейнбаум (1974). «2,2-(Триметилендитио)циклогексанон» . Органические синтезы . 54 : 39
{{cite journal}}: CS1 maint: multiple names: authors list (link); Сборник томов , т. 6, с. 1014 .
Внешние ссылки
[ редактировать ] СМИ, связанные с пирролидином, на Викискладе?
СМИ, связанные с пирролидином, на Викискладе?