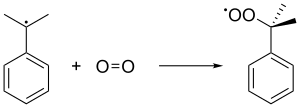Общий процесс
Кумоловый процесс ( кумол-фенольный процесс , Хока-процесс ) — промышленный процесс синтеза фенола и ацетона из бензола и пропилена . Этот термин происходит от кумола (изопропилбензола), промежуточного материала в процессе. Его изобрели Р. Удрис и П. Сергеев в 1942 г. (СССР). [1] и независимо Генрихом Хоком в 1944 году. [2] [3]
Этот процесс превращает два относительно дешевых исходных материала, бензол и пропилен , в два более ценных, фенол и ацетон . Другими необходимыми реагентами являются кислород из воздуха и небольшие количества радикального инициатора . Большая часть мирового производства фенола и ацетона в настоящее время основана на этом методе. В 2022 году кумоловым процессом было произведено около 10,8 млн тонн фенола. [4] Чтобы этот процесс был экономичным, также должен быть спрос на побочный продукт ацетон , а также на фенол . [5]


Этапы процесса
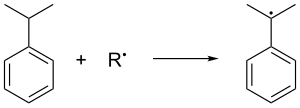
[ редактировать ]Кумол образуется при газофазном по Фриделю-Крафтсу алкилировании бензола пропеном. Бензол и пропен сжимают вместе до давления 30 стандартных атмосфер при температуре 250°C в присутствии каталитической кислоты Льюиса . Фосфорная кислота часто предпочтительнее алюминия галогенидов . Кумол окисляется на воздухе, который удаляет третичный бензильный водород из кумола и, следовательно, образует кумоловый радикал :
Затем радикал кумола связывается с молекулой кислорода, образуя пероксида радикал кумола, который, в свою очередь, образует гидропероксид кумола (C 6 H 5 C(CH 3 ) 2 O 2 H) путем отделения бензильного водорода от другой молекулы кумола. Этот последний кумол превращается в кумоловый радикал и возвращается в последующие цепные образования гидропероксидов кумола. Давление 5 атм используется для того, чтобы нестабильный пероксид сохранялся в жидком состоянии.
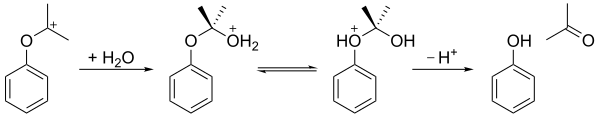
среде подвергается реакции перегруппировки Гидроперекись кумола в кислой ( перегруппировка Хока ) с образованием фенола и ацетона . На первом этапе протонируется концевой гидропероксиатом кислорода. За этим следует стадия, на которой фенильная группа мигрирует от бензильного углерода к соседнему кислороду, и молекула воды теряется, образуя резонансно стабилизированный третичный карбокатион . Согласованный механизм этой стадии аналогичен механизмам окисления Байера-Виллигера. [6] и реакции перегруппировки Криджи , а также окислительную стадию процесса гидроборирования-окисления . [7] В 2009 году было доказано, что подкисленная бентонитовая глина является более экономичным катализатором, чем серная кислота в качестве кислой среды.
Образующийся карбокатион затем подвергается воздействию воды, образуя структуру, подобную полуацеталю . После перехода протона от гидроксикислорода к эфирному кислороду ион распадается на фенол и ацетон.
Связанные реакции и модификации
[ редактировать ]Альтернативы совместному производству ацетона
[ редактировать ]Циклогексилбензол может заменить изопропилбензол. В результате перегруппировки Хока гидропероксид циклогексилбензола расщепляется с образованием фенола и циклогексанона . Циклогексанон является важным предшественником некоторых нейлонов . [8]
Начиная с алкилирования бензола смесью 1- и 2-бутелов , кумоловый процесс дает фенол и бутаноны . [5]
Альтернативы производству фенола
[ редактировать ]- Гидрохинон получают диалкилированием бензола пропеном с образованием 1,4-диизопропилбензола . Это соединение реагирует с воздухом с образованием бис(гидропероксида). Аналогично поведению гидроперекиси кумола он перегруппировывается в кислоте с образованием ацетона и гидрохинона. Окисление гидрохинона дает 1,4-бензохинон: [9]
- Резорцин получают аналогичным образом путем превращения 1,3-диизопропилбензола в бис(гидропероксид), который фрагментируется на резорцин и ацетон. [10]
- 2-Нафтол также можно получить методом, аналогичным кумоловому процессу. [11]
- 3-Хлорфенол , который не образуется при хлорировании фенола, может быть получен кумоловым процессом, начиная с алкилирования хлорбензола пропиленом. [12]
- Крезолы производятся из изопропилтолуола. [13]
Обработка ацетоном
[ редактировать ]Сырой ацетон гидрируют в жидкой фазе над никелем Ренея или смесью оксидов меди и хрома с получением изопропилового спирта . Этот процесс полезен, когда он сопровождается избыточным производством ацетона. [14] Компания Mitsui & Co. разработала дополнительные стадии гидрирования ацетона и дегидратации продукта изопропанола до пропена, который рециркулируется в качестве исходного реагента. [5]
Побочные продукты
[ редактировать ]Побочными продуктами кумолового процесса получения фенола и ацетона являются ацетофенон и альфа-метилстирол .
См. также
[ редактировать ]- Бисфенол А
- Процесс Доу (фенол)
- Алкилирование Фриделя Крафта
- Окисление Байера-Виллигера
- Процесс Рашига-Хукера (также производит фенол)
Ссылки
[ редактировать ]- ^ «Латвийский» . Архивировано из оригинала 3 марта 2016 г. Проверено 27 февраля 2011 г.
- ^ Хок, Х. и Ланг, С. (1944), Автоокисление углеводородов, IX. Сообщение: О пероксидах производных бензола. Отчеты Немецкого химического общества (серии A и B), 77: 257–264. два : 10.1002/cber.19440770321
- ^ Краткая энциклопедия химии (1993) Мэри Иглсо
- ^ «Объем, доля, анализ и прогноз рынка фенолов, 2035 г. - ChemAnalyst» . Химический аналитик . Проверено 9 апреля 2024 г.
- ^ Перейти обратно: а б с «Прямой путь к фенолу» . Архивировано из оригинала 9 апреля 2007 г. Проверено 26 декабря 2006 г.
- ^ Стрейтвизер, А; Хиткок, Швейцария (1992). «30» . Введение в органическую химию . Косовер, Э.М. (4-е изд.). Нью-Йорк: Макмиллан. стр. 1018 . ISBN 0-02-418170-6 .
- ^ КПК, Фоллхардт; Н. Э. Шор (2003). «22» . Органическая химия: структура и функции (4-е изд.). Нью-Йорк: Фриман. п. 988. ИСБН 0-7167-4374-4 .
- ^ Плоткин, Джеффри С. (21 марта 2016 г.). «Что нового в производстве фенола?» . Американское химическое общество. Архивировано из оригинала 27 октября 2019 г. Проверено 02 января 2018 г.
- ^ Герхард Франц, Роджер А. Шелдон «Окисление» в Энциклопедии промышленной химии Ульмана , Wiley-VCH, Вайнхайм, 2000 два : 10.1002/14356007.a18_261
- ^ К.В. Шмидель; Д. Декер (2012). «Резорцин». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a23_111.pub2 . ISBN 978-3527306732 .
- ^ Джеральд Бут «Производные нафталина» в Энциклопедии промышленной химии Ульмана, 2005, Wiley-VCH, Вайнхайм. два : 10.1002/14356007.a17_009 .
- ^ Франсуа Мюллер; Лилиан Кайяр (2011). «Хлорфенолы». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley VCH. дои : 10.1002/14356007.a07_001.pub2 . ISBN 978-3527306732 .
- ^ Роджер А. Шелдон (1983). Патай, Саул (ред.). Синтез и применение гидропероксидов и диалкилпероксидов . Химия функциональных групп ПАТАИ. Джон Уайли и сыновья. дои : 10.1002/9780470771730.ch6 .
- ^ Папа, А.Дж. «Пропанолы». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a22_173 . ISBN 978-3527306732 .