Иридийорганическая химия
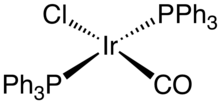




Иридийорганическая химия — химия металлоорганических соединений, содержащих иридий — углерод химическую связь . [2] Иридийорганические соединения имеют отношение ко многим важным процессам, включая гидрирование олефинов и промышленный синтез уксусной кислоты. Они также представляют большой академический интерес из-за разнообразия реакций и их значимости для синтеза тонких химических веществ. [3]
Классификация на основе основных степеней окисления
[ редактировать ]Иридийорганические соединения имеют много общего с родием, но в меньшей степени с кобальтом. Иридий может существовать в степенях окисления от -III до +V, но более распространены иридий (I) и иридий (III). соединения иридия(I) (d 8 конфигурация) обычно встречаются с плоско-квадратной или тригонально-бипирамидальной геометрией, тогда как соединения иридия (III) (d 6 конфигурация) обычно имеют октаэдрическую геометрию. [3]
Иридий(0)
[ редактировать ]Комплексы иридия(0) представляют собой бинарные карбонилы, главным членом которых является додекакарбонил тетраиридия , Ir 4 (CO) 12 . В отличие от родственного Rh 4 (CO) 12 , все лиганды CO являются терминальными в Ir 4 (CO) 12 , что аналогично разнице между Fe 3 (CO) 12 и Ru 3 (CO) 12 . [4]
Иридий(I)
[ редактировать ]Хорошо известным примером является комплекс Васки , карбонилхлорид бис(трифенилфосфин)иридия. Хотя комплексы иридия (I) часто являются полезными гомогенными катализаторами , комплекс Васки таковым не является. Скорее, он знаковый в разнообразии своих реакций. Другие распространенные комплексы включают Ir 2 Cl 2 (циклооктадиен) 2 , димер хлорбис(циклооктен)иридия . Аналог катализатора Уилкинсона IrCl(PPh 3 ) 3 ), подвергается ортометалированию:
- IrCl(PPh 3 ) 3 → HIrCl(PPh 3 ) 2 (PPh 2 C 6 H 4 )
Эта разница между RhCl(PPh 3 ) 3 и IrCl(PPh 3 ) 3 отражает в целом большую склонность иридия к окислительному присоединению . Аналогичную тенденцию демонстрируют RhCl(CO)(PPh 3 ) 2 и IrCl(CO)(PPh 3 ) 2 , только последний окислительно присоединяет O 2 и H 2 . [5] Олефиновые комплексы димер хлорбис(циклооктен)иридия и димер циклооктадиен-иридия часто используются в качестве источников «IrCl», используя лабильность алкеновых лигандов или их склонность к удалению путем гидрирования. Катализатор Крэбтри ([Ir(P(C 6 H 11 ) 3 )(пиридин)(циклооктадиен)]PF 6 ) является универсальным гомогенным катализатором гидрирования алкенов. [6]
(или 5 - Cp )Ir(CO) 2 окислительно присоединяет связи CH при фотолитической диссоциации одного лиганда CO.
Иридий(II)
[ редактировать ]Как и родий(II), иридий(II) встречается редко. Одним из примеров является иридоцен IrCp 2 . [7] Как и родоцен , иридоцен димеризуется при комнатной температуре. [8]
Иридий(III)
[ редактировать ]Иридий обычно поставляется в промышленных масштабах в степенях окисления Ir(III) и Ir(IV). Важными исходными реагентами являются гидрат трихлорида иридия и гексахлориридат аммония . Эти соли восстанавливаются при обработке CO, водородом и алкенами. Показательным является карбонилирование трихлорида: IrCl 3 (H 2 O) x + 3 CO → [Ir(CO) 2 Cl 2 ] − + СО 2 + 2 Н + + Cl − + (х-1) Н 2 О
Многие иридийорганические соединения образуются из димера дихлорида пентаметилциклопентадиенила иридия . Многие производные содержат кинетически инертные циклометаллированные лиганды. [9] Родственные полусэндвич-комплексы играли центральную роль в развитии активации CH . [10] [11]
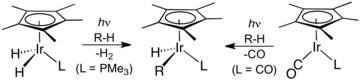
Иридийорганическая химия сыграла центральную роль в развитии активации CH , два примера которой показаны здесь.
Iridium(V)
[ редактировать ]Степени окисления выше III более характерны для иридия, чем для родия. Обычно они содержат лиганды сильного поля. Одним из часто цитируемых примеров является оксотримезитилилиридий (V). [12]
Использование
[ редактировать ]Преобладающим применением иридиевых комплексов является использование катализаторов в процессе Cativa процессе карбонилирования в метанола уксусной с получением кислоты . [13]

Оптические устройства и фоторедокс
[ редактировать ]иридия Комплексы , такие как циклометаллированные производные 2-фенилпиридинов, используются в качестве фосфоресцирующих органических светодиодов . [14] Родственные комплексы являются фотоокислительно-восстановительными катализаторами .
Возможные применения
[ редактировать ]Комплексы иридия высокоактивны при гидрировании как непосредственно, так и посредством трансферного гидрирования . Асимметричные варианты этих реакций широко изучены.
Многие полусэндвич-комплексы исследовались как возможные противораковые препараты. Родственные комплексы являются электрокатализаторами превращения углекислого газа в формиат. [9] [15] В академических лабораториях комплексы иридия широко изучаются, поскольку его комплексы способствуют активации CH , но такие реакции не используются ни в одном коммерческом процессе.
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ С.М. Бишофф; РА Периана (2010). Кислород- и углерод-связанные ацетилацетонато-иридий(III) комплексы . Неорганические синтезы. Том. 35. с. 173. дои : 10.1002/9780470651568 . ISBN 978-0-470-65156-8 .
- ^ Синтез металлоорганических соединений: Практическое руководство Санширо Комия Ред. С. Комия, М. Хурано 1997 г.
- ^ Перейти обратно: а б Крэбтри, Роберт Х. (2005). Металлоорганическая химия переходных металлов (4-е изд.). США: Wiley-Interscience. ISBN 0-471-66256-9 .
- ^ Гринвуд, штат Нью-Йорк; Эрншоу, А. (1997). Химия элементов (2-е изд.). Оксфорд: Баттерворт-Хайнеманн. стр. 1113–1143, 1294. ISBN. 0-7506-3365-4 .
- ^ Васька, Лаури ; ДиЛуцио, JW (1961). «Карбонильные и гидридо-карбонильные комплексы иридия по реакции со спиртами. Гидридокомплексы по реакции с кислотой». Журнал Американского химического общества . 83 (12): 2784–2785. дои : 10.1021/ja01473a054 .
- ^ Крэбтри, Роберт Х. (1979). «Соединения иридия в катализе». Акк. хим. Рез . 12 (9): 331–337. дои : 10.1021/ar50141a005 .
- ^ Келлер, HJ; Ваверсик, Х. (1967). «Спектроскопические исследования комплексных соединений. VI. Спектры ЭПР (C 5 H 5 ) 2 Rh и (C 5 H 5 ) 2 Ir». Дж. Органомет. Хим. (на немецком языке). 8 (1): 185–188. дои : 10.1016/S0022-328X(00)84718-X .
- ^ Фишер, EO ; Ваверсик, Х. (1966). «Об ароматических комплексах металлов. LXXXVIII. О мономерных и димерных дициклопентадиенилродии и дициклопентадиенилиридии и о новом методе получения незаряженных металлоароматических комплексов». Дж. Органомет. Хим. (на немецком языке). 5 (6): 559–567. дои : 10.1016/S0022-328X(00)85160-8 .
- ^ Перейти обратно: а б Лю, Чжэ; Сэдлер, Питер Дж. (2014). «Иридиорганические комплексы: противораковые агенты и катализаторы» . Отчеты о химических исследованиях . 47 (4): 1174–1185. дои : 10.1021/ar400266c . ПМЦ 3994614 . ПМИД 24555658 .
- ^ Эндрю Х. Янович; Роберт Г. Бергман (1982). «Углеродно-водородная активация в насыщенных углеводородах: прямое наблюдение M + R−H → M (R) (H)». Дж. Ам. хим. Соц . 104 : 352–354. дои : 10.1021/ja00365a091 .
- ^ Грэм, Уильям А.Г. (1982). «Окислительное присоединение углерод-водородных связей неопентана и циклогексана к фотохимически генерируемому комплексу иридия (I)». Журнал Американского химического общества . 104 (13): 3723–3725. дои : 10.1021/ja00377a032 .
- ^ Хэй-Мазервелл, RS; Уилкинсон, Г.; Хусейн-Бейтс, Б.; Херстхаус, МБ (1993). «Синтез и рентгеновская кристаллическая структура оксотримезитил-иридия (V)». Многогранник . 12 (16): 2009–2012. дои : 10.1016/S0277-5387(00)81474-6 .
- ^ Чунг, Осия; Танке, Робин С.; Торренс, Дж. Пол (2000). «Уксусная кислота». Энциклопедия промышленной химии Ульмана . Уайли. дои : 10.1002/14356007.a01_045 . ISBN 3-527-30673-0 .
- ^ Джэсан Ли; Сяо-Фань Чен; Тилини Батагода; Калеб Коберн; Петр Иванович Джурович; Марк Э. Томпсон; Стивен Р. Форрест (2016). «Темно-синие фосфоресцирующие органические светодиоды с очень высокой яркостью и эффективностью». Природные материалы . 15 (1–2): 92–98. Бибкод : 2016NatMa..15...92L . дои : 10.1038/nmat4446 . ПМИД 26480228 .
- ^ Маэнака, Юта; Суэнобу, Томоёси; Фукузуми, Шуничи (2012). «Каталитическая взаимопревращение водорода и муравьиной кислоты при температуре и давлении окружающей среды». Энергетика и экология . 5 (6): 7360–7367. дои : 10.1039/c2ee03315a .
