Атомный углерод
 | |
| Имена | |
|---|---|
| Название ИЮПАК Атомный углерод | |
| Систематическое название ИЮПАК Метандиилиден (заменитель) Углерод (добавка) | |
| Другие имена моноуглерод; одноатомный углерод; одноатомный углерод | |
| Идентификаторы | |
3D model ( JSmol ) | |
| ЧЭБИ | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.028.321 |
ПабХим CID | |
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA ) | |
| Характеристики | |
| С | |
| Молярная масса | 12.011 g·mol −1 |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Эта статья включает список общих ссылок , но в ней отсутствуют достаточные соответствующие встроенные цитаты . ( сентябрь 2010 г. ) |
Атомный углерод , систематически называемый углеродом и λ 0 -метан — бесцветное газообразное неорганическое химическое вещество с химической формулой C (также пишется [C]). Он кинетически нестабилен при температуре и давлении окружающей среды и удаляется путем автополимеризации.
Атомный углерод — простейшая из аллотропов углерода , а также прародитель углеродных кластеров. Кроме того, его можно считать мономером всех (конденсированных) аллотропов углерода, таких как графит и алмаз.
Номенклатура
[ редактировать ]Тривиальное название «моноуглерод» является наиболее часто используемым и предпочтительным названием IUPAC . Систематическое название «углерод» , действительное название ИЮПАК , построено в соответствии с композиционной номенклатурой. Однако как композиционное название оно не различает разные формы чистого углерода. Систематическое название λ 0 -метан , также допустимое название IUPAC, построен в соответствии с замещающей номенклатурой. Наряду с моноуглеродом это название действительно отличает главное соединение, поскольку оно получено с использованием структурной информации о молекуле. Чтобы лучше отразить его структуру, свободный атомарный углерод часто обозначается как [C]. λ 2 -метилий ( [CH] +
) — ион, образующийся в результате прироста H +
атомарным углеродом.
Характеристики
[ редактировать ]Амфотерность
[ редактировать ]Кислота Льюиса может присоединяться к электронной паре атомарного углерода, а электронная пара основания Льюиса может присоединяться к атомарному углероду путем присоединения: [1]
- :[C] + M → [MC]
- [С] + :L → [CL]
Из-за этого отдачи или принятия присоединенной электронной пары атомарный углерод имеет амфотерный характер Льюиса. [2] Атомный углерод способен отдавать до двух пар электронов кислотам Льюиса или принимать до двух пар электронов от оснований Льюиса.
Протон может присоединиться к атомарному углероду путем протонирования:
- С + Ч +
→ CH +
Из-за этого захвата протона ( H +
), атомарный углерод и его аддукты с основаниями Льюиса, такими как вода, также имеют основной характер Бренстеда-Лоури. Сопряженная с атомарным углеродом кислота - λ. 2 -метилий ( CH +
).
- ЧАС
33О +
+ С ⇌ Ч
2 О + СН +
Однако водные растворы аддуктов нестабильны из-за гидратации углеродного центра и λ 2 -метилиевая группа с образованием λ 2 -метанол (CHOH) или λ 2 -метан ( CH
2 ) или гидроксиметилий ( CH
2 ОН +
) группы соответственно.
- ЧАС
2О + С → СНОН - ЧАС
2 О + СН +
→ CH
2 ОН +
λ 2 Группа -метанола в аддуктах потенциально может изомеризоваться с образованием формальдегида или подвергаться дальнейшей гидратации с образованием метандиола . Гидроксиметилиевая группа в аддуктах потенциально может дополнительно гидратироваться с образованием дигидроксиметилия ( CH (OH) +
2 ) или окисляться водой с образованием формилия ( HCO +
). [1]
Электромагнитные свойства
[ редактировать ]Электроны в атомарном углероде распределяются по атомным орбиталям в соответствии с принципом Ауфбау для создания уникальных квантовых состояний с соответствующими энергетическими уровнями. Состояние с самым низким энергетическим уровнем, или основное состояние, представляет собой триплетное дирадикальное состояние ( 3 P 0 ), за которым следует 3 Р 1 и 3 П 2 . Следующие два возбужденных состояния, сравнительно близкие по энергии, представляют собой синглет ( 1 D 2 ) и синглетный дирадикал ( 1 С 0 ). Нерадикальное состояние атомарного углерода систематически называют λ. 2 -метилиден, а дирадикальные состояния, включающие основное состояние, называются углеродом (2•) или λ. 2 -метандиил. 1 Д 2 и 1 Состояния S 0 лежат 121,9 кДж моль −1 и 259,0 кДж моль −1 над основным состоянием соответственно. Переходы между этими тремя состояниями формально запрещены из-за требования переворота спина или спаривания электронов. Это означает, что атомарный углерод фосфоресцирует в ближней инфракрасной области электромагнитного спектра при длине волны 981,1 нм. Он также может флуоресцировать в инфракрасном диапазоне и фосфоресцировать в синей области при 873,0 нм и 461,9 нм соответственно при возбуждении ультрафиолетовым излучением.
Различные состояния атомарного углерода демонстрируют различное химическое поведение. Например, реакции триплетного радикала с нерадикальными соединениями обычно включают отщепление, тогда как реакции синглетного нерадикала включают не только отщепление, но и присоединение путем внедрения.
- [С] 2• ( 3 П 0 ) + Ч
2O ] → [CHOH] → [CH] + [HO - [С]( 1 Д 2 ) + Ч
2O + → [CHOH] → CO H
2 или Н
22CO
Производство
[ редактировать ]
Один из методов синтеза, разработанный Филом Шевлином и проделавший основную работу в этой области, заключается в пропускании большого тока через два соседних углеродных стержня, создавая электрическую дугу. Способ образования этого вида тесно связан с образованием фуллеренов C 60 , главное отличие состоит в том, что для образования атомарного углерода используется гораздо более низкий вакуум.
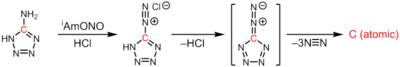
Атомный углерод образуется при термолизе 5-диазотетразола при экструзии 3 эквивалентов динитрогена: [3]
CN 6 → :C:+3N 2
Чистый источник атомарного углерода можно получить на основе термического разложения карбида тантала . В разработанном источнике [4] углерод загружается в тонкостенную танталовую трубку. После герметизации его нагревают постоянным электрическим током . Сольватированные атомы углерода диффундируют к внешней поверхности трубки и при повышении температуры наблюдается испарение атомарного углерода с поверхности танталовой трубки. Источник обеспечивает чисто атомы углерода без присутствия каких-либо дополнительных частиц.
Декарбонилирование субоксида углерода
[ редактировать ]Атомный углерод может быть получен декарбонилированием субоксида углерода . В этом процессе субоксид углерода разлагается с образованием атомарного углерода и монооксида углерода по уравнению:
- С
33О
2 → 2 СО + [С]
В этом процессе в качестве промежуточного продукта используется монооксид углерода , и он происходит в два этапа. Для обоих декарбонилирований необходимо фотолитическое дальнее ультрафиолетовое излучение.
- OCCCO → [CCO] + CO
- [CCO] → CO + [C]
Использование
[ редактировать ]Обычно образец атомарного углерода существует в виде смеси возбужденных состояний в дополнение к основному состоянию в термодинамическом равновесии. Каждое состояние по-разному вносит свой вклад в механизмы реакции, которые могут иметь место. Простой тест, используемый для определения того, какое состояние задействовано, состоит в использовании диагностической реакции триплетного состояния с O 2 . Если выход реакции не изменился, это указывает на то, что задействовано синглетное состояние. Основное состояние дирадикала обычно подвергается реакциям абстракции. Атомарный углерод использовался для получения «настоящих» карбенов путем отрыва атомов кислорода от карбонильных групп:
- R 2 C=O + :C: → R 2 C: + CO
Карбены, образовавшиеся таким образом, будут проявлять истинное карбеновое поведение. Карбены, полученные другими методами, такие как диазосоединения, могут проявлять свойства, которые лучше приписывают диазосоединениям, используемым для производства карбена (которые имитируют поведение карбена), а не самому карбену. Это важно с механистической точки зрения на поведение истинного карбена.
Реакции
[ редактировать ]Поскольку атомарный углерод является разновидностью с дефицитом электронов, он самопроизвольно автополимеризуется в чистой форме или превращается в аддукт при обработке кислотой или основанием Льюиса. [ двусмысленный ] Окисление атомарного углерода дает монооксид углерода, тогда как восстановление дает λ 2 -метан. Неметаллы , включая кислород , сильно атакуют атомарный углерод, образуя соединения двухвалентного углерода:
- 2 [С] + О
2 → 2 СО
Атомный углерод обладает высокой реакционной способностью, большинство реакций очень экзотермичны. Обычно их проводят в газовой фазе при температуре жидкого азота (77 К). Типичные реакции с органическими соединениями включают: [5]
- Внедрение в связь CH в алканах с образованием карбена.
- Деоксигенирование карбоксильных групп в кетонах и альдегидах с образованием карбена, 2-бутанона с образованием 2-бутанилидена.
- Внедрение в двойные связи углерод-углерод с образованием циклопропилидена, который подвергается раскрытию кольца, простым примером является внедрение в алкен с образованием кумулена.
При введении воды в связь ОН образуется карбен HC-OH, который перегруппировывается в формальдегид HCHO.
Ссылки
[ редактировать ]- ^ Jump up to: а б Хусейн, Д.; Кирш, LJ (1 января 1971 г.). «Реакции атомарного углерода C(2 3 PJ ) методом кинетической абсорбционной спектроскопии в вакуумном ультрафиолете». Труды Общества Фарадея . 67 : 2025–2035. doi : 10.1039/TF9716702025 .
- ^ Хаускрофт, Кэтрин Э.; Шарп, Алан Г. (2012). «Кислоты, основания и ионы в водных растворах». Неорганическая химия (4-е изд.). Pearson Education, Ltd. с. 227. ИСБН 978-0-273-74275-3 .
- ^ Шевлин, Филип Б. (1 мая 2002 г.). «Образование атомарного углерода при разложении хлорида 5-тетразолилдиазония». Журнал Американского химического общества . 94 (4): 1379–1380. дои : 10.1021/ja00759a069 .
- ^ Краснокутский С.А.; Хьюскен, Ф. (15 сентября 2014 г.). «Простой и чистый источник низкоэнергетического атомарного углерода». Письма по прикладной физике . 105 (11): 113506. Бибкод : 2014АпФЛ.105к3506К . дои : 10.1063/1.4895806 .
- ^ Реактивная промежуточная химия, Роберт А. Мосс, Мэтью С. Платц и Мейтленд Джонс-младший, Вили-Блэквелл, (2004), ISBN 978-0471233244
Дальнейшее чтение
[ редактировать ]- Белый Дж.Дж.; Падман Р. (1991). «Изображения атомарного углерода в межзвездной среде». Природа . 354 (6354): 511–513. Бибкод : 1991Natur.354..511W . дои : 10.1038/354511a0 . S2CID 4262147 .
- П. Б. Шевлин (1972). «Образование атомарного углерода при разложении хлорида 5-тетразоилдиазония». Дж. Ам. хим. Соц. 94 (4): 1379–1380. дои : 10.1021/ja00759a069 .
- П. Б. Шевлин (1980). «Получение и реакция атомарного углерода». В Р. А. Абрамовиче (ред.). Реактивные промежуточные продукты . Том. 1. Нью-Йорк: Пленум Пресс. п. 1.
- MJS Дьюар; диджей Нельсон; П.Б. Шевлин; К. А. Биесида (1981). «Экспериментальное и теоретическое исследование механизма дезоксигенации карбонильных соединений атомарным углеродом». Дж. Ам. хим. Соц. 103 (10): 2802. doi : 10.1021/ja00400a052 .
- Биесиада, Кейт А.; Шевлин, Филип Б. (1984). «Внутримолекулярный захват промежуточного продукта при дезоксигенировании карбонильного соединения атомарным углеродом». Журнал органической химии . 49 (6): 1151. doi : 10.1021/jo00180a047 .
- Мосс, Роберт А; Джонс, Мейтленд (2004). «Атомный углерод» . Реактивная промежуточная химия . Джон Уайли и сыновья. стр. 463–500 . ISBN 978-0-471-23324-4 .