GMP-синтаза
| GMP-синтаза (гидролизующая глутамин) | |||
|---|---|---|---|
 GMP-синтетаза, человеческая | |||
| Идентификаторы | |||
| Номер ЕС. | 6.3.5.2 | ||
| Номер CAS. | 37318-71-1 | ||
| Базы данных | |||
| ИнтЭнк | вид IntEnz | ||
| БРЕНДА | БРЕНДА запись | ||
| Экспаси | Просмотр NiceZyme | ||
| КЕГГ | КЕГГ запись | ||
| МетаЦик | метаболический путь | ||
| ПРЯМОЙ | профиль | ||
| PDB Структуры | RCSB PDB PDBe PDBsum | ||
| Генная онтология | АмиГО / QuickGO | ||
| |||
| С-концевой домен GMP-синтетазы | |||
|---|---|---|---|
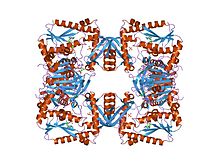 gmp-синтетаза Escherichia coli в комплексе с ампером и пирофосфатом. [ 1 ] | |||
| Идентификаторы | |||
| Символ | GMP_synt_C | ||
| Пфам | PF00958 | ||
| ИнтерПро | ИПР001674 | ||
| PROSITE | PDOC00405 | ||
| ОБЛАСТЬ ПРИМЕНЕНИЯ 2 | 1 галлон в минуту / ОБЛАСТЬ ПРИМЕНЕНИЯ / СУПФАМ | ||
| |||
| ГМПС | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | GMPS , GMP-синтаза, гуанинмонофосфатсинтаза, GATD7, GMP-синтаза | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | Опустить : 600358 ; МГИ : 2448526 ; Гомологен : 68367 ; GeneCards : GMPS ; ОМА : GMPS – ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Гуанозинмонофосфатсинтетаза ( EC 6.3.5.2 ), также известная как GMPS, представляет собой фермент , который превращает ксантозинмонофосфат в гуанозинмонофосфат . [ 6 ]
При синтезе пуриновых нуклеотидов de novo ИМФ является метаболитом точки ветвления, в этот момент путь расходится в сторону синтеза гуаниновых или адениновых нуклеотидов. В пути гуаниновых нуклеотидов участвуют два фермента, участвующих в превращении IMP в GMP, а именно дегидрогеназа IMP (IMPD1), которая катализирует окисление IMP в XMP, и GMP-синтетаза, которая катализирует аминирование XMP в GMP. [ 6 ]
Энзимология
[ редактировать ]В энзимологии GMP -синтетаза (гидролизующая глутамин) ( EC 6.3.5.2 ) представляет собой фермент химическую , катализирующий реакцию .
- АТФ + ксантозин-5'-фосфат + L -глутамин + H 2 O АМФ + дифосфат + ГМФ + L -глутамат
Четырьмя субстратами этого фермента являются АТФ , ксантозин-5'-фосфат , L -глутамин и H 2 O , тогда как его четырьмя продуктами являются АМФ , дифосфат , ГМФ и L -глутамат .
Этот фермент принадлежит к семейству лигаз , в частности тех, которые образуют углерод-азотные связи углерод-азотные лигазы с глутамином в качестве амидо-N-донора. Систематическое название этого класса ферментов — ксантозин-5'-фосфат: L -глутаминамидолигаза (АМФ-образующая) . Этот фермент участвует в обмене пуринов и метаболизме глутамата . по крайней мере одно соединение, психофуранин, Известно, что ингибирует этот фермент .
Структурные исследования
[ редактировать ]По состоянию на конец 2007 года 5 структур для этого класса ферментов было решено PDB с кодами доступа 1GPM , 1WL8 , 2A9V , 2D7J и 2DPL .
Роль в обмене веществ
[ редактировать ]Пуриновый обмен
[ редактировать ]GMP-синтаза является вторым этапом образования GMP из IMP; первый этап происходит, когда IMP-дегидрогеназа генерирует XMP, а затем GMP-синтетаза способна реагировать с глутамином и АТФ с образованием GMP. ИМФ также может превращаться в АМФ с помощью аденилсукцинатсинтетазы, а затем аденилсукцинатлиазы. [ 7 ]
Метаболизм аминокислот
[ редактировать ]ГМП-синтаза также участвует в метаболизме аминокислот, поскольку она генерирует L-глутамат из L-глутамина. [ 7 ]
Органическое участие
[ редактировать ]Этот фермент широко распространен, и ряд кристаллических структур был расшифрован, в том числе у Escherichia coli , Pyrococcus Horikoshii , Thermoplasma acidophil , Homo sapiens , Thermus thermophilus и Mycobacterium Tuberculus . Наиболее обширные структурные исследования были проведены на E. coli . [ 1 ]
Структура и функции
[ редактировать ]ГМП-синтаза образует тетрамер в форме открытого ящика, который представляет собой димер из димеров. Интерфейсы R скреплены гидрофобным ядром и бета-листом , в то время как интерфейсы димера P не имеют гидрофобного ядра и более изменчивы, чем интерфейсы R. [ 1 ] Этот фермент также связывает несколько лигандов , включая фосфат , пирофосфат , АМФ , цитрат и магний . [ 8 ]
Домен амидотрансферазы класса I
[ редактировать ]Амидотрансферазный домен отвечает за удаление амидного азота из глутаминового субстрата. Домен амидотрансферазы класса I состоит из 206 N-концевых остатков фермента и состоит из 12 бета-цепей и 5 альфа-спиралей ; ядро этого домена представляет собой открытый 7-нитевой смешанный бета-лист. Его каталитическая триада включает Cys 86, His 181 и Glu 183. His181 представляет собой основание, а Glu183 представляет собой акцептор водородной связи из кольца гистидина имидазольного . Cys86 представляет собой каталитический остаток и является консервативным. Он попадает в нуклеофильное колено, где находится в конце бета-цепи и начале альфа-спирали, и имеет небольшую гибкость в углах фи и пси; таким образом, Gly84 и Gly88 консервативны и обеспечивают плотную упаковку аминокислот, окружающих каталитический остаток. [ 1 ]
Синтетазный домен: домен АТФ-пирофосфатазы.
[ редактировать ]Синтетазный . домен отвечает за добавление абстрагированного азота к акцепторному субстрату Домен АТФ-пирофосфатазы состоит из бета-листа, содержащего 5 параллельных цепей с несколькими альфа-спиралями на каждой стороне. Петля P представляет собой мотив связывания нуклеотидов; остатки 235–241 составляют P-петлю, которая специфически связывается с пирофосфатом. [ 1 ]
Структура этого домена определяет специфичность этого фермента к АТФ. Карман связывания образует гидрофобные взаимодействия с адениновым кольцом, а основная цепь Val260 образует H-связи с несколькими атомами азота в кольце AMP, что исключает заместители в пуриновом кольце C2. Это создает чрезвычайную специфичность связывания аденина и АТФ. [ 1 ]
Ссылки
[ редактировать ]- ^ Jump up to: а б с д и ж Тесмер Дж.Дж., Клем Т.Дж., Дерас М.Л., Дэвиссон В.Дж., Смит Дж.Л. (январь 1996 г.). «Кристаллическая структура GMP-синтетазы представляет собой новую каталитическую триаду и представляет собой структурную парадигму для двух семейств ферментов». Структурная биология природы . 3 (1): 74–86. дои : 10.1038/nsb0196-74 . ПМИД 8548458 . S2CID 30864133 .
- ^ Jump up to: а б с GRCh38: Версия Ensembl 89: ENSG00000163655 – Ensembl , май 2017 г.
- ^ Jump up to: а б с GRCm38: выпуск Ensembl 89: ENSMUSG00000027823 – Ensembl , май 2017 г.
- ^ «Ссылка на Human PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Ссылка на Mouse PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ Jump up to: а б «Ген Энтрез: гуанинмонофосфатсинтетаза GMPS» .
- ^ Jump up to: а б Гарретт Р.Х. (1998). Биохимия . [Место публикации не указано]: Харкорт-Колледж. ISBN 0-03-044857-3 . OCLC 947935503 .
- ^ «Взаимодействие лиганд/металл: 1 галлон в минуту» . www.ebi.ac.uk. Проверено 21 октября 2021 г.
Дальнейшее чтение
[ редактировать ]- Пейдж Т, Бакай Б., Найхан В.Л. (1984). «Человеческая GMP-синтетаза». Международный журнал биохимии . 16 (1): 117–20. дои : 10.1016/0020-711X(84)90061-2 . ПМИД 6698284 .
- Накамура Дж., Штрауб К., Ву Дж., Лу Л. (октябрь 1995 г.). «Функция гидролиза глутамина GMP-синтетазой человека. Идентификация цистеина незаменимого активного центра» . Журнал биологической химии . 270 (40): 23450–5. дои : 10.1074/jbc.270.40.23450 . ПМИД 7559506 .
- Накамура Дж., Лу Л. (март 1995 г.). «Биохимическая характеристика GMP-синтетазы человека» . Журнал биологической химии . 270 (13): 7347–53. дои : 10.1074/jbc.270.13.7347 . ПМИД 7706277 .
- Херст М., Халидей Э., Накамура Дж., Лу Л. (сентябрь 1994 г.). «Человеческая GMP-синтетаза. Очистка белков, клонирование и функциональная экспрессия кДНК» . Журнал биологической химии . 269 (38): 23830–7. дои : 10.1016/S0021-9258(17)31590-9 . ПМИД 8089153 .
- Маруяма К., Сугано С. (январь 1994 г.). «Олиго-кэпирование: простой метод замены кэп-структуры эукариотических мРНК олигорибонуклеотидами». Джин . 138 (1–2): 171–4. дои : 10.1016/0378-1119(94)90802-8 . ПМИД 8125298 .
- Федорова Л., Кост-Алимова М., Гизатуллин Р.З., Алимов А., Забаровская В.И., Селес А. и др. (1997). «Назначение и упорядочение двадцати трех уникальных NotI-связывающих клонов, содержащих экспрессированные гены, включая ген гуанозин-5'-монофосфатсинтетазы, на хромосоме 3 человека». Европейский журнал генетики человека . 5 (2): 110–6. дои : 10.1159/000484744 . ПМИД 9195163 .
- Сузуки Ю, Ёситомо-Накагава К, Маруяма К, Суяма А, Сугано С (октябрь 1997 г.). «Создание и характеристика библиотеки кДНК, обогащенной по полной длине и по 5'-концу». Джин . 200 (1–2): 149–56. дои : 10.1016/S0378-1119(97)00411-3 . ПМИД 9373149 .
- Пеграм Л.Д., Мегонигал М.Д., Ланге Б.Дж., Ноуэлл П.С., Роули Дж.Д., Раппапорт Э.Ф., Феликс К.А. (декабрь 2000 г.). «Транслокация t (3; 11) при остром миелолейкозе, связанном с лечением, объединяет MLL с геном GMPS (ГУАНОЗИН-5'-МОНОФОСФАТ-СИНТЕТАЗА)». Кровь . 96 (13): 4360–2. дои : 10.1182/blood.V96.13.4360 . ПМИД 11110714 .
- Го Д., Хан Дж., Адам Б.Л., Колберн Н.Х., Ван М.Х., Донг З. и др. (декабрь 2005 г.). «Протеомный анализ субстратов SUMO4 в клетках HEK293 в условиях стресса, вызванного сывороточным голоданием». Связь с биохимическими и биофизическими исследованиями . 337 (4): 1308–18. дои : 10.1016/j.bbrc.2005.09.191 . ПМИД 16236267 .
- Абрамс Р., Бентли М. (1959). «Биосинтез пуринов нуклеиновых кислот. III. Образование гуанозин-5'-фосфата из ксантозин-5'-фосфата и L-глутамина». Арх. Биохим. Биофиз . 79 : 91–110. дои : 10.1016/0003-9861(59)90383-2 .
- Лагерквист У (июль 1958 г.). «Биосинтез гуанозин-5'-фосфата. II. Аминирование ксантозин-5'-фосфата очищенным ферментом из печени голубя» . Журнал биологической химии . 233 (1): 143–9. дои : 10.1016/S0021-9258(19)68044-0 . ПМИД 13563458 .
Внешние ссылки
[ редактировать ]- GMP + синтетаза в Национальной медицинской библиотеке США по медицинским предметным рубрикам (MeSH)
- PDBe-KB предоставляет обзор всей информации о структуре, доступной в PDB для GMP-синтазы человека [гидролизующей глутамин]





